Similar presentations:
Алкадиены. Алкины
1.
Алкадиены. Алкины2.
АЛКИНЫ(непредельные, ненасыщенные,
ацетиленовые)
Общая формула СnH2n-2
Алкины – это углеводороды, в молекулах которых помимо одинарных
связей между атомами углерода присутствует одна тройная связь (2π-связь).
3.
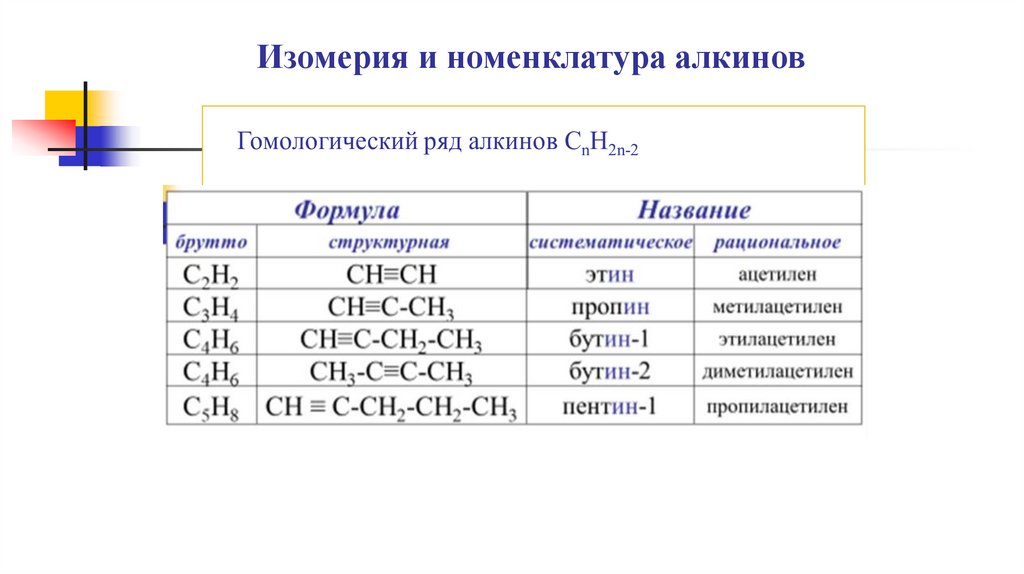
Изомерия и номенклатура алкиновФормула
брутто
структурная
С2Н2
СН≡СН
С3Н4
СН≡С-СН3
СН≡С-СН2-СН3
С4Н6
С4Н6
СН3-С≡С-СН3
С5Н8 СН ≡ С-СН2-СН2-СН3
Название
систематическое
рациональное
этин
пропин
бутин-1
бутин-2
пентин-1
ацетилен
метилацетилен
этилацетилен
диметилацетилен
пропилацетилен
4.
Изомерия и номенклатура алкиновГомологический ряд алкинов СnH2n-2
В названии по систематической номенклатуре:
1. Главная цепь, обязательна должна содержать тройную связь.
2. Нумерация цепи с той стороны, где ближе тройная связь.
3. В названии углеводорода после суффикса –ин, цифрой
указывают положение двойной связи.
1
2
3
4
5
6
7
C
H
C
H
C
-C
C
H
C
H
C
H
-3
3
2
H
метил
H
2,5-диметигептин-3C
3 C
3
5.
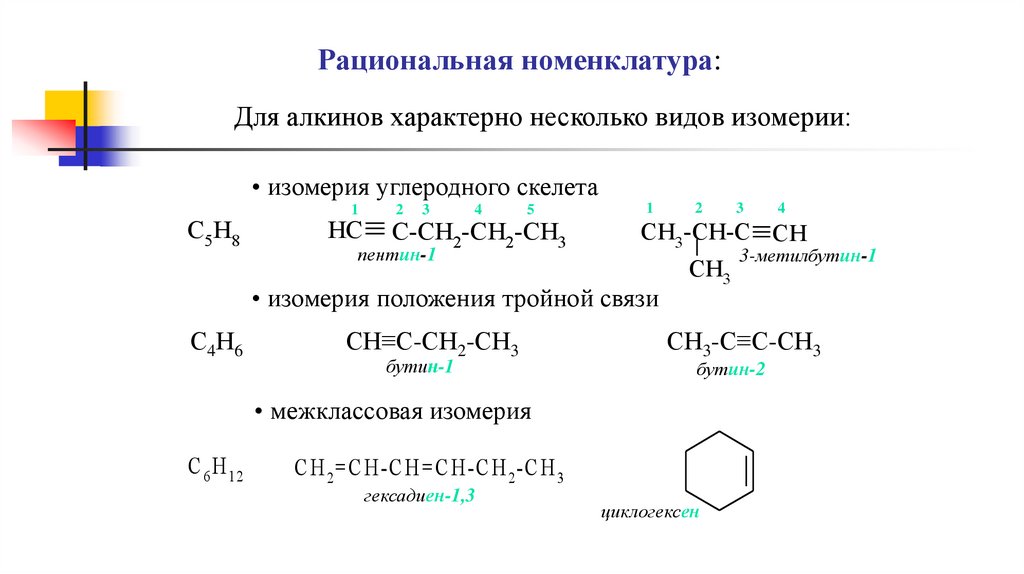
Рациональная номенклатура:Для алкинов характерно несколько видов изомерии:
• изомерия углеродного скелета
C5 H8
C5 H8HC
1
2
3
4
5
HC2-CH
C-CH
C-CH
23-CH2-CH3
2-CH
пентин-1
1
2
3
4
CH3-CH-CCHCH
3-CH-C CH
3-метилбутин-1
CH3
CH3
• изомерия положения тройной связи
С4Н6
СН≡С-СН2-СН3
бутин-1
СН3-С≡С-СН3
бутин-2
• межклассовая изомерия
C 6 H 12
C H 2 =C H-C H=C H-C H 2 -C H 3
гексадиен-1,3
циклогексен
6.
Физические свойстваФизические свойства закономерно изменяются, с ростом
молекулярной массы, но имеют более высокие температуры
плавления и кипения.
Ацетилен – бесцветный, легко сжижаемый газ с т.кип. -840С.
При горении ацетилена в чистом кислороде, в его пламени развивается температура
до 3000 0С.
Образует с воздухом взрывчатые смеси при его содержании от 3 до 82 %.
Слабо растворим в воде и этаноле, умеренно в ацетоне, особенно под давлением.
7.
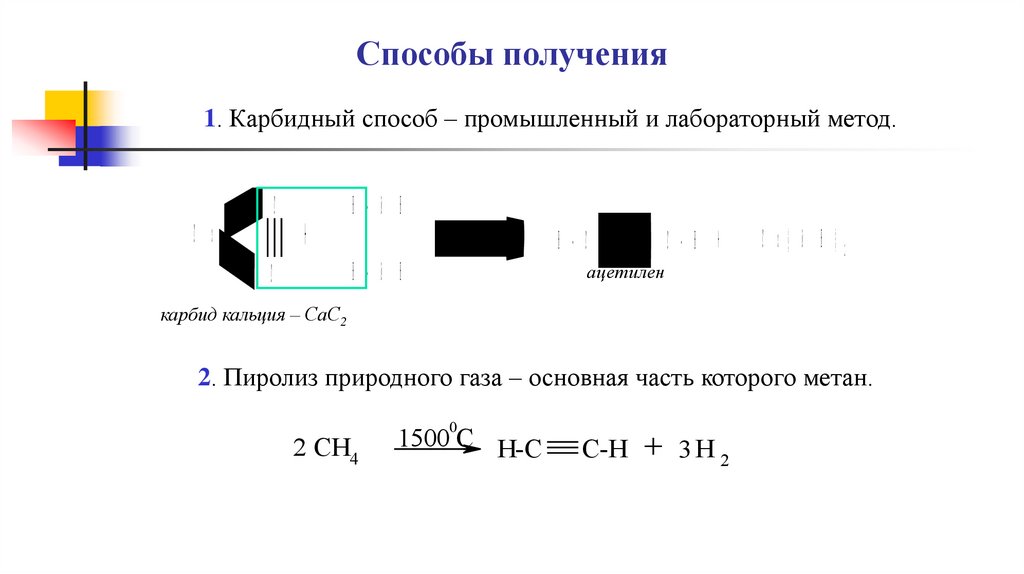
Способы получения1. Карбидный способ – промышленный и лабораторный метод.
C
C a
+
C
H - O H
C - H +
H - C
H - O H
C a( O H )2
ацетилен
карбид кальция – СаС2
2. Пиролиз природного газа – основная часть которого метан.
2 CH4
0
1500 C H-C
C-H + 3 H 2
8.
3. Дегидрогалогенирование дигалогенпроизводных соединений.H Cl
H-C - C-H
Cl H
H Br
C H 3- C - C - H 2 K O H
с п и р т . .р - р
H Br
2 KOH
с п и р т . .р - р
H-C
C H 3- C
C-H +
C-H +
2 K Cl+ 2 H2 O
2 K Br+ 2 H2 O
Отщепление галогеноводорода протекает по правилу Зайцева.
9.
Химические свойстваУчитывая особенности тройной связи, для алкинов характерны реакции
присоединения, которые протекают в две стадии, т.е. с избытком реагента.
1. Гидрирование – присоединение водорода, с образованием алкенов и алканов.
H-C
C-C H3
H2
Ni t
C H2 = C H-C H3
H2
Ni t
C H 3- C H 2- C H 3
2. Галогенирование – присоединение галогенов (Cl2, Br2, I2) с образованием
тетрагалогенпроизводных.
Cl
HC
CH +
Cl 2
C H = C H + C l2
Cl
Cl
Cl
CH - CH
Cl Cl
10.
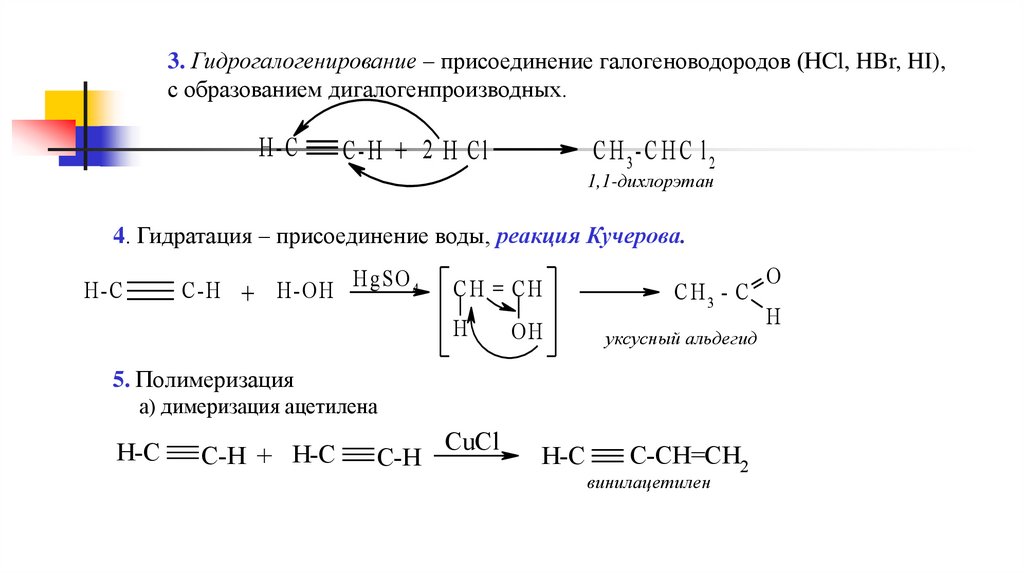
3. Гидрогалогенирование – присоединение галогеноводородов (НCl, HBr, HI),с образованием дигалогенпроизводных.
H-C
C-H + 2 H Cl
C H 3- C H C l2
1,1-дихлорэтан
4. Гидратация – присоединение воды, реакция Кучерова.
C-H + H-O H H gSO 4
H-C
CH = CH
H
OH
CH3 - C
уксусный альдегид
5. Полимеризация
а) димеризация ацетилена
H-C
C-H + H-C
C-H
CuCl
H-C
C-CH=CH2
винилацетилен
O
H
11.
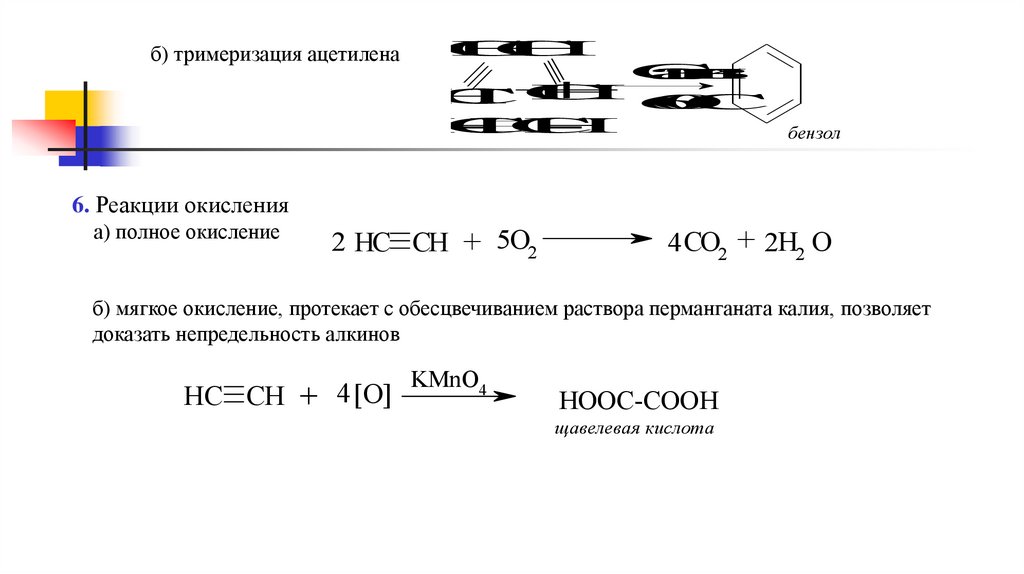
б) тримеризация ацетиленаC
H
C
H
C
а
к
т
и
в
C
H 6
H
C+
0
0
С
H
C
-C
H
бензол
6. Реакции окисления
а) полное окисление
2 HC CH + 5O2
ацетилен
4 CO2 + 2H2 O
б) мягкое окисление, протекает с обесцвечиванием раствора перманганата калия, позволяет
доказать непредельность алкинов
HC CH + 4 [O]
KMnO4
HOOC-COOH
щавелевая кислота
12.
в) жесткое окисление гомологов ацетиленаCH3-CH2-C
KMnO4
H2SO4
C-CH3
.
CH3-CH2-COOH + HOOC-CH3
пропионовая кислота
уксусная кислота
7. Реакция замещения Н атома на металл - качественная реакция на алкины
H-C
C-H + A g2O
N H3 H2 O
A g-C
C-Ag + 2 H2 O
ацетиленид серебра
13.
ПрименениеАлкины не используют в качестве топлива, вследствие высокой химической
активности, их выгоднее использовать в качестве исходного сырья для
промышленного синтеза.
Чаще всего используется ацетилен для получения:
ацетилен НС≡СН – для сварки и резки металлов;
этилового спирта C2H5OH – в производстве парфюмерных средств;
хлористый винил СН2=СНСl – в производстве полихлорвинила
уксусной кислоты CH3-COOH - в производстве красителей и лекарств;
акрилонитрил СН2=СН-СN – синтетические волокна;
хлоропрен СH2=CHCl-CH=CH2 - в производстве автошин;
хлорпроизводные – хорошие растворители.
14.
АЛКАДИЕНЫОбщая формула СnH2n-2
Диеновые углеводороды – это непредельные углеводороды, в молекулах которых
имеются две двойные связи.
Различают три типа диенов, в зависимости от расположения двойных связей:
а) с кумулированными двойными связями
СH2=C=CH2
пропадиен
аллен
б) с сопряженными двойными связями
СH2=CH-CH=CH2
бутадиен-1,3
дивинил
CH2 =CH-CH=CH-CH3
CH2 =CH-CH=CH-CH3
CH2 =C-CH=CH2
CH3
CH2 =C-CH=CH2
пентадиен-1,3
2-метилбутадиен-1,3
(изопрен)
2-метилбутадиен-1,3
в) с изолированными двойнымипентадиен-1,3
связями
CH2=CH-CH2-CH2-CH=CH2
CH3
(изопрен)
гексадиен-1,5
15.
Методы получения1. Дегидрирование н-бутана (двухстадийный каталитический процесс).
C r2 O 3 5 5 0 -6 0 0 0C
C H 3- C H 2- C H 2- C H 3
A l2 O 3
C H 2 = C H - C H 2 - C H 3+ H 2
M gO, ZnO C H =C H-C H =C H
б у т е н -1
2
2
5
5
0
6
0
0
C
бутадиен-1,3
C H 3- C H = C H - C H 3+ H 2
б у т е н -2
2. Метод Лебедева, включает две реакции одновременно - дегидратацию и дегидрирование.
Промышленный метод получения дивинила.
2 C H 3- C H 2- O H
этиловыйспирт
A l2 O 3, Z n O
42 5 C 0
C H 2 = C H - C H = C H 2+ 2 H 2 O +
бутадиен-1,3
H
2
Физические свойства
В обычных условиях пропадиен-1,2 (аллен) и бутадиен-1,3 – газы, 2-метилбутадиен-1,3 (изопрен) – летучая
жидкость.
16.
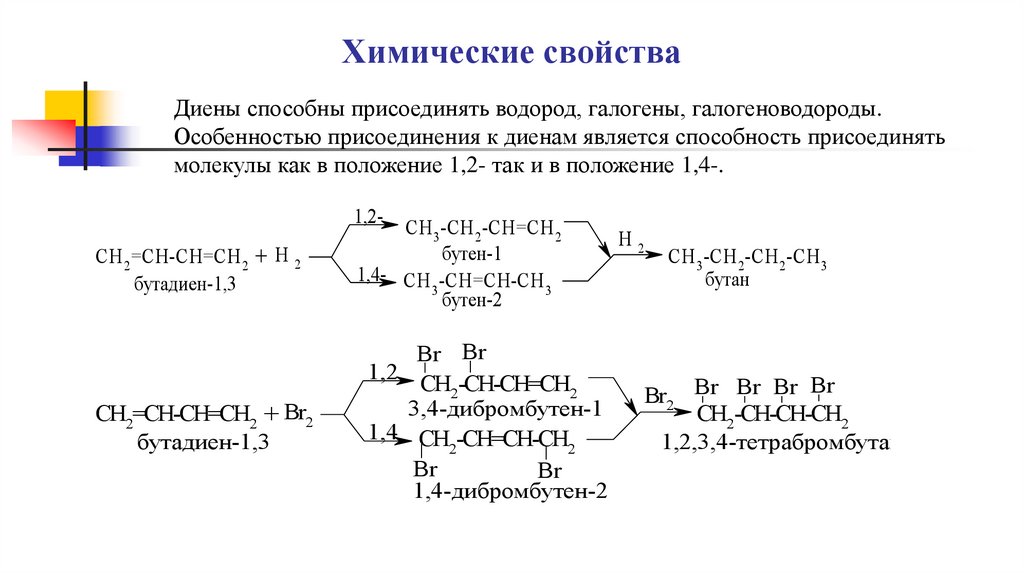
Химические свойстваДиены способны присоединять водород, галогены, галогеноводороды.
Особенностью присоединения к диенам является способность присоединять
молекулы как в положение 1,2- так и в положение 1,4-.
1,2СH 2 =CH-CH=CH 2 + H 2
бутадиен-1,3
CH 3 -CH 2 -CH=CH 2
бутен-1
1,4- CH -CH=CH-CH
3
3
бутен-2
СH2=CH-CH=CH2 + Br2
бутадиен-1,3
Br Br
1,2
CH2-CH-CH=CH2
3,4-дибромбутен-1
1,4 CH -CH=CH-CH
2
2
Br
Br
1,4-дибромбутен-2
H2
CH 3 -CH 2 -CH 2 -CH 3
бутан
Br2 Br Br Br Br
CH2-CH-CH-CH2
1,2,3,4-тетрабромбутан
17.
Реакции полимеризацииРеакция является основой для получения синтетических каучуков.
.... - C H 2 - C H = C H - C H 2 - .....
n
синтетический
бутадиеновый каучук
n С H 2= C H-C H = C H 2
бутадиен-1,3
Полимеризация сопряженных диенов протекает по механизму 1,4-присоединения, в этом случае
звено имеет цис- или транс-конфигурацию:
H
....
С=С
CH2
CH2
цис-
H
H
.....
С=С
CH2
CH2
....
H
транс-
Вулканизация – процесс, в котором происходит сшивание полимерных цепей за счет сульфидных мостиков, с
образованием эластичного материала, называемого резиной. Нагревании каучука проводят с серой в
количестве 8%.
Это приводит к увеличению прочности, устойчивости к истиранию, к действию органических растворителей и
других веществ.
18.
ПрименениеОсновная область применения диенов – это получение полимеров,
обладающих высокой эластичностью и напоминающих природный каучук.
изопрен (2-метилбутадиен-1,3) натуральный каучук – в производстве камер и покрышек
для автомобилей, самолетов, мотоциклов, тракторов, велосипедов, для производства
обуви, игрушек;
дивинил (бутадиен-1,3) синтетический каучук – в производстве шин, обмотки кабелей и
проводов;
хлоропрен (2-хлорбутадиен-1,3) – в производстве резины, обладающей бензо-, масло- и
теплостойкость.
19.
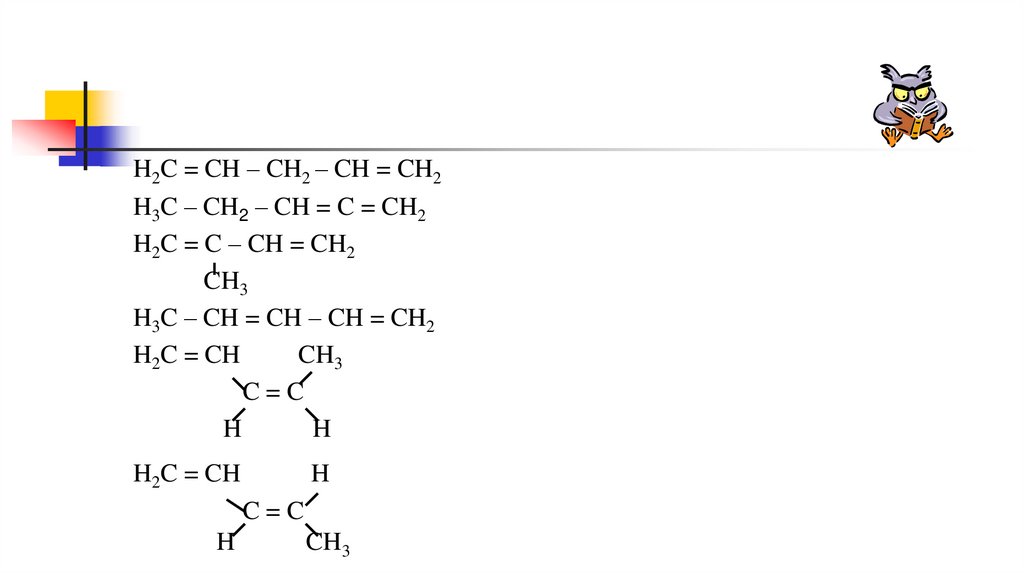
H2C = CH – CH2 – CH = CH2H3C – CH2 – CH = C = CH2
H2C = C – CH = CH2
CH3
H3C – CH = CH – CH = CH2
H2C = CH
CH3
C=C
H
H
H2C = CH
H
C=C
H
CH3
20.
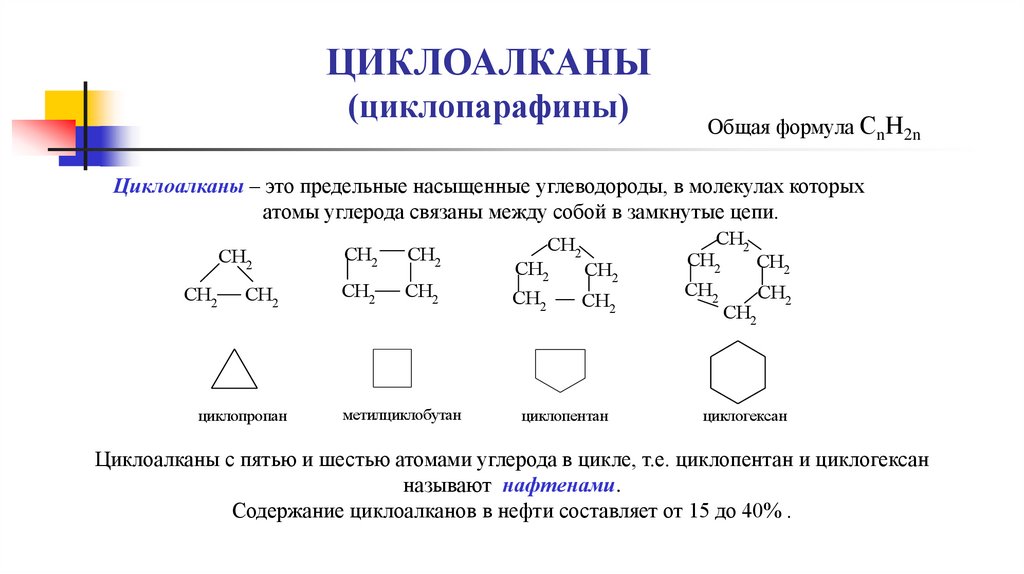
ЦИКЛОАЛКАНЫ(циклопарафины)
Общая формула СnH2n
Циклоалканы – это предельные насыщенные углеводороды, в молекулах которых
атомы углерода связаны между собой в замкнутые цепи.
CH2
CH2
CH2
циклопропан
CH2
CH2
CH2
CH2
метилциклобутан
CH2
CH2
CH2
CH2
CH2
CH2
циклопентан
CH2
CH2
CH2
CH2
CH2
циклогексан
Циклоалканы с пятью и шестью атомами углерода в цикле, т.е. циклопентан и циклогексан
называют нафтенами.
Содержание циклоалканов в нефти составляет от 15 до 40% .
21.
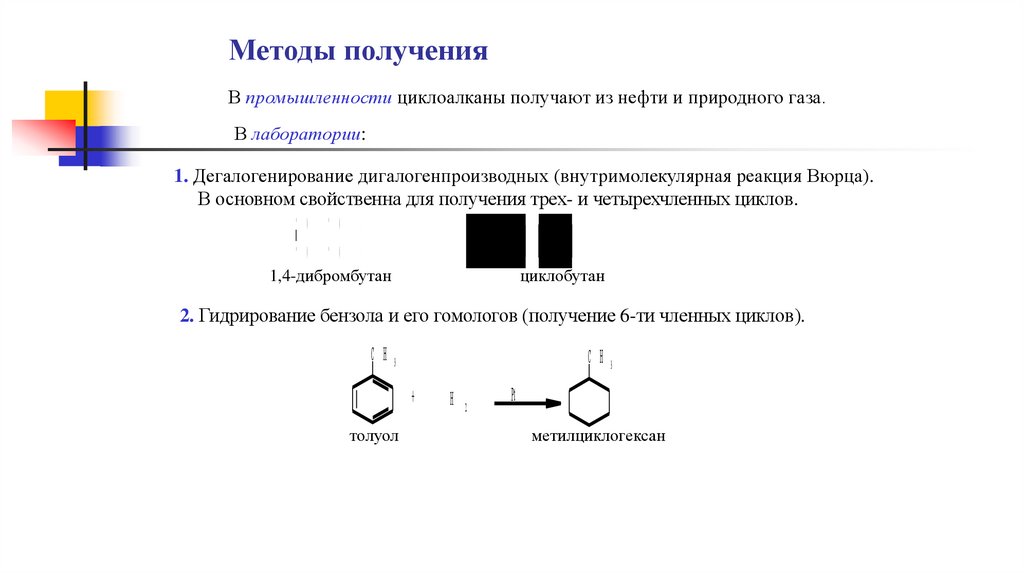
Методы полученияВ промышленности циклоалканы получают из нефти и природного газа.
В лаборатории:
1. Дегалогенирование дигалогенпроизводных (внутримолекулярная реакция Вюрца).
В основном свойственна для получения трех- и четырехчленных циклов.
C H 2- C H 2- B r
C H 2- C H 2- B r
t
Z n
+
+
Z n B r2
циклобутан
1,4-дибромбутан
2. Гидрирование бензола и его гомологов (получение 6-ти членных циклов).
C H 3
C H 3
+
толуол
H 2
Pt
метилциклогексан
22.
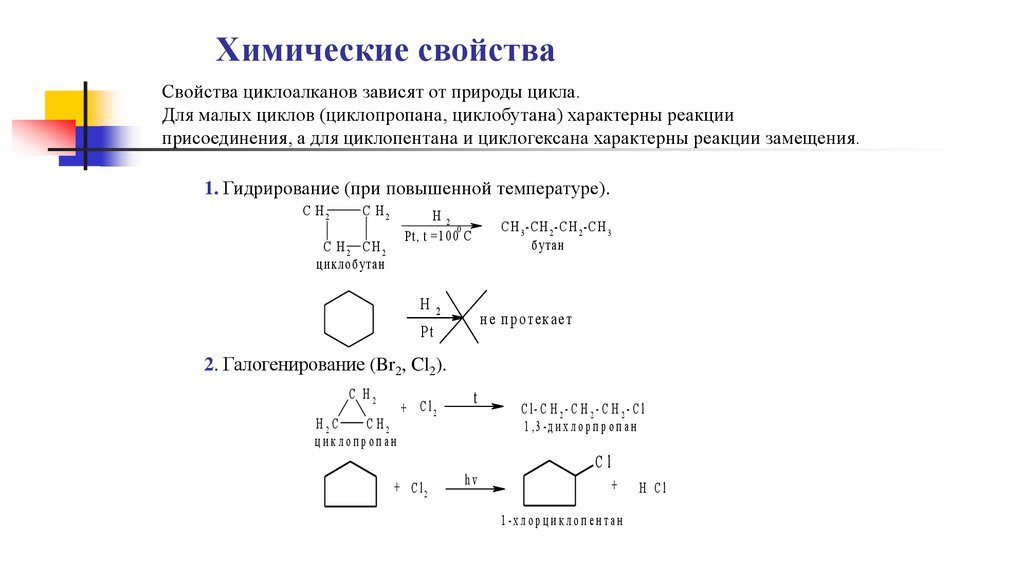
Химические свойстваСвойства циклоалканов зависят от природы цикла.
Для малых циклов (циклопропана, циклобутана) характерны реакции
присоединения, а для циклопентана и циклогексана характерны реакции замещения.
1. Гидрирование (при повышенной температуре).
C H2
C H2
H2
0
Pt, t = 1 0 0 C
C H2 CH2
ц и кло б утан
C H 3 -C H 2 -C H 2 -C H 3
б утан
H2
н е п р о тек ает
Pt
2. Галогенирование (Br2, Cl2).
C H2
H2C
C H2
циклопропан
+ C l2
+ C l2
t
hv
C l- C H 2- C H 2- C H 2- C l
1 ,3 - д и х л о р п р о п а н
Cl
+
1 -х л о р ц и к л о п е н т а н
H Cl
23.
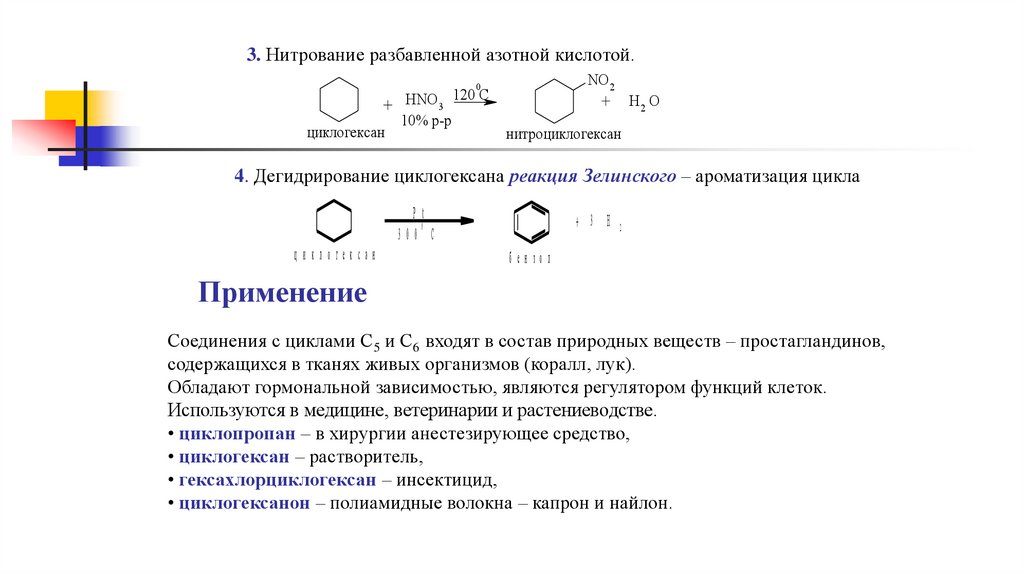
3. Нитрование разбавленной азотной кислотой.NO 2
0
120 С
+ HNO 3
10% р-р
циклогексан
+
H2 O
нитроциклогексан
4. Дегидрирование циклогексана реакция Зелинского – ароматизация цикла
P t
0
300 C
ц и клогексан
+ 3 H 2
бен зол
Применение
Соединения с циклами С5 и С6 входят в состав природных веществ – простагландинов,
содержащихся в тканях живых организмов (коралл, лук).
Обладают гормональной зависимостью, являются регулятором функций клеток.
Используются в медицине, ветеринарии и растениеводстве.
• циклопропан – в хирургии анестезирующее средство,
• циклогексан – растворитель,
• гексахлорциклогексан – инсектицид,
• циклогексанон – полиамидные волокна – капрон и найлон.












 chemistry
chemistry








