Similar presentations:
Ацетиленовые углеводороды. Алкины
1. Ацетиленовые углеводороды. Алкины.
2.
План урока1.
2.
3.
4.
5.
6.
7.
8.
Гомологический ряд алкинов.
Изомерия алкинов.
Номенклатура алкинов.
Строение алкинов.
Физические свойства алкинов.
Химические свойства алкинов.
Получение алкинов.
Применение алкинов.
3.
Алкины• Алкины – непредельные углеводороды,
содержащие в молекуле, помимо одинарных
связей, одну тройную связь между атомами
углерода, и соответствующие общей формуле
СnН2n - 2, где n ≥ 2.
• Алкины относятся к непредельным
углеводородам, так как их молекулы содержат
меньшее число атомов водорода, чем
насыщенные.
4.
Гомологический ряд алкиновC2H2
Этин
C3H4
Пропин
C4H6
Бутин
C5H8
Пентин
C6H10
Гексин
C7H12
Гептин
CnH2n-2
5.
Изомерия алкиновСтруктурная изомерия
1. Изомерия положения тройной связи (начиная с С4Н6):
СН С СН2 СН3
СН3 С С СН3
бутин-1
бутин-2
2. Изомерия углеродного скелета (начиная с С5Н8):
СН С СН2 СН2 СН3
СН С СН СН3
СН3
пентин-1
3-метилбутин-1
3. Межклассовая изомерия с алкадиенами и
циклоалкенами, (начиная с С4Н8):
СН С–СН2–СН
бутин-1
СН2=СН–СН=СН2
бутадиен-1,3
СН = СН
СН2 –СН2
циклобутен
6.
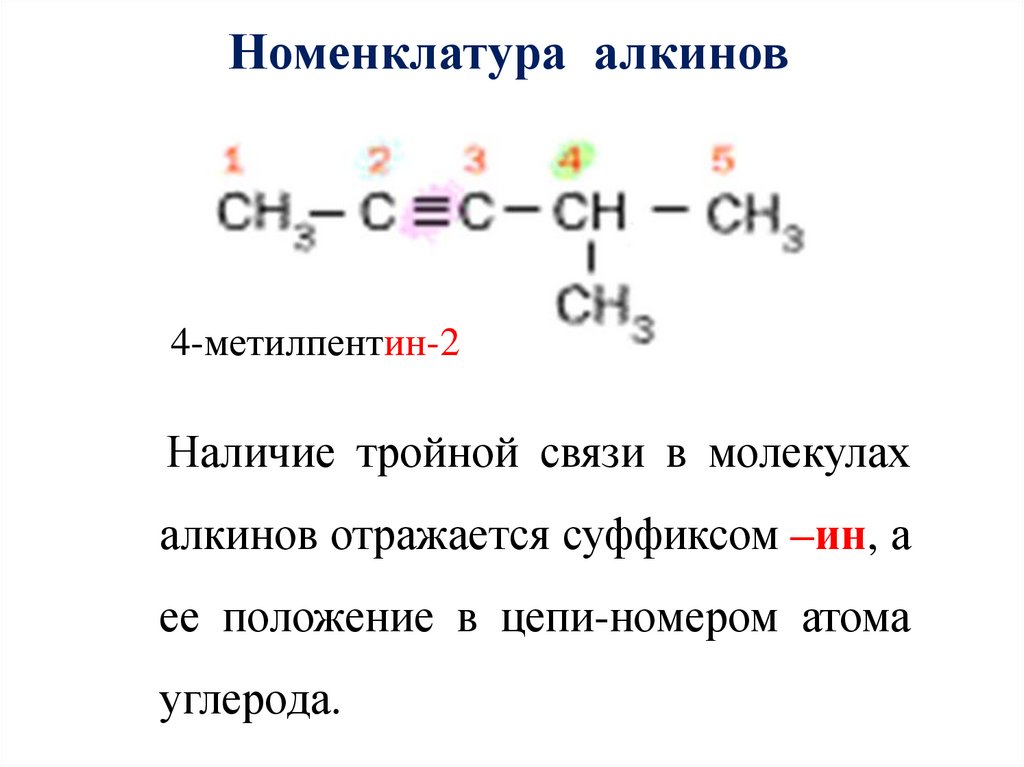
Номенклатура алкинов4-метилпентин-2
Наличие тройной связи в молекулах
алкинов отражается суффиксом –ин, а
ее положение в цепи-номером атома
углерода.
7.
Правила построения названий алкинов посистематической международной
номенклатуре ИЮПАК
• Выбрать самую длинную цепь атомов углерода;
• Пронумеровать ее с той стороны, к которой ближе
тройная связь;
• Указать положения и названия радикалов;
• Цифры от цифр отделяют запятыми, цифры от слов –
дефисами;
• Назвать главную цепь с суффиксом –ин (по числу атомов
углерода в главной цепи)
• В конце указать номер атома углерода содержащего
тройную связь
8.
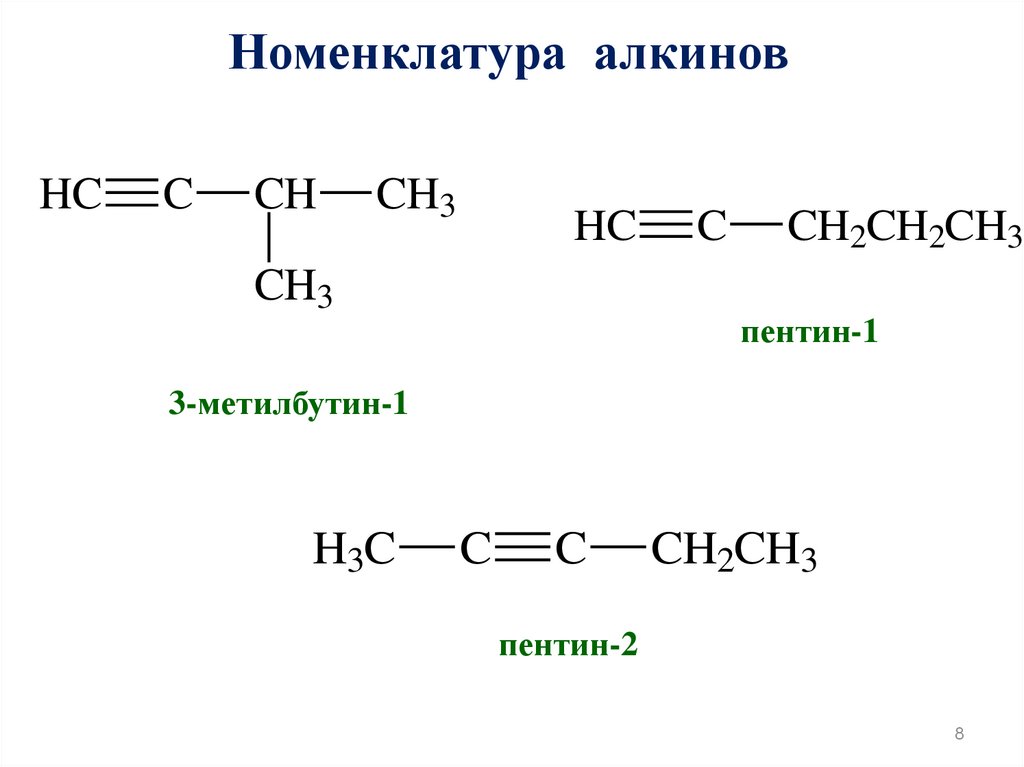
Номенклатура алкиновHC
C
CH
CH3
HC
CH3
C
CH2CH2CH3
пентин-1
3-метилбутин-1
H3C
C
C
CH2CH3
пентин-2
8
9.
Выполните задание• Назовите вещество.
• Составьте к нему три изомера разных
видов изомерии. Назовите изомеры.
10.
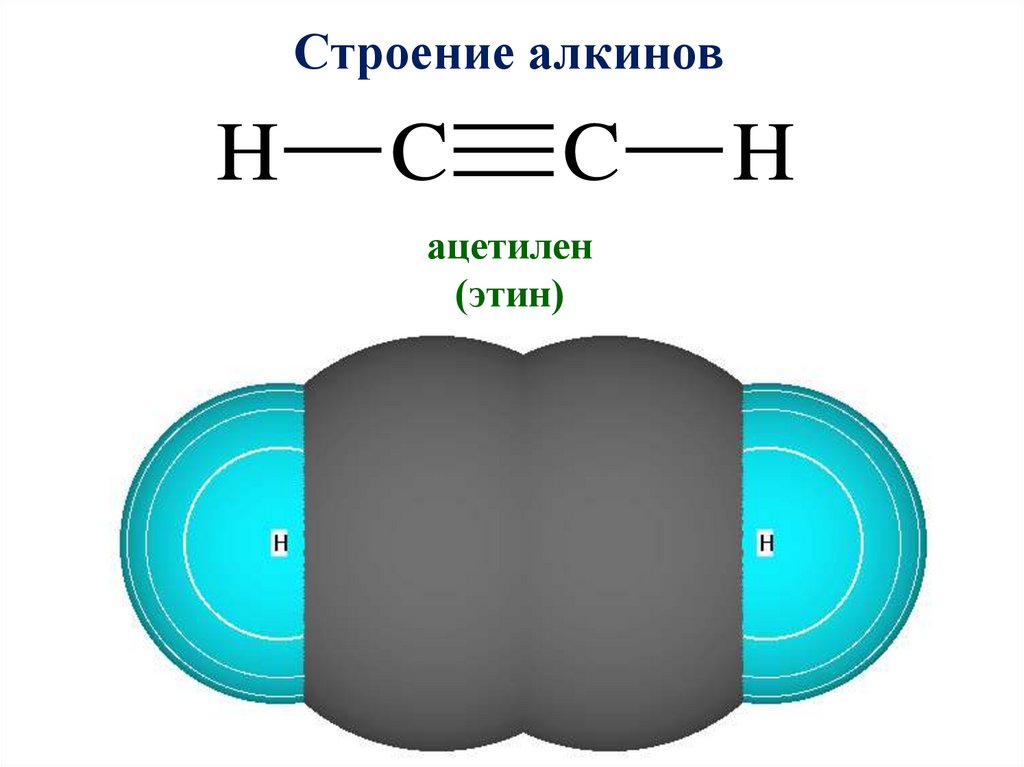
Строение алкинов11.
Строение алкиновH
C
C
ацетилен
(этин)
H
12.
Строение алкинов• Вид гибридизации –
sp
Валентный угол –
180
Длина связи С = С –
0,12 нм
Строение ─
линейное
Вид связи – ковалентная полярная
• По типу перекрывания – δ и 2 π
13.
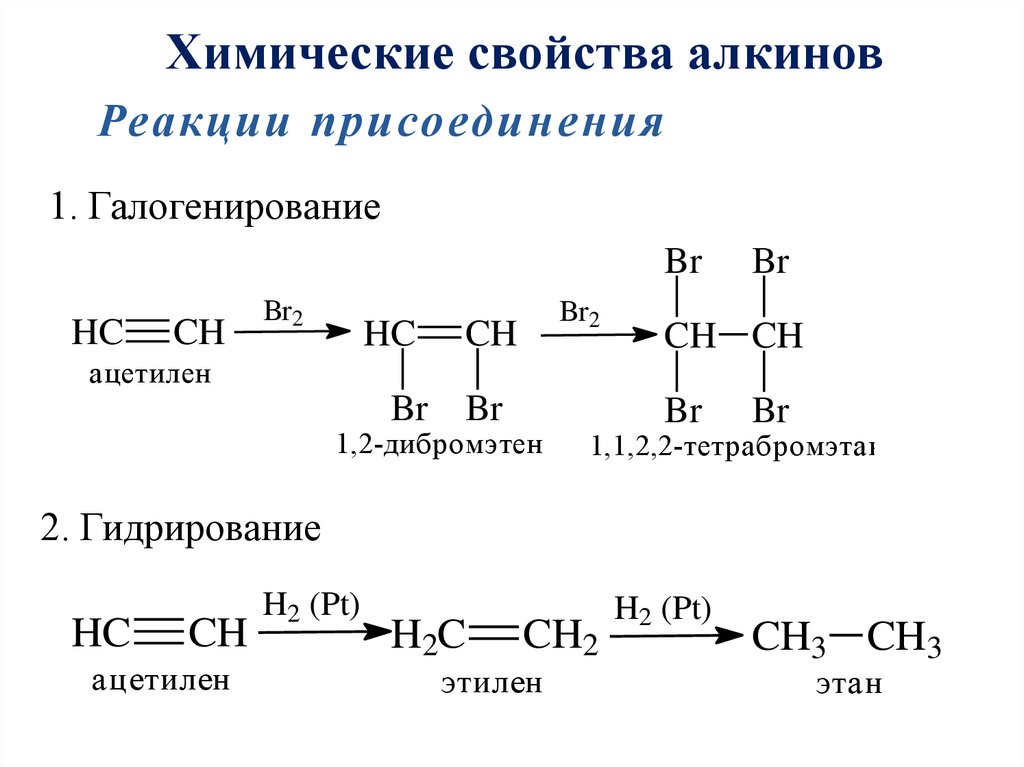
Химические свойства алкиновРеакции присоединения
1. Галогенирование
Br
HC
CH
Br2
HC
Br2
CH
Br
CH CH
ацетилен
Br
Br
1,2-дибромэтен
Br
Br
1,1,2,2-тетрабромэтан
2. Гидрирование
HC
CH
ацетилен
H2 (Pt)
H2C
CH2
этилен
H2 (Pt)
CH3 CH3
этан
14.
Химические свойства алкинов3. Гидротация
O
CH3C
CH + H2O
Hg+2, H2SO4
CH3 C
CH3
пропанон
(ацетон)
4. Гидрогалогенирование
Cl
HC
CH
HCl
HC
ацетилен
Cl
CH2
1-хлорэтен
(хлористый
винил)
HCl
CH CH2
Cl
1,1-дихлорэтан
15.
Химические свойства алкиновРеакции окисления
1. Горения
4CO2 + 2H2O
2HC CH + 5O2
Реакции полимеризации
CH
CH
CH
HC
CH
C (актив.)
400°С
CH
3НC CH С6H6 (бензол)
бензол
16.
Качественные реакции алкинов1. При взаимодействии ацетилена (или R C C H) с
аммиачными растворами оксида серебра выпадают осадки
нерастворимых ацетиленидов:
HC CH + 2[Ag(NH3)2]OH AgC CAg + 4NH3 + 2H2O
2. Ацетилен и его гомологи окисляются перманганатом калия с
расщеплением тройной связи и образованием карбоновых
кислот:
R C C R’ + 3[O] + H2O R COOH + R’ COOH
Алкины обесцвечивают раствор KMnO4, что используется
для их качественного определения.
3. Обесцвечивание бромной воды является качественной
реакцией на все непредельные углеводороды
17.
Получение алкиновАцетилен получают в промышленности двумя
способами:
1. Термический крекинг метана:
1500 С
2СН4 С2Н2 + 3Н2
2. Гидролиз карбида кальция:
CaC2 + 2H2O C2H2 + Ca(OH)2
3. Дегидрогалогенирование :
Br
H3C
CH
CH
Br
2,3-дибромбутан
CH3 + 2KOH
спиртовый
раствор
щелочи
H3C
C
C
CH3 + 2KBr + 2H2O
бутин-2
(диметилацетилен)















 chemistry
chemistry








