Similar presentations:
Особенности соединений углерода, их многообразие, роль в живой природе и практической деятельности человека
1. ОРГАНИЧЕСКАЯ ХИМИЯ Лекция 1
*1.
Особенности соединений углерода, их
многообразие, роль в живой природе и
практической деятельности человека.
2.
3.
4.
Краткая история органической химии.
Классификация органических соединений
Химическая связь в органических
соединениях
Нижник Я.П. http://norgchem.professorjournal.ru
1
11.10.2017
2.
* 1.Особенности соединений углерода, их многообразие,роль в живой природе и практической деятельности
человека.
Органическая химия – раздел химии, изучающий соединения углерода.
Термин был введён шведским химиком Й.Я. Берцелиусом в 1808 году.
Органическая химия изучает свойства органических соединений и
методы их получения
Органические соединения – это углеводороды и их производные.
Производные углеводородов содержат функциональные группы –
атомы или группы атомов, определяющих характерные химические
свойства соединения и принадлежность к определённому классу
соединений.
Нижник Я.П. http://norgchem.professorjournal.ru
2
11.10.2017
3.
* Почемусоединения одного элемента – углерода –
необходимо рассматривать отдельно от всех остальных?
1. Количество соединений углерода огромно
* Атомы
углерода способны связываться друг с другом, образуя
устойчивые цепочки и циклы, что делает количество соединений
углерода в принципе бесконечным.
*
Углерод способен образовывать одинарные, двойные и тройные
связи,
и
устойчивые связи с другими элементами.
Это
определяет огромное разнообразие органических соединений.
2. Соединения углерода имеют очень практическое
большое значение
* Органическая химия – основа биологической химии, молекулярной
биологии и фармакологии, и теоретическая основа для
производства средств защиты растений, моющих средств,
красителей, полимеров, различных нефтепродуктов и т.д.
Нижник Я.П.
http://norgchem.professorjournal.ru
3
11.10.2017
4.
* Зачемизучать
органическую
химию
студентам
нехимических
специальностей,
например
на
агротехническом,
биологическом
и
медицинском
факультетах?
* 1.
Органическая химия – основа биологической химии и
поэтому без знания органической химии невозможно понять
химию живого организма.
* 2.
Каждый специалист, работающий в области, связанной с
удобрениями, гербицидами, инсектицидами, лекарственными
препаратами,
красителями,
пищевыми
добавками,
нефтепродуктами должен знать основы органической химии
чтобы иметь представление о свойствах этих веществ и
потенциальных рисках.
Нижник Я.П.
http://norgchem.professorjournal.ru
4
11.10.2017
5.
Цикл трикарбоновых кислотCOOH
COOH
C O
CH2
CH2
COOH
HO C COOH
COOH
HC OH
CH2
CH2
COOH
COOH
COOH
CH
COOH
C COOH
HC
CH2
CH
COOH
COOH
COOH
HO CH
COOH
HC COOH
CH2
CH2
CH2
COOH
COOH
COOH
SKoA
C
O
C O
COOH
CH2
C
CH2
CH2
Нижник Я.П.
COOH
http://norgchem.professorjournal.ru
O
CH2 5
COOH
HC COOH
CH2
COOH
11.10.2017
6. 2. Краткая история органической химии
*2.1. Эмпирический период
В 17-18 вв. было получено большое количество органических
соединений в индивидуальном виде, таких например, как
щавелевая, лимонная, яблочная, мочевая, муравьиная кислоты,
мочевина и т.д.
2.2. Аналитический период
* Это 18 век – середина 19 века.
* Все органические соединения содержат углерод.
* Были созданы две теории – теория радикалов и теория типов.
* Представление о “жизненной силе” и концепция “витализма”,
утверждавшая наличие в организмах некой нематериальной
“жизненной силы” (vis vitalis) с помощью которой организм
синтезирует сложные органические вещества.
* Первый органический синтез провёл немецкий химик Ф. Вёлер в
1828 году нагреванием неорганического соединения – изоцианата
аммония, при этом образовывалась мочевина:
NH4OCN
Нижник Я.П.
http://norgchem.professorjournal.ru
t
6
CO(NH2)2
11.10.2017
7.
2.3. Структурный этап. 19 век – начало 20 века.* Немецкие
химики А. Кекуле и Г. Кольбе установили
четырёхвалентность углерода и высказали мысль о
способности атомов углерода соединяться в длинные
цепочки.
* Русский химик А.М. Бутлеров создал структурную теорию :
* “структура” – последовательность атомов и связей между
атомами в молекуле
* структура
определяет химические и физические свойства
веществ
* Голландский
химик Я.Х. Вант-Гофф и французский химик
Ж.А. Ле Бель представление о пространственном трёхмерном
строении органических молекул (1874).
Нижник Я.П.
http://norgchem.professorjournal.ru
7
11.10.2017
8.
CH3 CH2 CH2 CH2 OHCH3 CH2 CH OH
н-бутиловый спирт
втор-бутиловый спирт
CH3
CH3 CH CH2 OH
CH3
изобутиловый спирт
CH3
CH3 C OH
трeт-бутиловый спирт
CH3
O
CH3 C
H2O
Zn(CH3)2
CH3 C OH
Cl
Нижник Я.П.
http://norgchem.professorjournal.ru
CH3
CH3
8
11.10.2017
9.
2.4. Современный период*Развитие синтетической органической химии
*Внедрение квантово-механических
представлений и физических методов
исследования веществ
*Тесная связь с другими дисциплинами – с
физической, неорганической, биологической
и координационной химией.
Нижник Я.П.
http://norgchem.professorjournal.ru
9
11.10.2017
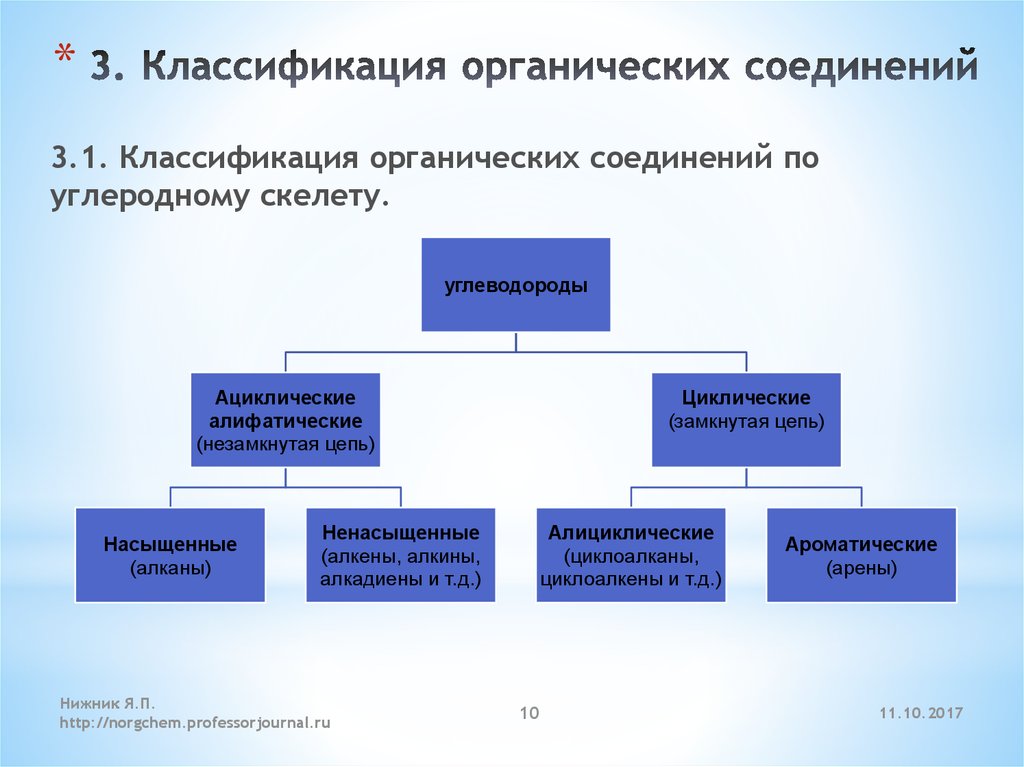
10. 3. Классификация органических соединений
*3.1. Классификация органических соединений по
углеродному скелету.
углеводороды
Ациклические
алифатические
(незамкнутая цепь)
Насыщенные
(алканы)
Циклические
(замкнутая цепь)
Ненасыщенные
(алкены, алкины,
алкадиены и т.д.)
Нижник Я.П.
http://norgchem.professorjournal.ru
Алициклические
(циклоалканы,
циклоалкены и т.д.)
10
Ароматические
(арены)
11.10.2017
11.
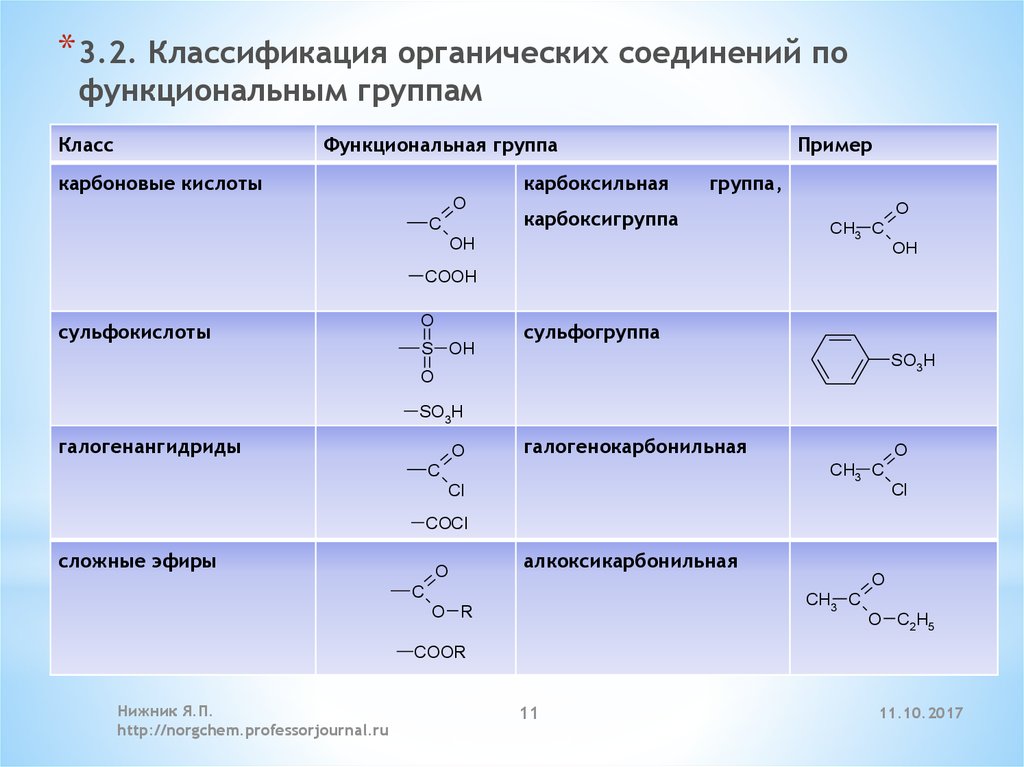
* 3.2. Классификация органических соединений пофункциональным группам
Класс
Функциональная группа
Таблица
1. Классы
карбоновые
кислоты
органических
соединений
O
C
карбоксильная
Пример
группа,
карбоксигруппа
OH
O
CH3 C
OH
COOH
сульфокислоты
O
сульфогруппа
S OH
SO3H
O
SO3H
галогенангидриды
O
галогенокарбонильная
O
CH3 C
C
Cl
Cl
COCl
сложные эфиры
O
алкоксикарбонильная
O
C
CH3 C
O R
O C2H5
COOR
Нижник Я.П.
http://norgchem.professorjournal.ru
11
11.10.2017
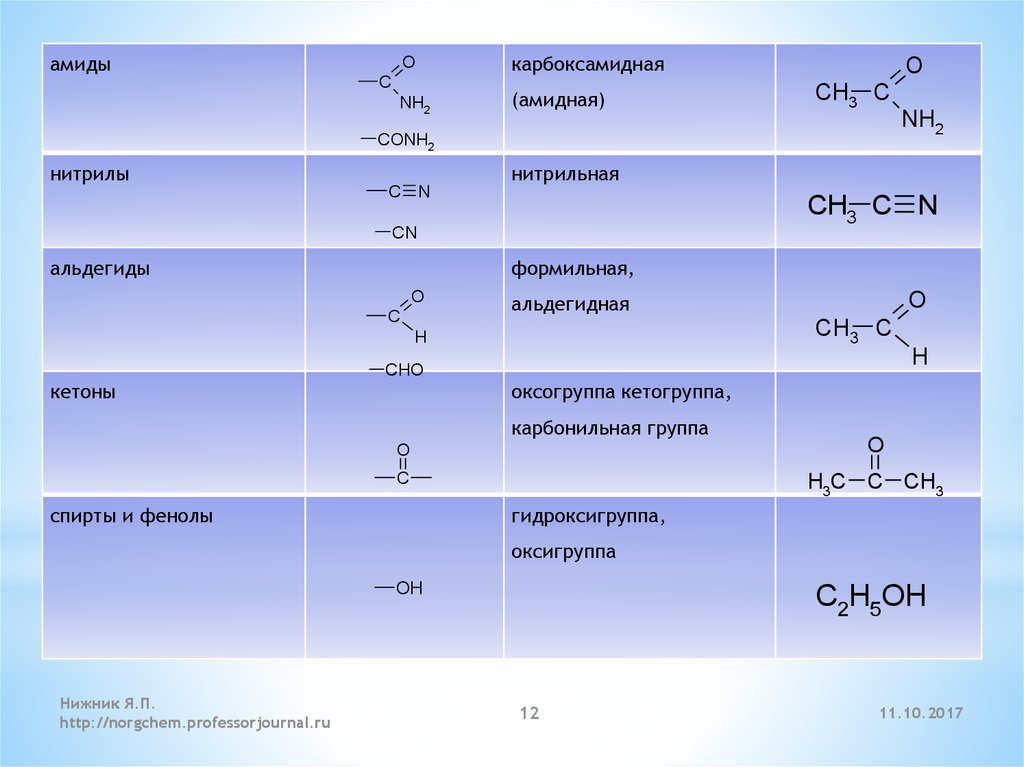
12.
амидыO
карбоксамидная
NH2
(амидная)
C
O
CH3 C
CONH2
нитрилы
NH2
нитрильная
C N
CH3 C N
CN
альдегиды
формильная,
O
C
O
альдегидная
CH3 C
H
H
CHO
кетоны
оксогруппа кетогруппа,
карбонильная группа
O
O
C
H3C C CH3
спирты и фенолы
гидроксигруппа,
оксигруппа
OH
Нижник Я.П.
http://norgchem.professorjournal.ru
C2H5OH
12
11.10.2017
13.
меркаптаны,тиолы
меркаптогруппа,
SH
тиогруппа,
сульфанильная группа
амины
аминогруппа
NH2
простые эфиры
C2H5 NH2
алкоксигруппа
O R
нитросоединения
C2H5SH
+ O
C2H5 O
C2H5
нитрогруппа
N
CH3NO2
O
NO2
нитрозосоединения
нитрозогруппа
N O
NO
NO
галогенопроизводные
-F, -Cl, -Br, -I
Нижник Я.П. http://norgchem.professorjournal.ru
галоген
13
C2H5Cl
11.10.2017
14.
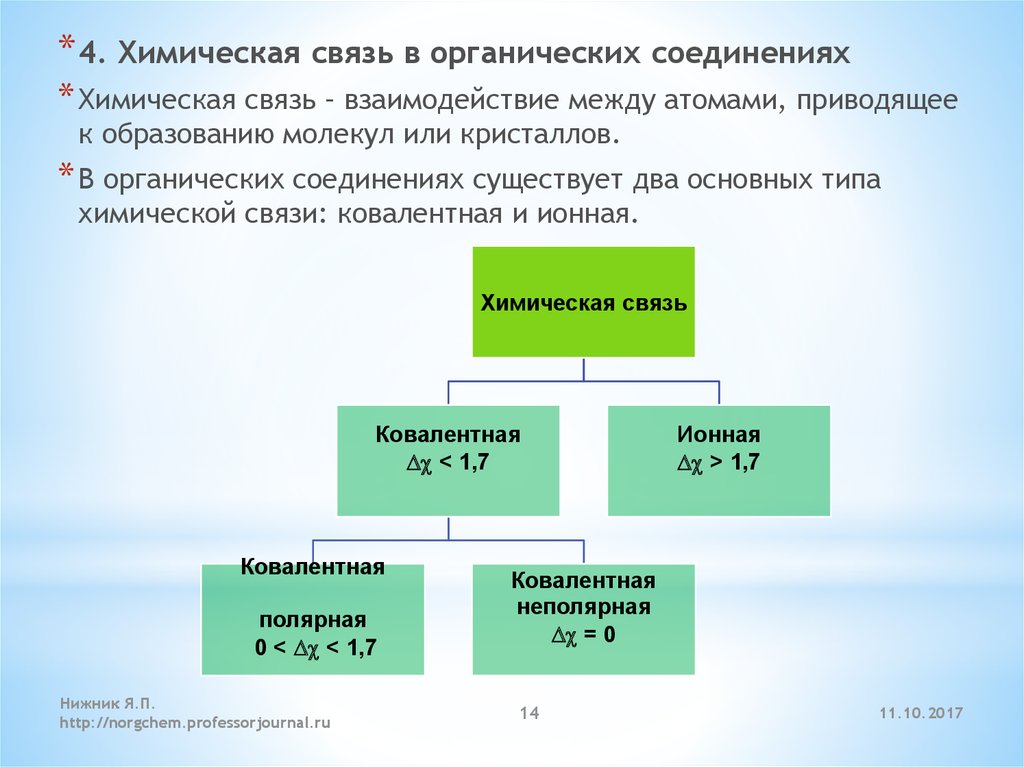
* 4. Химическая связь в органических соединениях* Химическая связь – взаимодействие между атомами, приводящее
к образованию молекул или кристаллов.
* В органических соединениях существует два основных типа
химической связи: ковалентная и ионная.
Химическая связь
Ковалентная
Dc < 1,7
Ковалентная
полярная
0 < Dc < 1,7
Нижник Я.П.
http://norgchem.professorjournal.ru
Ионная
Dc > 1,7
Ковалентная
неполярная
Dc = 0
14
11.10.2017
15.
* 4.1. Ионная связь* Встречается в органических соединениях редко
H3C
CH3
N
C
+
H3C N
NO2
Cl
Na
C
N
CH3
+
CH3
O2N
NO2
CH3
CH3 COO
Нижник Я.П.
http://norgchem.professorjournal.ru
15
-
Na
+
11.10.2017
16.
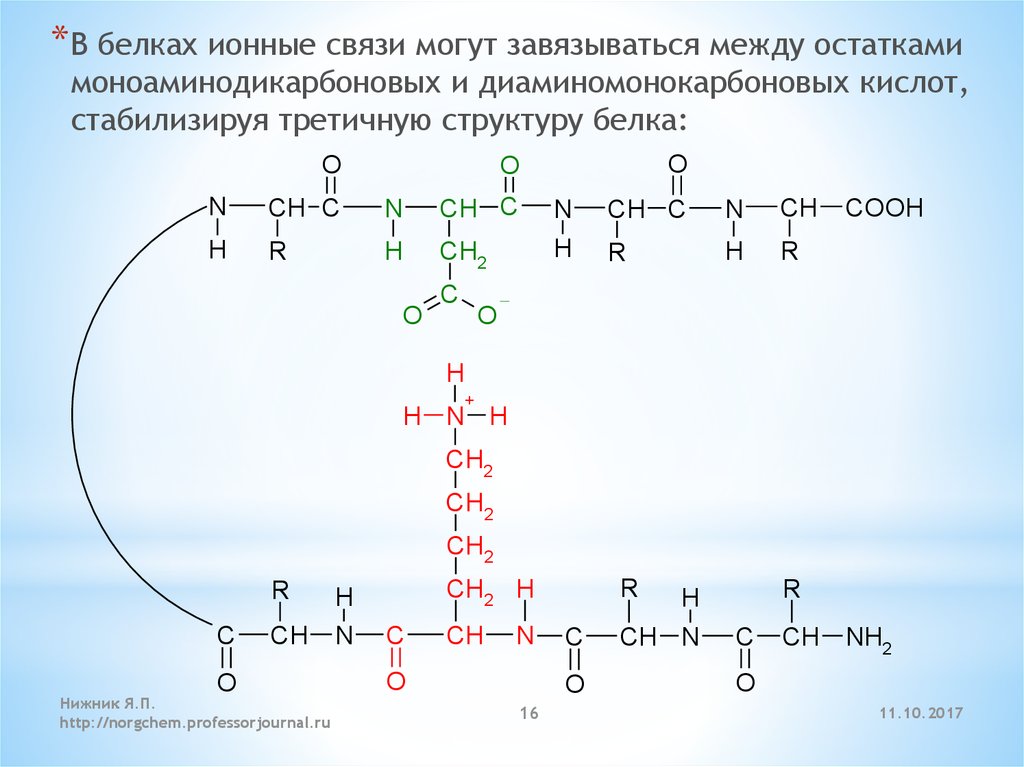
* В белках ионные связи могут завязываться между остаткамимоноаминодикарбоновых и диаминомонокарбоновых кислот,
стабилизируя третичную структуру белка:
O
O
O
N
CH C
N
CH C
N
CH C
N
CH
H
R
H
CH2
H
R
H
R
O
C
COOH
O
H
+
H N H
CH2
CH2
CH2
R
C
O
CH
Нижник Я.П.
http://norgchem.professorjournal.ru
H
N
R
CH2 H
C
CH
N
O
C
O
16
R
H
CH N
C
CH NH2
O
11.10.2017
17.
* 4.2. Ковалентная связь* Ковалентная связь является основной в органических
соединениях. Такая связь образуется путём обобществления
пары электронов двух атомов.
.
H. H
H. + . H
H
H
C.
H
H H
H
+
.C
H
H
H
H H
H
Нижник Я.П.
http://norgchem.professorjournal.ru
.
C. C
17
11.10.2017
18.
* 4.2.1. Классификация ковалентных связей.* I. По полярности.
H H
H C C
H
H
H H
OH
H H
Нижник Я.П.
http://norgchem.professorjournal.ru
H
H C C H
C C
H
H H
H C C
H
H
H
C C
H
Cl
18
H C C Cl
11.10.2017
19.
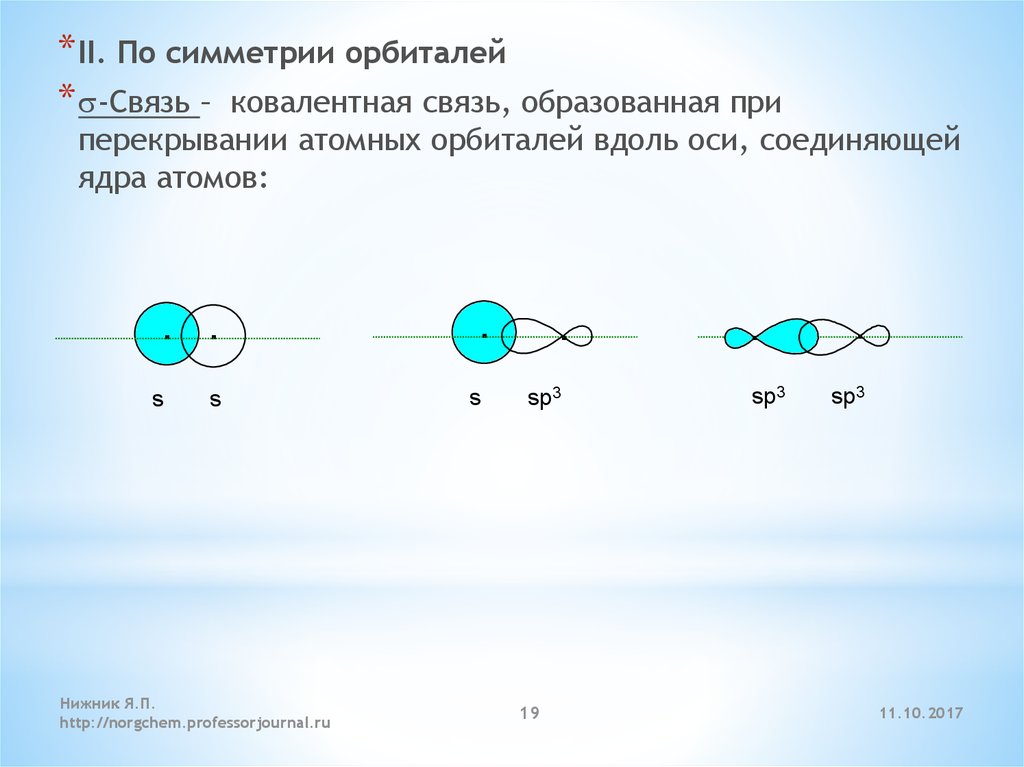
* II. По симметрии орбиталей* s-Cвязь – ковалентная связь, образованная при
перекрывании атомных орбиталей вдоль оси, соединяющей
ядра атомов:
. .
s
s
Нижник Я.П.
http://norgchem.professorjournal.ru
.
s
.
sp3
19
.
sp3
.
sp3
11.10.2017
20.
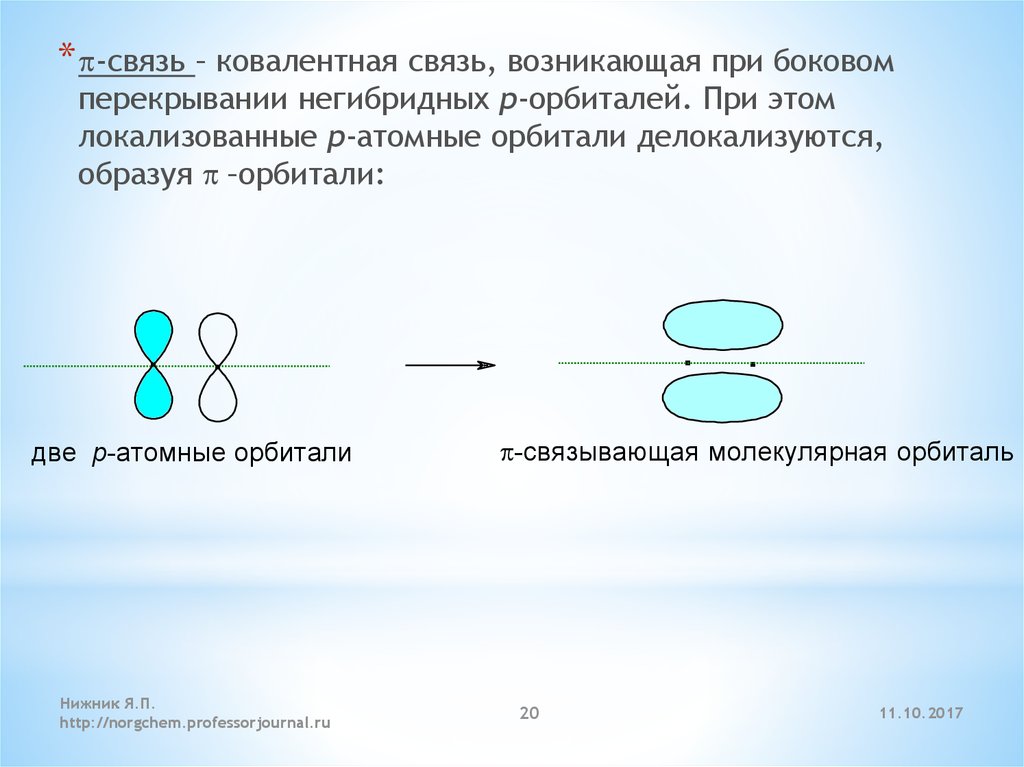
* p-связь – ковалентная связь, возникающая при боковомперекрывании негибридных p-орбиталей. При этом
локализованные p-атомные орбитали делокализуются,
образуя p –орбитали:
. .
. .
двe p-атомныe орбитали
Нижник Я.П.
http://norgchem.professorjournal.ru
p-связывающая молeкулярная орбиталь
20
11.10.2017
21.
* d-Связь – связь, образованная при фронтальномперекрывании d-орбиталей:
Такая связь образуется в неорганических соединениях
между атомами металлов
Нижник Я.П.
http://norgchem.professorjournal.ru
21
11.10.2017
22.
* III.Классификация ковалентных связей по способу образования
* Обменный
механизм. В образовании связи участвуют одноэлектронные атомные
орбитали. Каждый атом предоставляет 1 электрон для образования общей пары:
.
H. H
H. + . H
H
H
C.
H H
H
+
H
Нижник Я.П.
http://norgchem.professorjournal.ru
.C
..
H C C
H
H
H H
H
22
11.10.2017
23.
* Донорно-акцепторный механизм. Образование связипроисходит за счёт пары электронов донора и вакантной
(свободной) орбитали акцептора.
.
H +
.
H. H
+
H
семиполярная связь, которая является результатом и ковалентного
взаимодействия и притяжения противоположных зарядов:
CH3
H3C
CH3
....
O
..
.
N.
H3C
CH3
CH3
CH3
H3C N
Нижник Я.П.
http://norgchem.professorjournal.ru
....
.
N .O
..
CH3
CH3
+
O
H3C N
23
CH3
O
11.10.2017
24.
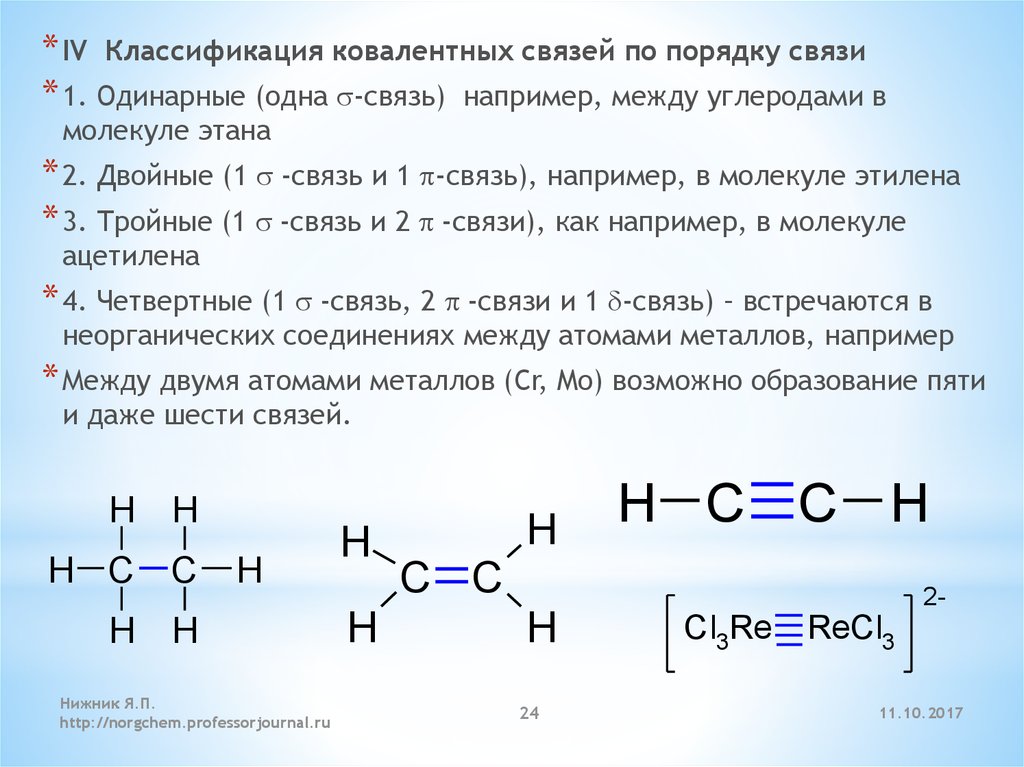
* IV Классификация ковалентных связей по порядку связи* 1. Одинарные (одна s-связь) например, между углеродами в
молекуле этана
* 2. Двойные (1 s -связь и 1 p-связь), например, в молекуле этилена
* 3. Тройные (1 s -связь и 2 p -связи), как например, в молекуле
ацетилена
* 4. Четвертные (1 s -связь, 2 p -связи и 1 d-связь) – встречаются в
неорганических соединениях между атомами металлов, например
* Между двумя атомами металлов (Cr, Mo) возможно образование пяти
и даже шести связей.
H H
H C C
H
H H
Нижник Я.П.
http://norgchem.professorjournal.ru
H
H
H
H C C H
C C
2-
H
24
Cl3Re
ReCl3
11.10.2017
25.
* 4.2.3. Характеристики ковалентных связей* Ι. Энергия связи
* ΙΙ. Длина связи
* ΙΙΙ. Полярность
* IV. Поляризуемость
связь
Энергия связи, кДж/моль*
Длина связи, нм**
С–С
346
0,154
С=С
606
0,134
С≡С
828
0,120
Нижник Я.П.
http://norgchem.professorjournal.ru
25
11.10.2017
26.
* 4.2.4. Гибридизация* Электронное строение атома углерода
1s2
2s2
2p2
1s2
2s1
2p3
H
H C :
H C H
H
H
Нижник Я.П.
http://norgchem.professorjournal.ru
26
11.10.2017
27.
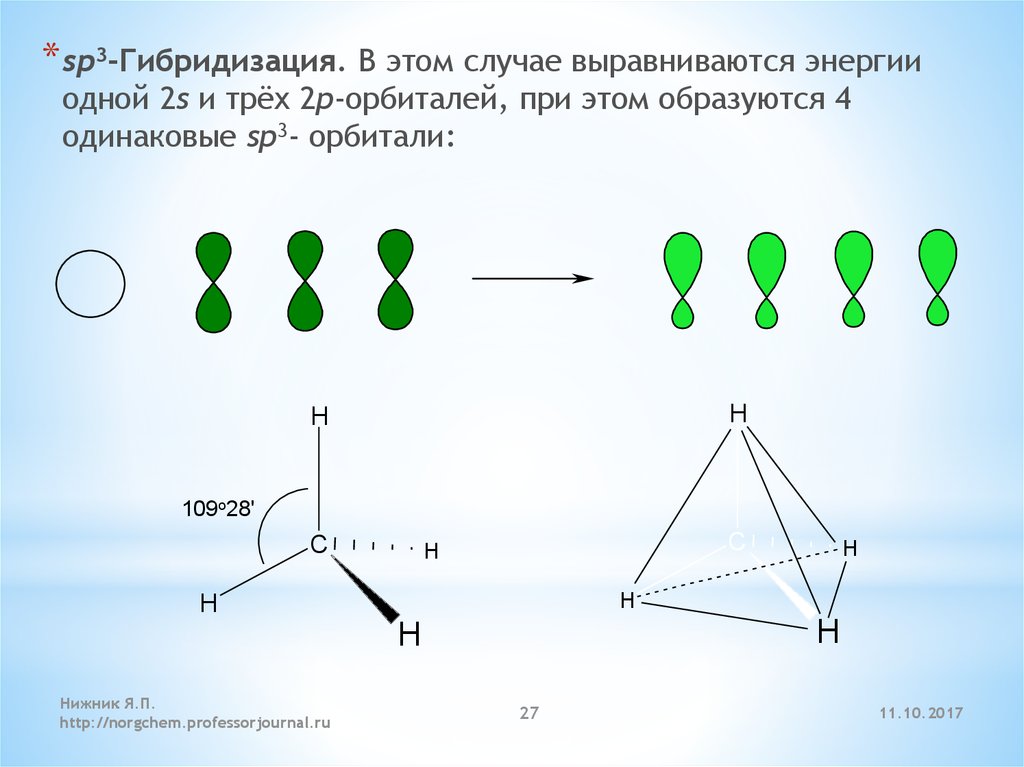
* sp3-Гибридизация. В этом случае выравниваются энергииодной 2s и трёх 2p-орбиталей, при этом образуются 4
одинаковые sp3- орбитали:
H
H
109o28'
C
C
H
H
H
H
H
Нижник Я.П.
http://norgchem.professorjournal.ru
H
27
11.10.2017
28.
* sp2-Гибридизация. Энергии одной 2s и двух 2p-орбиталейвыравниваются, при этом образуются 3 одинаковые sp2-
орбитали и остаётся одна негибридная p-орбиталь:
Нижник Я.П.
http://norgchem.professorjournal.ru
28
11.10.2017
29.
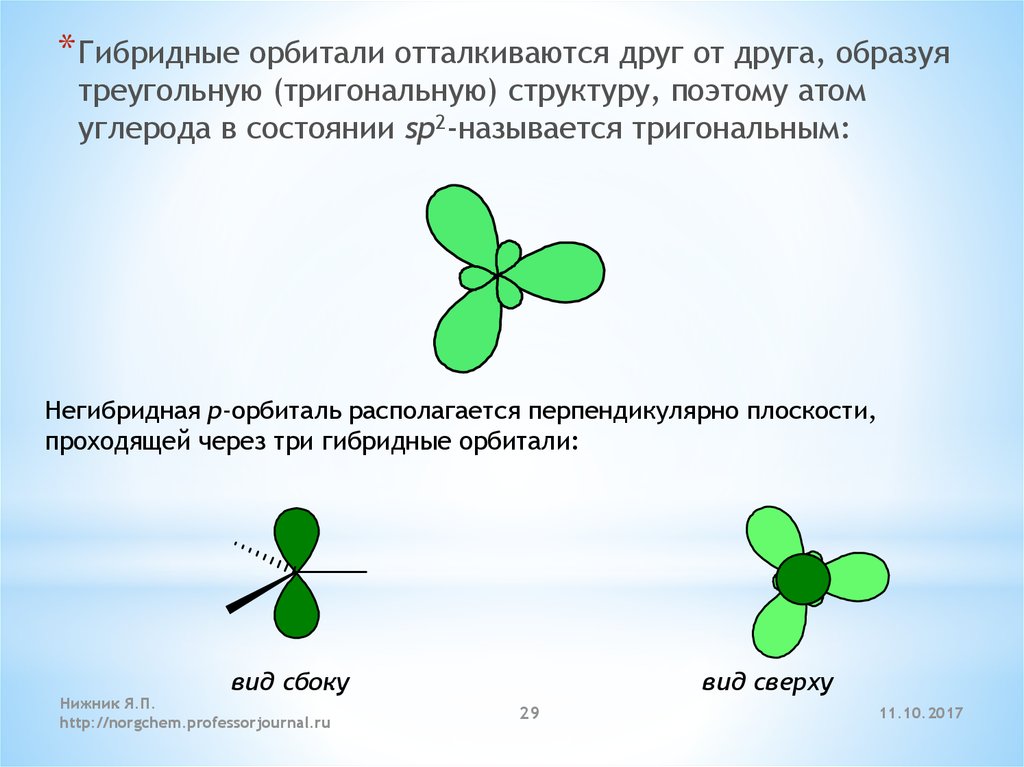
* Гибридные орбитали отталкиваются друг от друга, образуятреугольную (тригональную) структуру, поэтому атом
углерода в состоянии sp2-называется тригональным:
Негибридная p-орбиталь располагается перпендикулярно плоскости,
проходящей через три гибридные орбитали:
вид сбоку
Нижник Я.П.
http://norgchem.professorjournal.ru
вид сверху
29
11.10.2017
30.
* Три sp2-гибридные орбитали участвуют в образовании трёх s-связей:например в этилене:
H
~120o
C
~120o
H
~120o
H
C
H
Две негибридные орбитали перекрываются с образованием p-связи:
Нижник Я.П.
http://norgchem.professorjournal.ru
30
11.10.2017
31.
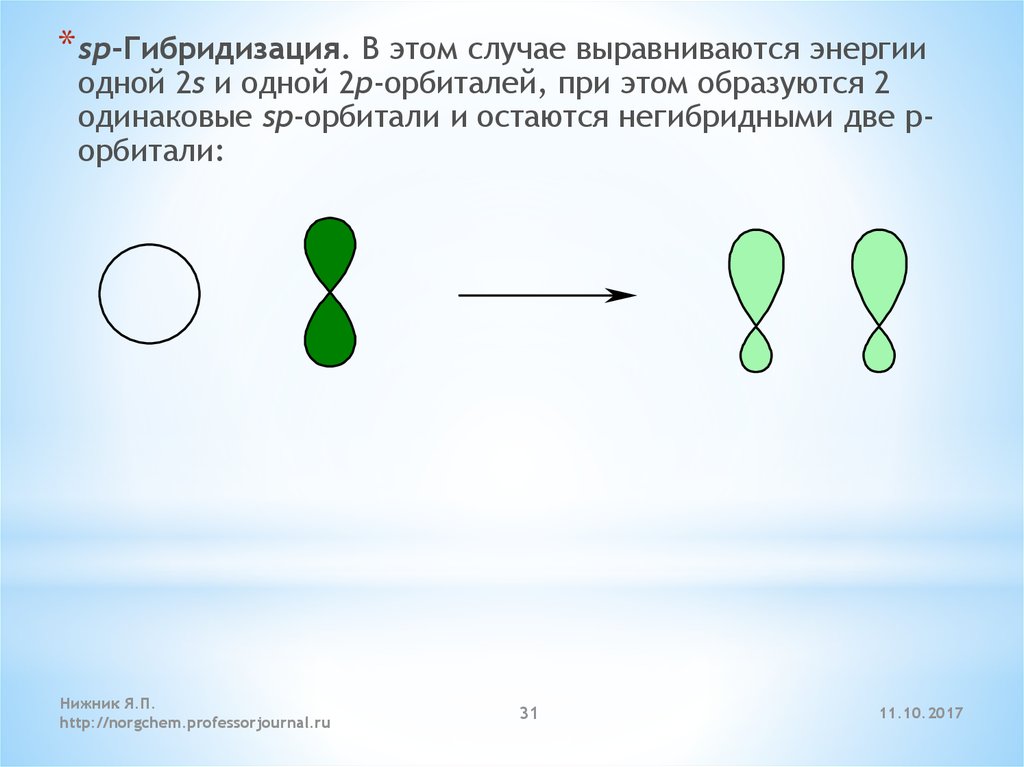
* sp-Гибридизация. В этом случае выравниваются энергииодной 2s и одной 2p-орбиталей, при этом образуются 2
одинаковые sp-орбитали и остаются негибридными две pорбитали:
Нижник Я.П.
http://norgchem.professorjournal.ru
31
11.10.2017
32.
* Две sp-гибридные орбитали отталкиваются друг от друга, приэтом максимумы электронной плотности располагаются на
одной прямой
x
Две негибридные p-орбитали располагаются перпендикулярно друг другу в
одной плоскости, которая перпендикулярна этой прямой x:
y
y
x
Нижник Я.П.
http://norgchem.professorjournal.ru
z
32
11.10.2017
33.
* Молекула ацетилена содержит атомы углерода в состоянии spгибридизации180o
H
C
C
H
За счёт гибридных орбиталей образуют связи с атомами водорода и s-связь
между атомами углерода:
x
Негибридные p-орбитали перекрываются, образуя две p-связи:
H
Нижник Я.П.
http://norgchem.professorjournal.ru
H
H
33
C
C
H
11.10.2017
34.
* 4.3. Другие типы взаимодействийВодородная связь – притяжение протонизированного атома водорода,
присоединённого к атому электроотрицательного элемента, к любому другому
атому, несущему отрицательный заряд.
H F ... H F
Нижник Я.П.
http://norgchem.professorjournal.ru
34
... H
F
11.10.2017
35.
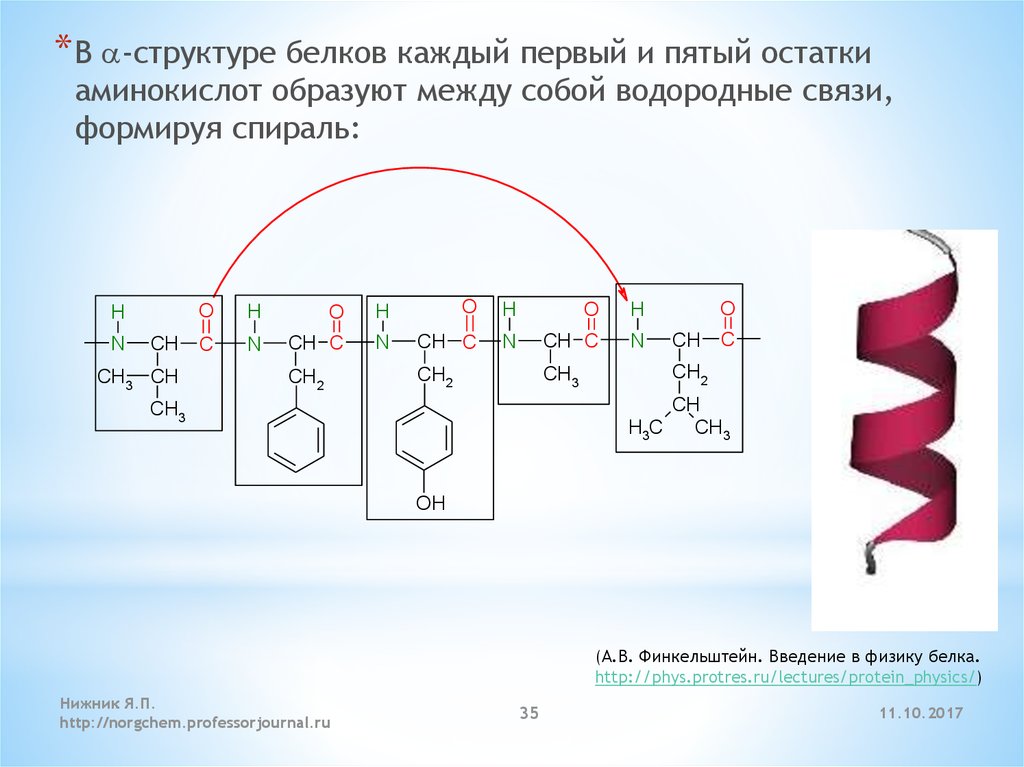
* В a-структуре белков каждый первый и пятый остаткиаминокислот образуют между собой водородные связи,
формируя спираль:
H
N
CH
CH3 CH
O
H
O
H
O
H
O
H
C
N
CH C
N
CH C
N
CH C
N
CH2
CH3
CH2
O
CH
C
CH2
CH
H3C
CH3
CH3
OH
(А.В. Финкельштейн. Введение в физику белка.
http://phys.protres.ru/lectures/protein_physics/)
Нижник Я.П.
http://norgchem.professorjournal.ru
35
11.10.2017
36.
* водородные связи между комплементарными основаниями вдвойной спирали ДНК: между аденином и тимином
образуются три водородные связи, а между гуанином и
цитозином завязываются две связи:
H
O.
N
N
R
. .H
N H
...
N
N
N
N H
...
N
N
R
N
O
H
N H.
N
..O
. . .H
CH3
N
N
N
O
R
H
Нижник Я.П.
http://norgchem.professorjournal.ru
36
11.10.2017
R
37.
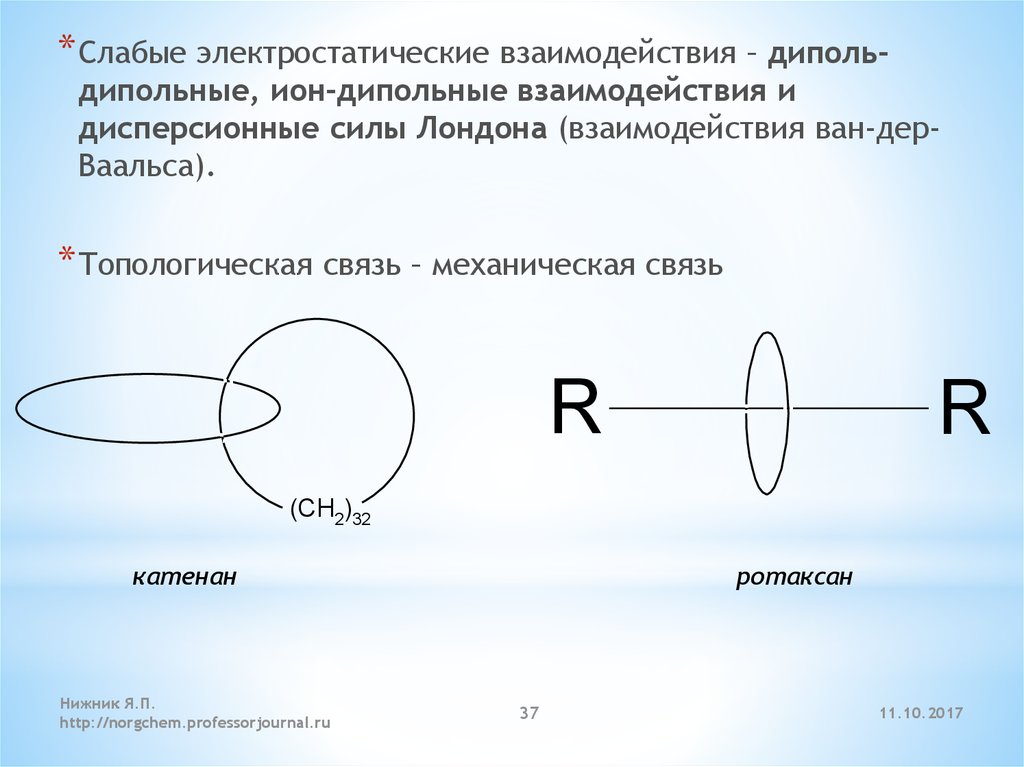
* Слабые электростатические взаимодействия – диполь-дипольные, ион-дипольные взаимодействия и
дисперсионные силы Лондона (взаимодействия ван-дерВаальса).
* Топологическая связь – механическая связь
..
.
R
. ..
R
(CH2)32
катенан
Нижник Я.П.
http://norgchem.professorjournal.ru
ротаксан
37
11.10.2017
38. Спасибо за Ваше внимание!
Нижник Я.П.http://norgchem.professorjournal.ru
38
11.10.2017

























 chemistry
chemistry








