Similar presentations:
Сополимеризация. Основные количественные характеристики процесса сополимеризации
1. СОПОЛИМЕРИЗАЦИЯ
• Сополимеризация – процесс совместнойполимеризации двух и более мономеров
является одним из эффективных способов
модификации синтетических полимеров.
Это объясняется тем, что сополимеры часто
обладают более ценными техническими
свойствами, чем полимеры, полученные из
одного мономера. Возможность широкого
изменения состава сополимера позволяет
управлять их свойствами.
2.
• Основнымиколичественными
характеристиками процесса
сополимеризации являются
константы относительной
активности мономеров
(константы
сополимеризации).
3. Основная реакция, определяющая состав сополимера и особенности процесса – рост цепи.
• Для процесса радикальнойсополимеризации характерны
такие же элементарные акты
реакций: инициирование, рост
цепи, обрыв цепи и различные
реакции передачи цепи, что и для
радикальной гомополимеризации.
4.
• При радикальной сополимеризации двух мономеров М1 и М2возможны четыре элементарные реакции роста цепи.
• Реакция роста цепи:
Скорость реакции роста:
K11
__М М *
• 1. __М1* + М1*
V11=K11 [М1*] [М1];
(1)
1 1
K12
__М М *
• 2. __М1* + М2
V12=K12 [М1*] [М2];
(2)
1 2
K21
__М М *
• 3. __М2* + М1
V21=K21 [М2*] [М1];
(3)
2 1
K22
__М М *
• 4. __М2* + М2
V22=K22 [М2*] [М2],
(4)
2 2
• где М1; М2; М1*; М2* – соответствующие мономеры и
радикалы; K11; K12; K21; K22 – константы скоростей реакций
присоединения мономеров к растущим макрорадикалам; [М]
[М*] – молярные концентрации мономеров и растущих
макрорадикалов в реакционной смеси; V11; V12; V21; V22 –
скорости роста цепи.
5.
• Скорости расходования мономеров М1 и М2 в ходереакции, совпадающие со скоростями их включения в
цепь сополимера, определяются следующими
уравнениями:
d [М1]
__ ______________ = K [М *] [М ] + K [М *] [М ] ;
11
1
1
21
2
1
(5)
dt
d [М2]
__ ______________ = K [М *] [М ] + K [М *] [М ] .
12
1
2
22
2
2
(6)
dt
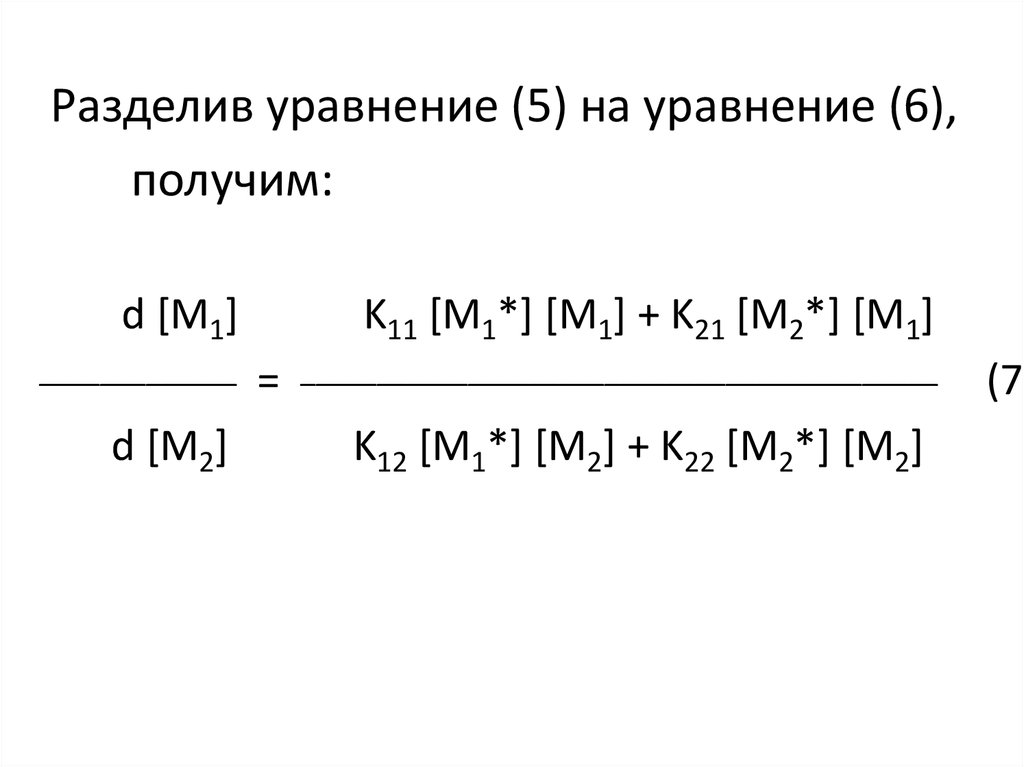
6.
Разделив уравнение (5) на уравнение (6),получим:
d [М1]
_____________
d [М2]
K11 [М1*] [М1] + K21 [М2*] [М1]
=
__________________________________________
K12 [М1*] [М2] + K22 [М2*] [М2]
(7)
7.
• В стационарном состоянииимеет место равенство
скоростей следующих реакций:
• K12 [М1*] [М2] = K21 [М2*] [М1] .
8.
Отношение константы скорости реакции взаимодействия растущего
макрорадикала М1* с мономером М1 к константе скорости реакции
взаимодействия макрорадикала М1* с мономером М2 называют
константой относительной активности мономера М1 в реакции
сополимеризации с мономером М2, или константой сополимеризации.
K11
• r1
=
K12
• Аналогично:
K22
• r2
=
K21
(9)
(10)
9. уравнение, связывающее состав сополимера и мономерной смеси (уравнение состава сополимера)
d [М1]_____________
d [М2]
[М1]
=
________
[М2]
r1 [М1] + [М2]
_________________
r2 [М2] + [М1]
10. На начальных стадиях превращения, когда концентрация мономеров М1 и М2 можно принять постоянными, состав сополимера будет
описываться уравнением:[m1]
_____________
[М1]
=
________
r1 [М1] + [М2]
___________
[m2]
[М2]
r2 [М2] + [М1]
где [m1] и [m2] – концентрации мономерных
звеньев в макромолекуле
11. Зависимость состава сополимера от состава смеси мономеров при различных значениях константы сополимеризации
молярная доля групп М2 в сополимере [m2]1,0
33
3
0,8
5
0,6
1
0,4
4
2
0,2
0
0,2
0,4
0,6
0,8
Молярная доля М2 в смеси мономеров
1,0
12.
• 1-й случай:r1 = r2 = 1; K11 = K12; K22 = K21 .
• Радикалы обоих
мономеров с одинаковой
скоростью присоединяются
к обоим мономерам, для
всех соотношений состав
сополимера равен составу
исходной смеси (линия
азеотропа).
1,0
33
3
0,8
5
0,6
1
0,4
4
2
0,2
0
0,2
0,4
0,6
0,8
Молярная доля М2 в смеси мономеров
1,0
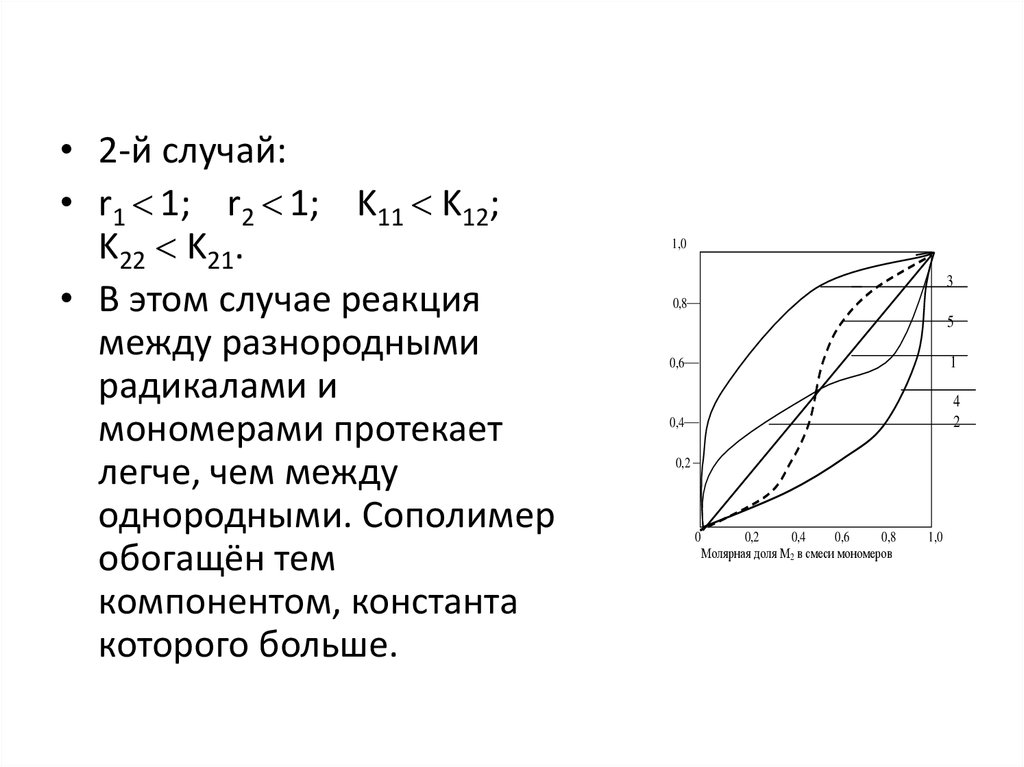
13.
• 2-й случай:• r1 1; r2 1; K11 K12;
K22 K21.
• В этом случае реакция
между разнородными
радикалами и
мономерами протекает
легче, чем между
однородными. Сополимер
обогащён тем
компонентом, константа
которого больше.
1,0
33
3
0,8
5
0,6
1
0,4
4
2
0,2
0
0,2
0,4
0,6
0,8
Молярная доля М2 в смеси мономеров
1,0
14.
• 3-й случай:• r1 1; r2 1; K11
K12; K22 K21.
• В этом случае
реакционная
способность
мономера М2 по
отношению к
радикалам М1* и М2*
выше, чем мономера
М1.
1,0
33
3
0,8
5
0,6
1
0,4
4
2
0,2
0
0,2
0,4
0,6
0,8
Молярная доля М2 в смеси мономеров
1,0
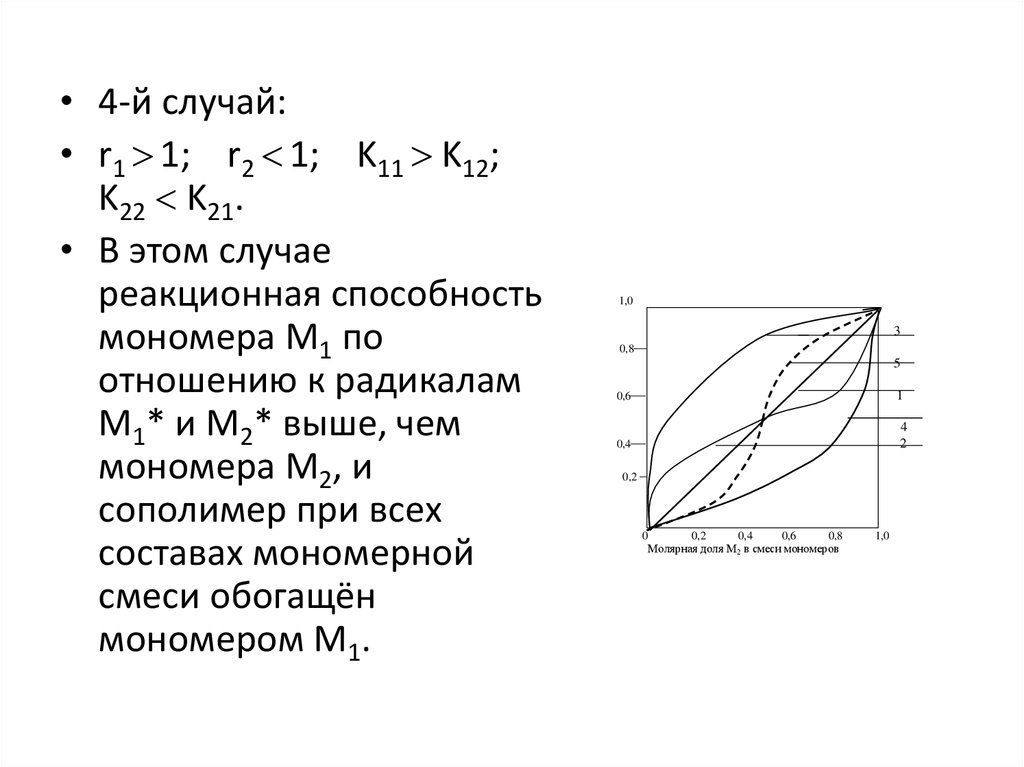
15.
• 4-й случай:• r1 1; r2 1; K11 K12;
K22 K21.
• В этом случае
реакционная способность
мономера М1 по
отношению к радикалам
М1* и М2* выше, чем
мономера М2, и
сополимер при всех
составах мономерной
смеси обогащён
мономером М1.
1,0
33
3
0,8
5
0,6
1
0,4
4
2
0,2
0
0,2
0,4
0,6
0,8
Молярная доля М2 в смеси мономеров
1,0
16.
• 5-й случай:• r1 1; r2 1; K11
K12; K22 K21.
• Этому случаю
соответствует
состояние, когда оба
радикала легче
присоединяются к
«своим» мономерам,
чем к «чужим».
1,0
33
3
0,8
5
0,6
1
0,4
4
2
0,2
0
0,2
0,4
0,6
0,8
Молярная доля М2 в смеси мономеров
1,0
17. Значение констант сополимеризации некоторых пар мономеров
М1М2
r1
r2
Стирол
Акриловая кислота
0,15
0,25
Стирол
Метакриловая кислота
0,15
0,70
Стирол
Метилметакрилат
0,50
0,44
Стирол
Винилацетат
55
0,01
Стирол
Малеиновый ангидрид
0,02
0
Винилацетат
Винилхлорид
0,23
1,68
Винилацетат
Метилакрилат
0,10
9,00
18.
• Кинетика ПМ различных мономеров зависит от ихстроения. Скорость цепной ПМ олефинов или
диолефинов зависит главным образом от степени
поляризации или легкости смещения электронной
плотности в молекуле мономера (поляризуемость
двойной связи в молекуле).
• Степень поляризации молекулы характеризуется ее
дипольным моментом. Двойная связь молекулы
этилена неполяризована и ее дипольный момент равен
нулю. Введение заместителей, особенно
несимметричное, приводит к изменению электронной
плотности двойной связи, и молекула становится
полярной. Значения дипольных моментов мономеров:
этилен – 0, пропилен (CH3CH=CH2) – 0,35, стирол
(C6H5CH=CH2) – 0,37, изобутилен ((CH3)2C=CH2) – 0,49,
винилхлорид (ClCH=CH2) – 1,44, акрилонитрил
(CH2=CHCN) – 3,88.
19.
• Симметричное замещение атомов водорода вэтилене одинаковыми атомами или группами
не сообщает молекуле полярности. Если же
заместители в симметрично замещенной
молекуле этилена различны, то молекула
такого производного этилена является
полярной.
• Электронодонорные заместители (алкил-;
алкокси-; фенильная группа) увеличивают
электронную плотность двойной связи С-С и
вызывают сдвиг плотности электронного
облака в сторону СН2-группы, т.е. отталкивают
электроны в направлении к углеродному
атому незамещенной метиленовой группы.
20.
• Особенностью ионной полимеризацииявляется очень высокая скорость реакции
при низких температурах, что обусловлено
низкой энергии активации процесса
образования активных центров. Ионную
полимеризацию проводят в растворе,
21.
• Полимеризация ненасыщенных соединений можетпроисходить не только по радикальному
механизму, но и по ионному – катионному или
анионному. Ионная ПМ является цепным
процессом.
• ИПМ протекает в присутствии катализаторов,
которые не расходуются (как инициаторы) в
процессе ПМ и не входят в состав цепи. В отличие
от радикальной ПМ, протекающей путем передачи
по цепи неспаренного электрона, ионная ПМ
протекает с образованием либо иона карбония,
либо карбаниона с последующей передачей цепи
положительного или отрицательного заряда. В
зависимости от характера катализатора (kt) и
заряда, образующегося иона различают катионную
или анионную ПМ.
22.
• Катионная ПМ – протекает в присутствиисоединений типа kt Фриделя-Крафта
(апротонные кислоты) - AlCl3, BF3, TiCl4,
SnCl4, и др. реже применяют протонные
кислоты – HCl, H2SO4, H3PO4 и другие
электроноакцепторные соединения.
Схематически катионную ПМ можно
изобразить:
• Kat++CH2=CHX KatCH2C+HX
• KatCH2C+HX+CH2=CHX Kat CH2CHXCH2C+HX
23.
• В настоящее время известны четыре типаобразования инициирующих катионов:
• 1. диссоциация катализаторов;
• 2. диссоциация комплекса, образующегося
из катализатора и сокатализатора;
• 3. взаимодействие катализатора и
мономера;
• 4. взаимодействие комплекса катализатора
и сокатализатора с мономером.
24. Образование инициирующих катионов по первому типу (дисс. Kt) происходит в случае применение в качестве kt протонных кислот:
• HX H++X• H++ CH2=CHX CH3C+HX• CH3C+HX + CH2=CHX CH3CHXCH2C+HX
и т.д.
25. Чаще всего катионы, инициирующие ПМ образуются в результате диссоциации комплексов из апротонной кислоты и сокатализатора.
• Образование катионов в этом случаеможно представить.
• TiCl4+H2O [TiCl4OH]-H+
[TiCl4OH]-+H+
• TiCl4+HCl [TiCl5OH]-H+
[TiCl5]-+H+
• H++ CH2=CHX CH3C+HX
• Рост цепи происходит присоединение
молекул мономера к иону карбония
• CH3C+HX+ CH2=CHX CH3CHXCH2C+HX и т.д.






















 chemistry
chemistry








