Similar presentations:
Ионная полимеризация
1.
2.
Ионная полимеризация3.
АНИОННАЯ ПОЛИМЕРИЗАЦИЯМономеры
ВИНИЛОВЫЕ мономеры с электроноакцепторными заместителями
CH2
CH
Роль X – стабилизация аниона
X – нитрил, сложноэфирная группа, арил, винил.
X
CH3
CH2
CH
CN
CH2
CH2
CH
C
COOCH3
акрилонитрил метилметакрилат стирол
CH2
CH
CH
CH2
1,3-бутадиен
Образование обобщенной единой ароматической системы ПИсвязей (бензольного ядра) приводит к значительному энергетическому
повышению устойчивости системы примерно на 40 ккал\моль по
сравнению с системой с тремя изолированными кратными связями. Это
является одной из причин того, что в зависимости от конкретных
условий реакции, ароматическое кольцо проявляет либо электроноакцепторные, либо электроно-донорные свойства
3
4.
АНИОННАЯ ПОЛИМЕРИЗАЦИЯОсновные стадии полимеризации:
1. Инициирование
2. Рост цепи
3. Обрыв цепи
4. Передача цепи
часто отсутствуют, но характерны для
полярных сред и полярных мономеров
Инициирование присоединение к мономеру :
а) части молекулы инициатора (A –B+) + M AM- + B+ (алкилы, алкоксиды
щелочных металлов)
Б) свободного аниона
A- + M AM- (NaNH2 в NH3 (жидк.))
в) перенос на молекулу мономера электрона с инициирующего анион-радикала
A. + M AM. (щелочные металлы с полициклическими ароматическими
углеводородами )
Г)металла
Ме + M Ме+ + M. (щелочные металлы в эфирных растворителях)
5.
Анионная полимеризацияИНИЦИИРОВАНИЕ
Инициируют металлалкилы, алкоксиды и амиды металлов, щелочи и
другие реагенты основного характера.
K+ + NH2-
KNH2
k
C4H9-Li + CH2=CH ин
C4H9 CH2 CH Li
k
NH2- + CH2=CH ин NH2 CH2 CH K+
C6H5
C6H5
C6H5
C6H5
При использовании щелочных металлов или систем на основе щелочного
металла с полициклическими углеводородами (дифенил, нафталин,
антрацен) инициирование происходит по механизму переноса электрона. В
результате образуются анион-радикалы мономера, которые
рекомбинируют с образованием дианиона.
.
k
e
Na + CH2=CH ин CH2
C6H5
.
2 CH2
CH Na
C6H5
CH Na
C6H5
Na CH
C6H5
CH2
CH2
CH Na
C6H5
6.
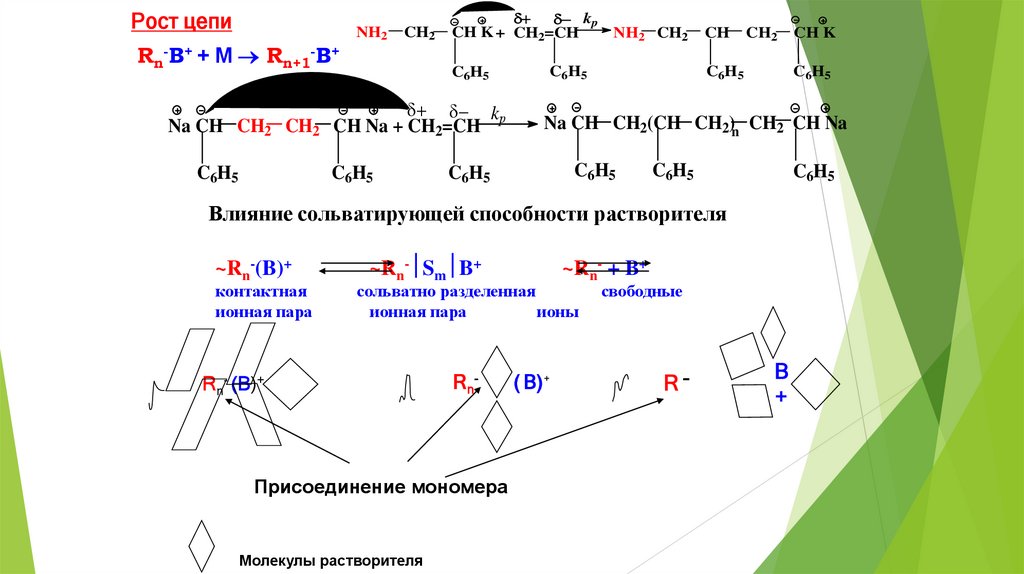
Рост цепиRn-B+ + M Rn+1-B+
Na CH CH2 CH2
C6H5
NH2
CH2
kp
CH K + CH2=CH
NH2 CH2
CH
C6H5
C6H5
C6H5
kp
CH Na + CH2=CH
C6H5
CH2
C6H5
Na CH CH2(CH CH2)n CH2 CH Na
C6H5
C6H5
C6H5
C6H5
Влияние сольватирующей способности растворителя
~Rn-(B)+
контактная
ионная пара
~Rn- Sm B+
~Rn- + B+
сольватно разделенная
ионная пара
ионы
Rn- (B)+
Rn -
Присоединение мономера
Молекулы растворителя
CH K
( B) +
свободные
R-
B
+
7.
Реакции обрыва в анионной полимеризации1. перенос гидрид-иона с конца растущей цепи на противоион
(полимеризация акрилонитрила)
~(CH2-CH)n
CN
CH
CH Li
H
CN
~(CH2-CH)n
CH
CH + LiH
CN
CN
2. перенос гидрид-иона с конца растущей цепи на мономер
(винилхлорид, винилиденхлорид, хлоропрен – перенос хлорид иона)
~(CH2-CH)n
CH2
~(CH2-CH)n
CH Li
На мономер
Cl
CH
CH2 + LiCl
Cl
Cl
3. отрыв протона растущей цепью от растворителя (полимеризация
стирола или бутадиена в толуоле или жидком аммиаке)
NH2-(CH2-CH)n
C6H5
CH2
CH K
C6H5
H
NH2
NH2-(CH2-CH)n
C6H5
CH2
+
-
CH2 + K NH2
C6H5
Реакции обрыва в анионной полимеризации реализуются с очень
большим трудом, они энергетически не выгодны
живые цепи
8.
Полимеризация ненасыщенных углеводородов(стирол, диены)
отсутствие
реакций
кинетического
обрыва
цепи
при
незначительной роли или полном отсутствии актов передачи цепи. Живые
цепи, способные к реакции роста вплоть до исчерпания мономера.
Кинетика такого процесса определяется соотношением констант
скоростей инициирования kи и роста цепи kp.
При kи >> kp
Vp = kp[M][I]0
Все цепи зарождаются практически одновременно. Образующиеся
полимеры характеризуются узким ММР (Mw/Mn~1).
Pn=nq[M]0/[I]0,
q – конверсия, n – число растущих концов в макромолекуле (n=1 или 2).
При kи << kp процесс протекает нестационарно и образующиеся
полимеры характеризуютя широким ММР.
9.
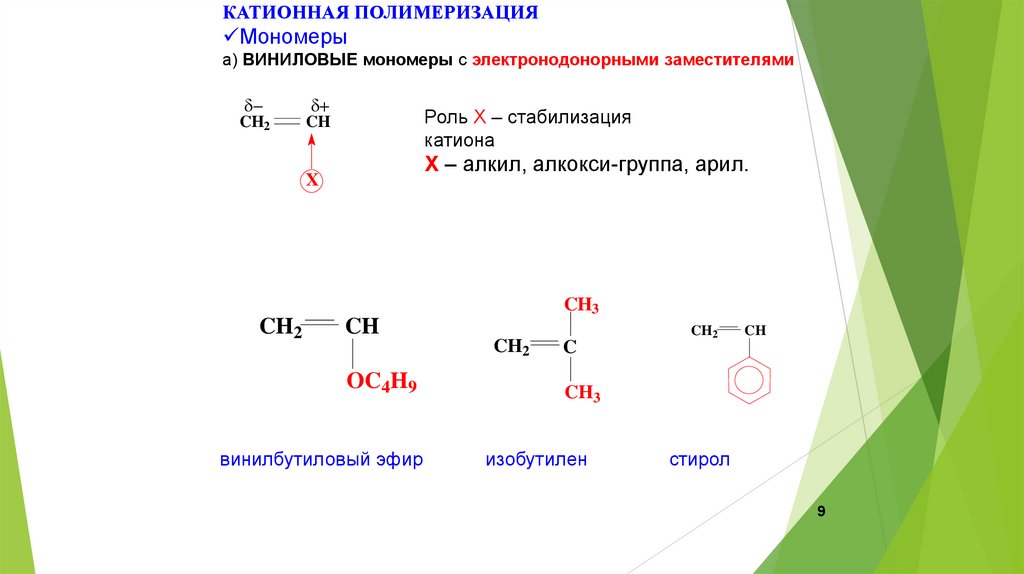
КАТИОННАЯ ПОЛИМЕРИЗАЦИЯМономеры
а) ВИНИЛОВЫЕ мономеры с электронодонорными заместителями
CH2
CH
Роль X – стабилизация
катиона
X – алкил, алкокси-группа, арил.
X
CH3
CH2
CH
CH2
C
OC4H9
CH3
винилбутиловый эфир
изобутилен
CH2
CH
стирол
9
10.
КАТИОННАЯ ПОЛИМЕРИЗАЦИЯОсновные стадии полимеризации:
1. Инициирование
2. Рост цепи
3. Обрыв цепи
в ряде случаев могут отсутствовать
4. Передача цепи
Инициирование – 1) образование
первичных активных частиц:
а) катионы, реагирующие свободно или в составе
ионной пары
б)
кислоты
Льюиса
сокатализаторов
BF3
в
присутствии
и 2) их присоединение к мономеру
11.
Катионная полимеризация1.протонодонорные кислоты
ИНИЦИИРОВАНИЕ
H2SO4, H3PO4, HClO4
2. Инициирование комплексом катализатор–сокатализатор –
кислоты Льюиса BF3, AlCl3, SnCl4 и др. в присутствии доноров протонов
(вода, галогенводородные кислоты, спирты) или галогеналкилов.
CH3
BF3 + CH2
Инициатор-соинициатор !!!
полимеризация не идет
C
CH3
CH3
BF3 + H2O + CH2
C
CH3
полимеризация идет
12.
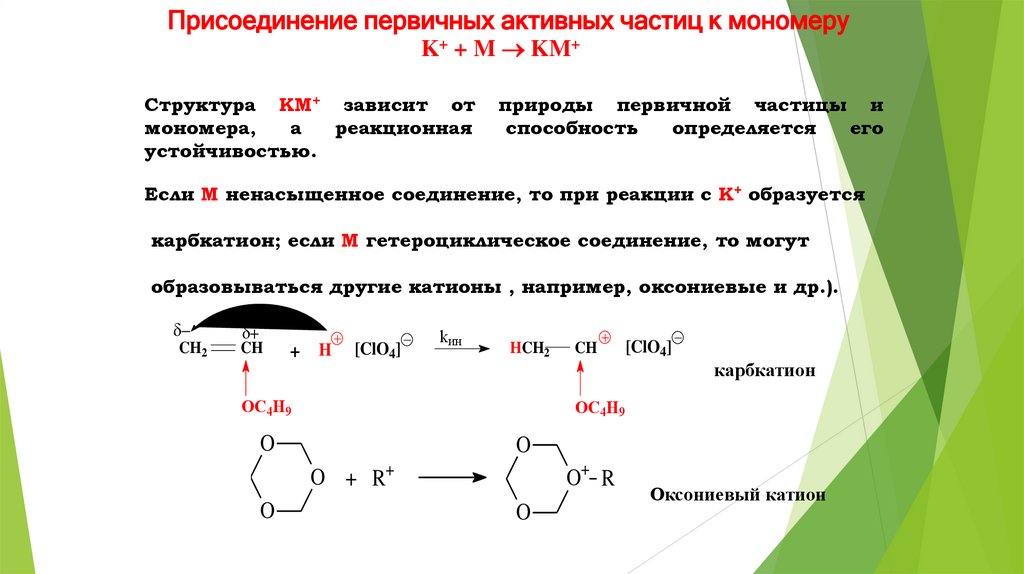
Присоединение первичных активных частиц к мономеруK+ + M KM+
Структура KM+ зависит от
мономера,
а
реакционная
устойчивостью.
природы первичной частицы и
способность
определяется
его
Если M ненасыщенное соединение, то при реакции с K+ образуется
карбкатион; если M гетероциклическое соединение, то могут
образовываться другие катионы , например, оксониевые и др.).
CH2
CH
+ H
[ClO4]
kин
HCH2
OC4H9
[ClO4]
карбкатион
OC4H9
O
O
O+ R
O + R+
O
CH
O
Оксониевый катион
13.
Обрыв цепи При катионной полимеризации реакции обрыва и передачицепи можно разделить условно, т.к. при обрыве часто происходит
регенерация катализатора (инициатора), способного
реинициировать полимеризацию.
Нейтрализация заряда на конце цепи (истинный
кинетический обрыв).
~CH2
CH[BF3OH]
ko
~CH2
CH[BF3OH]
OC4H9
OH + BF3
OC4H9
OC4H9
CH3Cl + ~CH2
CH
ko'
~CH2
CH
Cl
OC4H9
+ CH3+[BF3OH]-
14.
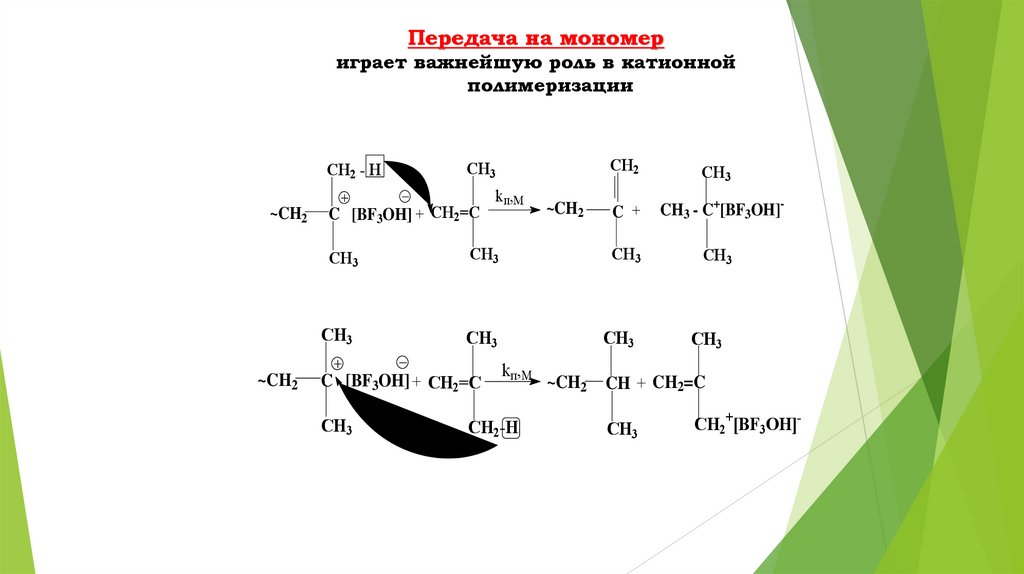
Передача на мономериграет важнейшую роль в катионной
полимеризации
CH2 - H
~CH2
~CH2
CH3
C [BF3OH] + CH2=C
kп,М
~CH2
CH2
CH3
C +
CH3 - C+[BF3OH]-
CH3
CH3
CH3
CH3
CH3
CH3
CH3
CH3
C [BF3OH] + CH2=C
CH3
kп,М
CH2-H
~CH2
CH + CH2=C
CH3
CH2+[BF3OH]-
15.
СОПОЛИМЕРИЗАЦИЯ – совместная полимеризация 2-х или болеемономеров (классификация).
Распределение звеньев в макромолекулах сополимеров
Статистические
сополимеры:
в
макромолекуле
сополимера
распределение мономерных звеньев описывается известным законом
статистики
~M1M1M2M1M2M2M1M1M1M2M1M1M2 ~
Чередующиеся (для 2-х мономерных
сополимера мономерные звенья чередуются
~ M1M2M1M2M1M2M1M2M1M2M1M2~
звеньев):
в
макромолекуле
Периодические: упорядоченная последовательность из более, чем двух
мономерных звеньев
~ M1M2М3M1M2М3M1M2М3M1M2М3M1M2М3M1M2М3~
16.
СополимеризацияГрадиентные: состав макромолекулы изменяется непрерывно вдоль цепи
~ M1M1М2M1M1М1M1M2М1M1M2М2M1M1М2M2M2М2~
Блок-сополимеры: линейные макромолекулы с длинными (полимерными)
блоками одинаковых звеньев, разделенными длинными (полимерными)
блоками других звеньев
~M1M1M1M1M1M1M1M1M1M1M1M1M2M2M2M2M2M2M2M2~
Привитые сополимеры: разветвленные макромолекулы, у которых
основная цепь состоит из звеньев одного мономера, а к ней ковалентно
присоединены одна или более боковых макромолекул, построенных из звеньев
другого мономера
~M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1~
M2M2M2M2M2M2M2M2M2M2M2M2M2M2~
17.
Композиционная неоднородностьмакромолекул сополимеров
Различают :
Мгновенную неоднородность, которая возникает в
результате статистического характера реакций обрыва цепи.
Конверсионную
неоднородность,
изменением
состава
сополимеризации.
мономерной
При
азеотропной
обусловленную
смеси
в
ходе
сополимеризации
составы
сополимера и мономерной смеси не меняются по ходу
реакции
и
остаются
равными
исходному
составу
мономерной смеси, что приводит к получению продуктов,
композиционная неоднородность которых минимальна и
связана только с ее мгновенной составляющей.
18.
Композиционная неоднородность макромолекулсополимеров
Эксплуатационные
свойства
бинарных
сополимеров зависят от:
среднего состава сополимера,
композиционной неоднородности
распределения мономерных звеньев в
макромолекулах.
Состав
отдельной
макромолекулы
может отличаться от среднего состава
всего
образца,
что
приводит
к
композиционной
неоднородности
сополимера.
19.
Реакция роста цепиКинетика реакции роста цепи определяет состав сополимеров
и весь комплекс их химических и физико-механических свойств
Концевая модель (Майо и Льюис, Алфрей и Голдфингер)
учитывает влияние концевого звена на реакционную способность
активного центра по отношению к молекулам мономеров.
M1* + M1 M1M1*
k11
V p ,11 k11[ M 1* ][ M 1 ]
M1* + M2 M1M2*
k12
V p ,12 k12[ M 1* ][ M 2 ]
M2* + M2 M2M2*
k22
V p , 22 k 22[ M 2* ][ M 2 ]
M2* + M1 M2M1*
k21
V p , 21 k 21[ M 2* ][ M 1 ]
d[M1 ]
[m1 ] V p ,11 V p , 21 k11[ M 1* ][ M 1 ] k 21[ M 2* ][ M 1 ]
dt
d[M 2 ]
[m2 ] V p , 22 V p ,12 k 22[ M 2* ][ M 2 ] k12[ M 1* ][ M 2 ]
dt
m1 k11[ M 1* ][ M 1 ] k 21[ M 2* ][ M 1 ]
m2 k 22 [ M 2* ][ M 2 ] k12 [ M 1* ][ M 2 ]
20.
Допущения для вывода уравнения состава сополимераPn >>1 (действительно реакция полимеризации)
Реакционная способность M1* и M2* не зависит от Pn
Условие квазистационарности: Vp,12=Vp,21 k [M *][M ]= k [M *][M ]
12
1
2
21
2
1
малые конверсии
Уравнение описывает состав «мгновенного» сополимера, образующегося на
начальных конверсиях, когда изменением концентраций мономеров можно
пренебречь.
k11
[M 1 ] [M 2 ]
m1 [ M 1 ] k12
[ M 1 ] r1 [ M 1 ] [ M 2 ]
m2 [ M 2 ] k 22
[ M 2 ] r2 [ M 2 ] [ M 1 ]
[M 2 ] [M 1 ]
k 21
r1 и r2 – константы сополимеризации
k 22
r2
k 21
k11
r1
k12
k11, k22 – константы скорости присоединения радикала к своему мономеру
k12, k21 – константы скорости присоединения радикала к чужому мономеру
21.
Диаграмма составов сополимеровr 1= k11 / k12
r2 = k22 / k21 Если r >1 и r <1, то сополимер обогащен
1
2
1) r1>1, r2<1
2) r1<1, r2>1
3) r1=1, r2=1
4) r1<1, r2<1
5) 6) r1 =0, r2=0
звеньями М1
Если r1<1 и r2>1, то сополимер обогащен
звеньями М2
Если r1=r2=1, то состав сополимера всегда равен
составу исходной смеси.
Если r1<1 и r2<1, то при малых содержаниях M1
в исходной смеси мономеров сополимер обогащен
звеньями М1, а при больших — звеньями M2
(тенденция к чередованию в сополимере звеньев
М1 и М2, которая тем больше, чем ближе к нулю
значения r1 и r2).
Если кривая состава пересекает диагональ
диаграммы составов; в точке пересечения,
называемой азеотропной, состав сополимера
равен составу сомономерной смеси.
Если r1>1 и r2>1, то наблюдается тенденция к
раздельной полимеризации мономеров в смеси.
Если r1=0, r2=0 образуется чередующийся
сополимер
22.
Радикальная сополимеризацияЗначения r1 , r2 и состав сополимера обычно слабо
зависят от природы растворителя и мало меняются с
температурой.
Исключение составляют
явления, связанные c донорно-акцепторными взаимодействиями
реагентов. Если один из мономеров оказывается сильным донором,
а другой – сильным акцептором, образуются чередующиеся
сополимеры.
Дополнительно
еще
сказываются
и
стерические
затруднения
Стирол – малеиновый ангидрид
r1=0
r2=0
сополимеризация ионогенных мономеров в зависимости от pH
Акриловая кислота – акриламид
pH =2
r1=0.9 r2=0.25,
pH =9
r1=0.3 r2=0.95
23.
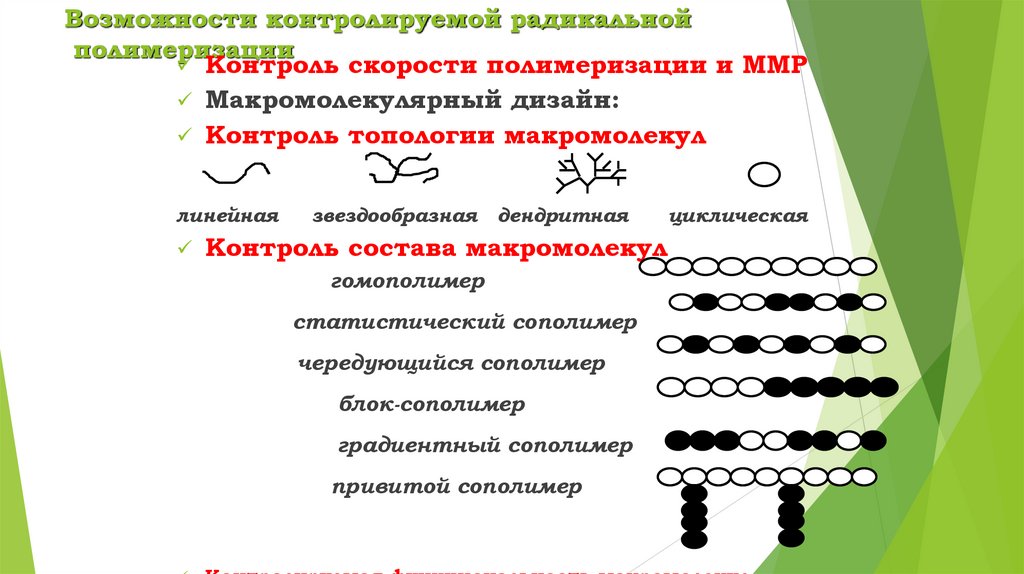
Возможности контролируемой радикальнойполимеризации
Контроль скорости полимеризации и ММР
Макромолекулярный дизайн:
Контроль топологии макромолекул
линейная
звездообразная
дендритная
Контроль состава макромолекул
гомополимер
статистический сополимер
чередующийся сополимер
блок-сополимер
градиентный сополимер
привитой сополимер
циклическая
24.
Новые возможности радикальнойполимеризации в контролируемом синтезе
макромолекул
Классическая радикальная
полимеризация
инициирование
рост
I 2 R1 .
R1 . + M P .
P . + nM Pn+1 .
обрыв
Pp . + Pn. P
передача
P . + SH PH +S .
25.
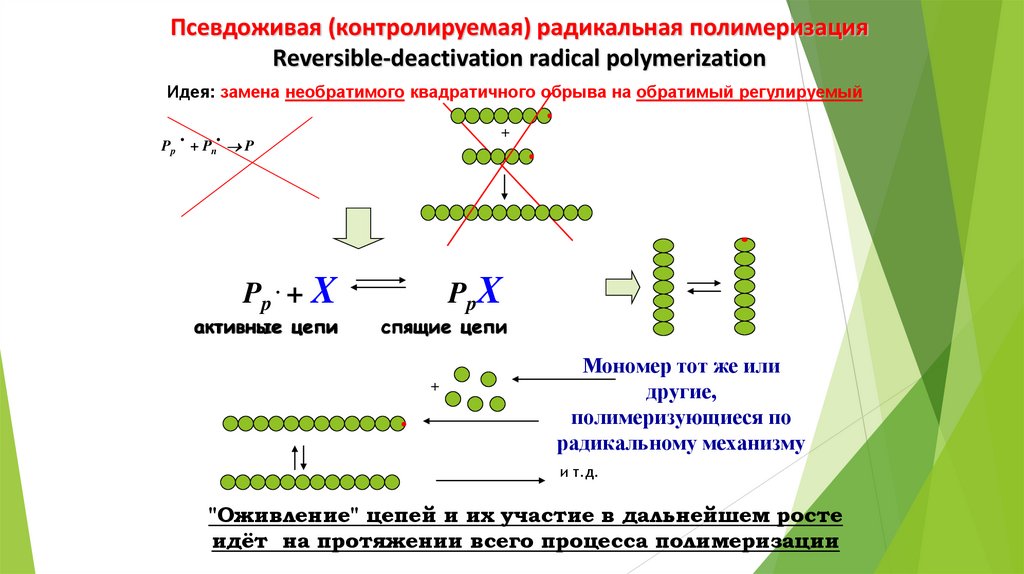
Псевдоживая (контролируемая) радикальная полимеризацияReversible-deactivation radical polymerization
Идея: замена необратимого квадратичного обрыва на обратимый регулируемый
.
.
+
Pp + Pn P
Pp . + X
активные цепи
PpX
спящие цепи
+
Мономер тот же или
другие,
полимеризующиеся по
радикальному механизму
и т.д.
"Оживление" цепей и их участие в дальнейшем росте
идёт на протяжении всего процесса полимеризации
26.
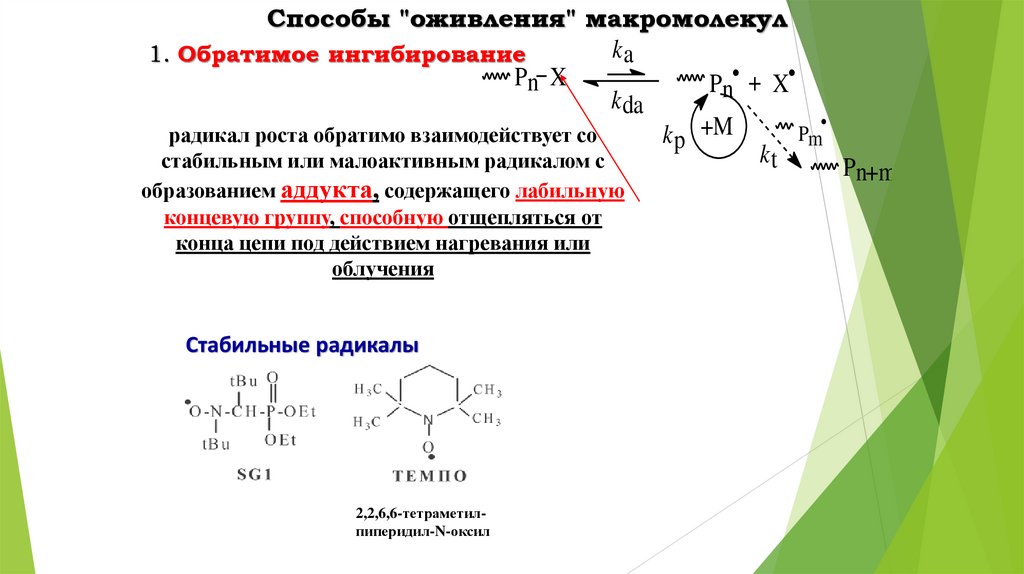
Способы "оживления" макромолекулka
1. Обратимое ингибирование
Pn X
Pn• + X
k da
Pm
радикал роста обратимо взаимодействует со
k p +M
kt
стабильным или малоактивным радикалом с
Pn+m
образованием аддукта, содержащего лабильную
концевую группу, способную отщепляться от
конца цепи под действием нагревания или
облучения
Стабильные радикалы
2,2,6,6-тетраметилпиперидил-N-оксил
27.
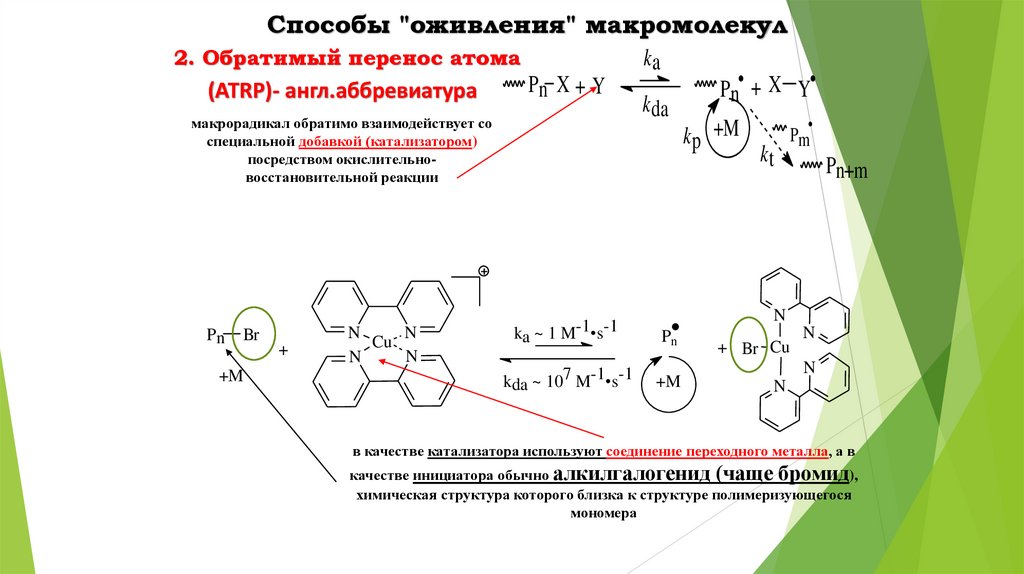
Способы "оживления" макромолекул2. Обратимый перенос атома
(ATRP)- англ.аббревиатура
ka
Pn X + Y
макрорадикал обратимо взаимодействует со
специальной добавкой (катализатором)
посредством окислительновосстановительной реакции
Pn
Br
+M
+
N
N
Cu
N
N
k da
Pn• + X Y
k p +M
kt
Pm
Pn+m
N
ka ~ 1 M-1•s-1
Pn
kda ~ 107 M-1•s-1
+M
+ Br Cu
N
N
N
в качестве катализатора используют соединение переходного металла, а в
качестве инициатора обычно алкилгалогенид (чаще бромид),
химическая структура которого близка к структуре полимеризующегося
мономера
28.
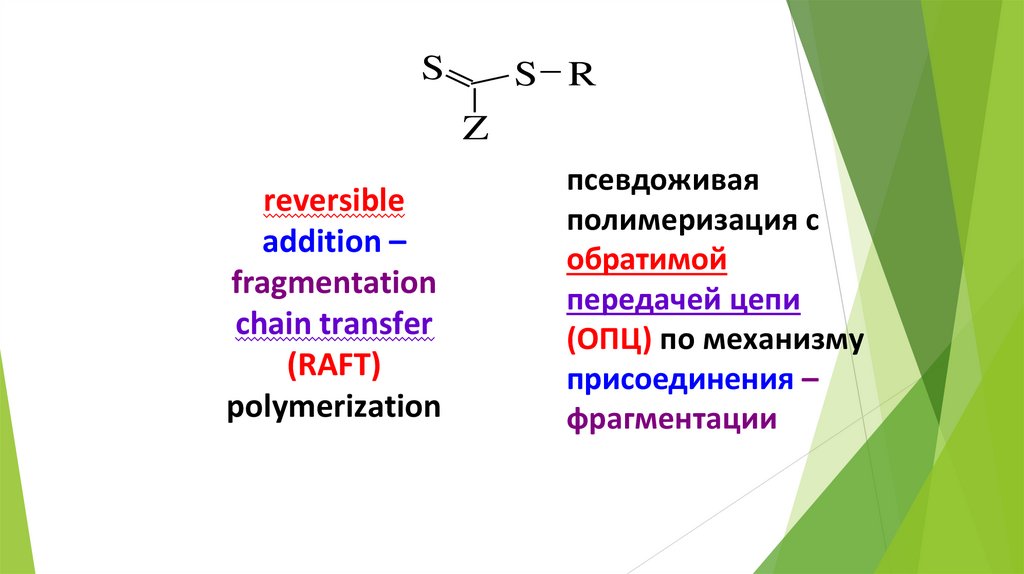
SS R
Z
reversible
addition –
fragmentation
chain transfer
(RAFT)
polymerization
псевдоживая
полимеризация с
обратимой
передачей цепи
(ОПЦ) по механизму
присоединения –
фрагментации
29.
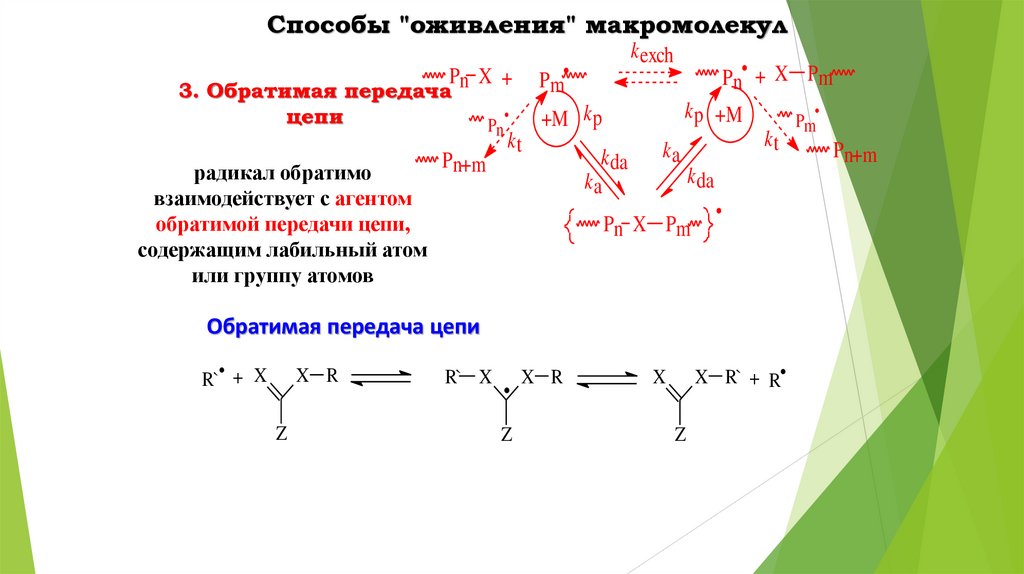
Способы "оживления" макромолекулPm
Pn X +
3. Обратимая передача
цепи
радикал обратимо
взаимодействует с агентом
обратимой передачи цепи,
содержащим лабильный атом
или группу атомов
Pn
Pn+m
k exch
Pn• + X Pm
k p +M
+M k p
kt
k da
ka
kt
ka
k da
Pn X Pm
Обратимая передача цепи
R`• + X
X R
Z
R` X
X R
Z
X R` + R
X
Z
Pm
Pn+m
30.
Поликонденсация31.
Сравнительные характеристики реакций полимеризации иполиконденсации
полимеризация
поликонденсация
1.Ступенчатая реакция между
1. цепная реакция
присоединения активных
центров (радикалов, анионов ,
катионов) к кратным связям
мономеров.
2.не выделяется
низкомолекулярное вещество.
3. молекулярная масса
образующегося полимера
практически не зависит от
конверсии.
4. практически нет
промежуточных олигомеров.
функциональными группами
многофункциональных
мономеров.
2.выделяется
низкомолекулярное вещество,
которое необходимо удалять
из реакционной среды.
3.молекулярная масса
полимера зависит от
конверсии, от константы
равновесия, от Са\Св, от конц.
низкомолекулярного вещества.
4. промежуточные олигомеры
стабильны и способны к
дальнейшим реакциям.
32.
33.
ПОЛИКОНДЕНСАЦИЯПоликонденсация
–
процесс
образования
макромолекул
в
результате
ступенчатого химического взаимодействия функциональных групп
многофункциональных мономеров и
реакции, а также молекул
n-меров, накапливающихся в ходе
n-меров между собой.
По типу участвующих в реакции мономеров
поликонденсацию подразделяют на:
ГОМОПОЛИКОНДЕНСАЦИЮ (1 мономер)
простые полиэфиры
n CH2
CH2
OH
OH
H+
CH2
o
CH2
O
TC
n H2O
n +
полиамиды
n NH2
R COOH
H+
o
NH
R
TC
n NH2
R COCl
H+
o
TC
CO
n H2O
n +
O
NH
R
CO
O
n HCl
n +
34.
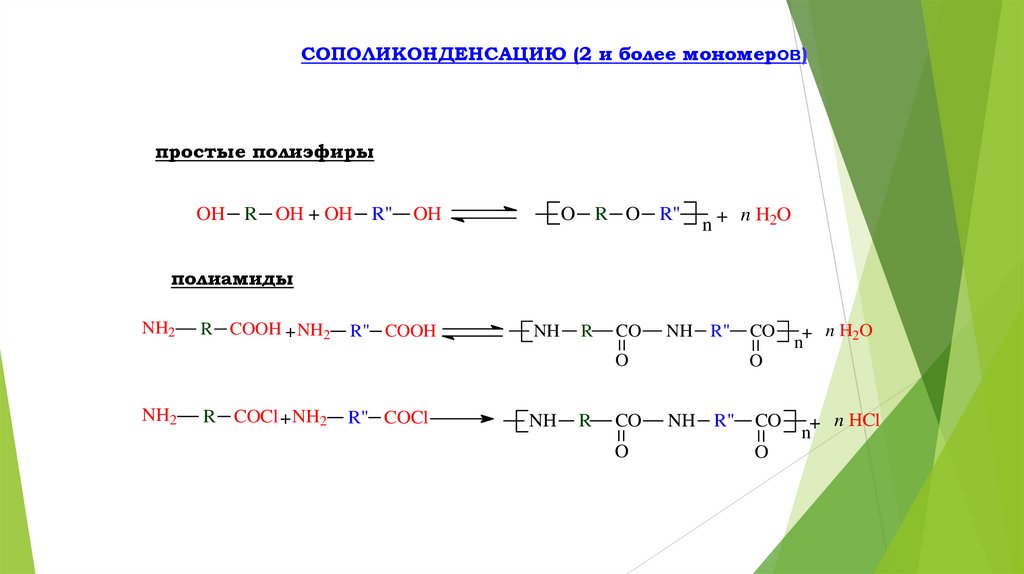
СОПОЛИКОНДЕНСАЦИЮ (2 и более мономеров)простые полиэфиры
OH R OH + OH R"
OH
O R O R"
n+
n H2O
полиамиды
NH2
R COOH + NH2
R" COOH
NH
R
CO
NH R"
O
NH2
R COCl + NH2
R" COCl
NH
R
CO
O
CO
+ n H2O
n
O
NH R"
CO
O
+ n HCl
n
35.
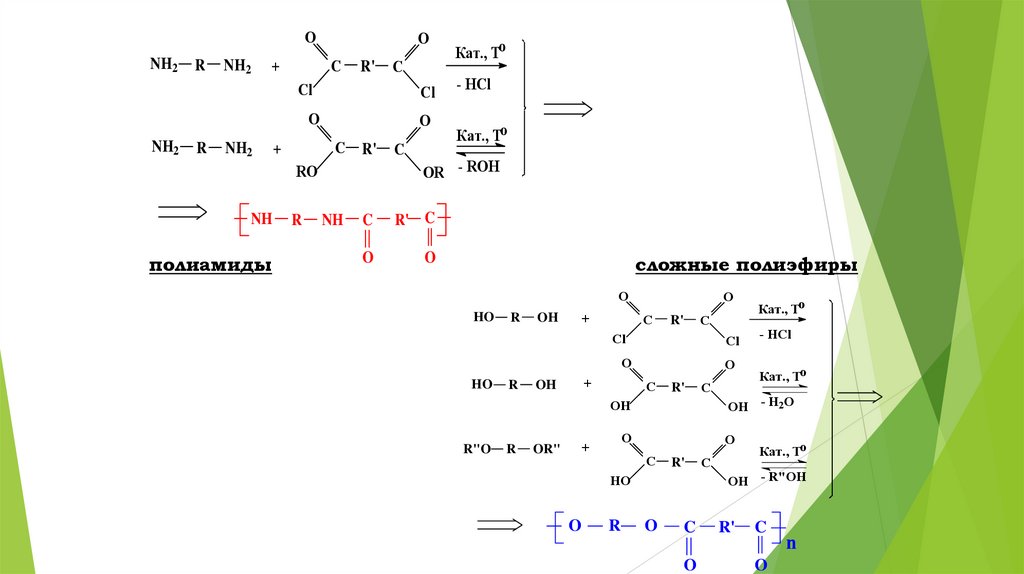
ONH2
NH2
R
R
NH2
O
Кат., To
Cl
Cl
- HCl
O
O
C
+
NH2
C
+
R'
R'
C
C
R' C
O
O
RO
NH
полиамиды
R
NH
C
Кат., To
OR - ROH
сложные полиэфиры
O
HO
HO
R
R
OH
+
C
R'
C
Cl
Cl
O
O
+
OH
O
C
R'
C
OH
R"O
R
OR"
O
+
R'
HO
O
R
O
C
O
C
- HCl
Кат., To
OH - H2O
O
C
Кат., To
Кат., To
OH - R"OH
R'
C
O
n
36.
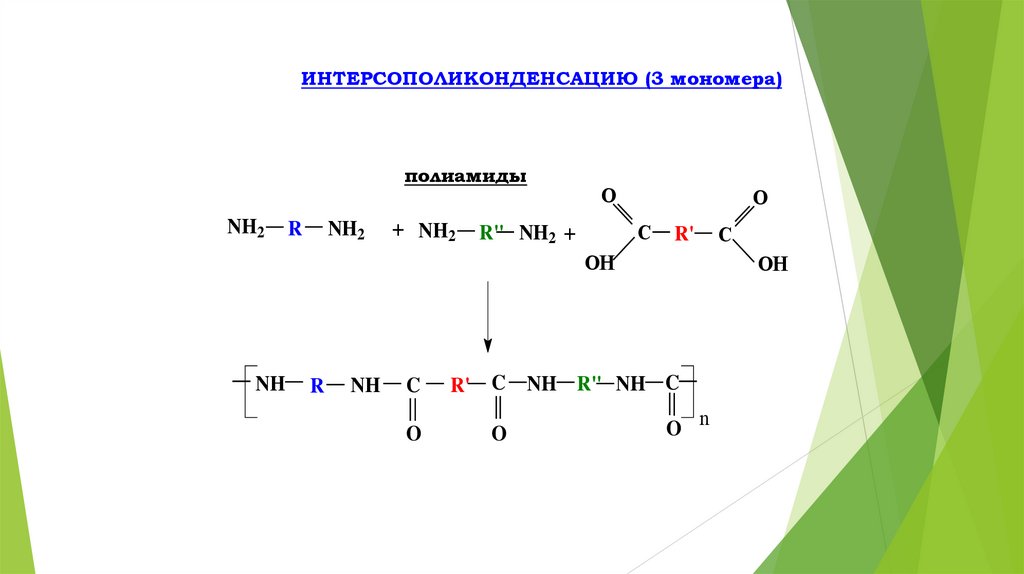
ИНТЕРСОПОЛИКОНДЕНСАЦИЮ (3 мономера)полиамиды
NH2
R
NH2
+ NH2
O
O
C
R" NH2 +
R'
OH
NH
R
NH
C
O
R'
C
O
C
OH
NH R" NH C
O n
37.
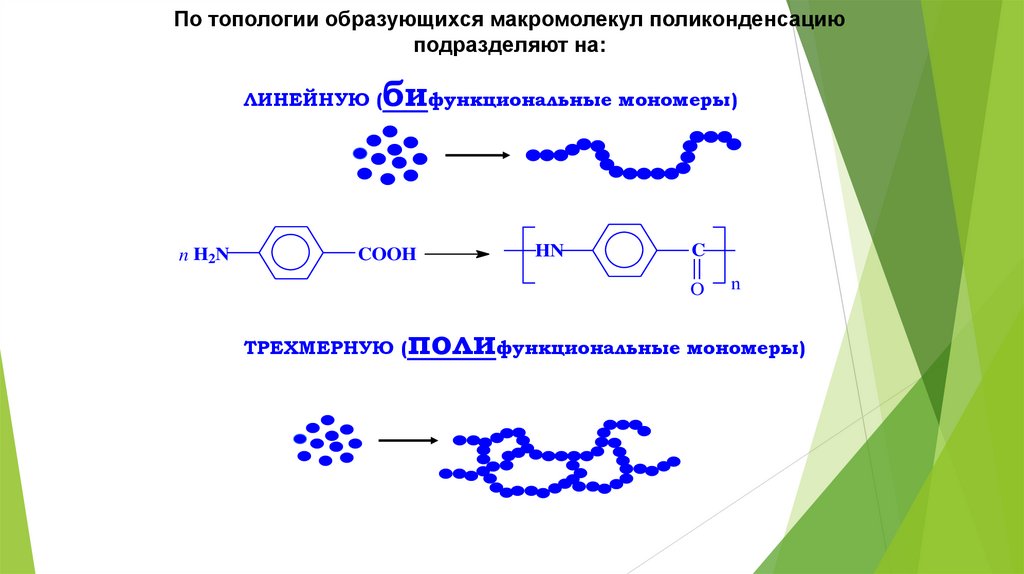
По топологии образующихся макромолекул поликонденсациюподразделяют на:
ЛИНЕЙНУЮ (
n H2N
бифункциональные мономеры)
COOH
HN
C
O
ТРЕХМЕРНУЮ (
n
полифункциональные мономеры)
38.
По значению константы поликонденсационного равновесия Kполиконденсацию подразделяют на:
n A+ n B
k1
A B A B A B
K = k1/k-1
k-1
равновесную (обратимую)
K 10 100
Степень завершенности реакции и степень
полимеризации лимитируются равновесными
концентрациями реагентов и продуктов реакции
неравновесную (необратимую)
К 103
Степень завершенности реакции и степень
полимеризации лимитируются не
термодинамическими, а кинетическими факторами
39.
Значения констант равновесия (К) для некоторыхслучаев поликонденсации
Необратимая поликонденсация
Тип
поликонденсации
Мономеры
К
полиэтерификация
бисфенол+бисбензоилхлорид (модельная
реакция)
4260
полиамидирование
Тетрамины+диангидриды ароматических
тетракарбоновых кислот
1015 –1025
Диамины+дихлорангидриды
ароматических дикарбоновых кислот
> 1015
Обратимая поликонденсация
Тип
поликонденсации
Мономеры
К
полиэтерификация
пентаметиленгликоль+адипиновая кислота
6.0
полиамидирование
-аминоундекановая кислота
8.9
40.
Побочные химические реакции , в результате которыхфункциональные группы утрачивают способность участвовать в
реакции роста.
1.
Взаимодействие
функциональных
групп
мономеров
с
монофункциональным соединением,
присутствующим в виде примеси
или специально введенной добавки – обрыв цепи.
2. Химическое превращение функциональных групп вследствие
протекания побочных реакций:
HOOC–R-COOH HR-COOH + CO2
ClOC-R-COCl + 2H2O HOOC-R-COOH + 2HCl
3. Циклизацияа) внутримолекулярная (реагируют функциональные
группы одной молекулы, 5–7 и 20–40 членные циклы) NH CH2 CH2
NH2(CH2)5COOH
C
CH2
CH2 CH2
O
б) межмолекулярная (реагируют функциональные группы разных
молекул)
HOCH2CH2OH + C2H5OOC-COOC2H5
O
CH2
CH2
C
C
O
O
O
+ 2C2H5OH
4. Деструкционные процессы – реакции, приводящие к разрыву
основной цепи макромолекул
41.
Кинетика поликонденсацииДля поликонденсации характерно исчезновение мономера
уже на ранних стадиях процесса, когда молекулярная масса
продукта реакции ещё очень мала.
Дальнейший рост цепи происходит при практически
полном отсутствии мономера в системе (при полимеризации
на ВСЕХ стадиях наряду с макромолекулами, активными
макрорадикалами (анионами и катионами) присутствует
мономер).
При количественном анализе кинетики поликонденсации
используют принцип Флори: активность реагирующих групп
не зависит от длины цепи макромолекулы.
Реакционная
способность
функциональных
групп
бифункционального
мономера
не
зависит
от
того,
прореагировала ли его другая функциональная группа.
Вязкость системы практически не влияет на скорость
реакции, т.к. такие реакции проводят при повышенных
температурах.
42.
Кинетика поликонденсацииДля необратимой поликонденсации и начальных стадий обратимой
поликонденсации, когда обратной реакцией можно пренебречь:
Мономеры взяты в эквимолярных количествах
Уравнение изменения концентрации
функциональных групп:
k – константа скорости реакции
d [ A]
d [ B]
k[ A][ B] k[ A]2
dt
dt
После интегрирования , введения начальной концентрации
функциональных групп [A]0 и глубины превращения q (доли
прореагировавших
к
данному
моменту
времени
функциональных групп):
[ A]0 [ A]
q
[ A]0
q
kt[ A]0
1 q
Для необратимой поликонденсации характерны высокие
скорости (k до 105 л/моль.с), низкие значения энергии
активации (8 – 40 кДж/моль); как правило, эти процессы
сильно экзотермичны.
43.
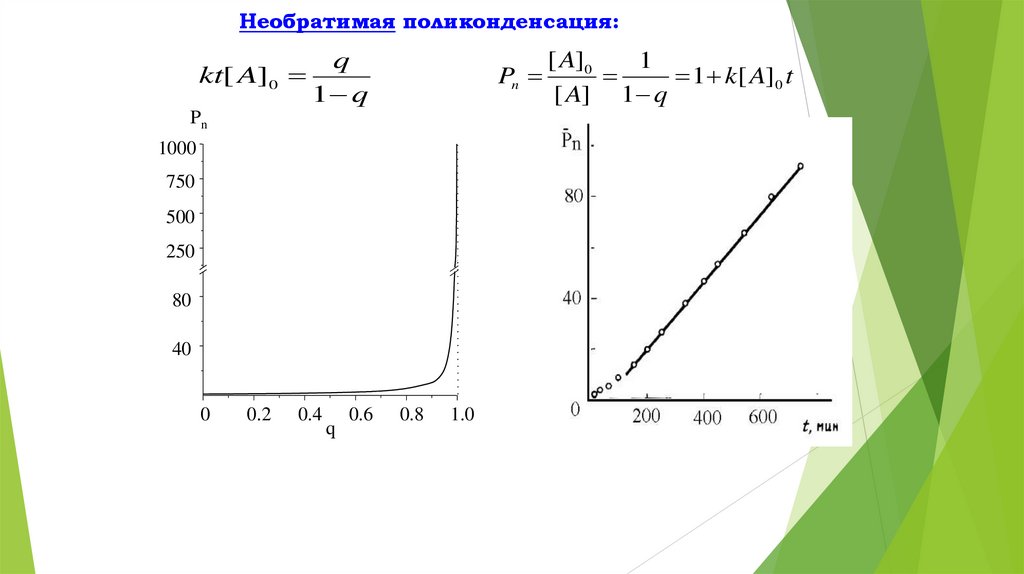
Необратимая поликонденсация:kt[ A]0
q
1 q
Pn
Pn
1000
750
500
250
80
40
0
0.2
0.4
q
0.6
0.8
1.0
[ A]0
1
1 k[ A]0 t
[ A] 1 q
44.
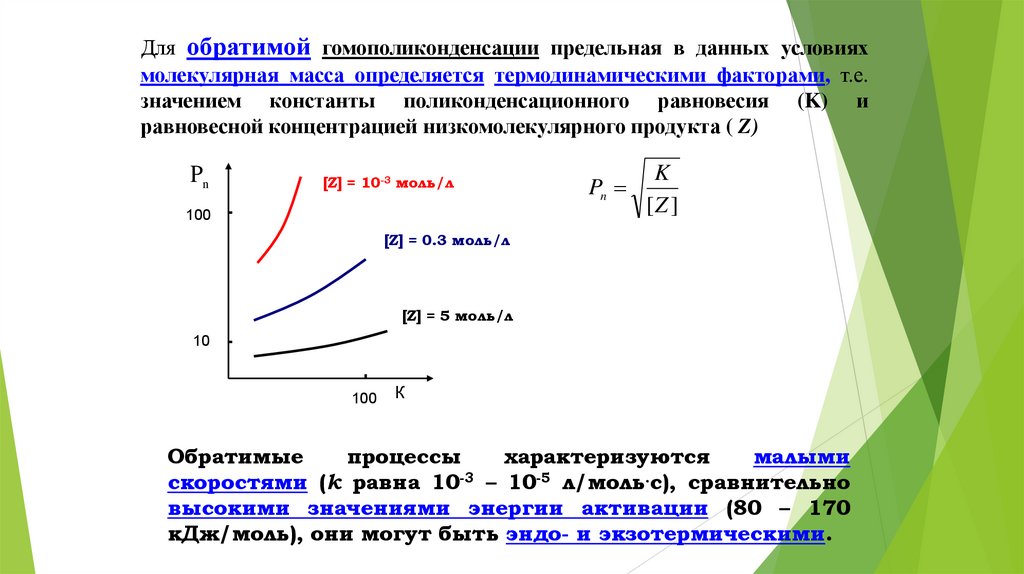
Для обратимой гомополиконденсации предельная в данных условияхмолекулярная масса определяется термодинамическими факторами, т.е.
значением константы поликонденсационного равновесия (K) и
равновесной концентрацией низкомолекулярного продукта ( Z)
Pn
[Z] = 10-3 моль/л
100
Pn
K
[Z ]
[Z] = 0.3 моль/л
[Z] = 5 моль/л
10
100
К
Обратимые
процессы
характеризуются
малыми
скоростями (k равна 10-3 – 10-5 л/моль.с), сравнительно
высокими значениями энергии активации (80 – 170
кДж/моль), они могут быть эндо- и экзотермическими.
45.
Факторы, влияющие на молекулярную массуполиконденсационных полимеров
1. Глубина проведения процесса q (необратимая поликонденсация)
2. Эквимольность реагирующих между собой исходных соединений
(молярное соотношение мономеров)
Нарушения:
Если в реакцию вводят неэквимольные количества исходных
веществ. Тогда
[ A]
r
1
[ B]
1 r
Pn
1 r 2rq
при q=1
1 r
Pn
1 r
Если в реакционной смеси присутствуют монофункциональные
соединения C, взаимодействующие с исходными веществами, то
2[A]
r
2[B] [C]
Если
функциональные
группы
мономеров
претерпевают
химические
изменения,
превращаясь
в
группы,
нереакционноспособные
в
условиях
поликонденсации
(циклизация, деструкционные процессы)
3. Наличие низкомолекулярных продуктов реакции ( олигомеров)
46.
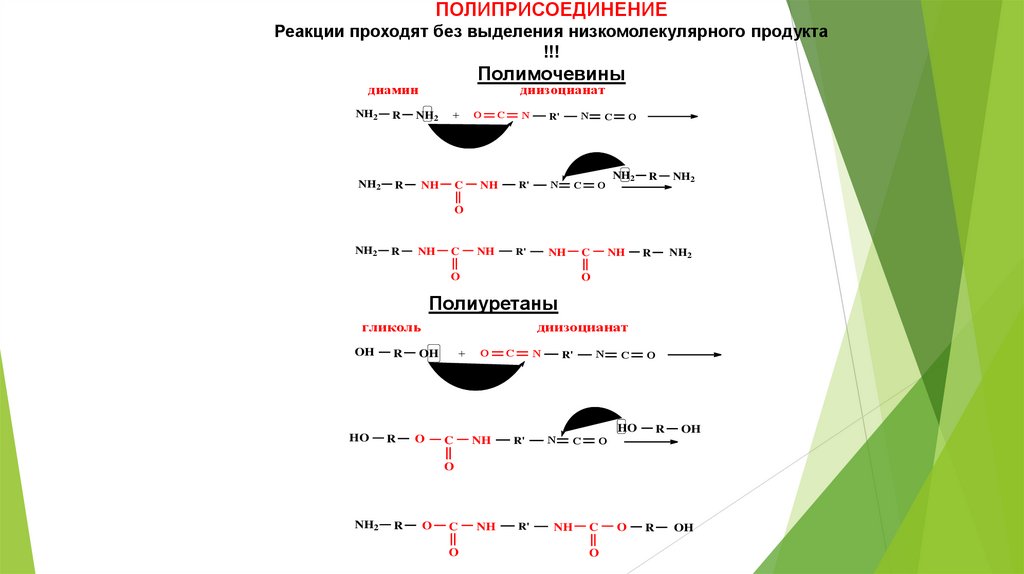
ПОЛИПРИСОЕДИНЕНИЕРеакции проходят без выделения низкомолекулярного продукта
!!!
Полимочевины
диамин
диизоцианат
NH2
R
NH2
+
O
C
N
R'
NH2
R
NH
C
NH
R'
N
NH
R'
NH
N
C
C
O
O
NH2
R
NH2
NH
R
NH2
O
NH2
R
NH
C
C
O
O
Полиуретаны
гликоль
диизоцианат
OH
R
OH
HO
R
O
+
O
C
N
R'
N
C
O
HO
C
NH
R'
N
NH
R'
NH
C
R
O
OH
O
NH2
R
O
C
O
C
O
O
R
OH
47.
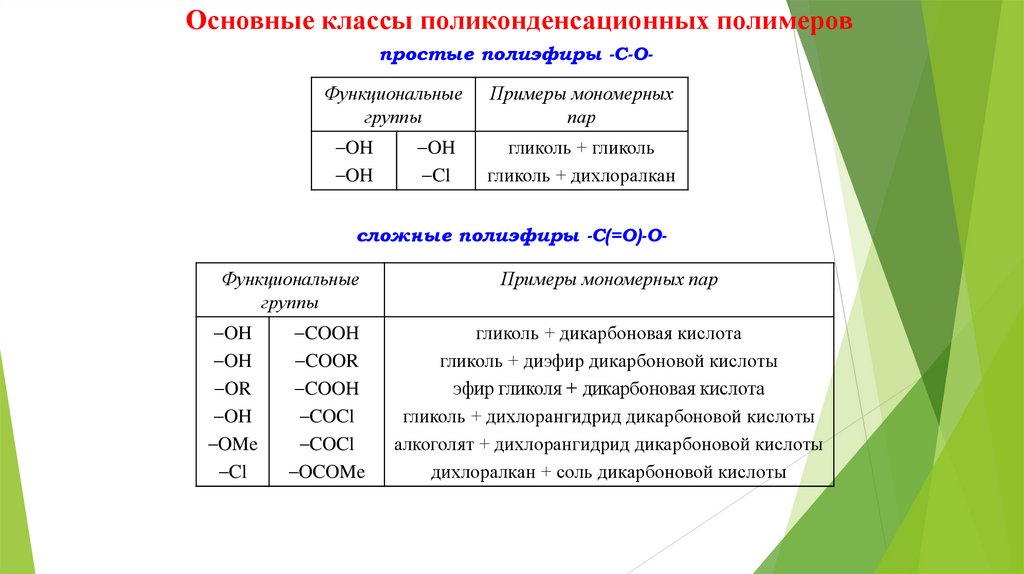
Основные классы поликонденсационных полимеровпростые полиэфиры -C-O-
Функциональные
группы
Примеры мономерных
пар
OH
OH
гликоль + гликоль
гликоль + дихлоралкан
OH
Cl
сложные полиэфиры -C(=O)-O-
Функциональные
группы
OH
OH
OR
OH
OMe
Cl
COOH
COOR
COOH
COCl
COCl
OCOMe
Примеры мономерных пар
гликоль + дикарбоновая кислота
гликоль + диэфир дикарбоновой кислоты
эфир гликоля + дикарбоновая кислота
гликоль + дихлорангидрид дикарбоновой кислоты
алкоголят + дихлорангидрид дикарбоновой кислоты
дихлоралкан + соль дикарбоновой кислоты
48.
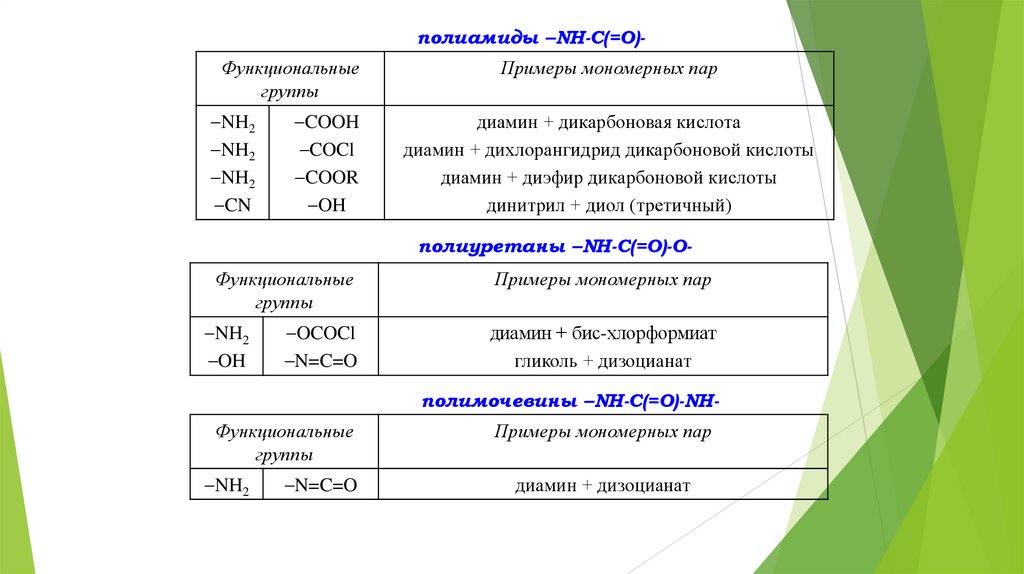
полиамиды –NH-C(=O)Функциональныегруппы
NH2
NH2
NH2
CN
COOH
COCl
COOR
OH
Примеры мономерных пар
диамин + дикарбоновая кислота
диамин + дихлорангидрид дикарбоновой кислоты
диамин + диэфир дикарбоновой кислоты
динитрил + диол (третичный)
полиуретаны –NH-C(=O)-O-
Функциональные
группы
Примеры мономерных пар
NH2
OH
диамин + бис-хлорформиат
гликоль + дизоцианат
OCOCl
N=C=O
полимочевины –NH-C(=O)-NHФункциональные
группы
NH2
N=C=O
Примеры мономерных пар
диамин + дизоцианат
49.
Некоторые конденсационные полимерыполиэтилентерефталат
полиэтиленадипинат
O
C
C O
O
O
O
C
(CH2)4
полиэтиленгликоль
n
C
O
CH2 CH2
O
CH2 CH2
n
O
O CH2
CH2
n
полиамид-6 (найлон-6,
капрамид)
NH C
полиамид-6,6
NH
(CH2)5
n
O
(CH2)6
NH C
(CH2)4
O
поли-пара-бензамид
(Кевлар)
NH C
полиуретаны
C NH R'
O
O
полимочевины
C NH R'
O
C
n
O
n
NH C O
R O
O
n
NH C NH R NH
O
n
50.
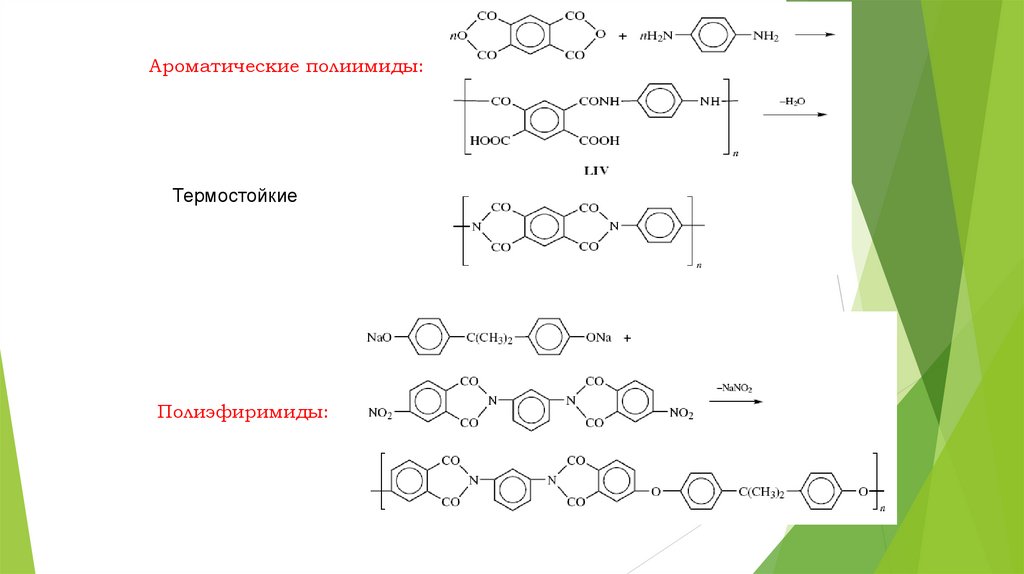
Ароматические полиимиды:Термостойкие
Полиэфиримиды:
51.
1. Полимеризации в блоке подвергаются жидкие мономеры вприсутствии
растворенных
в
них
инициаторов.
Такую
полимеризацию можно осуществлять по периодическому и
непрерывному способу. В первом случае полимер образуется в
формах, помещаемых в обогреваемые камеры. В зависимости от
используемой формы готовое изделие может иметь вид
пластины, трубы и т.д. Непрерывная полимеризация проводится
в полимеризационных башнях. Мономер, проходя через башню,
попадает в зоны с различной температурой, повышающейся в
направлении продвижения полимера. В последнюю зону
поступает готовый полимер, где он расплавляется и
выдавливается в виде жгутов, которые нарезаются на гранулы
(так получают, например, прозрачное органическое стекло из
стирола и метилметакрилата).
52.
2. Полимеризация в растворителях осуществляется всреде, растворяющей либо мономер и полимер, либо
только мономер. В первом случае продукт реакции –
раствор полимера в растворителе. Затем отделяют полимер
отгонкой растворителя либо осаждением полимера,
добавляя осадитель (например, воду). В растворе проводят
главным образом ионную полимеризацию.
3. Полимеризация в эмульсиях протекает с большими
скоростями
и
позволяет
получать
полимеры
с
высокомолекулярной массой в виде порошка или водных
эмульсий. Продуктом такой полимеризации является
водная дисперсия полимера – латекс. Выделяют полимер из
латекса добавлением электролита для разрушения
поверхностной пленки эмульгатора.
53.
4. Суспензионную полимеризацию проводят в жидкости,не растворяющей мономер, обычно в воде. Размер капель
мономера в водной фазе в сотни раз больше (от 1 мкм до 1
мм), чем при эмульсионной полимеризации. Также
добавляются эмульгаторы, образующие с каплями
мономера дисперсию. Получаемые частицы имеют форму
бисера или гранул. Полимер легко отделяется от водной
фазы в центрифуге без специальной коагуляции.
Стабилизаторы суспензии легко отмываются с поверхности
гранул, полимер содержит мало примесей. Недостаток
метода – загрязнение сточных вод.

































 chemistry
chemistry








