Similar presentations:
Растворы. Основные понятия. Концентрация. Законы Рауля
1.
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ – МСХА имени К.А.
ТИМИРЯЗЕВА
(ФГОУ ВПО РГАУ - МСХА имени К.А. Тимирязева)
КАФЕДРА ФИЗИЧЕСКОЙ И ОРГАНИЧЕСКОЙ ХИМИИ
Лекции
Дисциплина:
Физическая и коллоидная химия
Лектор:
Ст. Преподаватель кафедры физической и органической
химии
Моргунов Андрей Владимирович
2.
ХИМИЧЕСКАЯКИНЕТИКА
СТРОЕНИЕ
ВЕЩЕСТВА
РАСТВОРЫ
ФИЗИЧЕСКАЯ
ХИМИЯ
ХИМИЧЕСКАЯ
ТЕРМОДИНАМИКА
ЭЛЕКТРОХИМИЯ
КОЛЛОИДНАЯ
ХИМИЯ
3.
Лекция 1. Растворы.Основные понятия. Концентрация. Законы Рауля.
4.
Раствор – гомогенная смесь, состоящая из двух или большего числавеществ, состав которой в некоторых пределах может непрерывно
изменяться без скачкообразных изменений свойств.
Компоненты – составные части растворов (растворитель и растворенные
вещества).
Пример: NaCl в Н2О.
Растворы:
- газовые смеси;
- жидкие: растворы неэлектролитов и электролитов;
- твердые.
Образование раствора:
- самопроизвольный процесс с увеличением энтропии;
- динамический процесс – с увеличением концентрации растворенного
вещества (при данных Т и Р) ∆G=0.
Насыщенный раствор ∆G=0. (Растворимость – предельная концентрация
растворенного вещества);
Пересыщенный раствор ∆G>0. Перекристаллизация – способ очистки
веществ.
5.
Идеальные растворы (бензол + толуол):- нет взаимодействий между частицами растворенного вещества и
растворителя, а так же между собой;
- нет тепловых и объемных эффектов (∆Hp=0, ∆Vp=0).
Реальные растворы (Н2SO4 в Н2О):
- есть тепловые и объемные эффекты (∆Hp≠0, ∆Vp≠0);
- есть различные взаимодействия между частицами.
Неограниченная растворимость – достигается в условиях одинаковой
энергии взаимодействия между частицами (Е(А-А) = Е(В-В) = Е (А-В));
Ограниченная растворимость – обусловлена неравенством энергий
взаимодействия частиц (Е(А-А) ≠ Е(В-В) ≠ Е(А-В));
Критическая температура растворения (К) – температура, выше которой
происходит неограниченное взаимное растворение;
Закон распределения: С1/С2 = К (пример: растворимость иода в H2O и
ССl4 при Т=const), метод экстракции;
6.
Влияние на растворимость внешних условий:Давление:
- с ростом давления растворимость газов в жидкостях увеличивается;
Закон Генри С = k * P (для разбавленных растворов малорастворимых
газов при Т=const) пример: N2 в H2O;
- на растворение жидкостей и твердых веществ давление практически не
влияет;
Температура:
- с ростом температуры растворимость газов падает (сольватация частиц
экзотеромична);
- изменение T влияет на растворение жидкостей и твердых частиц в
зависимости от механизма (учесть разрушение Е крист. решетки и
энергии сольватации)
Растворимость веществ снижается при добавлении других веществ
(Высаливание).
7.
Концентрация раствора:Разбавленные растворы – растворы с концентрацией < 0,01 Моль/л.
- Молярная концентрация См
m
1000 , [моль/л];
M V
m
1000 , где Э f M
- Нормальная концентрация Сн
Э V
[моль-экв/л];
- Моляльная концентрация
- Массовая доля W %
- Объемная доля
Ст
n
mрастворителя
1000
, [моль/кг р-теля];
mвещества
m
100 , или W % вещества 100 , [% масс.];
mраствора
V
Vвещества
100 , [объемный процент];
Vраствора
- Мольная доля (раствор компонента А в растворителе B):
XA +XB = 1, XB = 1/XA;
- Активная концентрация a f C , где f – коэффициент активности.
8.
Давление насыщенного пара, I закон Рауля.m V2 3
Eк
k T
2
2
Давление насыщенного пара растворителя над раствором всегда меньше,
чем над чистым растворителем.
«А» – компонент раствора (растворитель).
PA k X A
0
0
Если X A 1 , то PA P 0 A , следовательно k P A , тогда PA P A X A .
Если добавить к веществу «А» вещество «В», то X A X В 1
0
0
0
Тогда PA P A (1 X В ) , или PA P A P A X В ;
Следовательно
P 0 A PA
P
0
XВ
(только при ∆Hp≈0, ∆Vp≈0).
A
Относительное понижение давления насыщенного пара растворителя над
раствором равно мольной доле растворенного вещества в растворе.
9.
10.
Температура замерзания (Тз) – Т начала образования кристаллов.Понижение температуры замерзания пропорционально понижению давления
пара. Тогда (учитывая I закон Рауля)
понижение температуры замерзания пропорционально концентрации
растворенного вещества:
TЗ k m
(справедливо для неэлектролитов)
k – криоскопическая постоянная (моляльное понижение температуры
замерзания),
m – моляльная концентрация
Вещество
К, град/моль
Вода
1,86
Уксусная кислота
3,90
Нафталин
6,8
Бензол
5,12
11.
Температура кипения (Ткип) – температура, при которой давлениенасыщенного пара над раствором становится равным внешнему давлению.
Повышение температуры кипения пропорционально понижению давления
насыщенного пара. Тогда (учитывая I закон Рауля)
повышение температуры кипения пропорционально концентрации
растворенного вещества:
, где
Tкип Е m
(справедливо для неэлектролитов)
Е – эбулископическая постоянная (моляльное повышение температуры
кипения),
m – моляльная концентрация
Вещество
Е, град/моль
Вода
0,514
Уксусная кислота
2,93
Нафталин
5,65
Бензол
2,64
12.
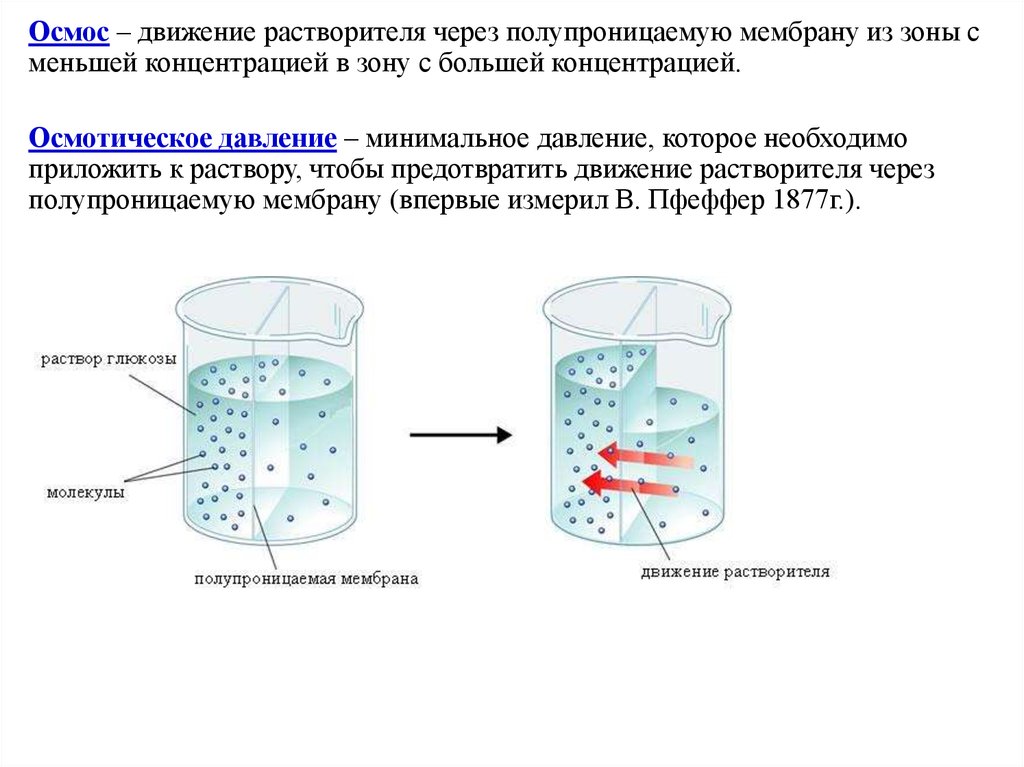
Осмос – движение растворителя через полупроницаемую мембрану из зоны сменьшей концентрацией в зону с большей концентрацией.
Осмотическое давление – минимальное давление, которое необходимо
приложить к раствору, чтобы предотвратить движение растворителя через
полупроницаемую мембрану (впервые измерил В. Пфеффер 1877г.).
13.
Вант-Гофф предложил эмпирическое уравнение:Pосм С R T
(только для идеальных, либо сильно разбавленных молекулярных растворов)
Измерение осмотического давления:
Статический метод:
1 – прошлифованный градуированный
капилляр;
2 – ячейка с раствором;
3 – полупроницаемая мембрана
14.
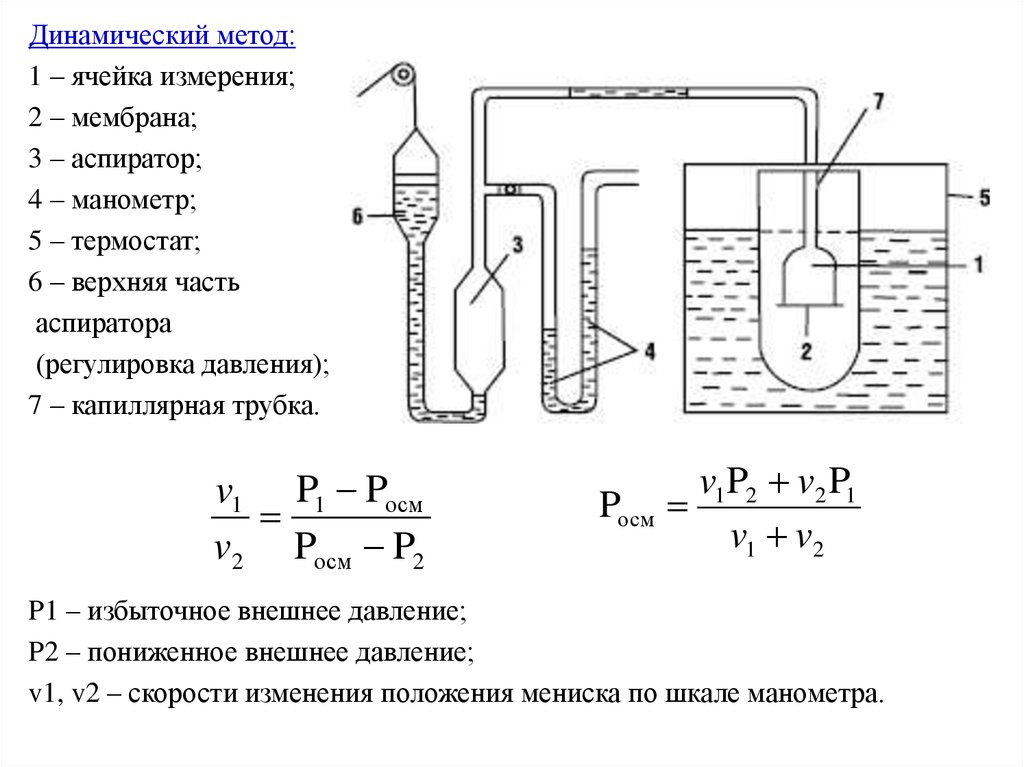
Динамический метод:1 – ячейка измерения;
2 – мембрана;
3 – аспиратор;
4 – манометр;
5 – термостат;
6 – верхняя часть
аспиратора
(регулировка давления);
7 – капиллярная трубка.
v1 P1 Pосм
v2 Pосм P2
Pосм
v1P2 v2 P1
v1 v2
P1 – избыточное внешнее давление;
P2 – пониженное внешнее давление;
v1, v2 – скорости изменения положения мениска по шкале манометра.
15.
Растворы электролитовСольватация (гидратация) – электростатическое взаимодействие с молекулами
растворителя (Д.И. Менделеев, И.А. Каблуков, С. Аррениус).
∆Hр – теплота растворения (3,8 кДж/моль);
Uр – энергия кристаллической решетки (778 лДж/моль);
∆Hг – теплота гидратации (-774,2 кДж/моль).
16.
Закон Кулонаq1 q2
F
2
4 0 r
1
17.
Слабые электролиты:Ковалентные соединения, подвергающиеся в воде частичной диссоциации
(слабые кислоты и основания, некоторые соли, органические кислоты, амины,
фенолы и пр.)
АВ А В
динамическое равновесие
Cтепень диссоциации (α) – отношение количества продиссоциированных
молекул к общему количеству молекул до диссоциации (0↔1, зависит от
природы вещества и растворителя, T, концентрации).
Закон действующих масс (Гульдберга и Вааге 1864г.):
К – константа диссоциации,
Зависит от природы вещества и
растворителя, температуры
К(СН3СООН) = 1,86*10-5
К(ССl3COOH) = 1*10-1
[ A ] [B ]
К
[ AB]
18.
Если N – число молекул электролита до диссоциации,то число диссоциированных молекул N – Nα = N(1 – α);
Если каждая молекула распадается на n ионов, то число всех частиц (молекул и
ионов) равно N(1 – α) + nNα = N(1 – α + n α)
i – изотонический коэффициент Вант-Гоффа показывает во сколько раз
суммарная эффективная концентрация частиц, образовавшихся в процессе
диссоциации, больше, чем молекул до диссоциации.
N (1 n )
i
1 (n 1)
N
для слабых электролитов
Tкип i Е m
TЗ i k m
Pосм i С R T
для неэлектролитов
Tкип Е m
TЗ k m
Pосм С R T
19.
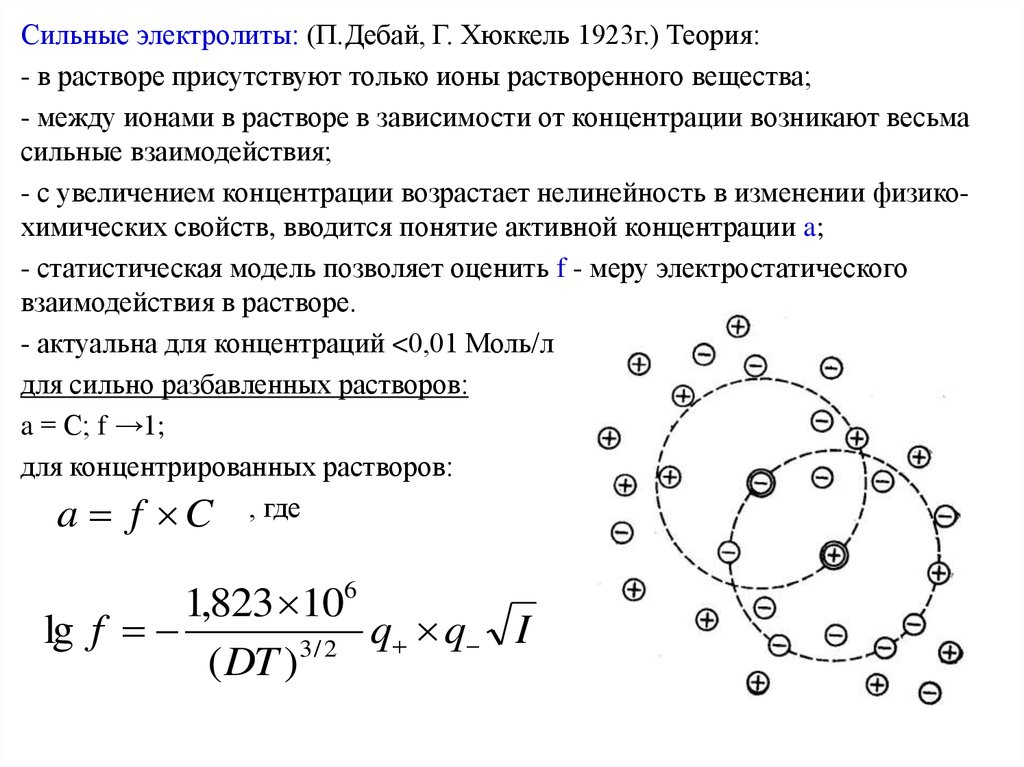
Сильные электролиты: (П.Дебай, Г. Хюккель 1923г.) Теория:- в растворе присутствуют только ионы растворенного вещества;
- между ионами в растворе в зависимости от концентрации возникают весьма
сильные взаимодействия;
- с увеличением концентрации возрастает нелинейность в изменении физикохимических свойств, вводится понятие активной концентрации a;
- статистическая модель позволяет оценить f - меру электростатического
взаимодействия в растворе.
- актуальна для концентраций <0,01 Моль/л
для сильно разбавленных растворов:
a = С; f →1;
для концентрированных растворов:
a f C , где
1,823 10
lg f
q q I
3/ 2
( DT )
6
20.
Ионная сила раствора – величина, характеризующая меру интенсивностиэлектрического поля (ионной атмосферы), обусловленную концентрацией
растворенных заряженных частиц (ионов).
1
2
I Ci z i
2
21.
для слабых электролитовдля сильных электролитов
Tкип i Е m
Tкип f i Е m
TЗ i k m
Pосм i С R T
TЗ f i k m
Pосм f i С R T



















 chemistry
chemistry








