Similar presentations:
Концентрация растворов. Закон Рауля
1.
РастворыРаствором можно назвать многокомпонентную, гомогенную,
термодинамически равновесную систему, образованную за счет всех
возможных сил взаимодействия (вандерваальсовских, водородных,
химических) между всеми составляющими ее частицами.
2.
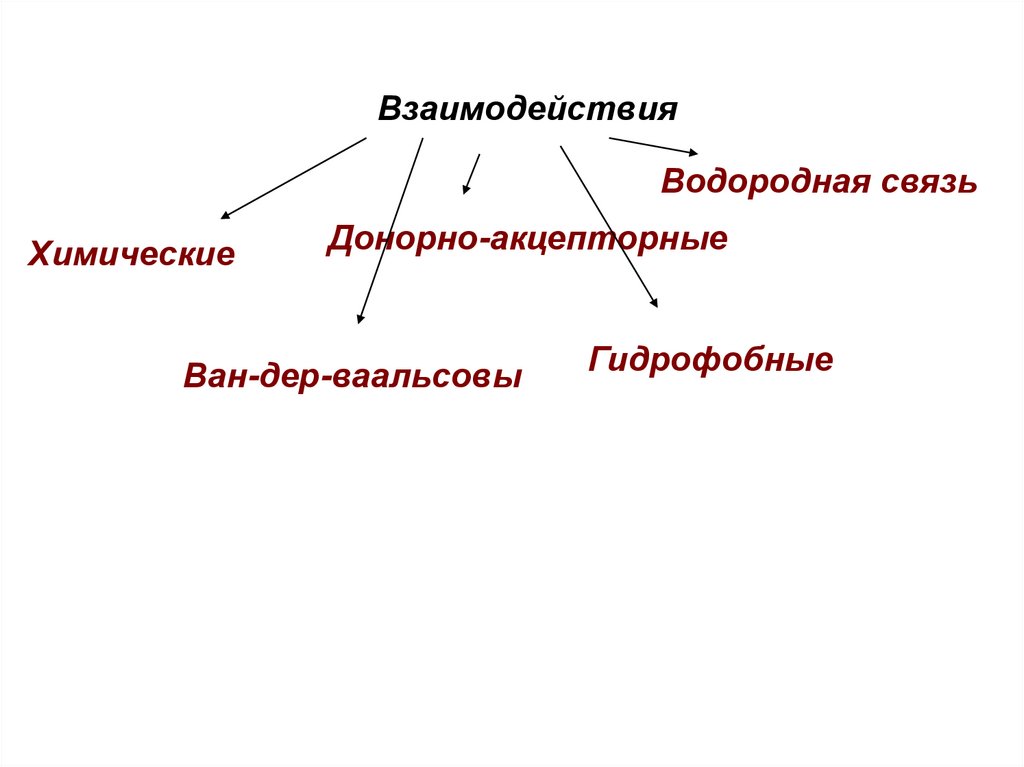
ВзаимодействияВодородная связь
Химические
Донорно-акцепторные
Ван-дер-ваальсовы
Гидрофобные
3. Концентрация растворов
1. Массовые доли (проценты)ma
W
mp p
ma
W%
100
mp p
2. Объемные доли (проценты)
Va
Y
Vp p
Va
Y%
100
Vp p
3. Мольные доли (проценты)
na
X
np p
na
X%
100
np p
4.
4. Молярная концентрация – количество мольрастворенного вещества в 1 литре раствора (моль/л)
na
c
Vp p
5. Нормальная концентрация – количество мольэквивалента растворенного вещества в 1 литре раствора
(моль-экв./л)
6. Моляльная концентрация – количество моль
растворенного вещества в 1 килограмме растворителя (моль/кг)
ni
bi
m
5.
Растворение твердых веществН раств Н субл Н сольв
Растворение кристаллических веществ
Н раств Н кр. реш. Н сольв
Растворение жидких веществ
Н раств Н пар Н сольв
Растворение газообразных веществ
Н раств Н сольв
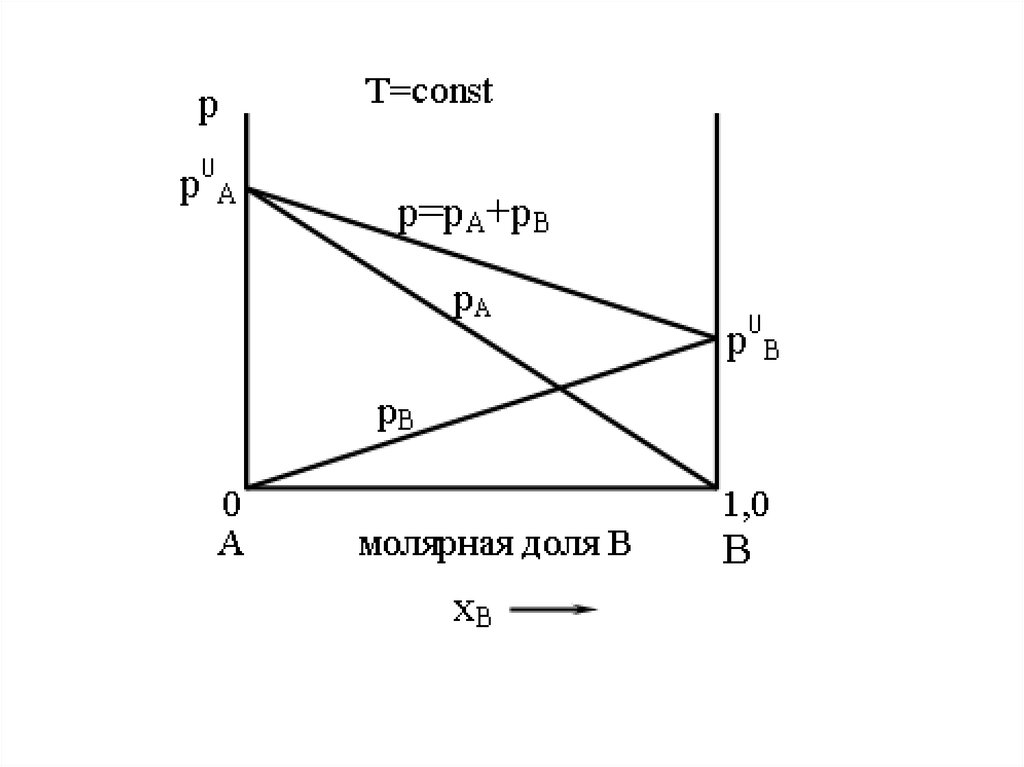
6. Идеальные растворы. Закон Рауля.
При любой заданной температуре парциальное давление насыщенногопара компонента раствора прямо пропорционально его мольной доле в
растворе, причем коэффициент пропорциональности равен давлению
насыщенного пара над чистым компонентом.
PA PA0 x A
PB PB0 x B
Относительное понижение давления пара растворителя над раствором
равно мольной доле растворенного вещества и не зависит от природы
растворенного вещества
молярные доли компонентов в паре (yА, уВ), в соответствии с законом Дальтона,
будут равны:
7.
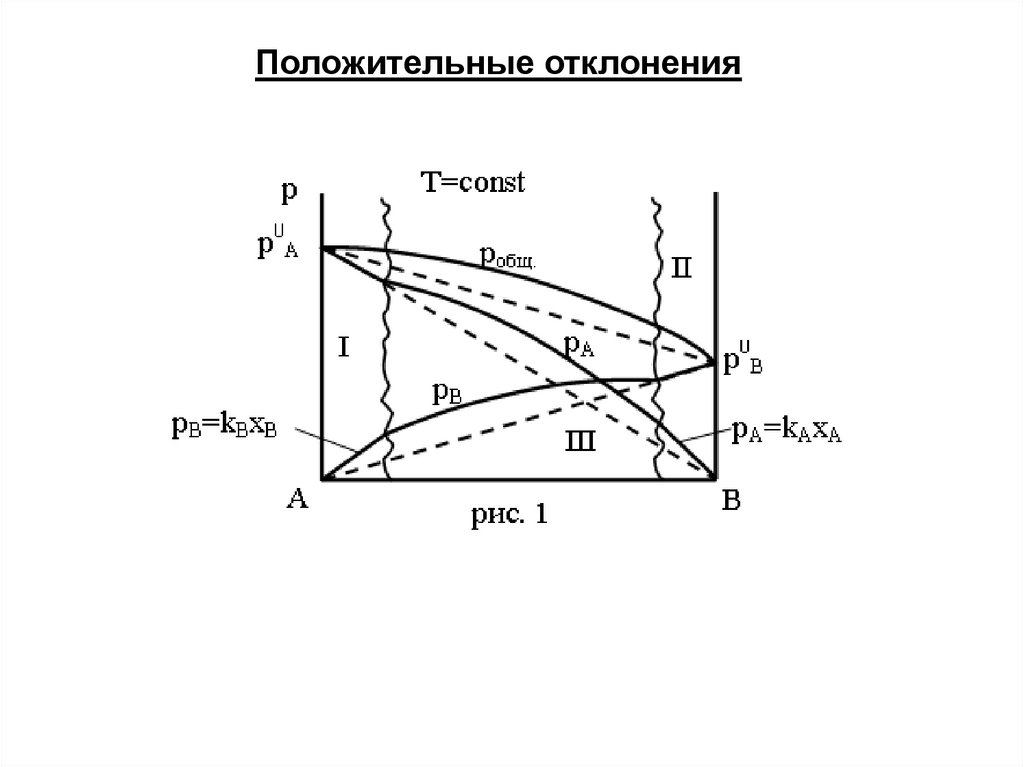
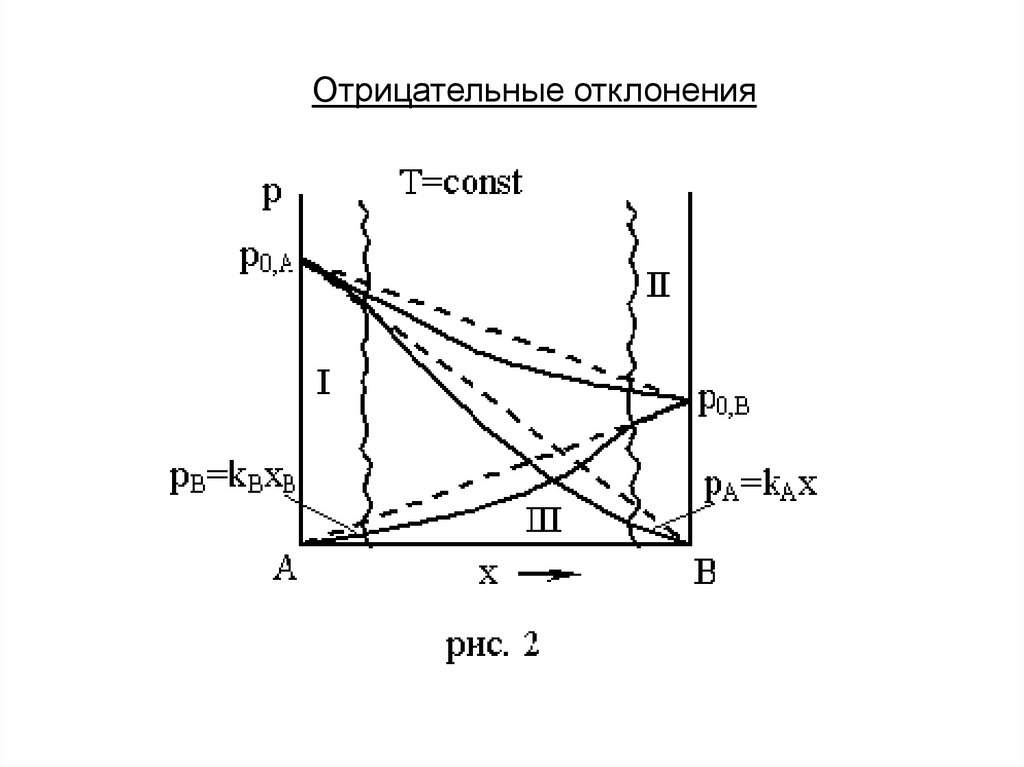
8. Реальные растворы. Отклонения от закона Рауля.
ai i ·xiположительные
отрицательные
9.
Положительные отклонения10.
Отрицательные отклонения11.
Диаграммы состояния жидкость-пар длябинарных систем
12.
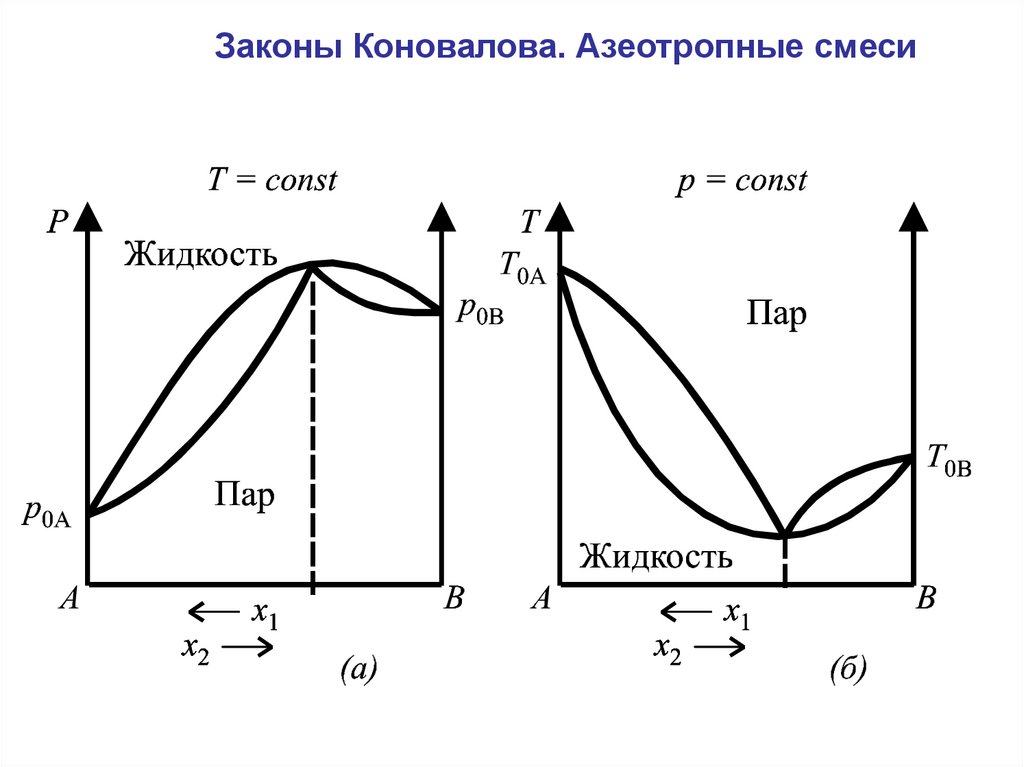
Законы Коновалова. Азеотропные смеси13.
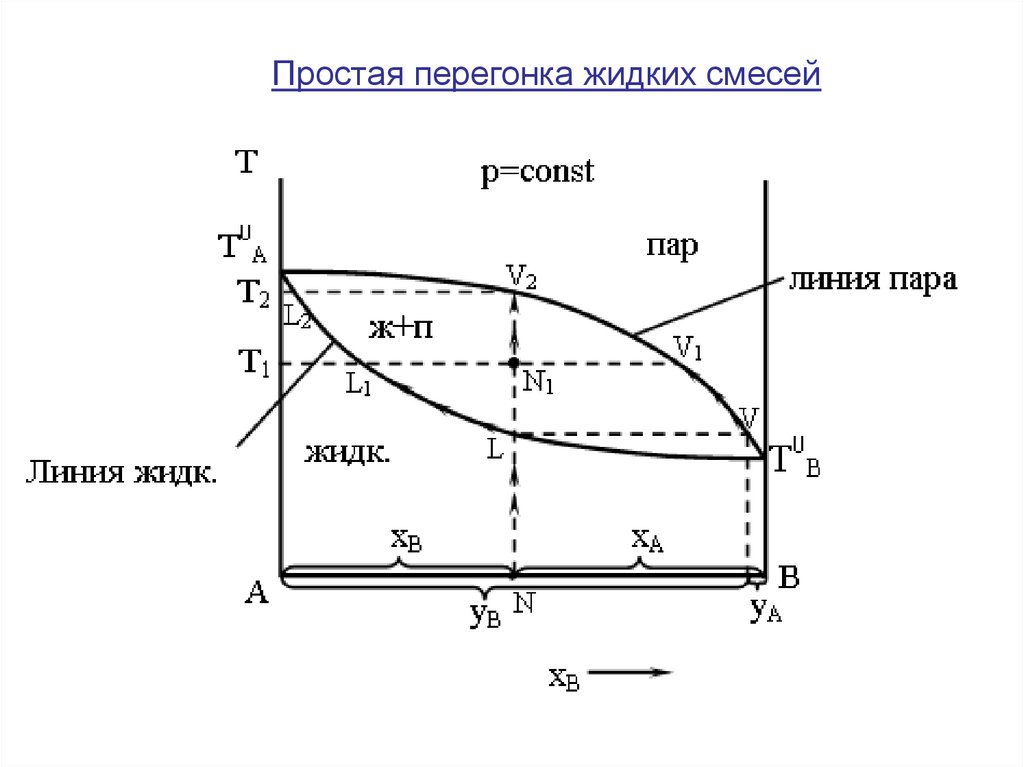
Простая перегонка жидких смесей14.
Фракционная перегонкаТ
b'
c'
d'
Т3
Т2
a'
А
a 1 b 2 c
Т4
Т1
3 d
В
15.
Ректификация16.
Перегонка двойных жидких растворов 2-го типаТ
Т
С
а)
0
ТА
2
пар
1
б)
пар
1
3
0
ТА
2
3
1
4
2
3
0
2
ТВ
1
жидкость
0
жидкость
А
а
ТВ
С
С'
b В
А
С'
В
17.
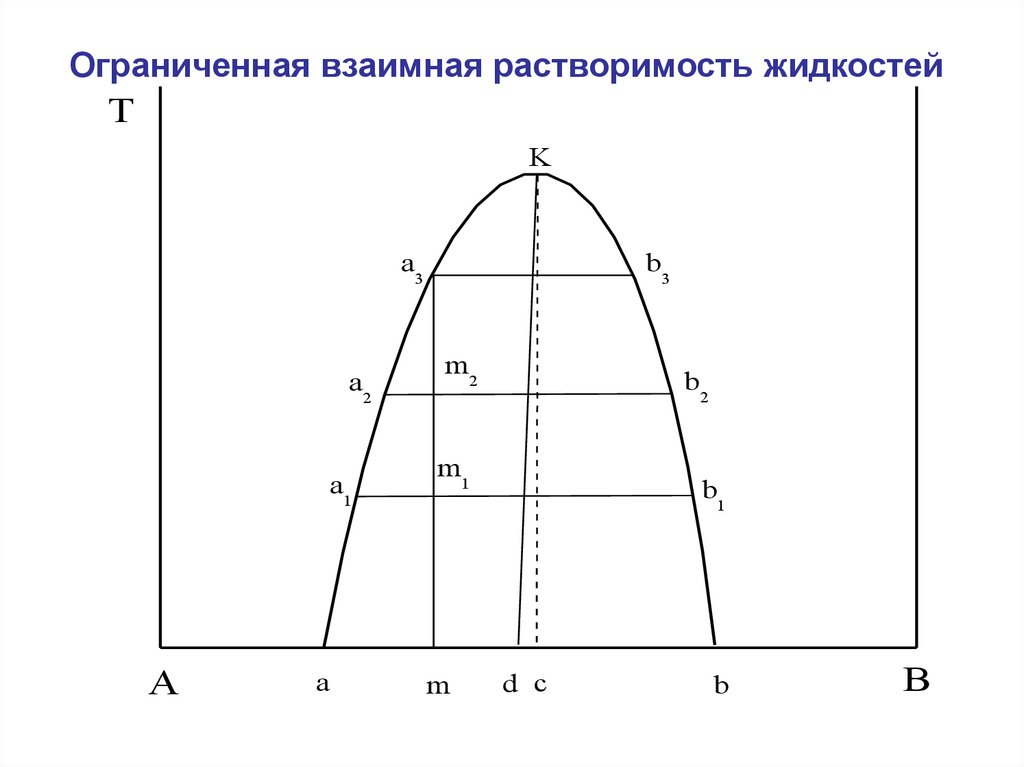
Ограниченная взаимная растворимость жидкостейТ
K
a3
a2
a1
A
a
b3
m2
b2
m1
m
b1
d c
b
B
18.
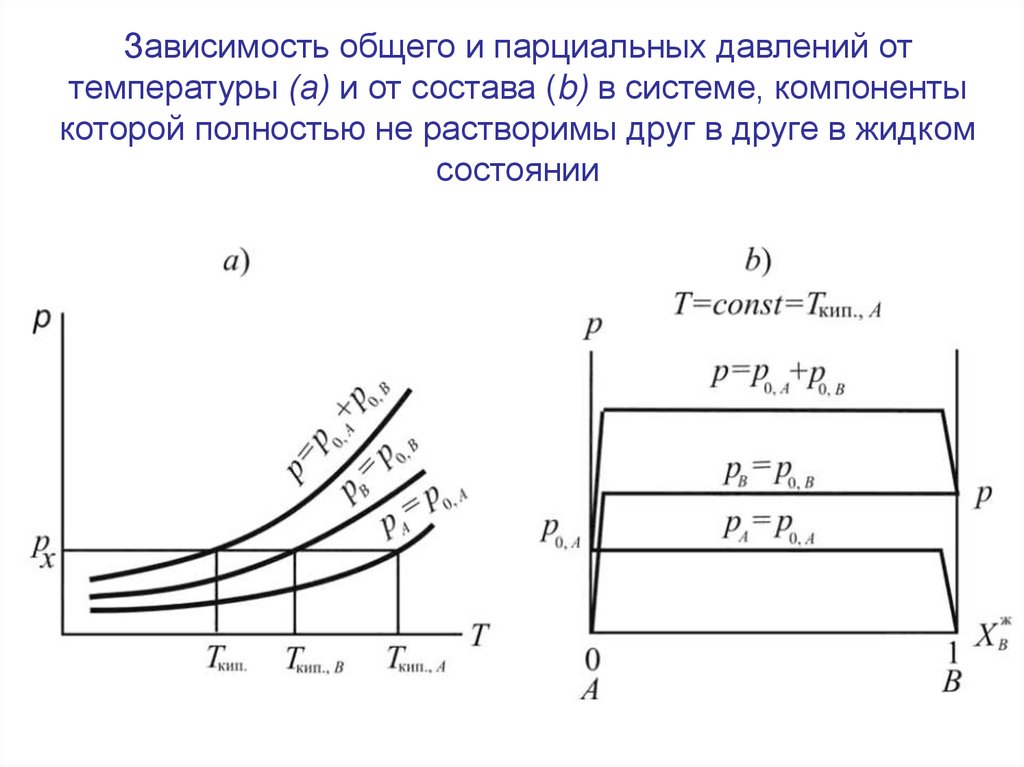
Зависимость общего и парциальных давлений оттемпературы (а) и от состава (b) в системе, компоненты
которой полностью не растворимы друг в друге в жидком
состоянии
19.
Диаграммы общее давление - состав (а) итемпература кипения - состав (b) для системы
из двух взаимно нерастворимых жидкостей
20.
21.
Распределение растворенного вещества между двумяжидкими фазами
степень n – показатель диссоциации
или ассоциации молекул
22.
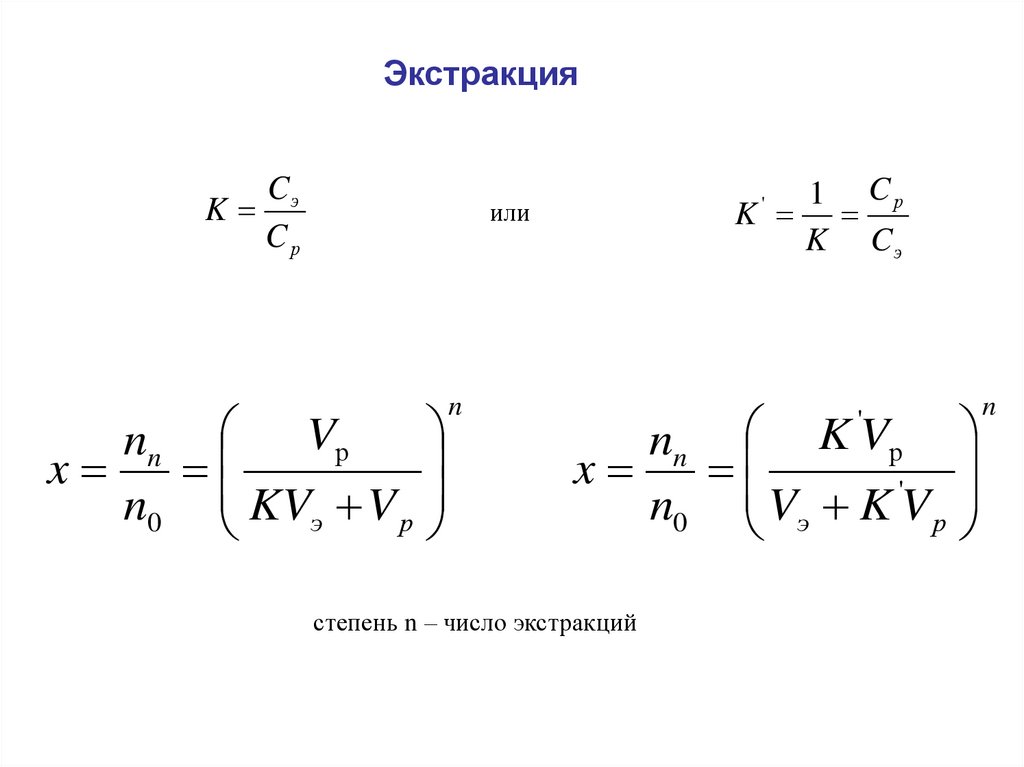
ЭкстракцияK
Cэ
Cр
1 Cр
K
K Cэ
'
или
Vр
nn
x
n0 KVэ V р
n
nn K Vр
x
'
n0 Vэ K V р
степень n – число экстракций
'
n
23.
Растворимость твердых веществ в жидкостяхуравнение Шредера
H пл
ln xнас
2
T
RT
P
идеальный раствор
H раств
ln xнас
2
RT
T P
реальный раствор
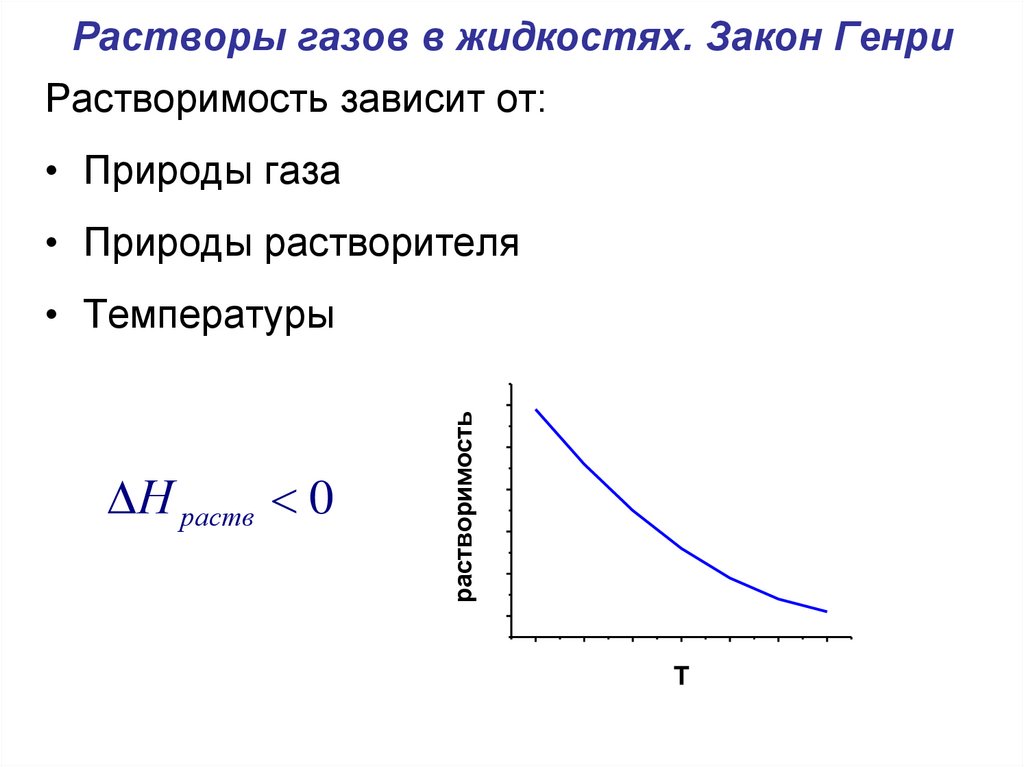
24. Растворы газов в жидкостях. Закон Генри
Растворимость зависит от:• Природы газа
• Природы растворителя
• Температуры
Н раств 0
растворимость
50
40
30
20
10
0
1
2
3
4
T
5
6
7
25.
•ДавленияС k P
Закон Генри
P - давление газа над раствором
C - концентрация газа в растворе
эффект высаливания
уравнение Сеченова
константа
k - Генри
26. Коллигативные свойства раствора. Изменение температуры замерзания и кипения
Эбулиоскопия — метод исследования температур кипения растворовRT02·M
Tкип Т Т 0
·b E·b
Н исп·1000
Криоскопия – метод исследования температур замерзания
(кристаллизации) растворов
RTпл2 ·М
Tзам. T0 T
·b К·b
Н пл·1000
27.
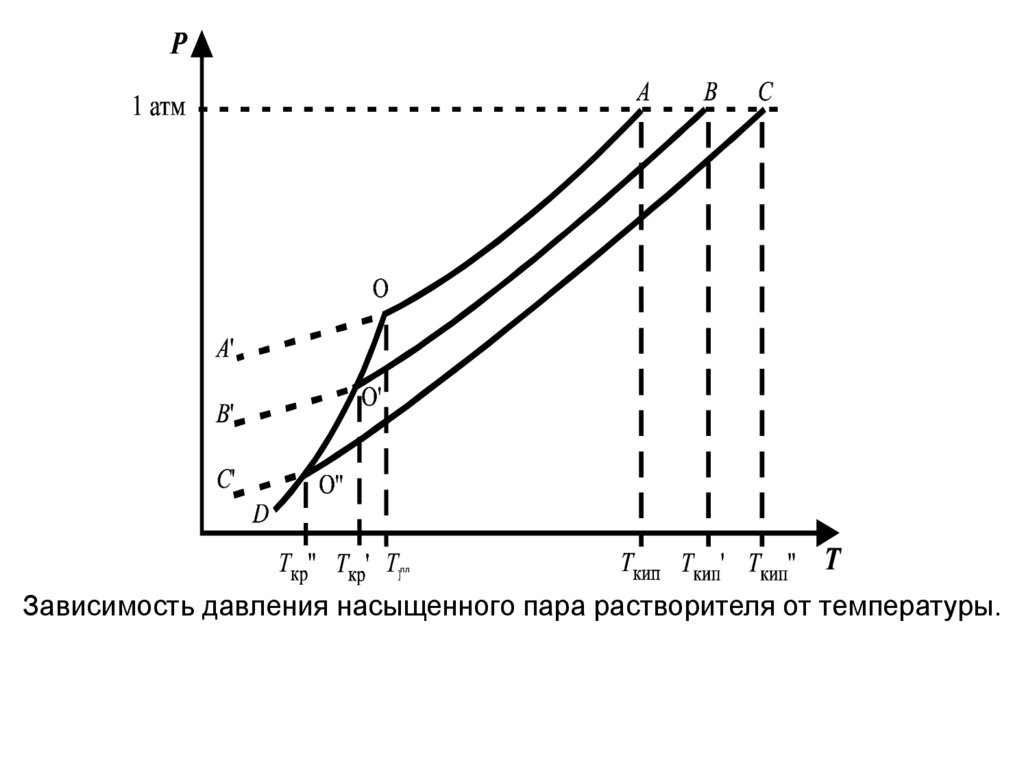
плЗависимость давления насыщенного пара растворителя от температуры.
















 chemistry
chemistry








