Similar presentations:
Арнайы салыстырмалылық теориясының элементтері
1. Қарағанды мемлекеттік техникалық университеті
ФИЗИКАФизика кафедрасы
Арнайы салыстырмалылық
теориясының элементтері.
Құрастырушылар:
Салькеева А.К.
2.
№5 Лекция жоспары1. Арнайы салыстырмалылық теориясының
элементтері.
2.Эйнштейн постулаттары.
3.Лоренц түрлендірулері.
4.Түрлендірулер инварианттары.
5. Жылдамдықтарды қосудың релятивтік заңы.
6.Импульс
пен
энергияны
релятивтік
түрлендіру
3.
Галилей түрлендіруіx x ut
y y
z z
t t
4.
5.
dx dxu
dt dt
– К жүйеде
x x u
y y
u
z z
-классикалық
жылдамдықтарды қосу
ережесі
6.
d d dudt
dt dt
u const
a a
du
0
dt
F ma
F F
7.
Галилей салыстырмалыпринциптері
1.Механикалық
заңдары
барлық
инерцилық жүйелерде бірдей өтеді. Бүл
жүйелер өзара инвариантты (бірдей).
2.Барлық инерциялық санақ жүйесінде
механика
заңдарынің
түжырымдау
бірдей орындалады.
8.
Жарық жылдамдығын өлшеу9.
Релятивтік теория.Эйнштейн постулаттары
1.Табиғаттың заңдары барлық инерцилы
жүйелерде бірдей өтеді.
2. Вакуумдағы жарық жылдамдығы жарық
көзінің немесе бақылаушының қозғалыс
жылдамдығына тәуедлі емес. Ол барлық
инерциялы жүйелерде бірдей болады.
10.
Лоренц түрлендіруіK ( x, y , z , t )
K ( x , y , z , t )
11.
constx ct
x ct
x x c(t t )
x x
t t
12.
K Kx t
x
2
1 2
c
K K
x
x t
1
2
c
2
13.
y yt
z z
t x / c
1 2
c
2
2
t
t x / c
1
2
c
2
2
14.
Лоренц түрлендіруінің салдарыК
жүйесі
К'
t2 t1
жүйесі
t 2 t1
t1
t1 x / c 2
1
1 2
c
2
t 2
2
c2
t 2 x / c
1
2
c
2
2
15.
c1
1
2
c
2
2
c
2
16.
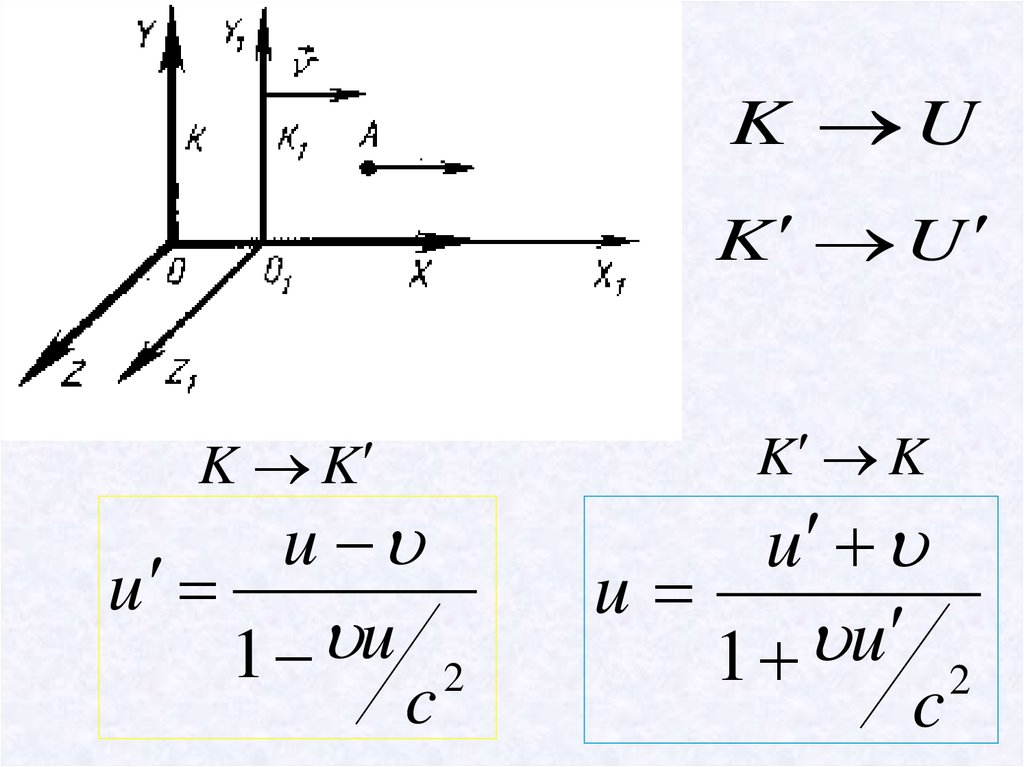
K UK U
K K
u
u
1 u 2
c
K K
u
u
u
1
2
c
17.
Жылдамдықтарды қосу релятивистік заңыu u
u c
c
c
c
u
c
c
1 c 2 1
c
c
c
u c
18.
Релятивтік динамиканың заңдарыc
m
m0
1
p m
p
2
c
2
m0
1
2
c
2
19.
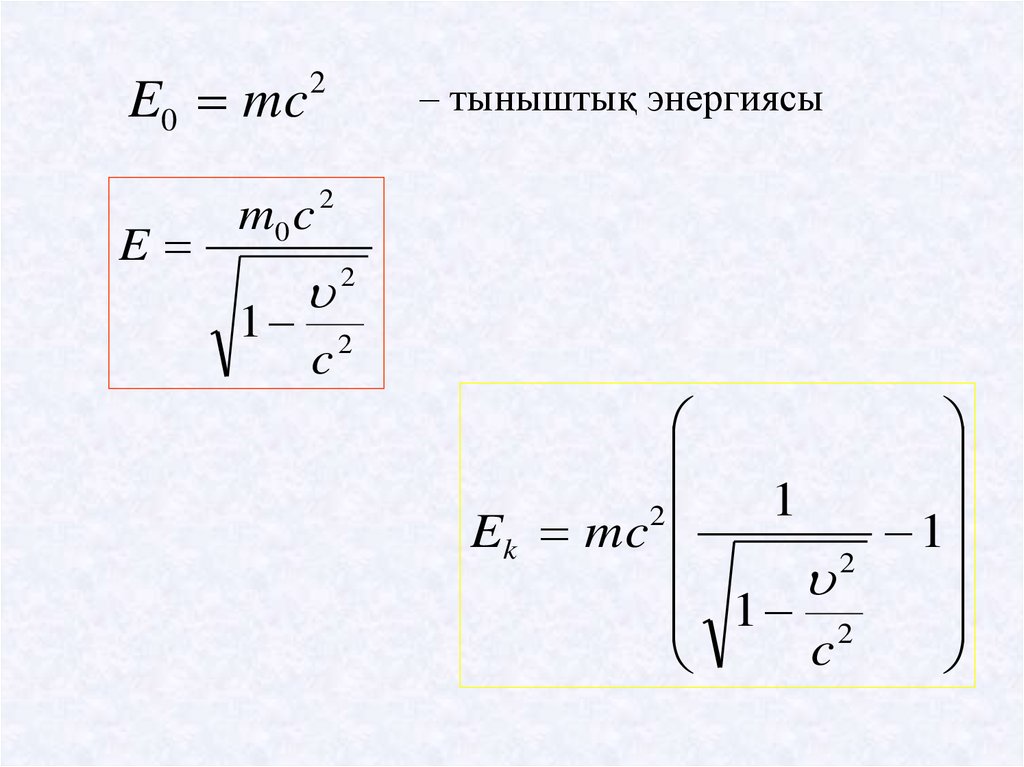
E0 mcE
2
m0 c
1
– тыныштық энергиясы
2
2
c2
1
2
Ek mc
1
2
1
2
c
20.
№5ДәрісСтатистикалық физика және
термодинамика
Лекция жоспары
1. Молекула – кинетикалық теорияның негіздері
2. Температураның молекула-кинетикалық мағынасы.
3. Идеал газ молекулаларының орташа кинетикалық
энергиясы.
4. Термодинамикалық параметрлер. Тепе-тендік күйлері мен
процестері, олардың термодинамикалық диаграммаларда
бейнелеу.
5. Газ заңдары. Идеал газ күйінің теңдеу.
21.
mM
N
NA
N A 6,022 10 моль
23
1
m0 – бір молекуланың массасы
1 кг/моль
22.
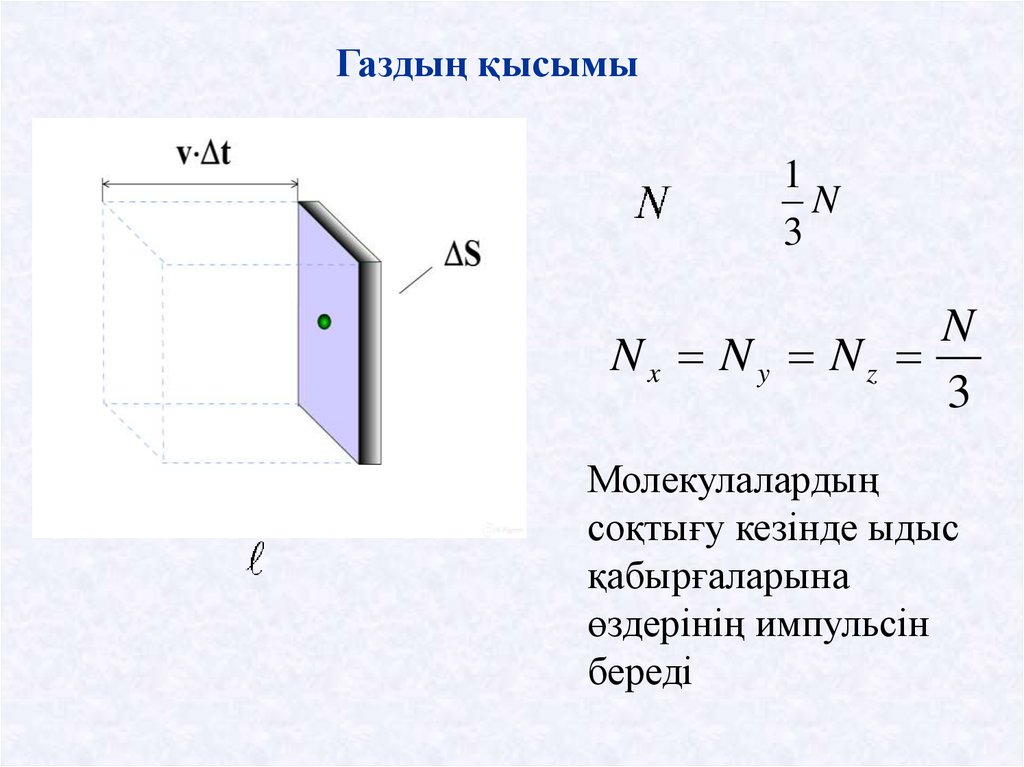
Газдың қысымы1
N
3
N
Nx N y Nz
3
Молекулалардың
соқтығу кезінде ыдыс
қабырғаларына
өздерінің импульсін
береді
23.
2m 2m mF
dt
2 /
2
2
2
2
m N
1 m 1 m 2
F
...
3
24.
S2
25.
FP
S
F
1 mN
1 N
2
2
m
S
3 S
3V
N
n
V
1
2
P
3
1
2
P nm
3
26.
2 mP n
3
2
2
2
P nE k
3
m 2
2
Ek
27.
PV RTPV 2 N AV
2 NA
T
Ek
Ek
R
3 VR
3 R
3 R
Ek
T
2 NA
R
k
1,38 10 23 Дж / К
NA
R
k
NA
3
E k kT
2
28.
T = t + 273,15P, V, T
mVM
m
P
RT
M
M
m
PV
RT
M
mVM
V
M
29.
mR
R
PV
NA
T N
T
M
NA
NA
N (m / M ) N A
P nkT
R
k
NA
30.
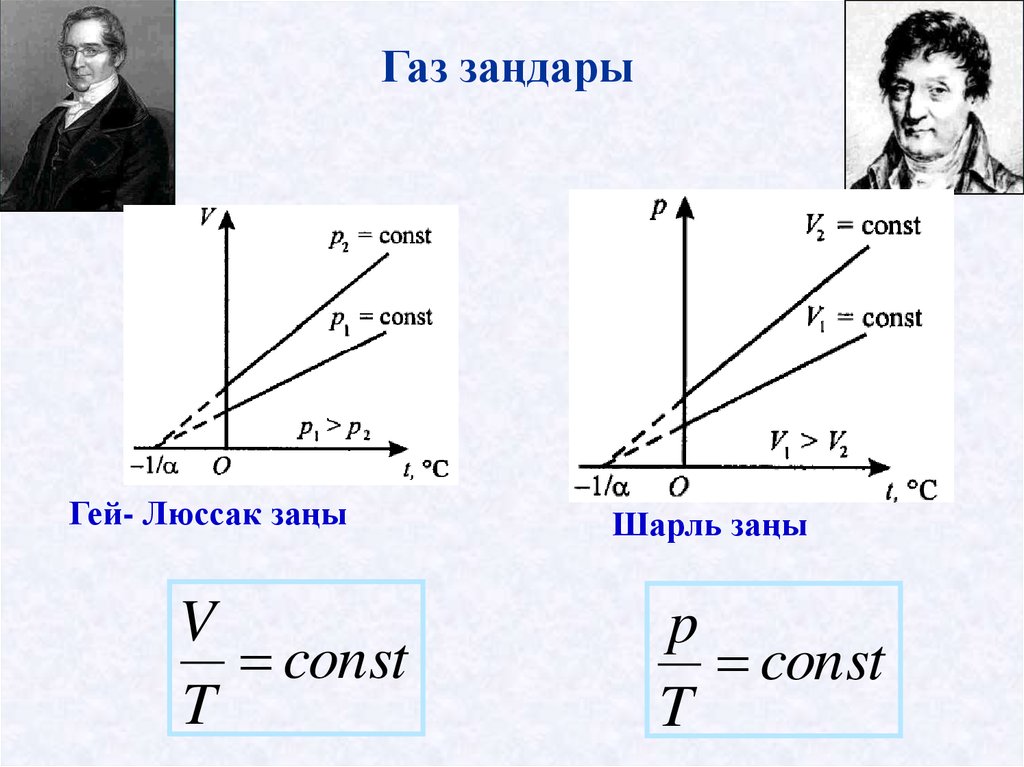
Газ заңдарыБойль – Мариотт заңы
pV const
31.
Газ заңдарыГей- Люссак заңы
V
const
T
Шарль заңы
p
const
T
32.
Дальтон заңы: газ қоспасының қысымыәрбір газдың жеке-жеке өндірілген
парциалдық қысымдарының қосындысына
тең.
P P1 P2 P3 ...
33.
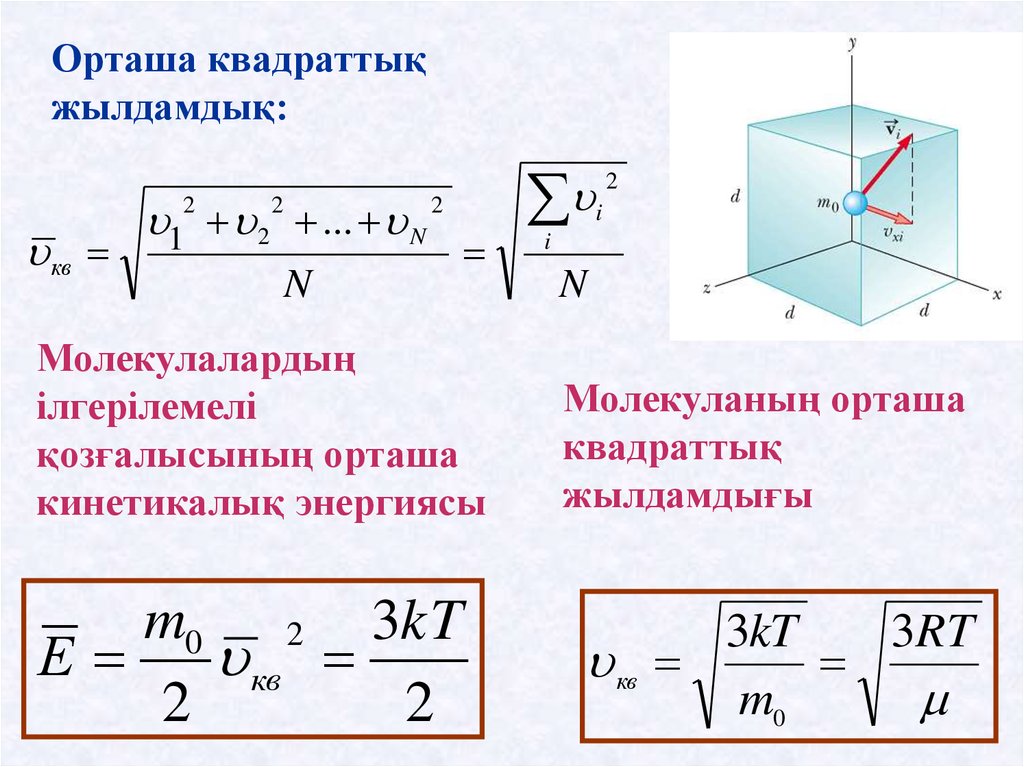
Орташа квадраттықжылдамдық:
1 2 ... N
2
кв
2
2
N
Молекулалардың
ілгерілемелі
қозғалысының орташа
кинетикалық энергиясы
m0 2 3kT
Е
кв
2
2
2
i
i
N
Молекуланың орташа
квадраттық
жылдамдығы
3kT
3RT
кв
m0
34.
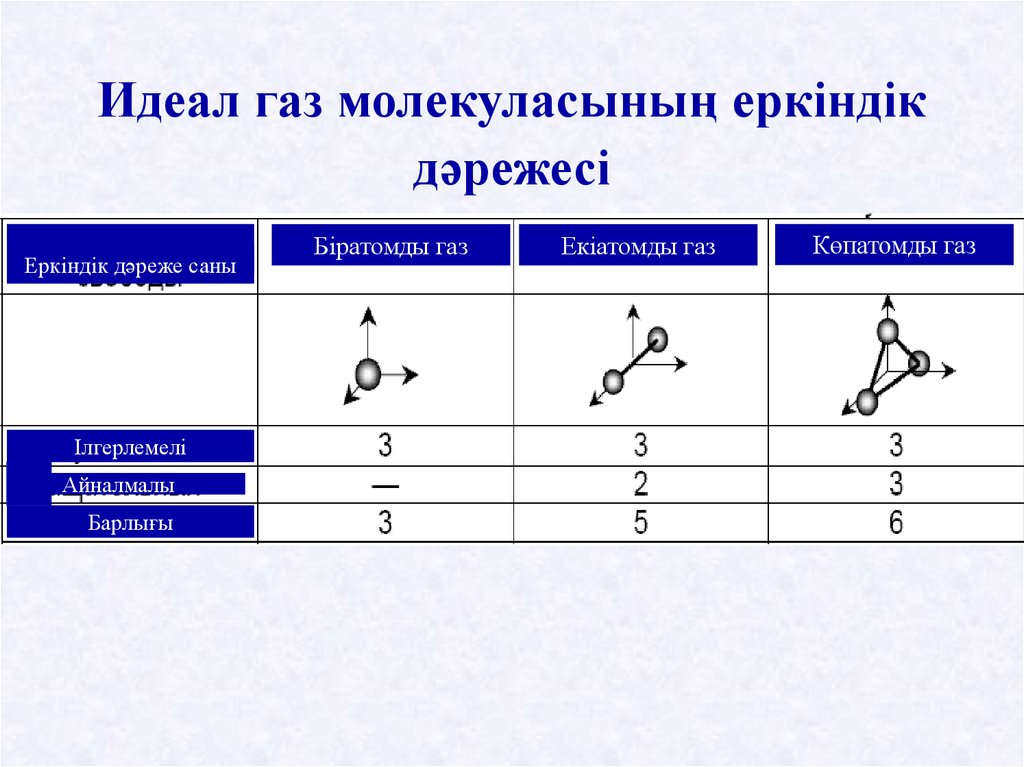
Идеал газ молекуласының еркіндікдәрежесі
Еркіндік дәреже саны
Ілгерлемелі
Айналмалы
Барлығы
Біратомды газ
Екіатомды газ
Көпатомды газ
35.
Идеал газдың ішкіэнергиясы
EP 0
i m
U
RT
2M
U ~T
Идеал
газдың
ішкі
энергиясы
жеке-жеке
молекулалардың
кинетикалық
энергиясынан
құралады. Ішкі энергия күй функциясы боп табылады,
оның өзгеруі жүйенің бастапқы және соңғы күйлеріне
ғана тәуелді.
36.
Максвелл таралуы250 С темпертурада
молекулалардың көп бөлігі
~400м/с жылдамдықпен
қозғалады
250С температурадағы
оттегі
1000 0 С температурадағы оттегі
37.
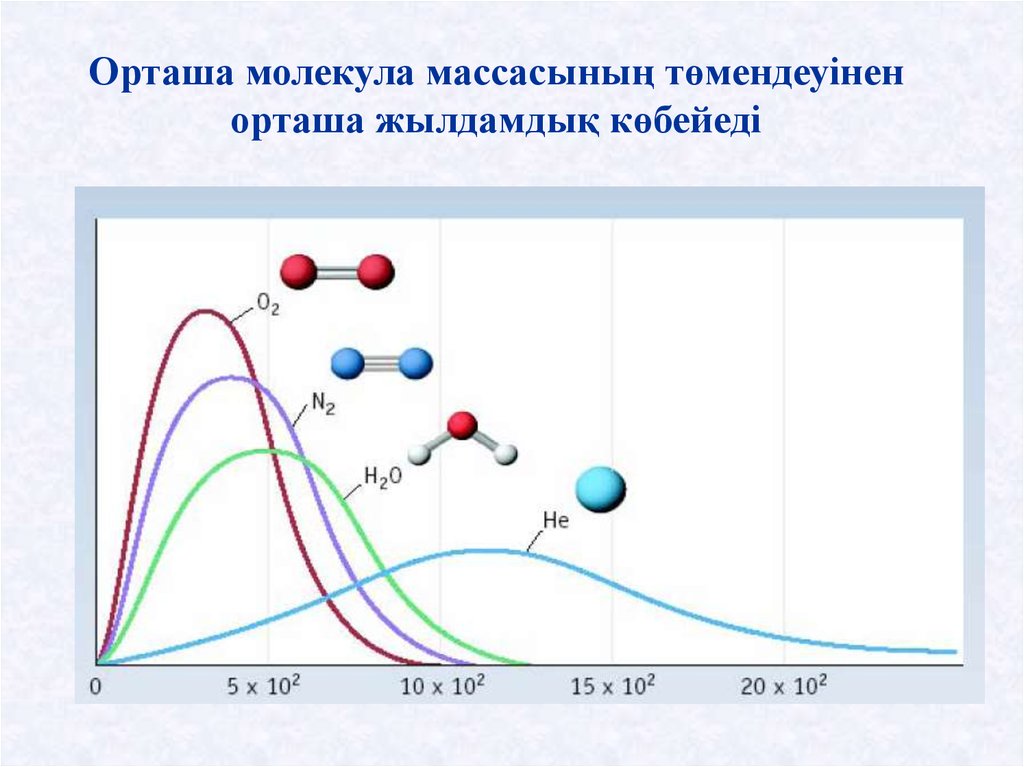
Орташа молекула массасының төмендеуіненорташа жылдамдық көбейеді
38.
Максвелл таралуы функциясыТаралу функциясы – жылдамдығы -
dN
f ( )
Nd
+ d аралықта жататын молекула
санының бөлігі.
f ( ) А e
2
f ( )d 1
0
m0 2
2 kT
Молекулалардың
жылдамдық бойынша
таралы функциясы
Нормалау(қалыпқа келтіру) шарты
m0
A 4
2 kT
3
2
39.
Идеал газ күйін сипаттайтын жылдамдықтар2kT
2 RT
в
m0
8kT
8RT
а
m0
3kT
3RT
кв
m0
Ең үлкен ықтималдылық
Орташа арифметикалық
Орташа квадраттық
40.
Гальтонтақтасы
молекулалардың
жылдамдық
бойынша
таралуын
сипаттайды(модельдейді)
41.
Барометрлік формулаm0 gh
gh
p p0 exp
p0 exp
RT
kT
P P0 e
g h
RT
P P0 e
gmh
kT
Биіктік өскенде, ауа қысымы
экспоненциалды заң бойынша төмендейді



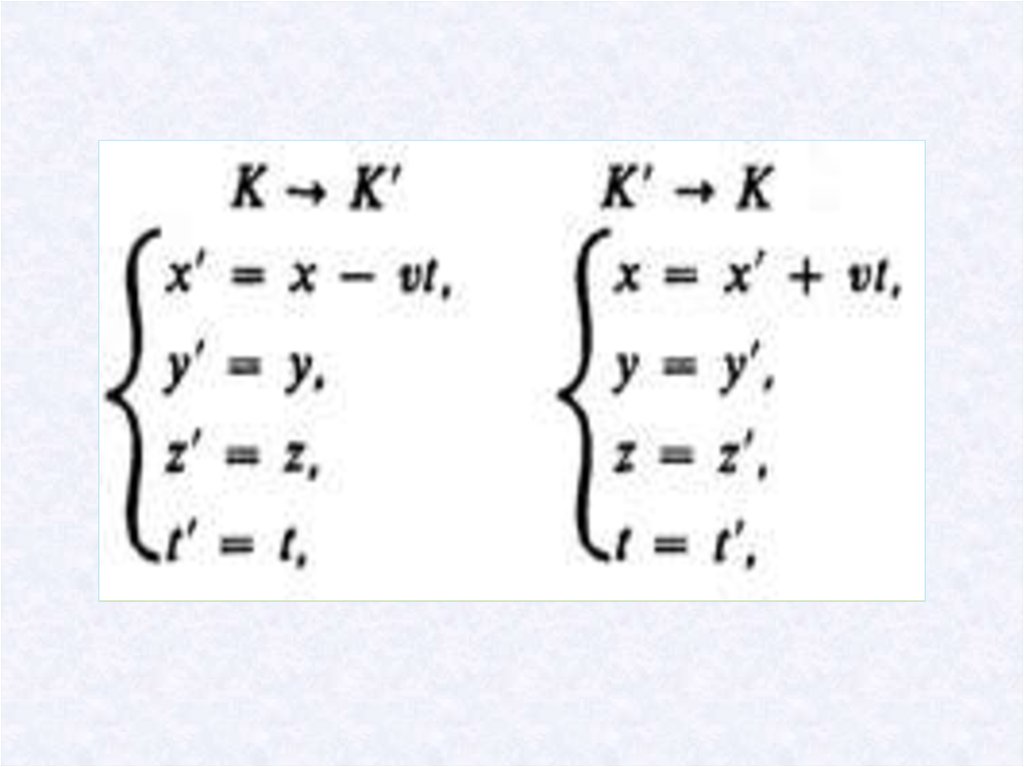

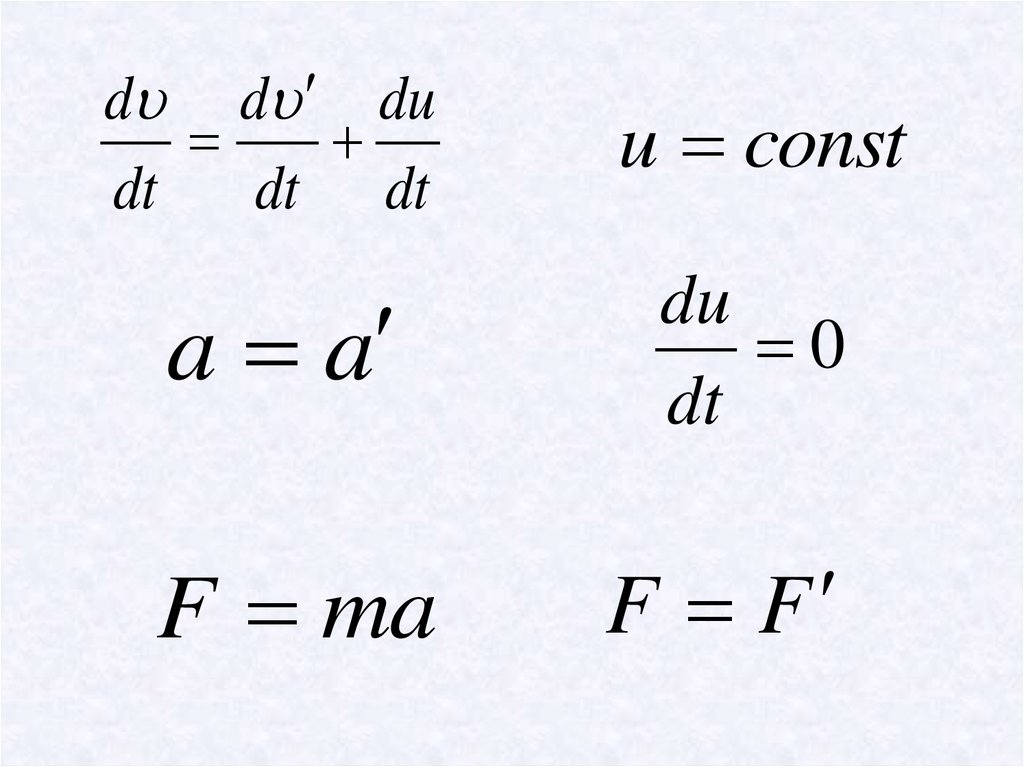



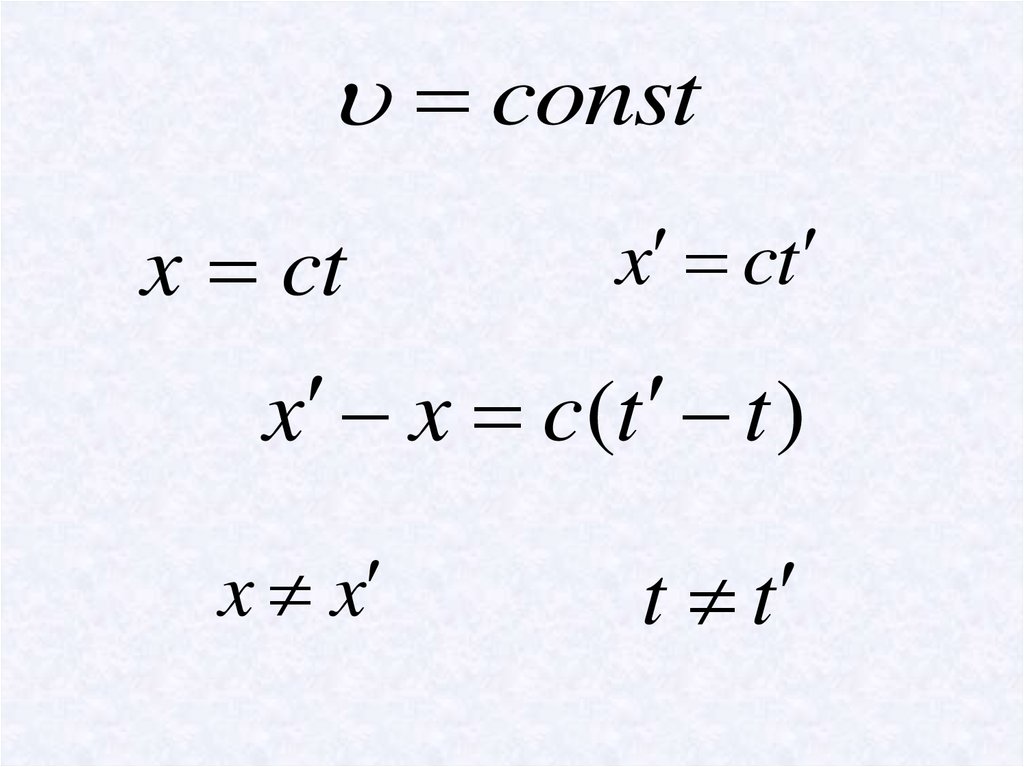
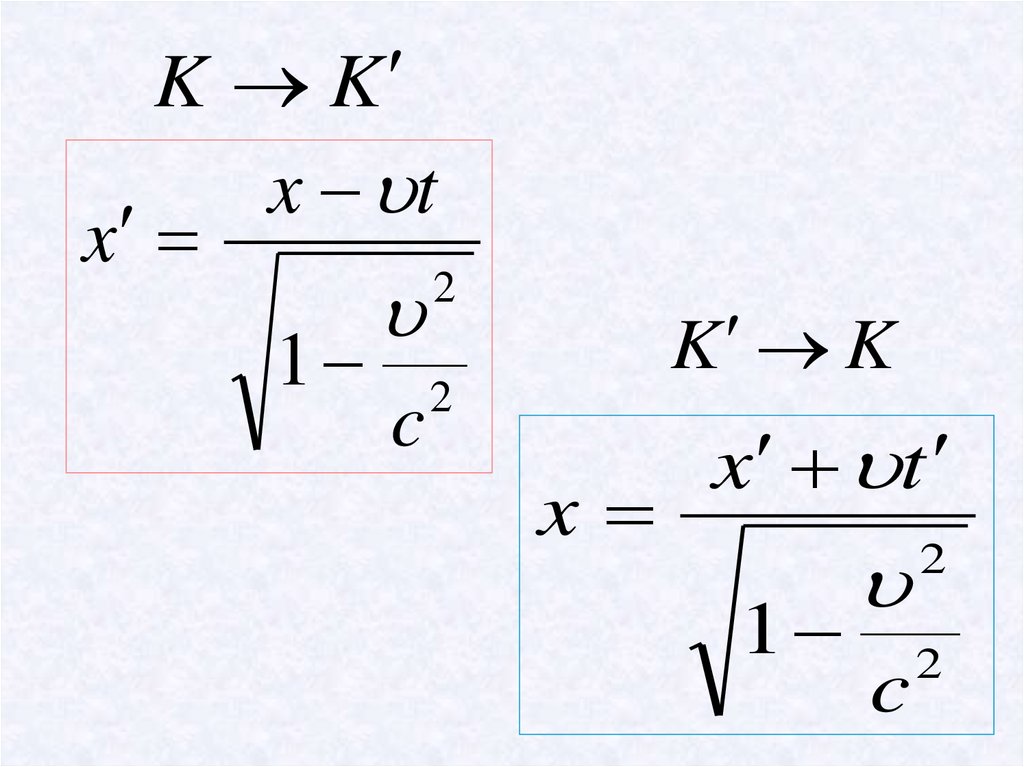


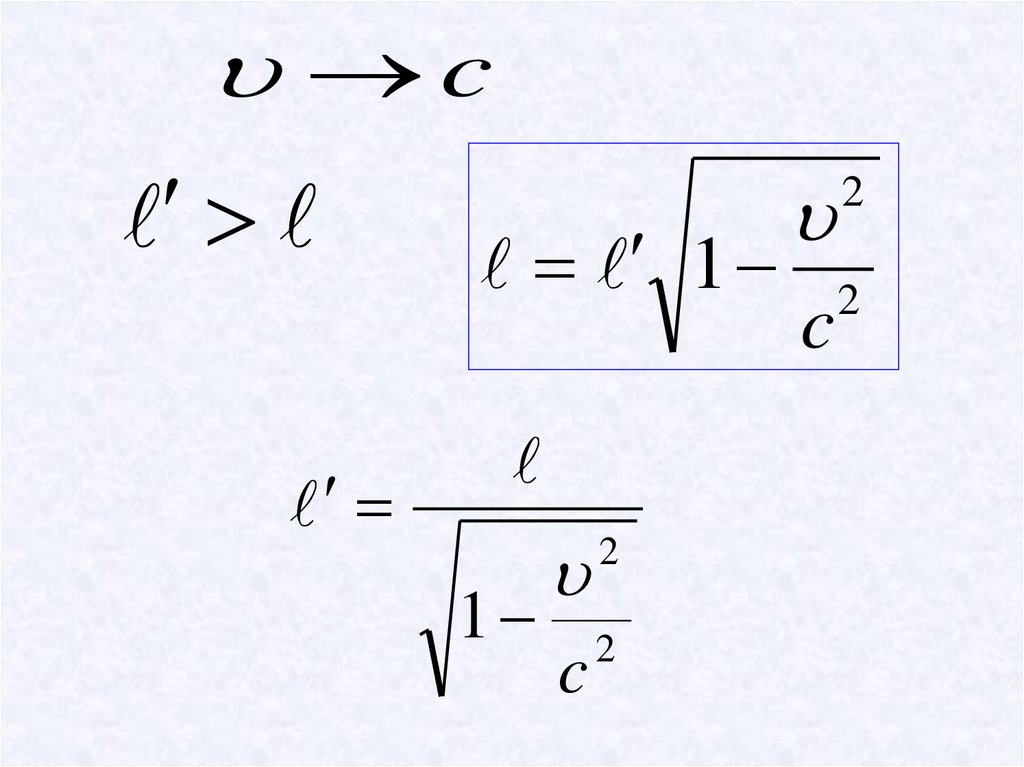






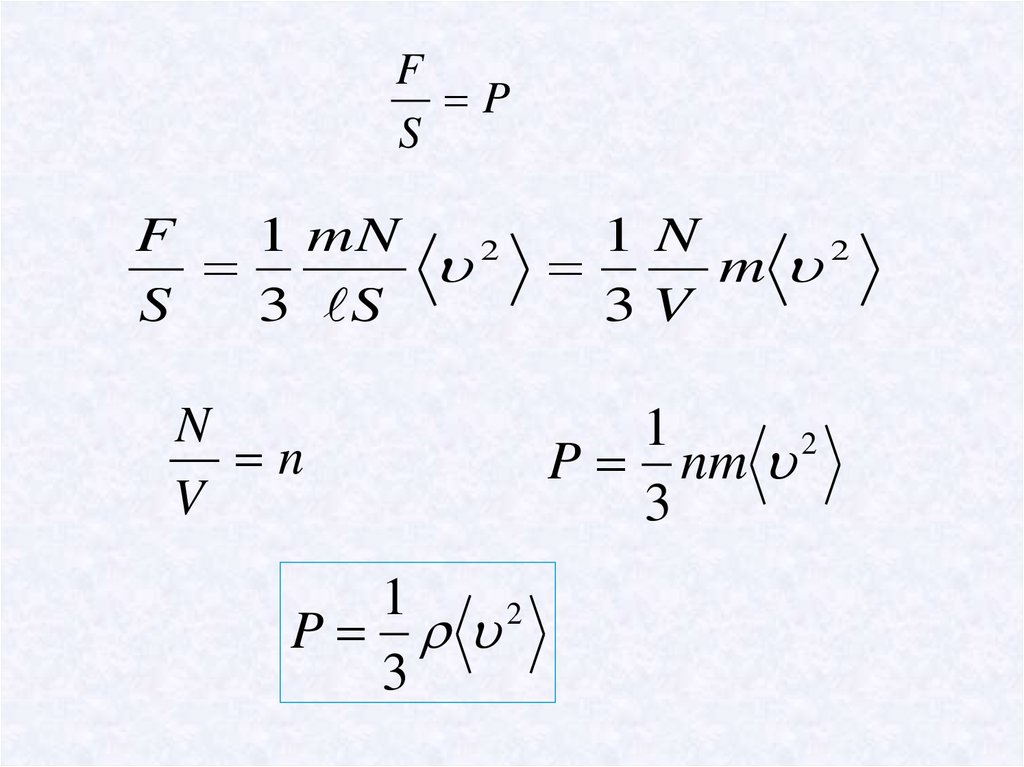
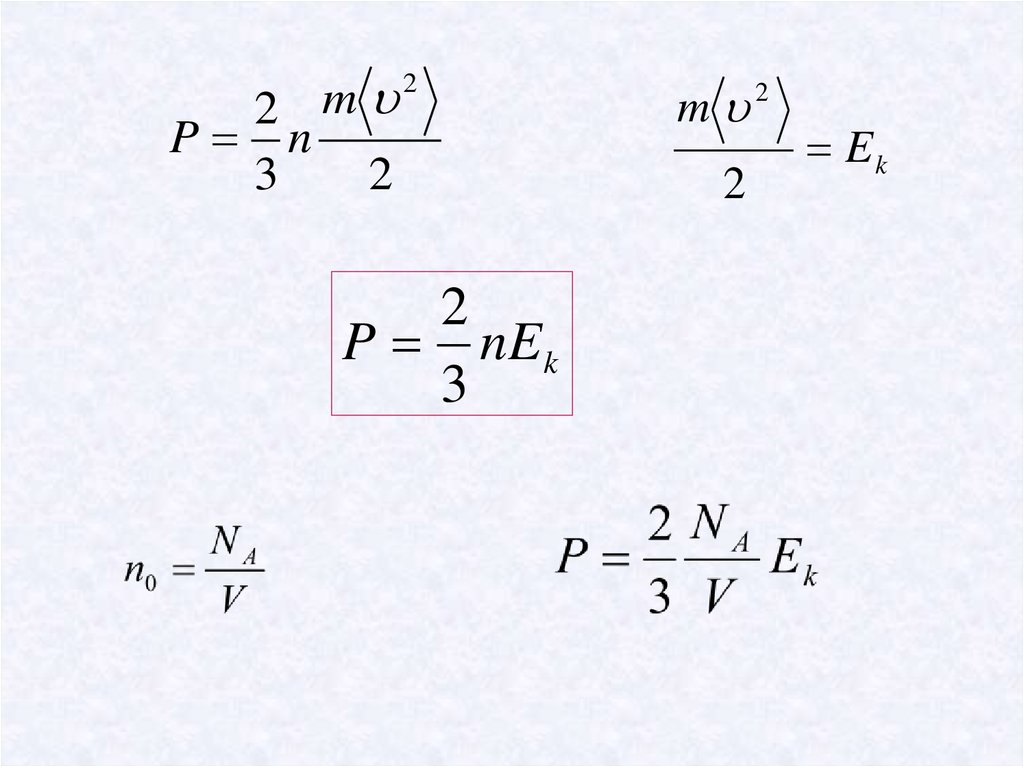


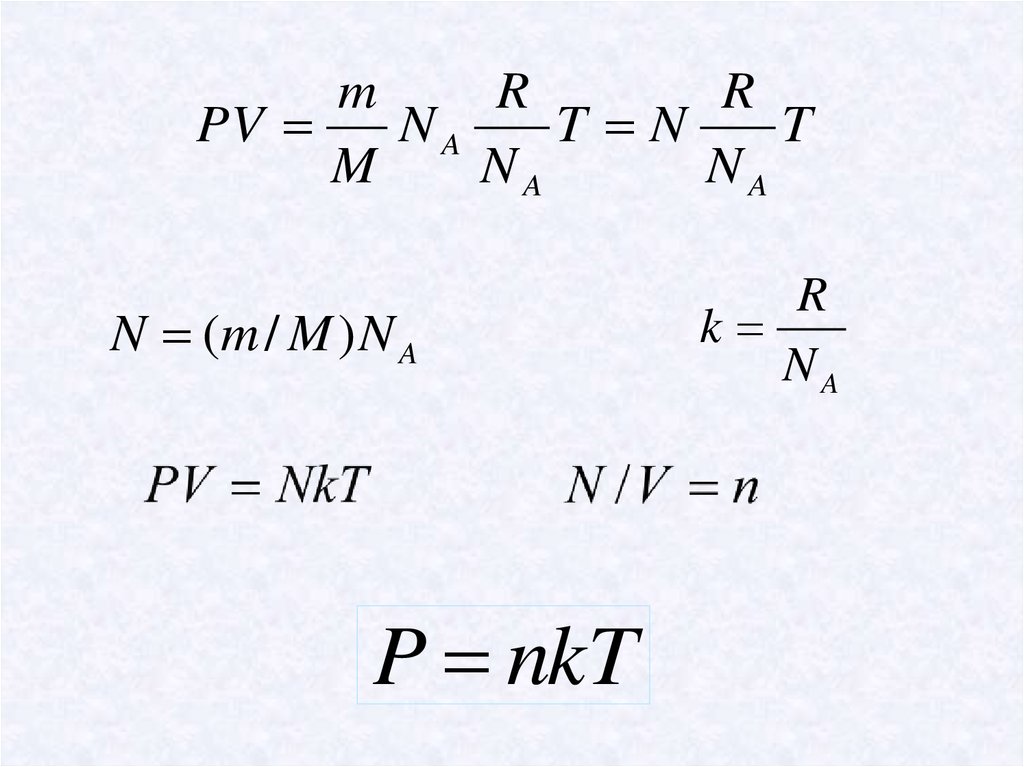








 physics
physics








