Similar presentations:
Ермодинамика негіздері
1.
Азаматтық Авиация АкадемиясыТЕРМОДИНАМИКА
НЕГІЗДЕРІ
Орындаған: АТ-16.6.2 тобының студенттері
Нағызбаев Б. Наурызғалиев Ж.
2.
ИДЕАЛ ГАЗДЫҢ ІШКІЭНЕРГИЯСЫ
Барлық газ молекулаларының толық
энергиясы газдың ішкі энергиясы деп
аталады. Идеал газдың
молекулалары бір-бірімен
әсерлеспегендіктен, олардың
потенциалдық энергиясы болмайды.
im
U
RT
2
3.
Ішкі энергияның өзгерісіІшкі энергия күйдің функциясы болып
табылады
Ішкі энергияның өзгеруінің екі
тәсілі бар:
Жүйенің немесе сыртқы күштердің
ЖҰМЫСЫ;
Қоршаған ортадан жүйеге берілетін,
ЖЫЛУЫ.
Тепловой
резервуар
Жұмыс пен жылу- процесстің күйі емес,функциясы!!
4.
Газдың ұлғаю жұмысыA p V
2
A pdV
1
A 0
A 0
работу производит газ
работа производится внешними силами
5.
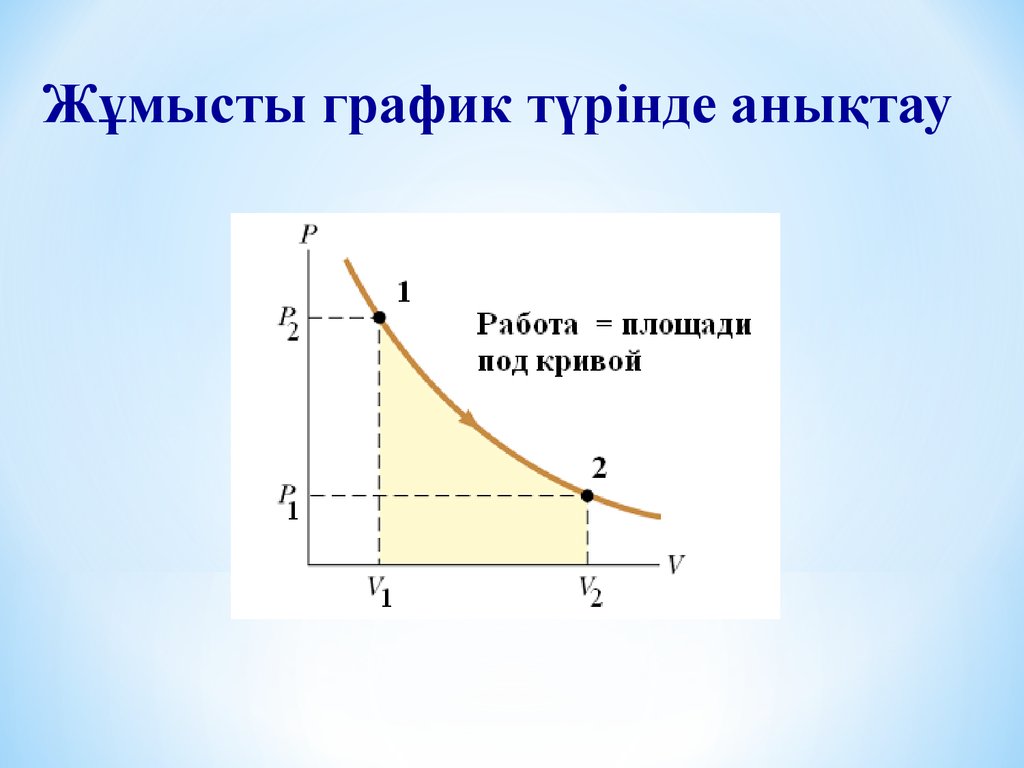
Жұмысты график түрінде анықтау6.
Газдың ұлғаю жұмысыӘртүрлі процестерде 1 күйден 2 күйге өткенде жұмыс
әркезде әртүрлі. Жұмыс процесстің функциясы болып
табылады.
7.
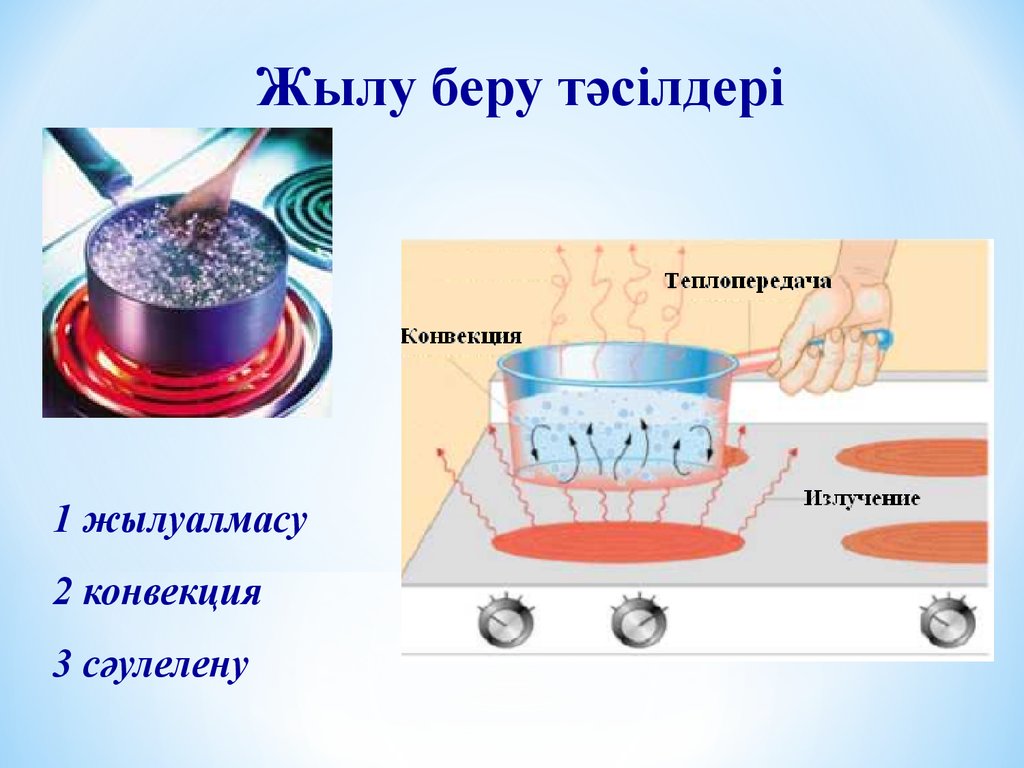
Жылу беру тәсілдері1 жылуалмасу
2 конвекция
3 сәулелену
8.
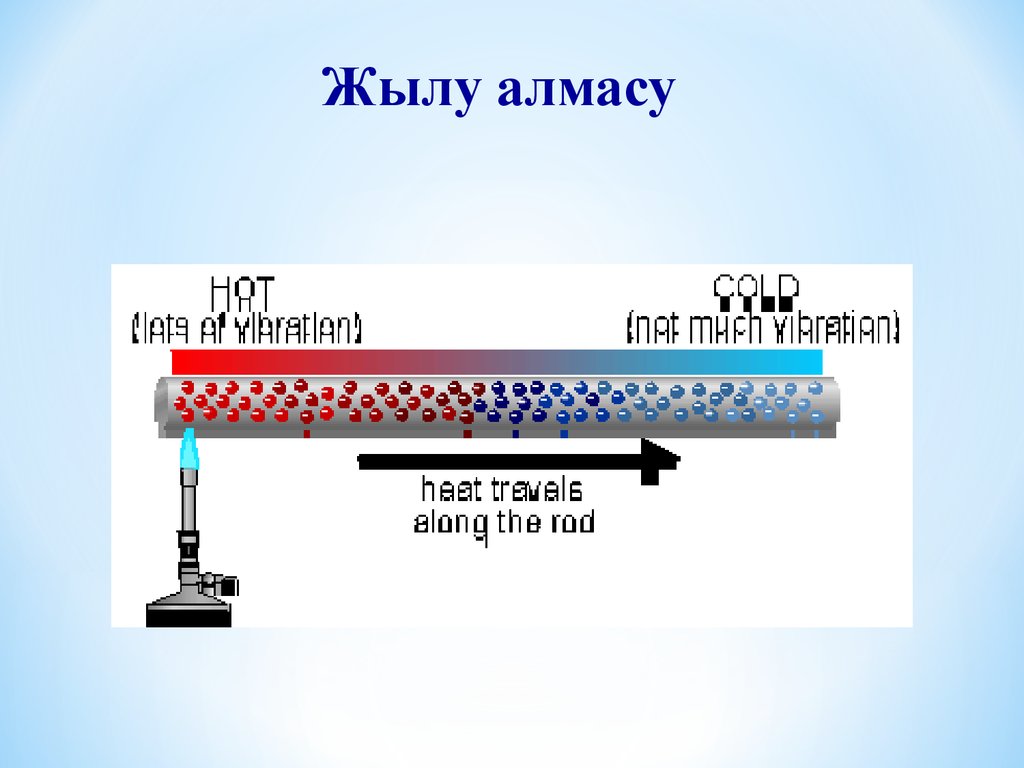
Жылу алмасу9.
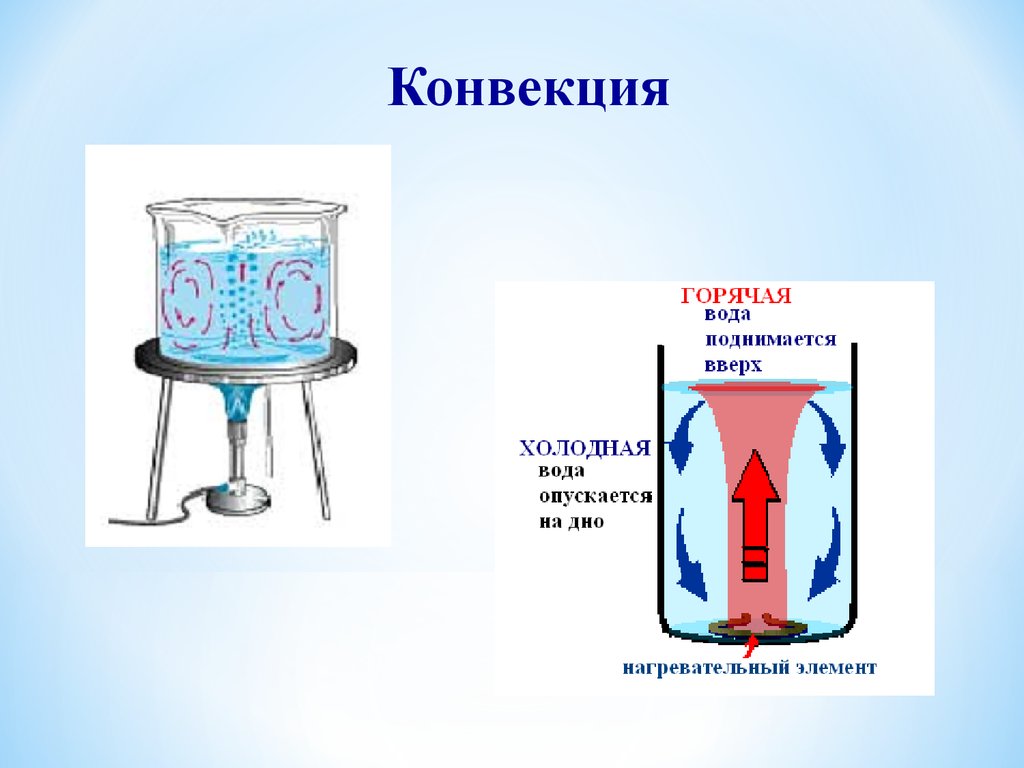
Конвекция10.
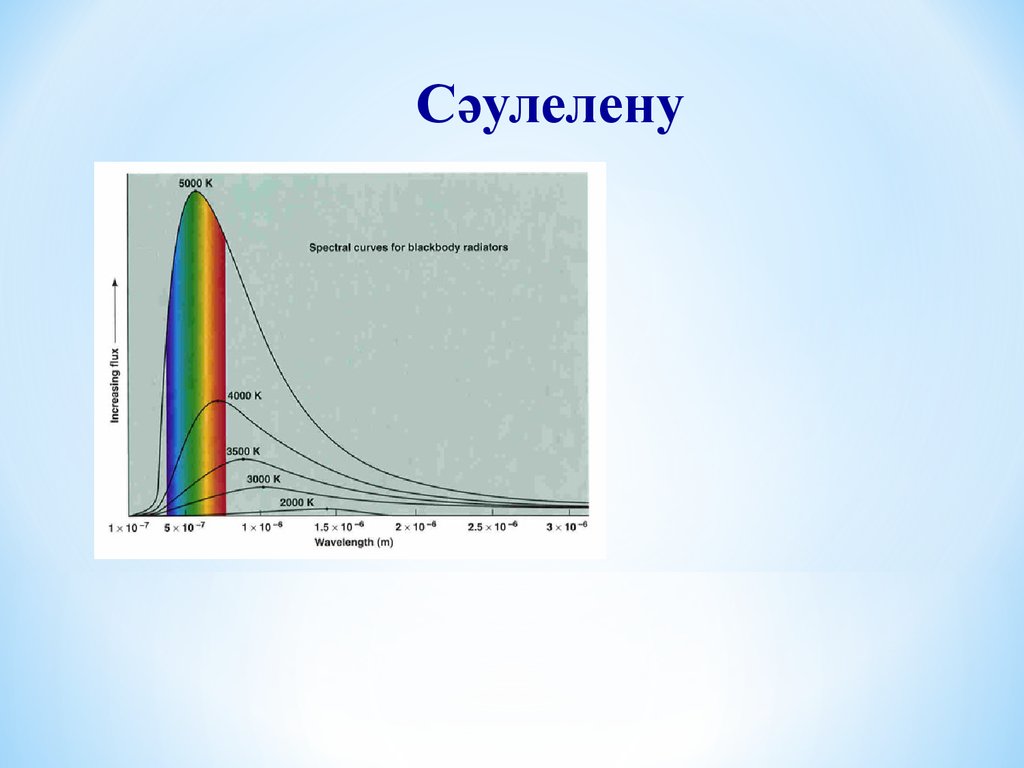
Сәулелену11.
Термодинамиканың біріншібастамасы
Q U A
Q dU A
12.
ЖылусыйымдылықМеншікті жылусыйымдылық
Q
c
mdT
Мольдік жылусыйымдылық
Q
Q
С
dT m dT
13.
Жылусыйымдылық поцесстіңтүріне тәуелді
dU A i 2
СP
R
dT dT
2
dU i
СV
R
dT 2
Тұрақты көлемдегі мольдік
жылусыйымдылық
C P CV R
CP i 2
CV
i
Тұрақты қысымдағы
мольдік жылусыйымдылық
Мольдік жылусыйымдылық
арасындағы байланыс (Майер
теңдеуі)
Пуассон коэффициенті
(адиабата көрсеткіші)
14.
Изобаралық процессm
A p V R T
im
m
U
R T CV T
2
m
Q U A C P T
15.
Изохоралық процессA 0
im
m
U
R T CV T
2
m
Q U CV T
16.
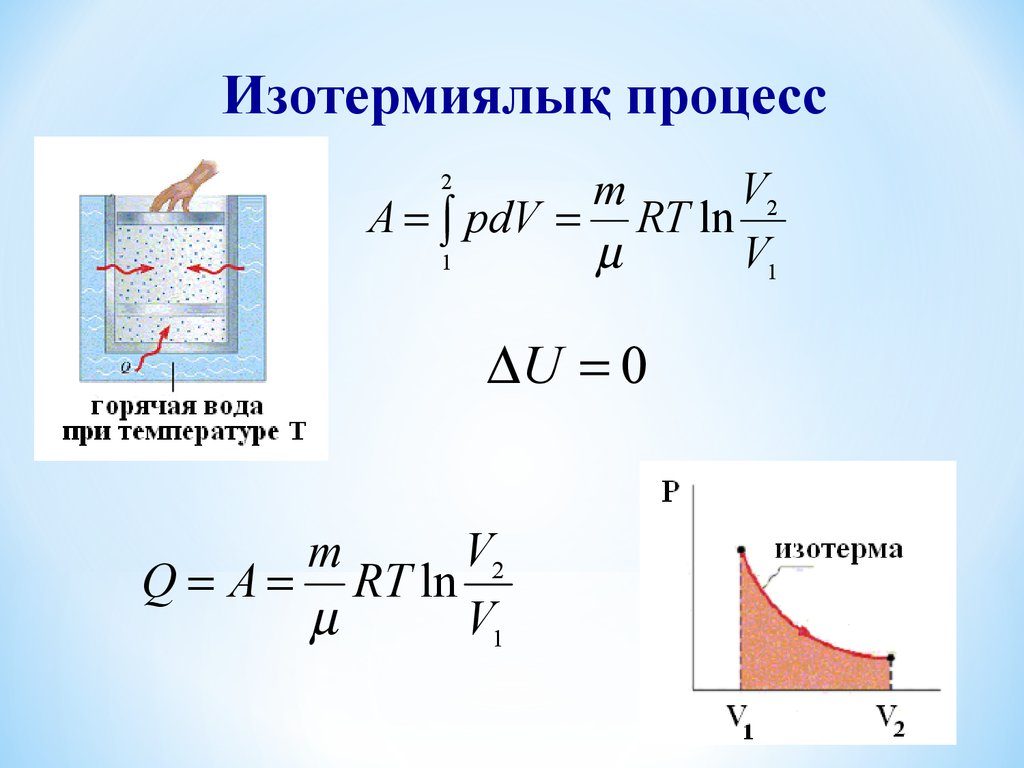
Изотермиялық процессV2
m
A pdV RT ln
V1
1
2
U 0
V2
m
Q A RT ln
V1
17.
Адиабаталық процессАдиабаталық процесс кезінде
газдың берілген массасы үшін
оның дәрежедегі
көлемніңкөбейтіндісі тұрақты,
газдың істеген жұмысы газ
температурасының өзгеруіне
пропорционал болады.
pV const
TV 1 const
T p
1
const
1
V1
p1V1
A
1
1 V2
A U
18.
Карно циклы1-2 изотерма
2-3 адиабата
3-4 изотерма
4-1 адиабата
max
A Q1 Q2
Q1
Q1
T1 T2
T1
19.
ЭнтропияКарно циклы үшін
Q1 Q2
0
T1 T2
немесе
Q
T 0
Энтропия де аталатын мәнді Клаузиус енгізді:
Q
dS
T
20.
ЭнтропияТермодинамикалық ықтималдылық пен
энтропияны Больцман байланыстырды:
S k ln w
Энтропия – жүйедегі жиынтықсыздықтың
деңгейінің өлшемі; үлкен энтропия үлкен хаосқа
сәйкес келеді.
21.
Термодинамиканың екіншібастамасы
Суықтан ыстыққа бағыт жоқ
Мәңгілік двигательдің екінші түрін жасау мүмкін емес,
жылытқыштан алынған жылуды толықтай жұмысқа
айналдыратын процесс болмайды.
ЭнтропТұйықталған жүйенің энергиясы азаймайды
S 0
S 0
Қайтымды
процесс үшін
S 0
Қайтымсыз процесс
үшін
22.
Назар аударғандарыңызғарахмет!
















 physics
physics








