Similar presentations:
Термодинамика негіздері
1.
ТЕРМОДИНАМИКАНЕГІЗДЕРІ
2.
Дәріс жоспары1. Идеал газдың ішкі энергиясы Газдың ұлғаю
жұмысы
2. Термодинамиканың бірінші заңы
3. Жылусыйымдылқ теориясы
4. Карно циклы және оның ПӘК
5. Энтропия. Энтропииның ықтималды
салыстырмалы күйімен байланысы
Термодинамиканың екінші заңы және оның
физикалық мәні
3.
Идеал газдың ішкі энергиясыИдеал газдың ішкі энергиясы
оның молекулаларының
кинетикалық энергиясынан
тұрады
im
U
RT
2
4.
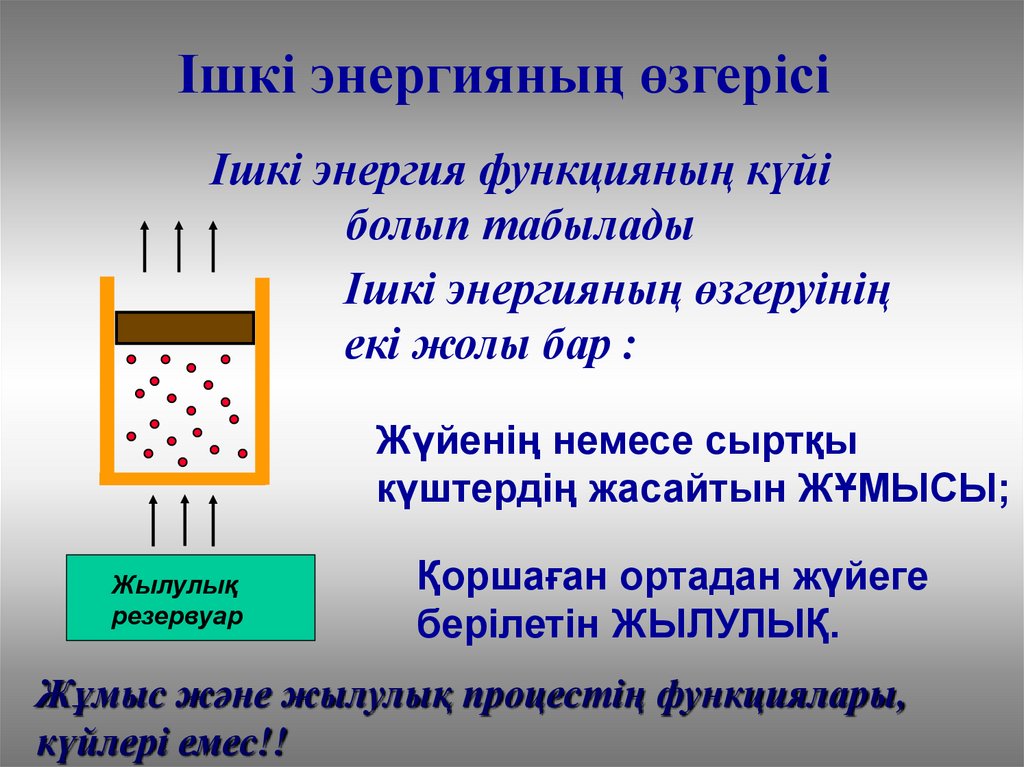
Ішкі энергияның өзгерісіІшкі энергия функцияның күйі
болып табылады
Ішкі энергияның өзгеруінің
екі жолы бар :
Жүйенің немесе сыртқы
күштердің жасайтын ЖҰМЫСЫ;
Жылулық
резервуар
Қоршаған ортадан жүйеге
берілетін ЖЫЛУЛЫҚ.
Жұмыс және жылулық процестің функциялары,
күйлері емес!!
5.
Газ ұлғаюының жұмысыA Fd pS p V
A p V
A 0
A 0
2
A
pdV
Жұмысты газ атқарады
1
Жұмыс сыртқы күштер тарапынан
болады
6.
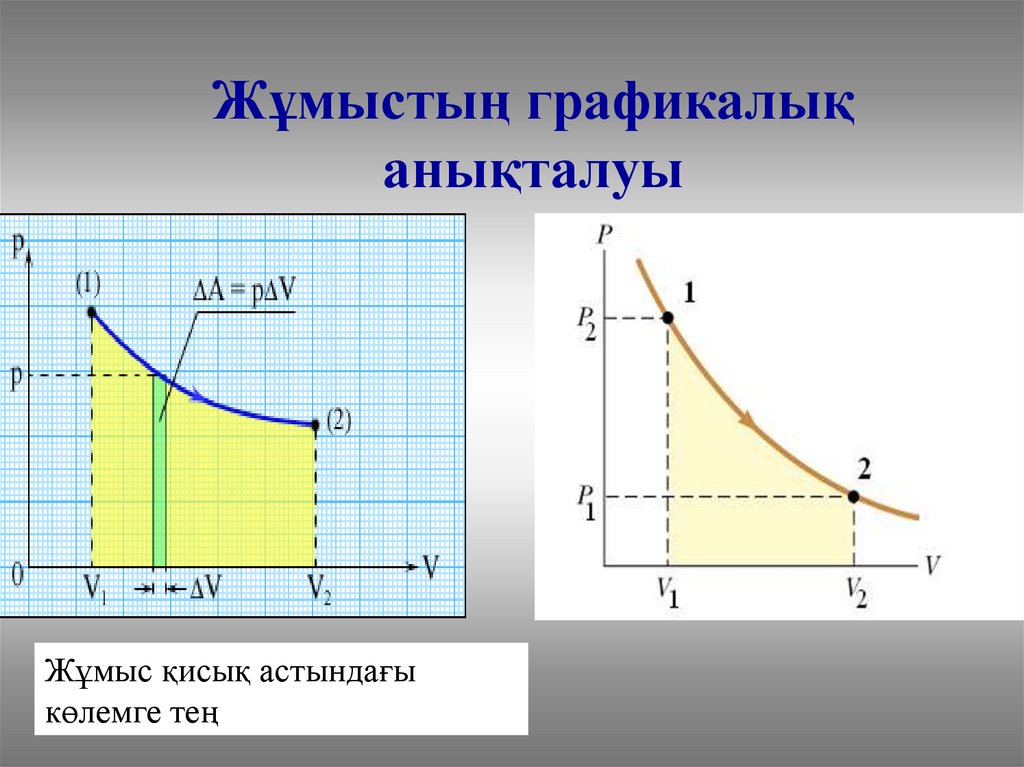
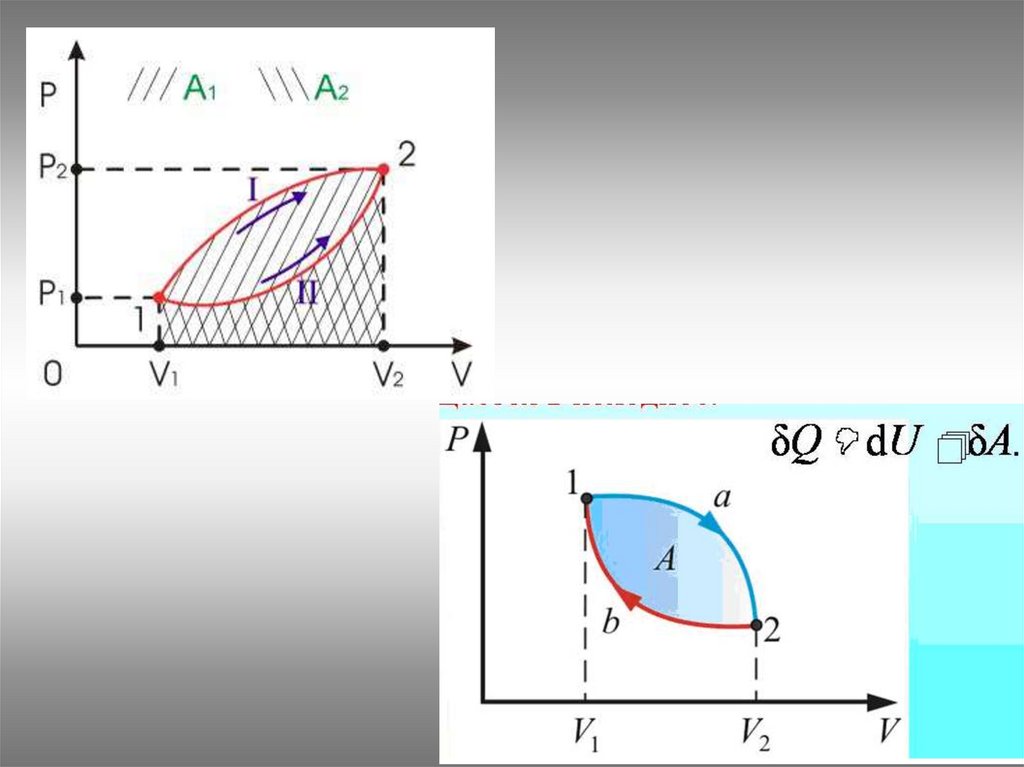
Жұмыстың графикалықанықталуы
Жұмыс қисық астындағы
көлемге тең
7.
Газ жұмысыБір күйден екінші күйге өту әртүрлі процесстер
тарапынан болады және ол кездегі атқарылатын
жұмыс та әр түрлі. Жұмыс функцияның процессі
болып табылады
8.
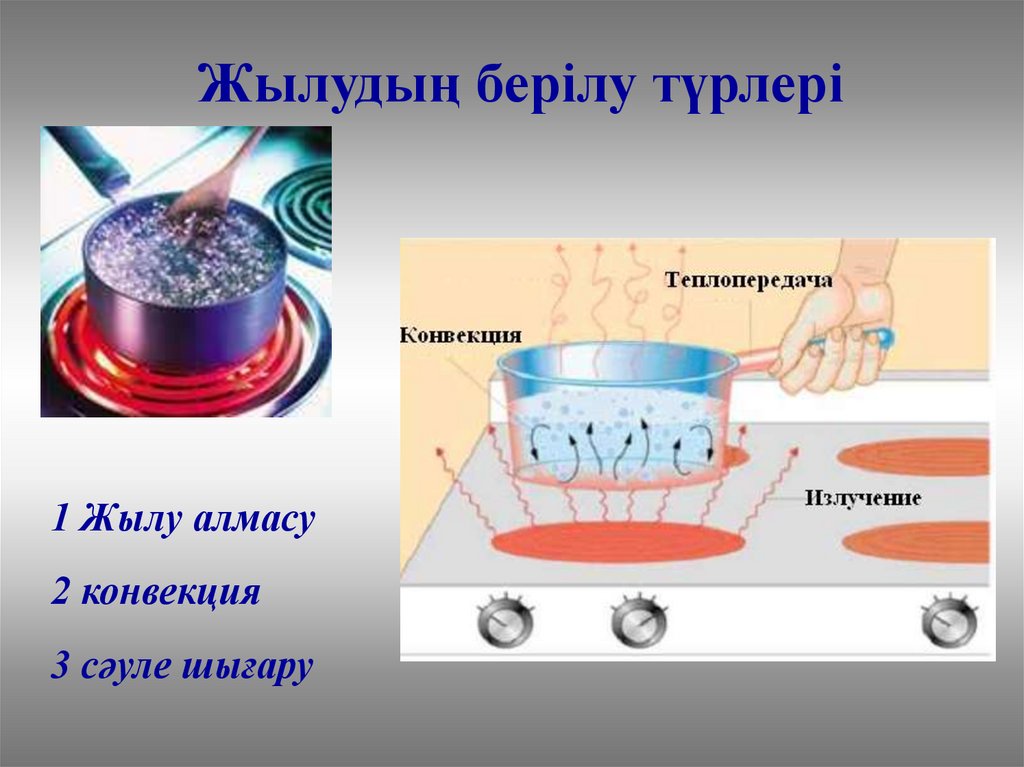
Жылудың берілу түрлері1 Жылу алмасу
2 конвекция
3 сәуле шығару
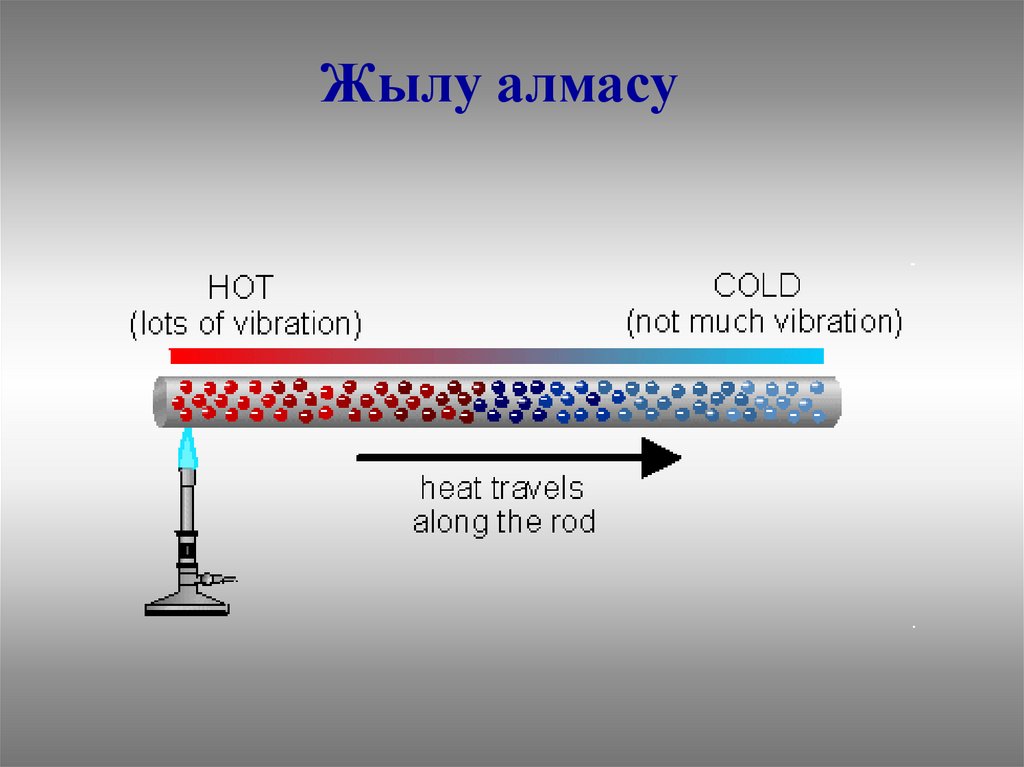
9.
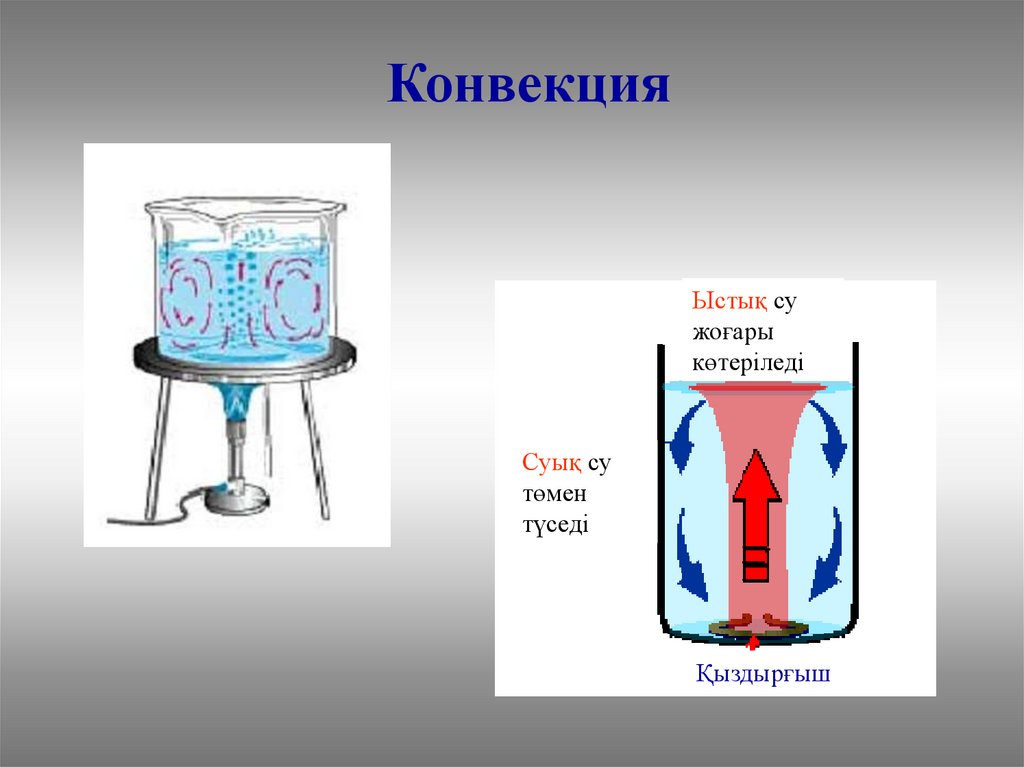
Жылу алмасу10.
КонвекцияЫстық су
жоғары
көтеріледі
Суық су
төмен
түседі
Қыздырғыш
11.
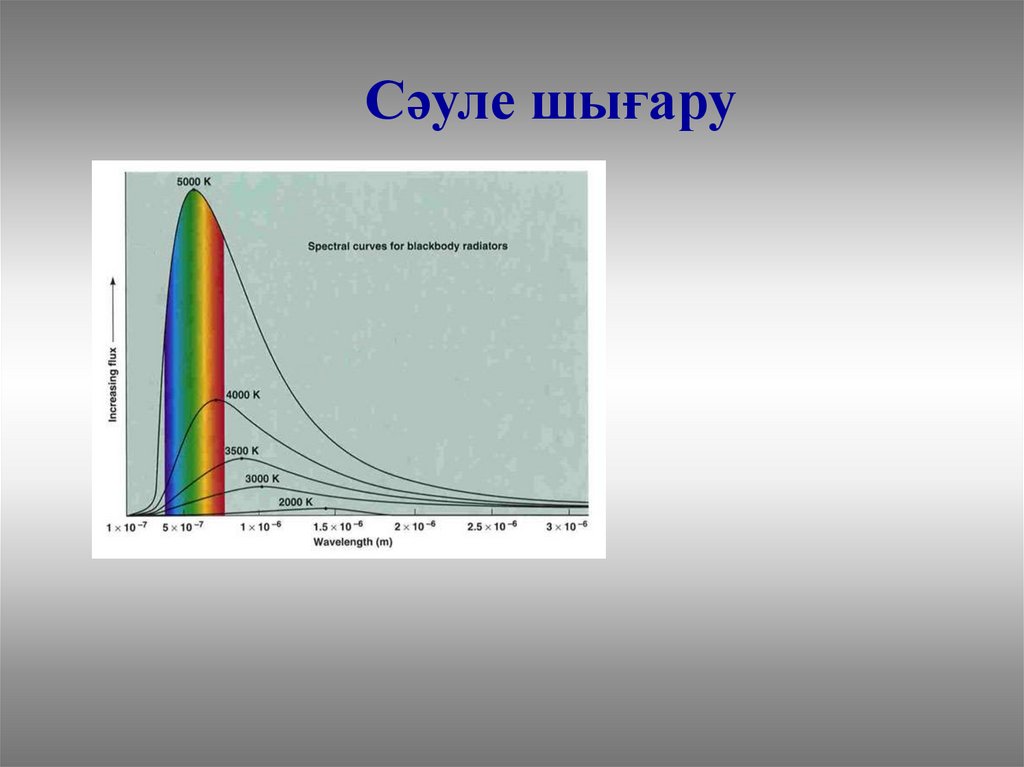
Сәуле шығару12.
13.
Термодинамиканың бірінші заңыQ U A
Q dU A
2
dU U 2 U1
1
2
dA A12
1
2
dQ Q
12
1
14.
ЖылусыйымдылықМеншікті жылусыйымдылық
c
Q
C
Q
dT
Дж
C
К
mdT
Молярлық жылусыйымдылық
Q
Q
С
dT m dT
V const
Cv
P const
CP
15.
V constA P V 0
QV dU
CV dT dU
dU M
CV
dT
dU M CV dT
U M CV T
m
U
CV T
M
16.
P constC p C V
A PdVM
Q dU M PdVM
Q
dU M
dVM
P
dT
dT
dT
PVM RT
dU M
dVM
CP
P
dT
dT
CP CV R
CP CV R
R
1
CV
CV
CV
R
CV
1
17.
Жылусыйымдылық процесстүріне байланысты
dU i
СV
R
dT 2
Тұрақты көлемдегі
молярлық
жылусыйымдылық
C P CV R
CP i 2
CV
i
dU A i 2
СP
R
dT dT
2
Тұрақты қысымдығы
молярлық жылусыйымдылық
Молярлық
жылусыйымдылық
арасындағы байланыс
(Майера теңдеуі)
Пуассона коэффициенті
(адиабата көрсеткіші)
18.
Изобаралық процессA p V
m
R T
im
m
U
R T CV T
2
Q U A
m
C P T
19.
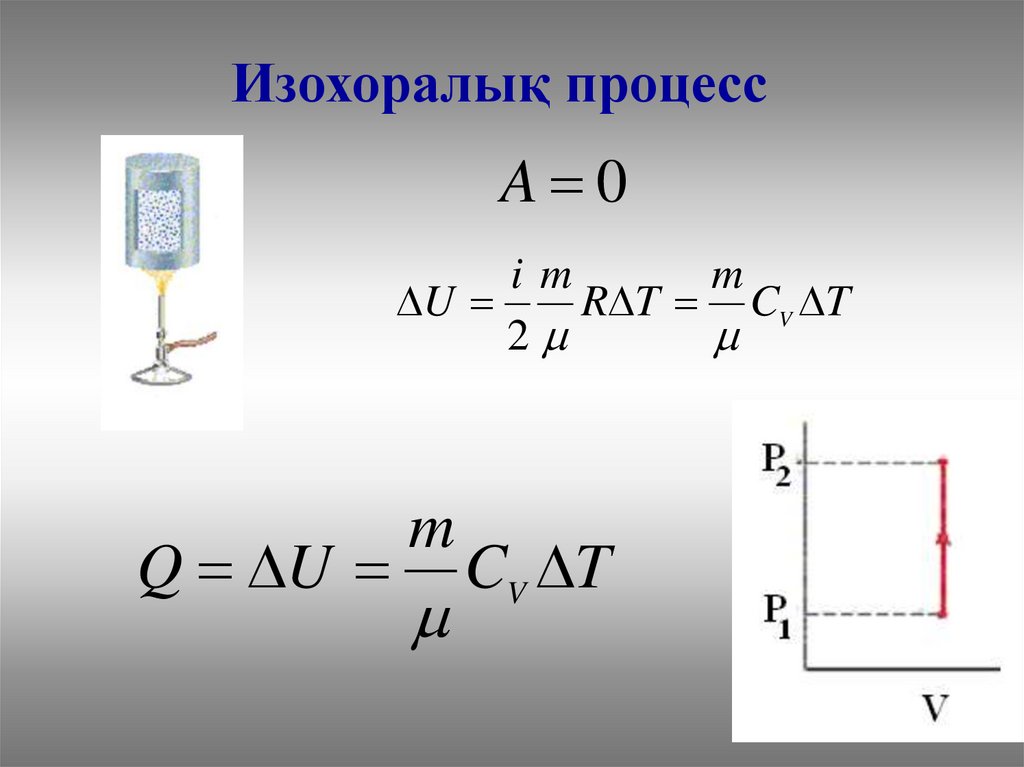
Изохоралық процессA 0
im
m
U
R T CV T
2
Q U
m
CV T
20.
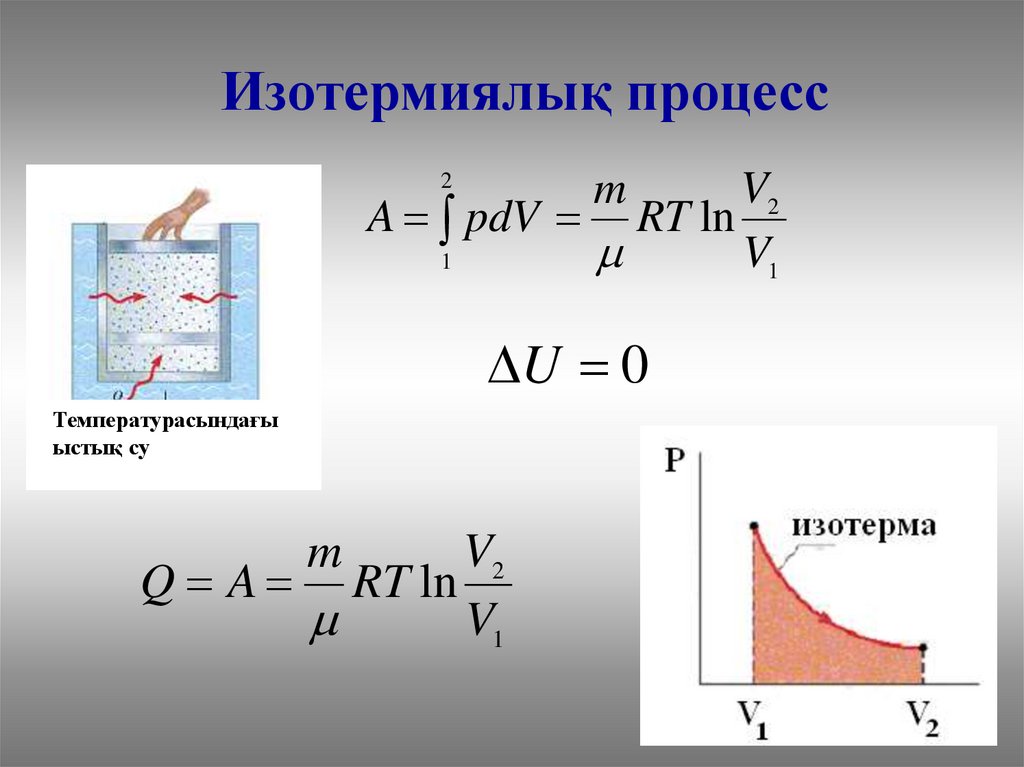
Изотермиялық процессV2
A pdV RT ln
V1
1
m
2
U 0
Температурасындағы
ыстық су
V2
Q A RT ln
V1
m
21.
Адиабаталық процессpV const
Адиабаталық процесс кезінде
қысымның ұлғаюы көлемнің
кішіреуі мен температураның
жоғарылауына тәуелді.
Процесстің теңдеуі:
p1V1 V1
A
1
1 V2
TV
1
T p
1
A U
1
const
const
22.
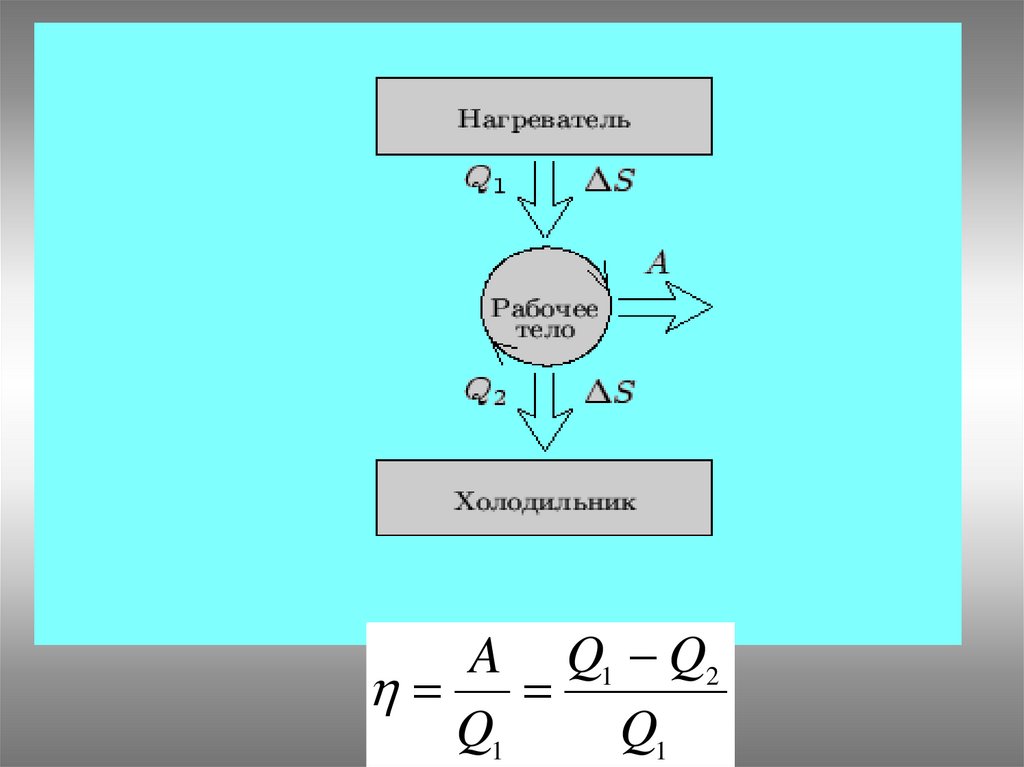
A Q1 Q2Q1
Q1
23.
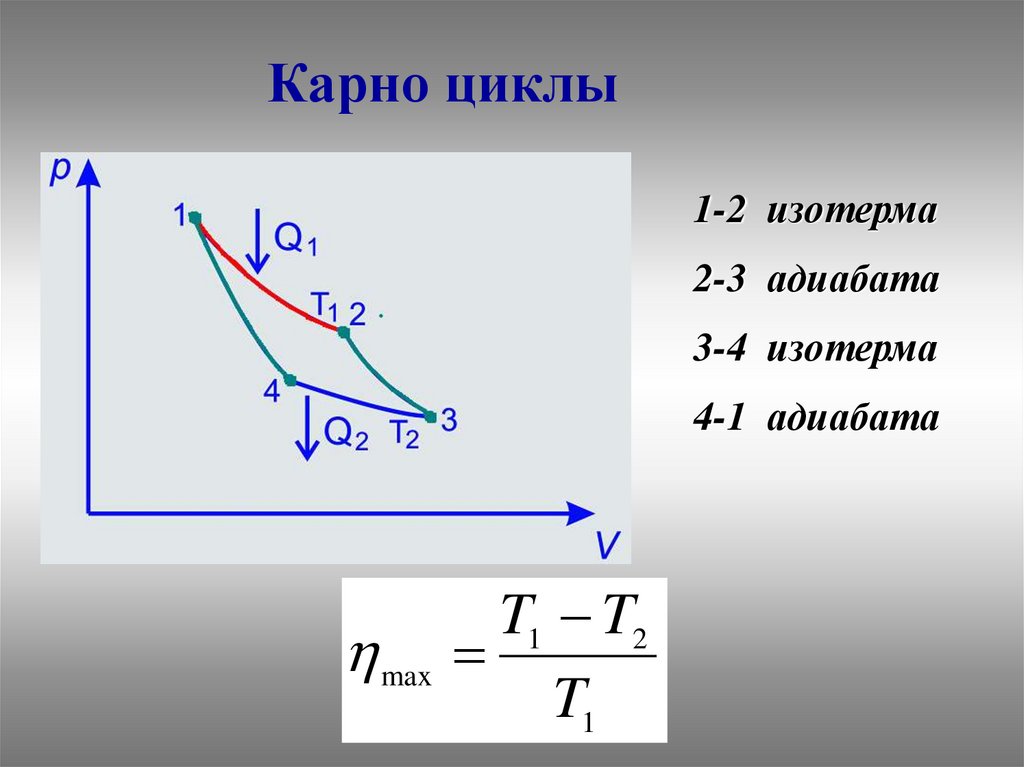
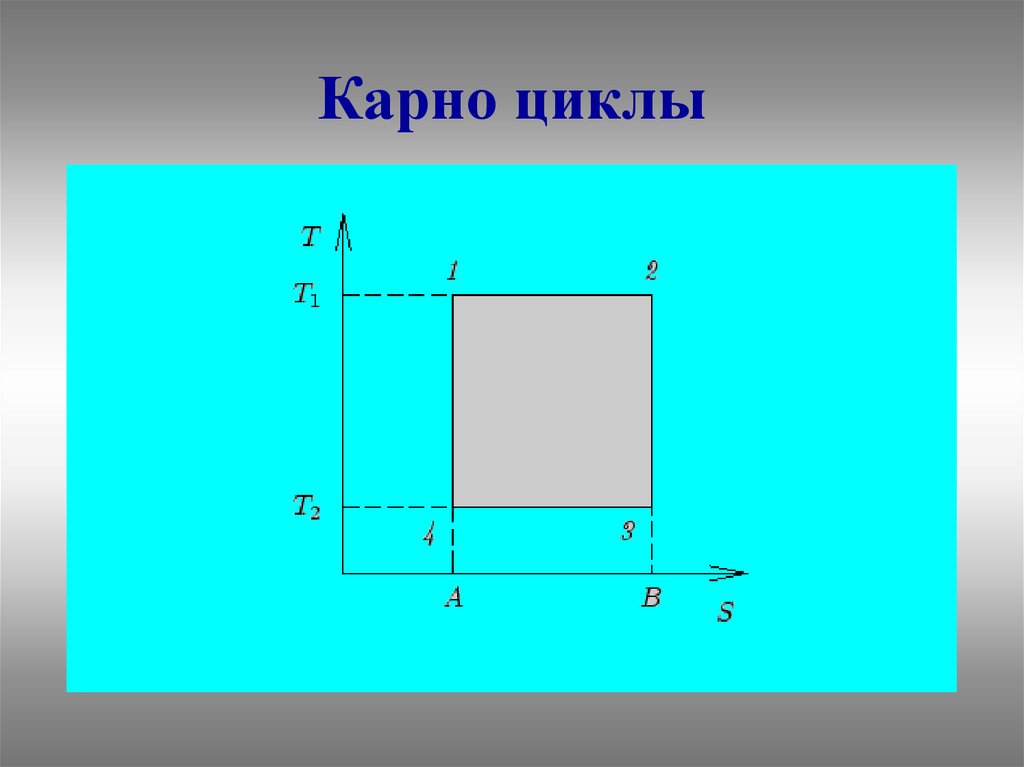
Карно циклы1-2 изотерма
2-3 адиабата
3-4 изотерма
4-1 адиабата
T1 T2
max
T1
24.
ЭнтропияКарно циклы үшін
Q
Q1 Q2
0
T1 T2
немесе
T 0
Клаузиус өлшем енгізді, оны энтропия деп атады:
dS
Q
T
25.
Карно циклы26.
ЭнтропияБольцман энтропияны термодинамикалық
мүмкіндікпен байланыстырды :
S k ln w
Энтропия жүйенің біркелкілік емес шамасы;
үлкен энтропия үлкен хаосқа соқтырады
27.
Термодинамиканың екіншібастамасы
Суық денеден ыстық денеге жылу берілу мүмкін емес
Бір рет қана берілген жылудың көмегімен сыртқы
ортаның қасиетін өзгертпей мәңгі двигатель алу мүмкін
емес
Оқшауланған жүйедегі энтропия ондағы барлық
процесстерде кемікейді
S 0
S 0 Өңделетін
процесстер
үшін
S 0
Өңделмейтін
процесстер үшін







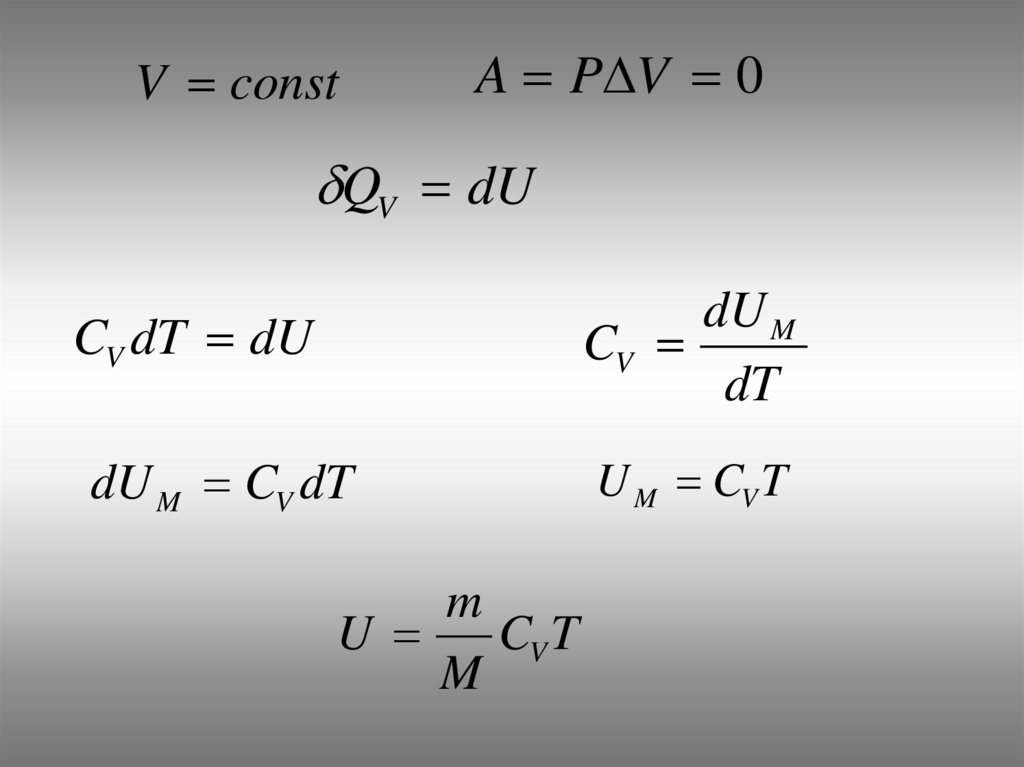








 physics
physics








