Similar presentations:
Специфическое поведение гетерофункциональных соединений как результат взаимного влияния атомов
1.
http://linda6035.ucoz.ru/2.
Теория химического строенияБутлеров Александр Михайлович 1861г
Свойства веществ зависят не только от
их состава, но и от химического
строения, т.е. от порядка соединения
атомов в молекуле и характера их
взаимного влияния.
http://linda6035.ucoz.ru/
3. Электронный эффект
Смещение электронной плотности по системехимических связей, вызванное присутствием
заместителя, отличающегося
электроотрицательностью (ЭО) от атома углерода,
что приводит к изменению реакционной
способности отдельных связей и молекулы в
целом.
http://linda6035.ucoz.ru/
4. Индуктивный эффект ( I )
Передача электронного влияния заместителя по цепи σ-связей.Передаётся по цепи σ-связей с затуханием
(не проявляется через 3-4 хим. Связи)
-I
+I
Заместитель с высокой ЭО
Электронная плотность
смещает электронную плотность смещается в сторону заместителя,
на себя и приобретает частично обладающего большей ЭО (от себя)
отрицательный заряд (σ-)
Атомы углерода приобретают
Проявляют все функциональные частично положительный заряд (σ+)
О
группы:
Проявляют углеводородные
– С ОН
– ОН – СН=СН2
радикалы – R
– NH2
– С ≡ СН
О
– NO2 – С Н
и д.р.
http://linda6035.ucoz.ru/
5.
Графически индуктивный эффект обозначаетсястрелкой по валентному штриху в сторону
более ЭО атома:
+I
+σIII
+σII
+σI
–σ
СН3
СН2
СН2
ОН
+σI
>
+σII
>
+σIII
Связь С – Н практически неполярна,
её индуктивный эффект принят за ноль.
http://linda6035.ucoz.ru/
-I
6.
Примеры проявления индуктивногоэлектронного эффекта ( I )
СН3
– σI
СН3
ОН
– σII
С2Н5
СН3
ОН
– σIII
СН
ОН
– σIV
СН3
С
ОН
СН3
СН3
– σIV
>
– σIII
>
– σII
>
– σI
Положительный индуктивный эффект алкильного радикала
возрастает с увеличением длины и разветвлённости.
http://linda6035.ucoz.ru/
7.
Атомы углерода в sp и sp2 гибридизации проявляют болеевысокую ЭО и проявляют -I, при этом происходит смещение
электронной плотности σ и π-связей.
СН3
http://linda6035.ucoz.ru/
СН
СН2 -I
+I
СН3
8.
Мезомерный эффект (М)Перераспределение электронной плотности в системе
сопряжения под влиянием заместителя, являющегося
участником этой системы сопряжения.
–М
+М
Гетероатом заместителя участвует
в системе сопряжения π – связью
(π,π – сопряжение)
–I
–
σ
Примеры:
–σ
–σ
+σ
http://linda6035.ucoz.ru/
+σ
+σ
СН2 = СН – С
+σ
–σ
–σ
N +σ
О
–М
Гетероатом участвует в системе
сопряжения р - электронами
(р,π – сопряжение)
Примеры:
СН2 = СН
Cl
Н
– I
Пиридин
–М
N
Н
–I
+М
Мезомерный эффект не затухает.
Пиррол
–I
+М
9.
Электронные эффекты некоторых заместителей.Заместитель
Электронные эффекты
Индуктивный
Мезомерный
Алкильные
радикалы – R
+I
– NH2 – NHR – NR2
-I
+М
– OH – OR
-I
+М
Галогены ( F, Cl, Br, I )
C=O
– COOH – COOR
– NO2
–С≡N
– SO3H
-I
-I
-I
-I
-I
-I
+ М (│-I │>│+M│)
–M
–M
–M
–M
–M
http://linda6035.ucoz.ru/
Характер
совместного
действия
Электронодоноры –
повышают
электронную
плотность в системе
связей
(│-I │<│+M│)
Электроноакцепторы
– понижают
электронную
плотность в системе
связей.
10.
Протолитическая теория Бренстеда - ЛоуриПротолиты
Кислоты
Нейтральные молекулы
или ионы, способные
отдавать протон
(доноры протонов)
Основания
Амфолиты
Нейтральные молекулы
или ионы, способные
присоедтнять протон
(акцепторы протонов)
Нейтральные молекулы
или ионы, способные
отдавать или присоединять
протон в зависимости
от условий
Кислота и основание образуют сопряжённую пару:
КИСЛОТА
Н+ + ОСНОВАНИЕ
сопряжённая пара
http://linda6035.ucoz.ru/
11.
Кислотно – основное взаимодействиеНА
кислота
+
В
основание
Ка =
[А – ] [ВН+]
[НА ] [В]
С увеличением Ка
С уменьшением рКа
http://linda6035.ucoz.ru/
А–
+
сопряжённое
основание
ВН+
сопряжённая
кислота
рК = – lg Ка
сила кислоты возрастает
12.
Качественная оценка силы кислоты определяется стабильностьюсопряжённого основания (аниона).
Факторы, обуславливающие стабильность аниона:
I
Природа атома кислотного центра.
1. Электроотрицательность (ЭО)
Повышение ЭО стабилизирует анион и повышает кислотные свойства.
2. Поляризуемость атома кислотного центра
Связана с размером атома.
Увеличение радиуса атома кислотного центра приводит к
делокализации электронов внешнего электронного уровня в большем
объёме, что усиливает кислотные свойства.
II Стабилизация аниона за счёт участия атома кислотного центра в системе
сопряжения увеличивает кислотные свойства.
III Возможность стабилизации аниона в результате делокализации заряда
кислотного центра за счёт наличия ЭА заместителей.
IV Возможность сольватизации аниона в растворе.
http://linda6035.ucoz.ru/
13.
Сравнение кислотных свойств органических соединений.Н
Пропан
рКа
С2Н5 – СН2
H
H
рКа
Этанамин
С2Н5 – N
Этанол
С2Н5 – ОН
рКа
Этантиол
С2Н5 – SH
рКа
С2Н5СН3 + Na
С2Н5NН2 + Na
2С2Н5OН + 2Na
С2Н5OН + NaOH
С2Н5SН + NaOH
2С2Н5SН + HgCl2
http://linda6035.ucoz.ru/
~ 40
~ 30
~ 16
~ 10,5
возрастание
кислотных
свойств
2C2H5ONa + H2↑
ЭТОКСИД НАТРИЯ
C2H5ONa + H2O
практически не идёт
ЭТАНОАТ НАТРИЯ
C2H5SNa + H2O
ЭТАНТИОЛЯТ НАТРИЯ
(C2H5S)2Hg↓ + 2HCl
ЭТАНТИОЛЯТ РТУТИ (II)
14.
СН3 – СН3СН2 = СН2
СН ≡ СН
ЭТАН
ЭТЕН
ЭТИН
Рост кислотных свойств
Рост электроотрицательности атома углерода
СН ≡ СН + 2AgOH
АММИАЧНЫЙ
РАСТВОР
алифатические спирты
R – OH
рКа = 16 ÷ 18
AgC ≡ CAg + 2H2O
АЦЕТИЛИНИД
СЕРЕБРА
ОН
фенолы
RO – + H+
О–
+ Н+
рКа ~ 10
Делокализация отрицательного заряда в систему сопряжения увеличивает
кислотные свойства
ОН
ОNa
+ NaOH
+ H2O
ФЕНОЛЯТ НАТРИЯ
http://linda6035.ucoz.ru/
15.
Карбоновые кислоты проявляют наиболее высокие кислотные свойстваR– С
О
OH
│– I │< │+ М │
R– С
О
O
– ⅟₂
– ⅟₂
+ Н+
Влияние радикала на карбоксильную группу приводит к изменению кислотных
свойств
CH3 → CH → COOH
CH3 → CH2 → COOH
CH3 → COOH
H – COOH
↑
CH3
рКа ~ 5
рКа ~ 4,9
Рост кислотных свойств
CH3 → COOH
рКа = 4,75
http://linda6035.ucoz.ru/
CH2 → COOH
↓
Cl
рКа = 2,86
рКа ~ 4,75
Cl
CH → COOH
Cl
рКа = 1,29
рКа ~ 3,8
Cl
↑
Cl ← CH → COOH
↓
Cl
рКа = 0,65
16.
Влияние заместителей на кислотные свойства феноловOH
OH
O2N
NO2
ЭА
ЭА
NO2
ЭА
OH
ЭА
N
О
OH
ЭД СН
3
+ I
О
OH
ЭД
NН2
│– I │< │+ М │
– I –М
рКа = 0,8
рКа = 7,1
Уменьшение кислотных свойств
http://linda6035.ucoz.ru/
рКа = 10
рКа = 10,1
рКа = 10,5
17.
Основание БренстедаНА
+
кислота
[ВН] + А –
В
основание
ониевая соль
Присоединяют протон с образованием солей.
Сила основания определяется доступностью для протона пары электронов
гетероатома.
Наиболее сильные основания – анионы (углерод не проявляет основных свойств)
R – NH2
R – OH
R – SH
Сила оснований уменьшается
R – NH2 + H2O
[RN+H3] OH–
(C2H5)2NH + HCl
[C2H5NH2]+Cl–
C2H5OH + H2SO4
[C2H5OH2]+HSO4¯
только серная
кислота
http://linda6035.ucoz.ru/
этилоксонийгидросульфат
+ H2O
C2H5OH + H2SO4 + H2O
18.
Ароматические амины слабее алифатических–σ
R → NH2
NH2
–I
УСИЛИВАЕТ ОСНОВНЫЕ
СВОЙСТВА
│– I │< │+ М │
ОСНОВНЫЕ СВОЙСТВА
ОСЛАБЛЯЮТСЯ
В амидах карбоновых кислот более сильным основным центром является
оксогруппа
–σ
R– С
О
NH2
+ H+
R– С
+
ОH
NH2
ПАРА ЭЛЕКТРОНОВ АТОМА АЗОТА ВХОДИТ В р,π – СОПРЯЖЕНИЕ С ОКСОГРУППОЙ
http://linda6035.ucoz.ru/
19.
Влияние заместителей на силу основного центраH3C → N ← CH3
↑
ЭД
CH3 ЭД
ЭД
NH3
F3C ← N → CF3
↓
ЭА
ЭА
CF3
ЭА
Уменьшение основных свойств
NH2
CH3 → O
ЭД
http://linda6035.ucoz.ru/
NH2
NH2
N
O
O
ЭА
20.
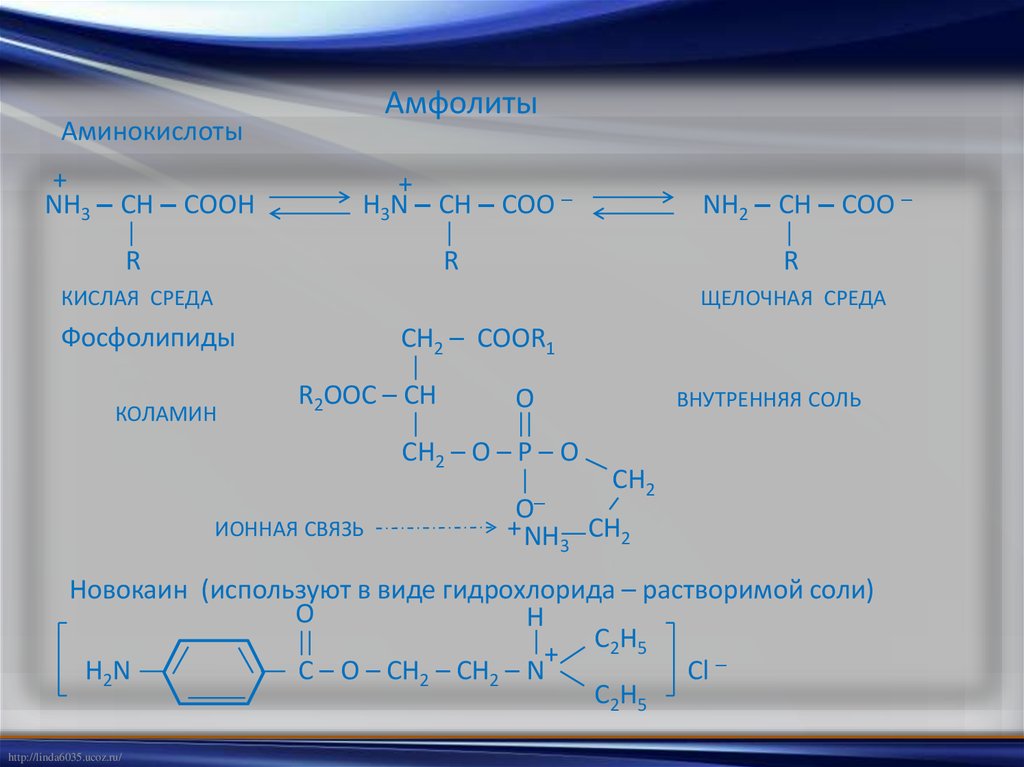
АмфолитыАминокислоты
+
NH3 – CH – COOH
+
H3N – CH – COO –
R
NH2 – CH – COO –
R
R
КИСЛАЯ СРЕДА
ЩЕЛОЧНАЯ СРЕДА
Фосфолипиды
КОЛАМИН
CH2 – COOR1
R2OOC – CH
O
CH2 – O – P – O
ИОННАЯ СВЯЗЬ
ВНУТРЕННЯЯ СОЛЬ
CH2
O–
+ NH CH2
3
Новокаин (используют в виде гидрохлорида – растворимой соли)
O
H
C2H5
+
H2N
C – O – CH2 – CH2 – N
Cl –
C2H5
http://linda6035.ucoz.ru/
21.
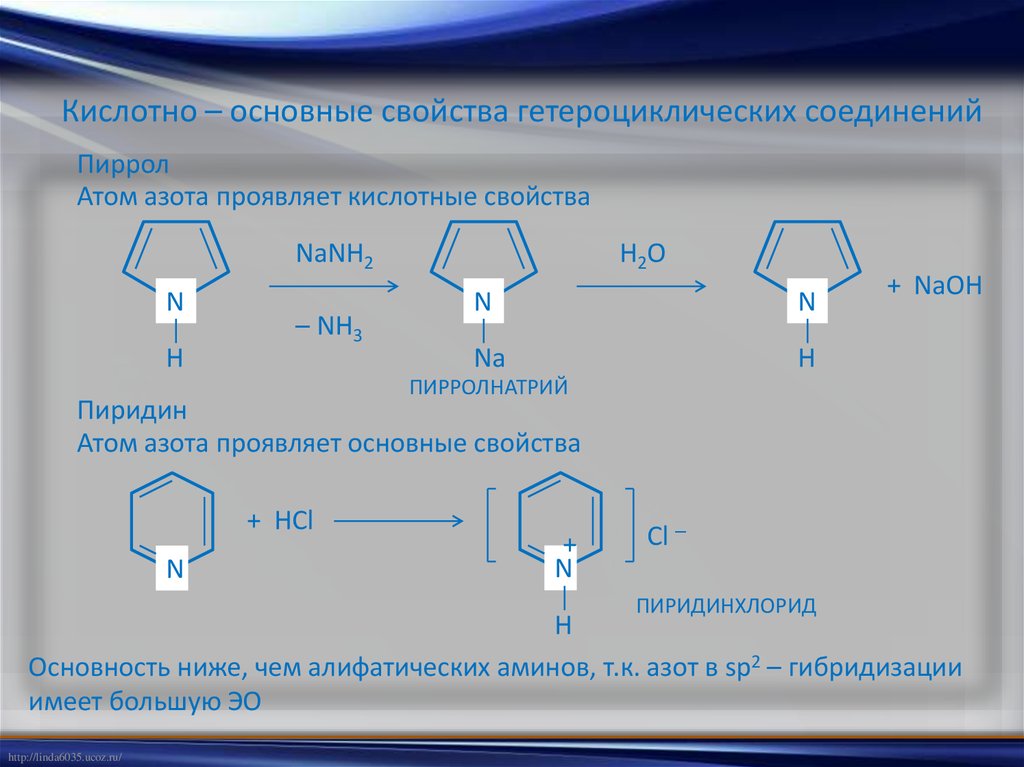
Киcлотно – основные свойства гетероциклических соединенийПиррол
Атом азота проявляет кислотные свойства
NaNH2
N
Н
– NH3
Н2О
N
N
Na
Н
+ NaOH
ПИРРОЛНАТРИЙ
Пиридин
Атом азота проявляет основные свойства
+ HCl
N
+
N
Cl –
ПИРИДИНХЛОРИД
Н
Основность ниже, чем алифатических аминов, т.к. азот в sp2 – гибридизации
имеет большую ЭО
http://linda6035.ucoz.ru/
22.
ИмидазолАмфолит – проявляет кислотные свойства (пиррольный атом азота)
и основные свойства (пиридиновый атом азота)
основный
центр
N
N
Н
http://linda6035.ucoz.ru/
кислотный
центр




















 chemistry
chemistry








