Similar presentations:
Управление качеством на фармацевтическом предприятии. Служба качества фармацевтических компаний
1. Южная Казахстанская Фармацевтическая Академия Министерство Здравохранение Республики Казахстана Технология лекарственных производств
Управление качеством нафармацевтическом предприятии Служба
качества фармацевтических компаний
Выполнил: Килыбаев Е.
Гр. 401 “Б” ТФП
Приняла: Бакытжанова А
2.
Система менеджмента качества предприятия фармацевтического
профиля необходимо считать комплексом процессов (наиболее
часто классифицируемых на основные, управленческие и
обеспечивающие), с грамотно документированным определением их
взаимосвязей и взаимодействия, формулированием показателей
результативности и методов их мониторинга, условий анализа и
политикой постоянного улучшения. Каждый из процессов этой
системы должен управляться с учетом современных принципов
менеджмента качества, а также быть согласованным с
соответствующими требованиями правил GMP и отвечать
действующим нормативным и законодательным требованиям. Один
из главных концептуальных вопросов в этом направлении —
создание рационального алгоритма выполнения всех описанных
выше требований. Исходя из этого, представляется интересным
разработать методологию формирования ИСМ в фармацевтической
индустрии и изучить возможность и рациональность внедрения таких
систем на отечественных предприятиях. Актуальность такой работы
может быть подтверждена серьезной значимостью возникшей
проблемы адаптации производителей лекарственных
средств развивающихся стран к общепринятым в современном мире
законам, нормативам, стандартам, а также желанием сформировать
систему качественного производства и контроля лекарств в
соответствии с требованиями GMP.
3. Общие направления развития стандартов
ПериодПотребности
Стандарт
Масштаб применения
Назначение
1. Индустриализация
(до 1900 г.)
Технические нормы на
готовую продукцию
Национальные
стандарты в
США,
Великобритании
, Германии и
Франции
Национальный
Техника, технология
2. Контроль качества
(середина ХХ
века)
Нормы на испытание
готовой продукции;
контроль
технологического
процесса
MIL 45208, MIL 1549A,
MIL9858A,ОТУ(общие
технические
условия), ЧТУ
(частные
технические
условия) и т.п.
Национальные армии
Сохранность безопасности техники
3. Обеспечение
качества:
1-е поколение
(60-70-е годы ХХ века)
Обеспечение качества
готовой продукции;
нормы ее
сохранности
Американские
национальные
стандарты CFIAPPB,
ANST-SAME,
FM VC
Национальный(в первую
очередь для
передачи энергии
на расстояние)
Обеспечение надежности техники
4. Обеспечение
качества:
2-е поколение(80-е начало 90-х
годов ХХ века)
система признанных
различными
станами норм
Общеевропейские
стандарты ISO
EN(European
norms)
Национальный,
международный
организационное
5. Обеспечение
качества:
3-е поколение (с 90-х
годов ХХ века
и, вероятно, до
30-40-х годов
ХХI века)
превентивные действия по
созданию системы
улучшения качества
ISO
Международный, и
только после
этого
национальный
руководящее
4.
• В настоящее время в развитии фармацевтического производства нашейстраны наступил критический момент, характеризующийся
разнонаправленными тенденциями и, прежде всего, снижением
конкурентоспособности большинства устаревших отечественных
предприятий.
• Понятия «качество» и «безопасность» должны стать девизом
предприятий фармацевтической промышленности. Фармацевтический
рынок мира динамично развивается, что приводит к повышению
конкуренции и требовании к организации управления
фармацевтическими предприятиями. В этих условиях определение
основных направлений повышения конкурентоспособности является
важной стратегической задачей фармацевтического предприятия.
• Проведенный анализ фармацевтических предприятий стран – лидеров
мировой экономики показывает, что достижения стратегической цели в
управлении обеспечивается интегрированных систем использования
европейских методов менеджмента качества, сертификация систем в
соответствии с ISO 9000, GMP, GLP, GCP, GDP, т.д. [1]
5.
• Система менеджмента качества (СМК) – это системавнутрифирменного управления, направленная на достижение
определенных критериев качества выпускаемой продукции, созданная
в организации для формирования политики в области качества и
достижения поставленных задач. СМК позволяет создать на
предприятии порядок, при котором ответственность персонала точно
распределена и документирована. Особенностью современных
подходов к менеджменту качества является то, что требования
предъявляются не к качеству продукции напрямую, а к системе
менеджмента, которая в свою очередь призвана обеспечивать
предсказуемый и стабильный уровень качества продукции, процесса
производства и деятельности организации в целом. СМК
фармацевтического предприятия – это управляющая система,
направляющая и контролирующая деятельность предприятия,
связанную с качеством лекарственных средств. При этом
непосредственными объектами управления являются факторы и условия, влияющие на качество лекарственных средств, а также
процессы формирования качества лекарственных средств на разных
стадиях и этапах производства. [2]
6.
• Система обеспечения качества при производстве лекарственныхсредств должна гарантировать, что:
• Продукция разработана с учетом всех требовании и стандартов;
• На все операции по производству и контролю составлена четкая
документация в соответствии с правилами стандарта;
• Ответственность и полномочия строго определены;
• Выполняются мероприятия по производству, поставке и
использованию надлежащего исходного сырья и упаковочного
материала;
• Проводиться контроль промежуточной продукции и технологического
процесса, а также валидация;
• Контроль и проверка готовой продукции проводиться в соответствии с
требованиями стандарта и законодательства;
• Выполняется процедура проведения самоинспекции и/или аудита
качества, по которой регулярно оценивают эффективность и
пригодность системы обеспечения качества.
7.
Необходимо отметить, что внедрение стандартов ИСО серии 9000 на
предприятии является добровольным решением руководства и направлено,
прежде всего, на повышение конкурентоспособности предприятия. В отличие
от этого, внедрение стандарта GMP в медицинской промышленности РК с 2014
года при производстве готовых лекарственных средств является обязательным.
В то же время становится все более очевидным, что осуществить такой переход
невозможно без разработки и внедрения на предприятиях интегрированных
систем менеджмента качества (ИСМ). Под интегрированной системой
менеджмента понимается система, отвечающая требованиям двух и более
международных стандартов, функционирующая как единое целое.
Для фармацевтических предприятий наиболее характерно создание
интегрированной системы менеджмента, которая соответствует требованиям
стандартов ИСО серии 9000 и правилам GMP. В связи с этим
совершенствования деятельности на фармацевтическом предприятии
необходимо внедрение интегрированных систем менеджмента, отвечающих
требованиям международных стандартов и обобщающих мировой опыт
системного управления. Количество фармацевтических предприятий с
интегрированной системой менеджмента качества увеличивается с каждым
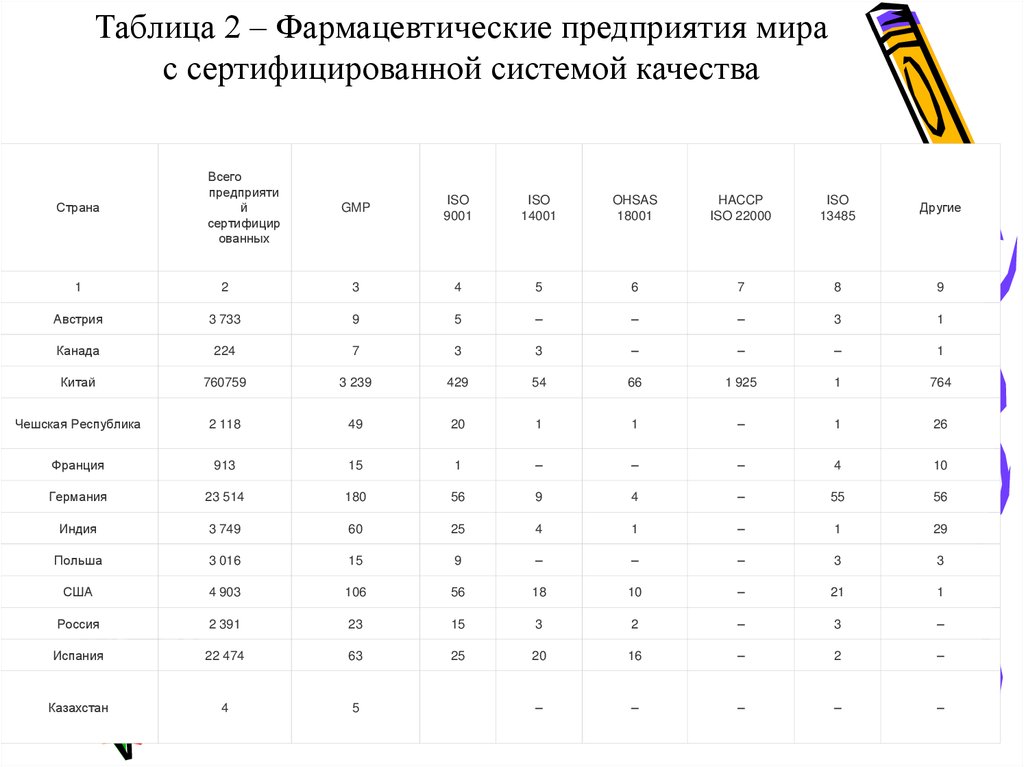
годом.(табл. 2).
8. Таблица 2 – Фармацевтические предприятия мира с сертифицированной системой качества
СтранаВсего
предприяти
й
сертифицир
ованных
GMP
ISO
9001
ISO
14001
OHSAS
18001
HACCP
ISO 22000
ISO
13485
Другие
1
2
3
4
5
6
7
8
9
Австрия
3 733
9
5
–
–
–
3
1
Канада
224
7
3
3
–
–
–
1
Китай
760759
3 239
429
54
66
1 925
1
764
Чешская Республика
2 118
49
20
1
1
–
1
26
Франция
913
15
1
–
–
–
4
10
Германия
23 514
180
56
9
4
–
55
56
Индия
3 749
60
25
4
1
–
1
29
Польша
3 016
15
9
–
–
–
3
3
США
4 903
106
56
18
10
–
21
1
Россия
2 391
23
15
3
2
–
3
–
Испания
22 474
63
25
20
16
–
2
–
Казахстан
4
5
–
–
–
–
–
9.
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
Основными преимуществами внедрения интегрированной системы менеджмента
являются:
Изменение подхода к обеспечению качества и безопасности лекарственных средств, что
снижает потери от возникновения брака и отзыва продукции;
Четкое определение ответственности за обеспечение безопасности лекарственных
средств;
Документальное подтверждение уверенности в безопасности лекарственных средств, что
особо важно при работе с потребителем, в т.ч. при судебных разбирательствах.
Обеспечение системного подхода, включающего все параметры безопасности
лекарственных средств – от сырья до потребителя;
Более экономное использование ресурсов для управления безопасностью;
Снижение финансовых издержек, связанных с выпуском некачественной продукции;
Повышение доверия потребителя к качеству выпускаемых лекарственных средств;
Обеспечение деятельности предприятия в целом и оптимального режима работы систем
контроля и верификации в частности;
Увеличение возможностей выхода на новые рынки сбыта и расширение существующих;
Повышение готовности у зарубежных инвесторов идти на капиталовложение;
обеспечение репутации производителя качественных и безопасных лекарственных
средств.
10.
Систему обеспечения качества фармацевтического предприятия нужно рассматривать,
как интегрированную систему, в основе которой лежат стандарты (базовые и
дополнительные).Базовые стандарты:
Серии ИСО 9000, описывающие организационную структуру управления качеством;
Стандарты GMP, которые содержат требования к производству и контролю качества
лекарственных средств для человека и животных (СТ РК 1617-2006). [5]
Дополнительные стандарты:
Стандарты, устанавливающие требования к системе экологического менеджмента (ISO
14001:2004);
Стандарты, устанавливающие требования к системе менеджмента безопасности
продукции (ИСО 22000-2007, Управление рисками по качеству ICH Q9, ISO 31000:2009);
1. Стандарты ИСО
Стандарты, устанавливающие требования к информационной безопасности (ISO/IEC
27001:2005);
Стандарты, устанавливающие требования в области охраны здоровья и безопасности
труда (OHSAS 18001:2007);
Стандарты, помогающие предприятию разработать и внедрить эффективную систему
управления, направленную на повышение уровня условий труда и жизненного уровня
сотрудников компании (SA 8000; ISO 26000:2010).
11.
• «На сегодня из 42 производителя лекарственных средств 4производственных участков двух производителей - АО «Химфарм» и
АО «Нобел АФФ» имеют заключения о соответствии стандарту GMP».
• 18 производителей также планируют получить сертификаты GMP.
Сейчас они делают для этого все возможное: строят новые здания,
проводят реконструкцию старых зданий, обучают инженер-технологов
и.т.д. Продолжается подготовка национального инспектората с
привлечением международных специалистов. Всего по стране обучено
свыше 200 специалистов государственного органа.
• Проводится работа по вступлению Казахстана в международную
систему сотрудничества фармацевтических инспекций (PIC/S). В марте
2015 Казахстан получил статус заявителя на присоединение к PIC/S.
• PIC/S - международная организация, объединяющая фармацевтические
инспекционные органы для обеспечения активного сотрудничества в
области GMP.











 medicine
medicine management
management








