Similar presentations:
Техническая термодинамика. Основные понятия и исходные положения термодинамики. (Лекция 1)
1.
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКАОСНОВНЫЕ ПОНЯТИЯ
И ИСХОДНЫЕ ПОЛОЖЕНИЯ
ТЕРМОДИНАМИКИ
2. 1. Основные понятия и законы термодинамики 2. Круговые процессы и циклы тепловых машин 3. Теплопередача 4. Элементы строительной теплотехник
Разделы учебной дисциплины«Теплофизика»
1. Основные понятия и законы
термодинамики
2. Круговые процессы и циклы
тепловых машин
3. Теплопередача
4. Элементы строительной
теплотехники
3. 1. Бендерский Б.Я. Техническая термодинамика и теплопередача. Ижевск: НИЦ РХД, 2007. 264 с. 2. Базаров И.П. Термодинамика. М.: Физматлит, 1961. 292 с. 3. Ис
Рекомендуемая литература1. Бендерский Б.Я. Техническая
термодинамика и теплопередача.
Ижевск: НИЦ РХД, 2007. 264 с.
2. Базаров И.П. Термодинамика. М.:
Физматлит, 1961. 292 с.
3. Исаченко В.П., Осипова В.А.,
Сукомел А.С. Теплопередача. М.:
Энергоиздат, 1981. 416 с.
4. Богословский В.Н. Строительная
теплофизика. М.: Высшая школа, 1970.
376 с.
4. Термодинамика – наука о закономерностях взаимного преобразования различных видов энергии. Техническая термодинамика – раздел термодина
Предмет термодинамикиТермодинамика – наука о закономерностях взаимного
преобразования различных видов энергии.
Техническая термодинамика – раздел термодинамики,
изучающий процессы, явления и устройства, в которых
осуществляется всевозможное преобразование теплоты в
работу.
Термодинамика реализует феноменологический метод
изучения физических явлений, т. е. не требует
привлечения модельных представлений о структуре
вещества и рассматривает явление в целом.
5.
Термодинамическая системаТермодинамическая система – материальное тело (или совокупность
тел), способное (способных) обмениваться с другими телами (между
собой) энергией и (или)веществом.
Система, не обменивающаяся энергией с внешними телами является
изолированной.
Изолированная система с течением времени всегда переходит в
состояние термодинамического равновесия и никогда самопроизвольно
выйти из него не может (первый постулат термодинамики)
Термодинамическая система,
обменивающаяся веществом с другими
системами, называется открытой.
Термодинамическая система, которая не
может обмениваться теплотой с другими
системами называется теплоизолированной
или адиабатно-изолированной.
6. Различают гомогенные и гетерогенные системы. Гетерогенная система – макроскопически неоднородная физико-химическая система, которая сос
Термодинамическая системаРазличают гомогенные и гетерогенные системы.
Гетерогенная система – макроскопически неоднородная
физико-химическая система, которая состоит из
различных по своим свойствам частей, разграниченных
поверхностями раздела.
Состояния ТС : равновесное (стационарное),
неравновесное (нестационарное).
В неравновесной системе под действием градиентов
параметров возникают потоки теплоты и вещества,
стремящиеся вернуть ее в равновесное состояние.
7.
Параметры состоянияОсновные параметры: давление P, температура Т,
объем V. Также параметрами являются внутренняя
энергия U, энтальпия Н, энтропия S и др.
Экстенсивные параметры –
характеризуют систему как
целое. Это масса и
пропорциональные ей
величины, например –
объем. Эти величины
имеют аддитивный
характер – общая масса
системы равна сумме масс
ее отдельных частей и т.п.
Интенсивные параметры –
не зависят от массы и могут
принимать вполне
определенные значения в
каждой точке системы.
8. Температура – мера нагретости тела. С т.з. молекулярно-кинетической теории, температура – мера интенсивности теплового движения молекул.
ТемператураТемпература – мера нагретости тела. С т.з. молекулярнокинетической теории, температура – мера интенсивности
теплового движения молекул.
mc 2 3
kT
2
2
где k – постоянная Больцмана 1.380622 10-23 Дж/К
(T 273) K t C t R (t 32) F
5
5
4
9
o
o
o
o
К – по Кельвину, С – по Цельсию, R – по Реомюру, F –
по Фаренгейту
9.
ДавлениеДавление представляет собой средний результат силового
воздействия молекул на стенки оболочки, которой
ограничено рабочее тело, и определяется силой,
действующей по нормали на единицу площади поверхности
тела.
В соответствии с молекулярно кинетической теорией газа
давление определяется как
2
2 mc
p n
3
2
Где n – число молекул в единице объема, m – масса
молекулы, с – средняя скорость движения молекул.
1 Па = 1 Н/м2
1 бар = 105 Па
10.
Удельный объемУдельный объем – объем единицы массы вещества.
Обратная величина – плотность вещества:
v V
M
M V 1 v
М – масса рабочего тела, V – объем
Термодинамические параметры v, p, и Т в равновесном
состоянии связаны зависимостью f (p, v, T) =0
Любой из параметров состояния системы является
функцией других ее параметров:
p 1 (v, T ) v 2 ( p, T ) T 3 ( p, v)
11.
Уравнение состоянияФункциональная зависимость между параметрами простой
термодинамической системы – давлением, объемом,
температурой – называется уравнением состояния:
F ( p , v, T ) 0
где каждая из переменных является функцией двух других
Идеальный газ – система, в которой можно пренебречь
объемом молекул и силами их взаимного притяжения.
pv RT
Из уравнения состояния получим приращение давления:
p
p
p v T
v T
T v
12.
Уравнение состоянияСвязь между коэффициентом объемного расширения α при
постоянном давлении, изотермическим коэффициентов
сжатия β и термическим коэффициентом давления k имеет
вид:
1 p
1 v
1
v
T k
p T v
v T p
v p T
Пользуясь этими соотношениями и уравнением
состояния, получаем зависимость
k T p
Это соотношение справедливо при любом конкретном виде
функциональной связи объема, давления и температуры в
уравнении состояния
13.
Уравнение Ван дер ВаальсаДля одного моля имеет вид:
a
p 2 (v b) RT
v
При p ≥ a/v2 и v >> b это уравнение переходит в
уравнение состояния идеального газа
pv RT
Поправка b учитывает объем, занимаемый молекулами
газа
реального
газа;
так
называемое
«мертвое
пространство», куда не могут проникнуть молекулы
реального газа при движении, т.е. объем зазоров между
молекулами при их плотной упаковки.
Таким образом:
b v мол v заз
14.
Уравнение Ван дер ВаальсаПоправка к давлению a/v2 учитывает силы взаимодействия
между молекулами реальных газов. Она представляет
внутреннее давление, которое определяется из следующих
соображений: два соседних элемента газа будут
взаимодействовать с силой пропорциональной произведению
количеств веществ, заключенных в элементарных объемах.
Следовательно, внутреннее давление р2 определяется как:
p2 ~ n 2 ~ 2 ~
1
v2
где ρ – плотность газа.
Таким образом, полное давление складывается из внешнего и
внутреннего давлений:
a
p p2 p 2
v
15.
v (b RT / p)v (a / p)v ab / p 03
2
На участке ВСА изотермы
Т1 давление растет с
увеличением объема
(dP/dV) > 0.
Данное состояние
неустойчиво, поскольку
здесь должны усиливаться
малейшие флуктуации
плотности.
Поэтому область ВСА не
может устойчиво
существовать.
К – критическая точка с критическими параметрами рабочего
тела pk, Tk и vk, причем (v-vk)3=0. Отсюда:
3vk b RTk / p k
b vk / 3
2
3v k a / p k
2
a 3v k p k
3
v k ab / p k
R 8 p k v k / 3Tk
16.
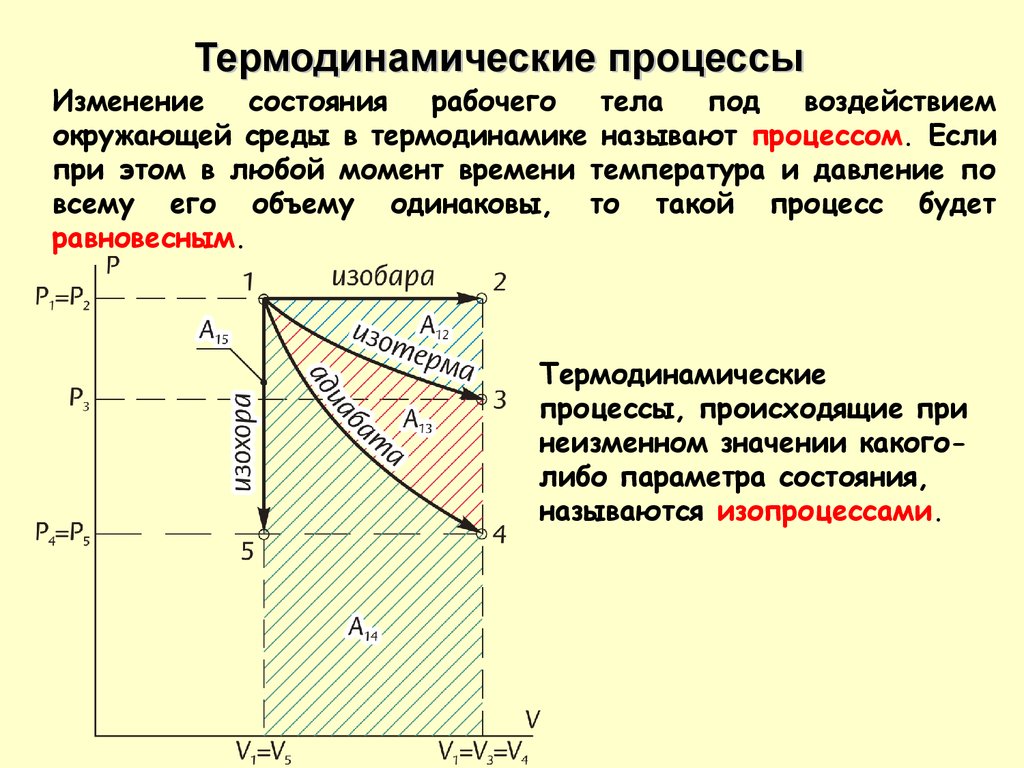
Термодинамические процессыИзменение
состояния
рабочего
тела
под
воздействием
окружающей среды в термодинамике называют процессом. Если
при этом в любой момент времени температура и давление по
всему его объему одинаковы, то такой процесс будет
равновесным.
Термодинамические
процессы, происходящие при
неизменном значении какоголибо параметра состояния,
называются изопроцессами.
17.
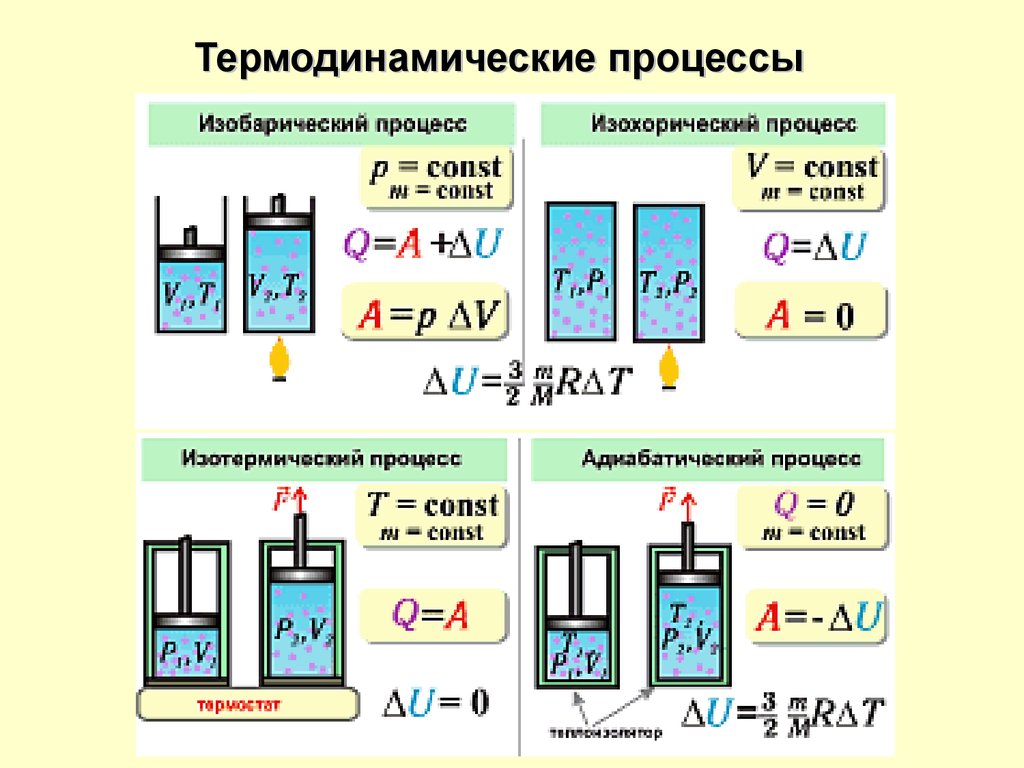
Термодинамические процессы18.
Термодинамические процессыОсновным
свойством
равновесного
термодинамического
процесса является обратимость.
Обратимым называется процесс,
при котором имеется
возможность возвращения
системы из любого
промежуточного или конечного
состояния в исходное таким
образом, чтобы во внешней среде
не осталось никаких изменений.
При обратимом процессе работа,
совершаемая системой при
переходе из начального
состояния в конечное –
максимальна, а работа,
затрачиваемая на обратный
перевод – минимальна.
Все реальные процессы протекают с конечной скоростью и не являются
равновесными или обратимыми.
19.
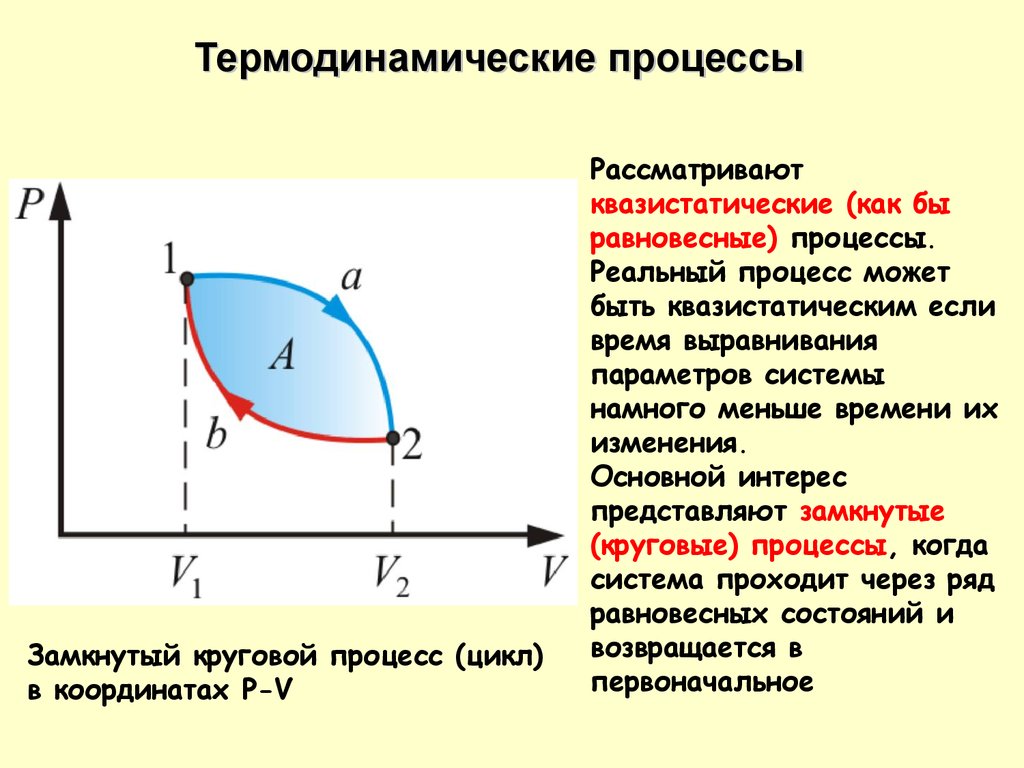
Термодинамические процессыЗамкнутый круговой процесс (цикл)
в координатах P-V
Рассматривают
квазистатические (как бы
равновесные) процессы.
Реальный процесс может
быть квазистатическим если
время выравнивания
параметров системы
намного меньше времени их
изменения.
Основной интерес
представляют замкнутые
(круговые) процессы, когда
система проходит через ряд
равновесных состояний и
возвращается в
первоначальное
20.
Идеальные газы и их смесиУравнение состояния идеального газа Клапейрона
Pv RT
R – удельная газовая постоянная, Дж/(кг*К)
Для произвольной массы М:
PV MRT
Уравнение Менделееева – Клапейрона для 1 кмоль:
PV R T
Rμ – универсальная газовая постоянная, Дж/(кмоль*К)
0.01013 106 22.4
R
8314
T
273
PV
При нормальных условиях: Р0 = 0,1013 МПа, t0 = 0 oC,
Vμ = 22.4 м3/(кмоль*К)
21.
Идеальные газы и их смесиДля любого газа:
R
8314
R
Молекулярная масса некоторых газов
Газ
N
Ar
H2
O2
CO
CO2
Аммиак
воздух
μ
28
40
2
32
28
44
17
29
Для газовой смеси массой М уравнение состояния имеет вид:
8314MT
pV MRСМ T
СМ
RСМ – газовая постоянная смеси
μСМ – молекулярная масса смеси
22.
Идеальные газы и их смесиГазовая смесь может быть задана массовыми
объемными ri или мольными ni долями.
mi
gi
M
i = 1.. n
n
M mi
1
Аналогично для объема:
n
V
i
долями
n
g
1
i
1
n
VСМ
r
i
1
1
1
Газовая постоянная:
n
RСМ g i Ri
1
RСМ
1
n
r R
i
1
i
1
gi,
23.
Идеальные газы и их смесиПри известной газовой постоянной RСМ:
CМ
n
8314
8314
n
8314 ri Ri 1
RСМ
1
g
R
i i
1
Давление газовой смеси равно сумме парциальных давлений
компонентов, входящих в состав смеси:
n
p pi
1
Парциальное давление – давление, которое имеет
занимающий весь объем смеси при той же температуре.
pi pri
газ,
pg i СМ
pi
i
mi
iVi
RСМ
i
gi
ri
ri
mСМ СМ VСМ
Ri
СМ
Связь между массовыми и
объемными долями




















 physics
physics








