Similar presentations:
УК
1.
Угольная кислота.Карбонаты.
Жёсткость воды
2.
Угольная кислотаУгольная кислота образуется
при растворении оксида
углерода (IV) в воде.
Эта кислота нестойкая и почти
сразу распадается на исходные
вещества.
СО2 + Н2О
Н2СО3
3.
Получение угольной кислоты и исследование еёсвойств
СО2 + Н2О
Н2СО3
4.
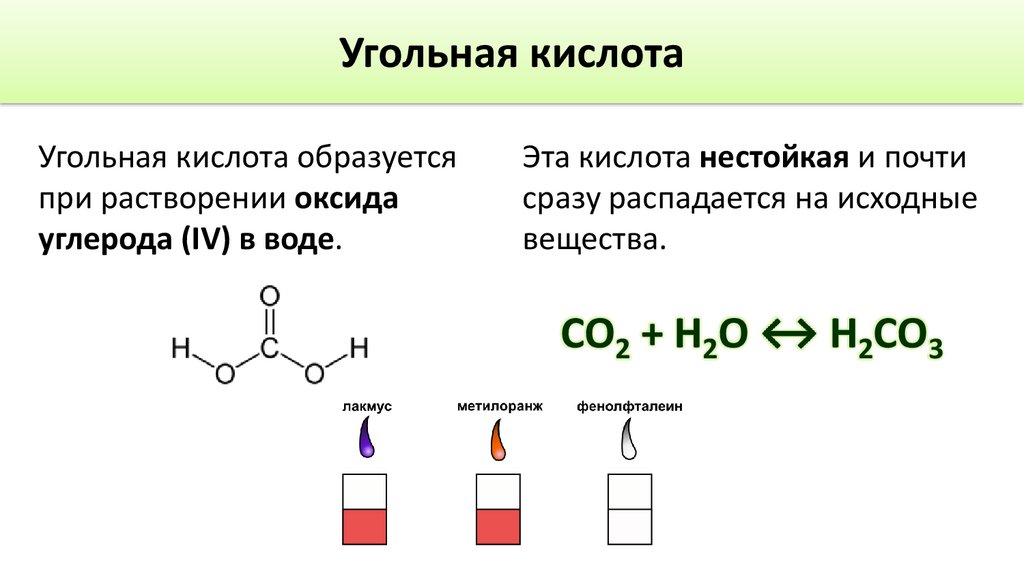
Свойства угольной кислотыДиссоциация
Н2CO3
H+ + HCO3-
HCO3-
H+ + CO32-
Соли
Средние
СаСО3 – карбонат кальция
Кислые
Са(НСО3)2 – гидрокарбонат кальция
5.
Соли угольной кислоты➢ В воде растворимы только карбонаты калия, натрия и
аммония.
➢ Карбонаты других металлов нерастворимы в воде.
➢ При нагревании эти карбонаты разлагаются на оксид металла
и углекислый газ.
t
MgCO3 = MgO + CO2↑
➢ Кислые соли растворимы
t
CaCO3 = CaO + CO2↑
в воде.
t
(NH4)2CO3 = 2NH3↑ + CO2↑ + H2O
6.
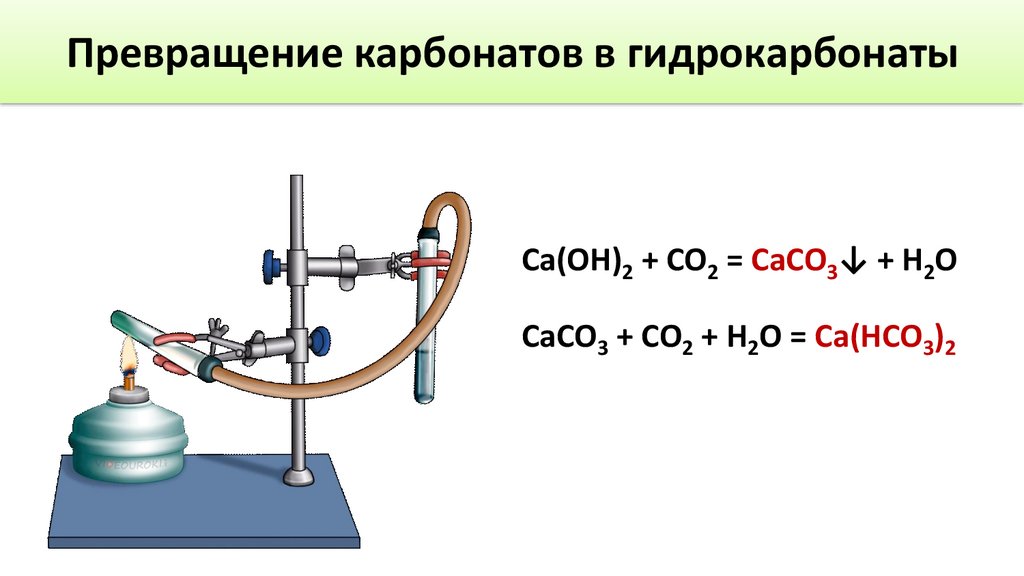
Превращение карбонатов в гидрокарбонатыCa(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
7.
Жёсткость водыЖёсткость воды
Временная
Ca2+ HCO3Mg2+
Постоянная
t
Ca(HCO2)2 = CaCO3↓ + H2O + CO2↑
8.
Образование накипи на стенках котлов,чайников, труб парового отопления.
9.
Сталактиты и сталагмиты10.
Жёсткость водыЖёсткость воды
Временная
Постоянная
Mg2+
Ca2+
SO42-
Cl-
Na2CO3
сода
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
11.
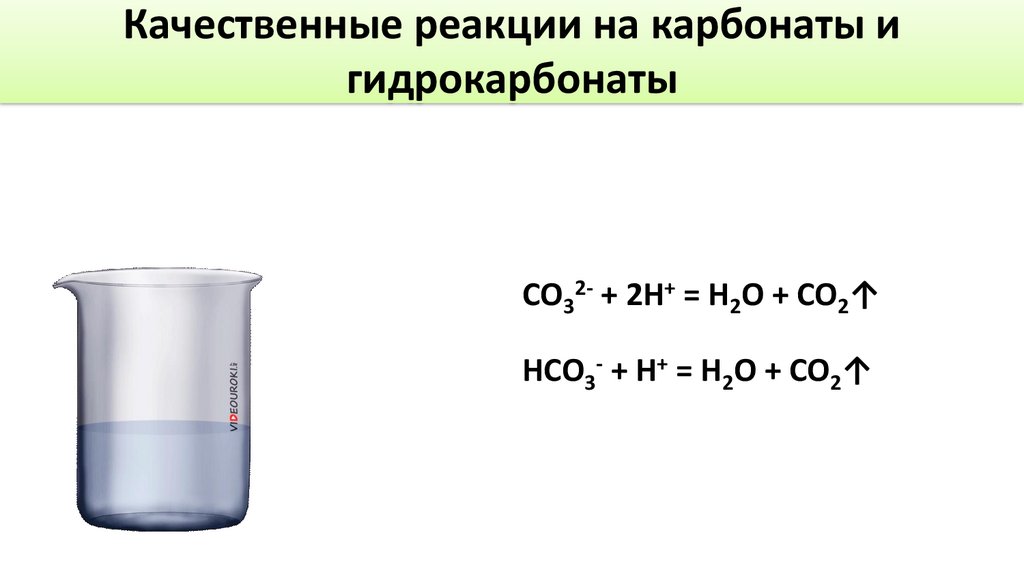
Качественные реакции на карбонаты игидрокарбонаты
CO32- + 2H+ = H2O + CO2↑
HCO3- + H+ = H2O + CO2↑
12.
Применение солей угольной кислотыNa2CO3 · 10H2O
кристаллическая сода
Na2CO3
кальцинированная сода
13.
Применение солей угольной кислотыNaHCO3
питьевая сода
K2CO3
поташ
14.
Применение солей угольной кислотыСаСО3
известняк,
или мрамор
15.
Выводы➢ Угольная кислота – это двухосновная слабая неустойчивая кислота.
➢ Угольная кислота образуется при растворении в воде углекислого газа.
➢ Она диссоциирует по двум ступеням.
➢ Угольная кислота образует два типа солей – карбонаты и гидрокарбонаты.
➢ Карбонаты многих металлов нерастворимы в воде и при нагревании
разлагаются, а гидрокарбонаты – это растворимые соли.
16.
Выводы➢ Карбонаты можно перевести в гидрокарбонаты и наоборот: для перевода
карбоната в гидрокарбонат через карбонат пропускают углекислый газ в
воде, а при нагревании гидрокарбонатов образуются карбонаты.
➢ Различают временную и постоянную жёсткость.
➢ Временная жёсткость обусловлена наличием гидрокарбонатов кальция и
магния и устраняется кипячением, постоянная жёсткость обусловлена
наличием других солей кальция и магния, а устраняется добавлением
соды.
17.
Выводы➢ Качественными реакциями на карбонат и гидрокарбонат-ион является
действие кислот на эти соли, при этом наблюдается бурное выделение
углекислого газа.
➢ Карбонаты и гидрокарбонаты многих металлов находят широкое
применение во многих отраслях народного хозяйства.













 chemistry
chemistry