Similar presentations:
Свойства газов
1. Свойства газов
Идеальный газ:давление, энергия,
законы.
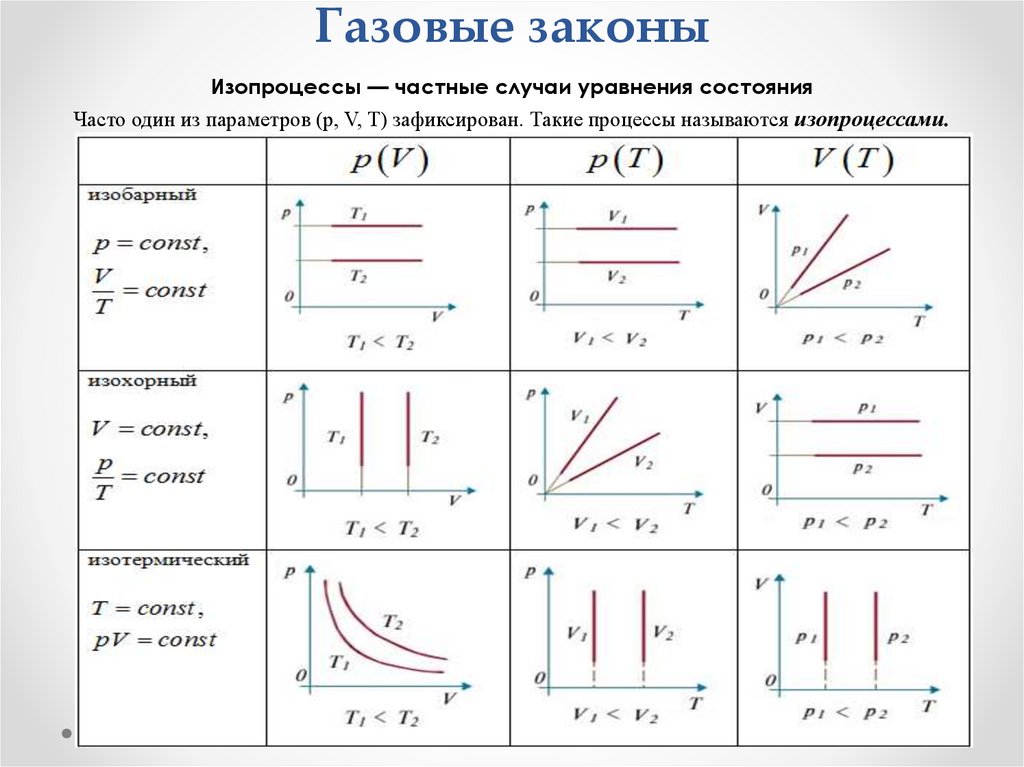
2. Состояние газа определяется тремя параметрами
• Объем (V) — пространство, которое занимает газ. [л,м³].
• Давление (p) — сила на единицу площади. [Па, атм.,
бар]. p = F/S.
• Температура (T) — мера средней кинетической
энергии молекул. [К]. T(K) = t(°C) + 273.
• В.: «Измените один параметр — остальные
отреагируют. Наша задача — найти законы этой
связи».
3. Модель «Идеальный газ» — наш рабочий инструмент
• Определение: Упрощенная модель, где:o Молекулы — материальные точки (размером
пренебрегаем).
o Нет сил притяжения между молекулами (кроме
момента удара).
o Удары молекул о стенки абсолютно упругие.
• Вывод: Воздух, азот, кислород при не слишком
высоком давлении и не слишком низкой
температуре ведут себя как идеальный газ. Это
большинство технических ситуаций!
4. Давление идеального газа
• Почему газ давит? Молекулярно-кинетическаякартина
• Объяснение: Давление — это результат
бесчисленных упругих ударов молекул
о стенки. Каждый удар передает стенке
маленький импульс. Сумма этих импульсов
в единицу времени на единицу площади и есть
сила давления.
• Аналогия: «Представьте град, бьющий по крыше.
Чем крупнее градины (масса) и чем чаще они
падают (концентрация и скорость), тем сильнее
общий «напор» на крышу».
5. Основное уравнение МКТ идеального газа
• Давление зависит от:o Концентрации молекул (n): n = N/V. Чем больше молекул в единице
объема, тем чаще удары.
o Массы молекулы (m₀): Чем тяжелее молекула, тем сильнее удар.
o Скорости молекул (

















 physics
physics








