Similar presentations:
Урок 19. Общая характеристика элементов VIIА-группы – галогенов
1.
Тема урока: Общая характеристикаэлементов VIIА-группы – галогенов
2.
Общая характеристика1. К элементам VII гр., главной подгруппы относятся: F, Cl, Br, I, At
2. Общее название - галогены (греч. «солеобразующие») большинство их соединений с металлами представляют собой
типичные соли (KCl, NaCl и т.д.).
3. Галогены имеют степень окисления +1,+3,+5,+7, -1 (F)
4. В природе наиболее распространён - хлор.
5. Астат получен искусственным путём.
3.
Электронные формулыF
Галогены – р-элементы
На внешнем энергетическом
уровне 7 электронов, один
из них неспаренный .
1S22S22P5
22S22P63S23P5
1S
CI
Br
I
…4S24P5
…5S25P5
4.
Строение атомаF
+9
2
7
CI
1) Увеличиваются заряды атомных ядер
2) Увеличивается число энергетических уровней
3) Увеличивается радиус атома
4) Число электронов на внешнем уровне постоянно
+17
Br
2 8 7
+35
I
+53
2 8 18 7
2 8 18 18 7
Неметаллические-окислительные
свойства ослабевают,
металлические - восстановительные
усиливаются !!!
5.
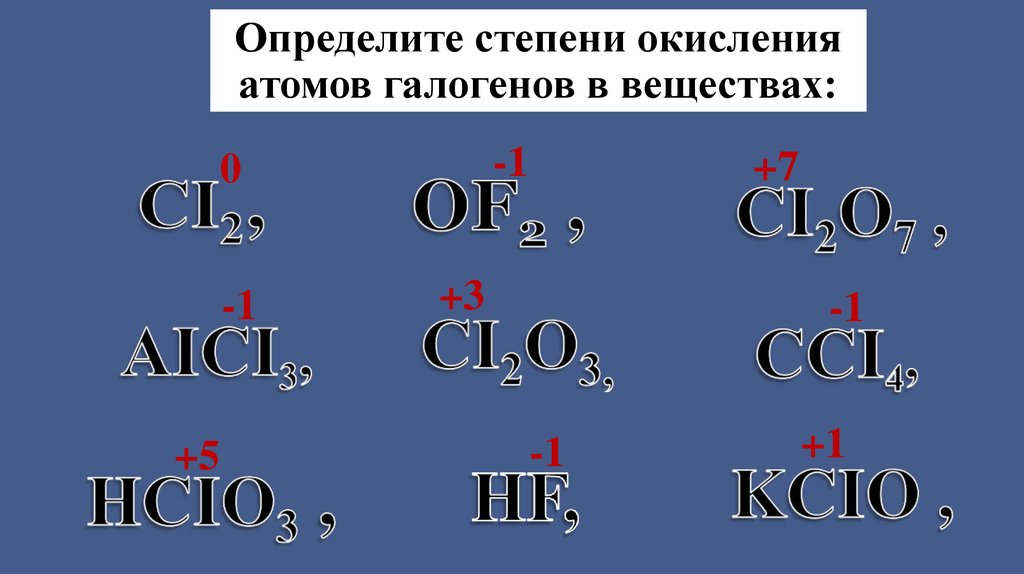
Определите степени окисленияатомов галогенов в веществах:
-1
0
-1
+5
+7
+3
-1
-1
+1
6.
Строение молекул1.
2.
3.
Молекулы галогенов состаят из двух атомов: F2; Cl2; Br2; I2
Связь – ковалентная неполярная.
Кристаллическая решётка молекулярная.
7.
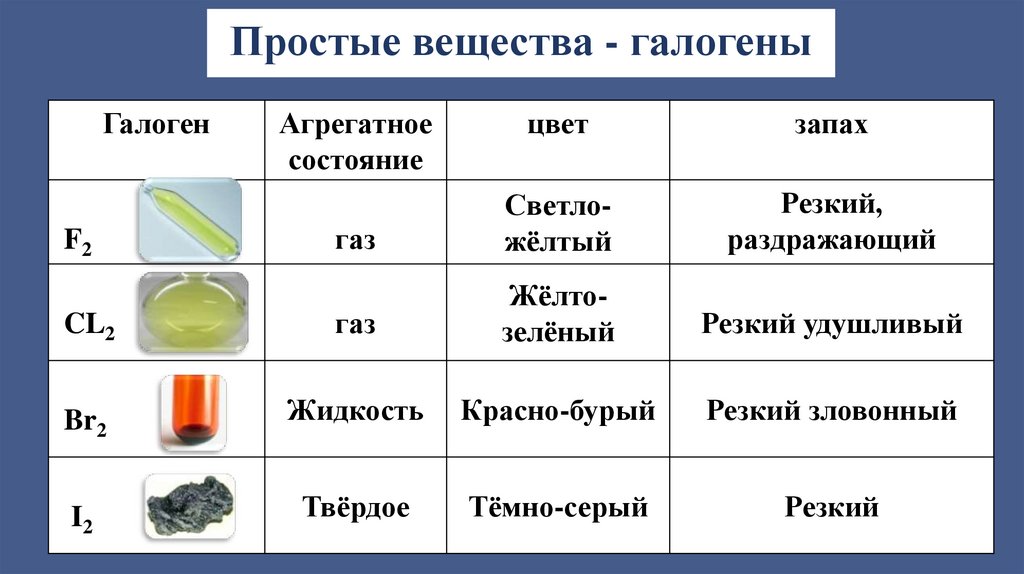
Простые вещества - галогеныГалоген
цвет
запах
газ
Светложёлтый
Резкий,
раздражающий
CL2
газ
Жёлтозелёный
Резкий удушливый
Br2
Жидкость
Красно-бурый
Резкий зловонный
I2
Твёрдое
Тёмно-серый
Резкий
F2
Агрегатное
состояние
8.
Химические свойства1. Взаимодействие с металлами (сильные окислители)
+1
-1
2 Na0 + CI20 = 2 NaCI
CI20 окислитель
Получаются соли: фториды, хлориды, бромиды, иодиды.
9.
2. Взаимодействие с водородом+1 -1
0
0
Н2 + F2 = 2Н F + Q
0
0
Н2 + CI2 = 2НCI + Q
0
0
Н2 + Br2 = 2НBr
0
0
Н2 + I2 =
2Н I - Q
10.
3. Взаимодействие с другими неметаллами2S + Cl2 → S2Cl2
Возможно также получение и других соединений серы с хлором.
2S + F2 → SF6
2P + 3Cl2 = 2PCl3
2P + 5Cl2 = 2PCl5
Si + 2F2 = SiF4
С кислородом не реагируют!
11.
4. Взаимодействие с растворами солей галогеновF2
CI2 Br2 I2
CI2 + 2NaBr = 2 NaCl + Br2
CI2 + 2NaI = 2 NaCl + I2
Br2 + 2NaI = 2 NaBr + I2
12.
5. Взаимодействие с водойCI2 + H2O = HCI + HCIO
соляная
кислота
хлорноватистая
кислота
2F2 + 2Н2О = 4НF + О2
плавиковая
кислота
13.
5. Взаимодействие с растворами щелочей0
-1
+1
Cl2 +2NaOH = NaCl +NaCl O +H2O
(без нагревания) хлорид натрия гипохлорит натрия
+5
0
-1
3Cl2 +6NaOH = 5NaCl +NaCl O3 + 3H2
(при нагревании) хлорид натрия хлорат натрия
Cl2 + CO → COCl2 фосген
14.
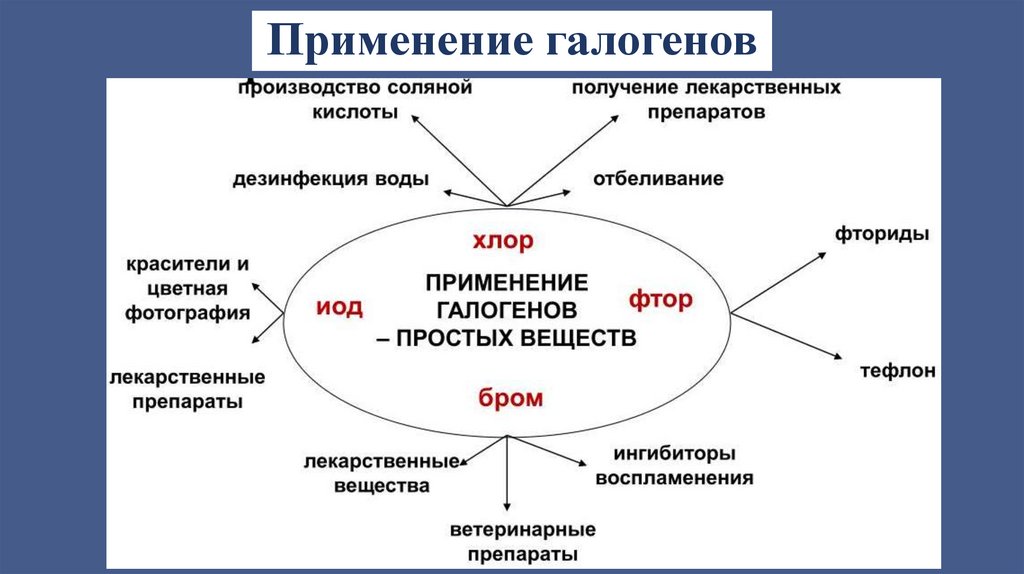
Применение галогенов15.
Вопросы для закрепления!1. Опишите общую характеристику галогенов.
2. Опишите строение атома галогенов.
3. Опишите простые вещества – галогены.
4. Какими химическими свойствами обладают галогены?
5. Где применяются галогены?
15
16.
Домашнее заданиеП. 11 (читать) +
повторять в тетради.
16
17.
СПАСИБО ЗА ВНИМАНИЕ!17














 chemistry
chemistry








