Similar presentations:
Галогены
1. Галогены
2.
• К элементам VII группы, главной подгруппы относятсяфтор F, хлор Cl, бром Br, иод I, астат At
• Общее название - галогены (греч. «солеобразующие») большинство их соединений с металлами представляют собой
типичные соли (KCl, NaCl и т.д.).
3.
•Общая характеристика галогеновГалогены – это естественная группа
элементов , расположенных в главной
подгруппе 7 группы.
Фтор (F), хлор(Cl), бром (Br), йод (I), астат
(At)
Галогены имеют степень окисления
+1,+3,+5,+7, -1
У фтора только -1
В природе наиболее распространён- хлор.
Астат получен искусственным путём.
4.
Электронные формулыF
1S22S22P5
2
S
CI
1S22S22P63S23P5
Br …4S24P5
I
P
5
…5S25P5
Вывод: галогены - р - элементы
На внешнем энергетическом
уровне 7 электронов, один из них
неспаренный .
5.
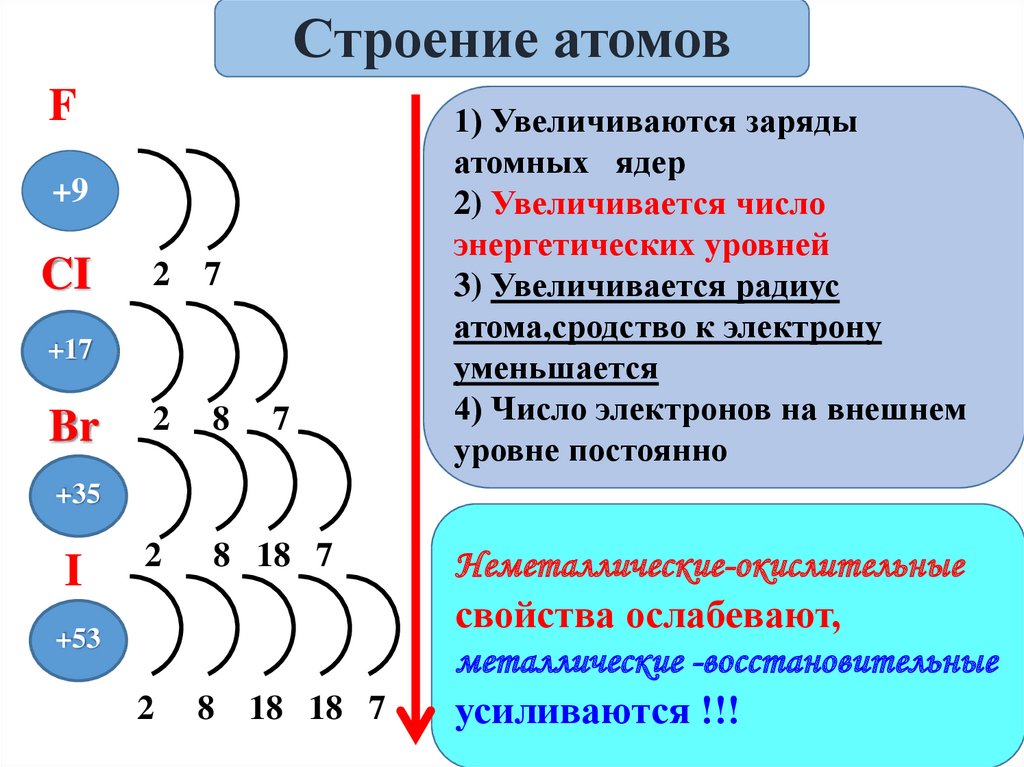
Строение атомовF
+9
CI
2
7
2
8
2
8 18 7
+17
Br
7
1) Увеличиваются заряды
атомных ядер
2) Увеличивается число
энергетических уровней
3) Увеличивается радиус
атома,сродство к электрону
уменьшается
4) Число электронов на внешнем
уровне постоянно
+35
I
+53
2
8
18 18 7
Неметаллические-окислительные
свойства ослабевают,
металлические -восстановительные
усиливаются !!!
6.
Определите степени окисленияатомов галогенов в веществах :
0
-1
-1
+5
+7
+3
-1
-1
+1
7.
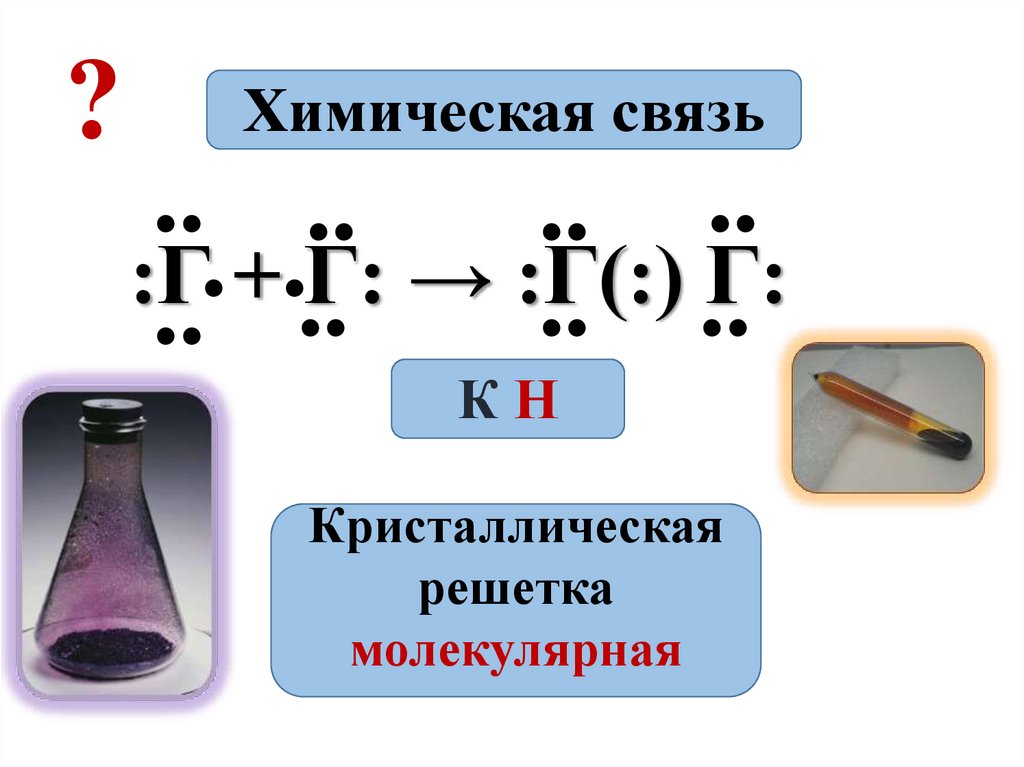
• Молекулы галогенов состоят из двух атомов•F2; Cl2; Br2; I2
Cl + Cl → Cl Cl
• Связь – ковалентная неполярная
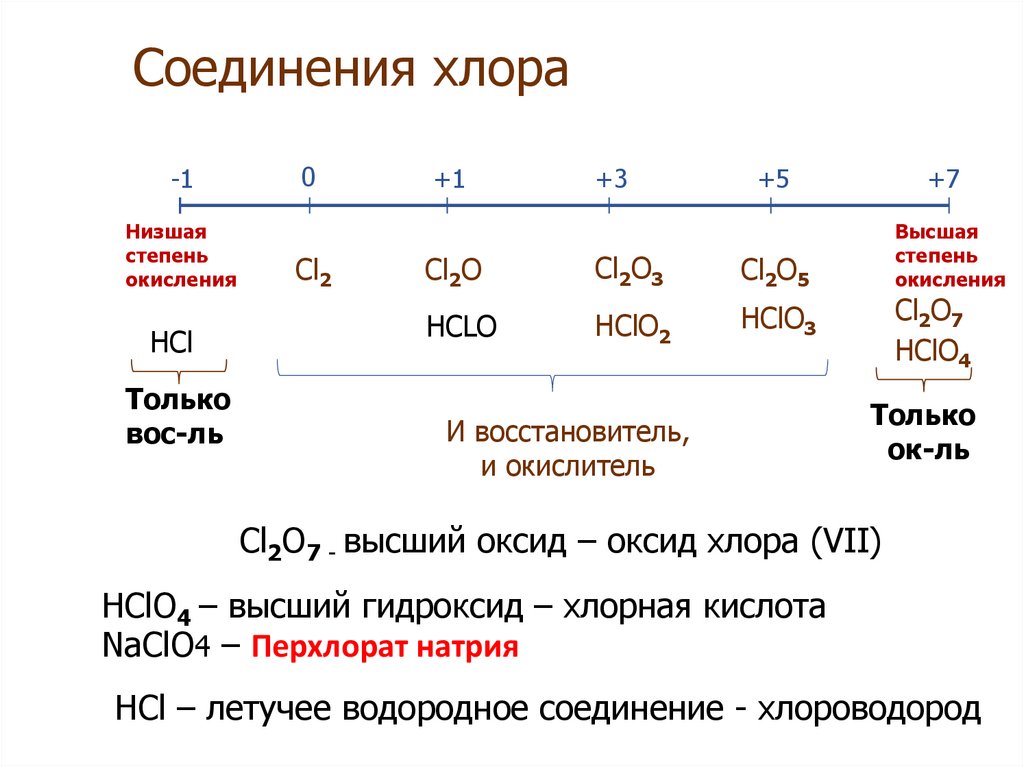
8. Соединения хлора
-1Низшая
степень
окисления
HCl
Только
вос-ль
0
Cl2
+1
+3
+5
Cl2O
Cl2O3
Cl2O5
HCLO
HClO2
HClO3
И восстановитель,
и окислитель
+7
Высшая
степень
окисления
Cl2O7
HClO4
Только
ок-ль
Cl2O7 - высший оксид – оксид хлора (VII)
HClO4 – высший гидроксид – хлорная кислота
NaClO4 – Перхлорат натрия
HCl – летучее водородное соединение - хлороводород
9.
?Химическая связь
.. ..
.. ..
.
.
:Г
+
Г:
→
:Г(:)
Г:
.. ..
.. ..
КН
Кристаллическая
решетка
молекулярная
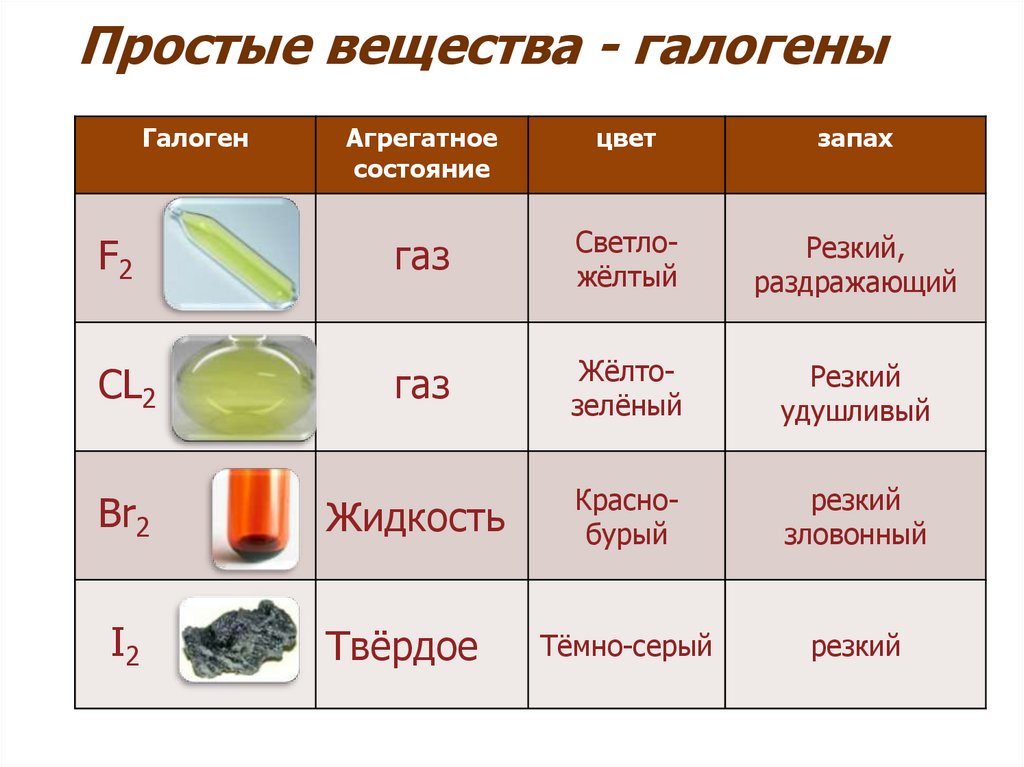
10. Простые вещества - галогены
ГалогенАгрегатное
состояние
цвет
запах
F2
газ
Светложёлтый
Резкий,
раздражающий
CL2
газ
Жёлтозелёный
Резкий
удушливый
Жидкость
Краснобурый
резкий
зловонный
Тёмно-серый
резкий
Br2
I2
Твёрдое
11.
Химические свойства галогенов1.Взаимодействие с металлами
+1
-1
2 Na0 + CI20 = 2 NaCI
CI20 окислитель
Получаются соли:
фториды,хлориды,бромиды,иодиды.
12. Химические свойства
Сильные окислители (+е)1. Взаимодействуют с металлами:
2Na + Cl2 = 2NaCl
Zn + Br2 =
Fe + Cl2 =
Al + I2 =
13.
+2-1
+3
-1
Кто окислитель?
14.
2.Взаимодействие с водородом+1 -1
Н20 + Г20 = 2Н Г
+1 -1
Н20 + F20 = 2Н F + Q
Н20 + CI20 = 2Н CI + Q
Н20 + Br20 = 2НBr
Н20 + I20 = 2Н I - Q
15. Химические свойства
2. Взаимодействуют с неметаллами:2S + Cl2 → S2Cl2 Возможно также получение и
других соединений серы с хлором: SCl2, SCl4.
2P + 3Cl2 = 2PCl3
2P + 5Cl2 = 2PCl5
Si + 2F2 = SiF4.
С кислородом не реагируют!
16.
4.Взаимодействие с растворами солейгалогенов:
F2
CI2
Br2
I2
CI2 + 2NaBr = 2 NaCl + Br2
CI2 + 2NaI = 2 NaCl + I2
Br2 + 2NaI = 2 NaBr + I2
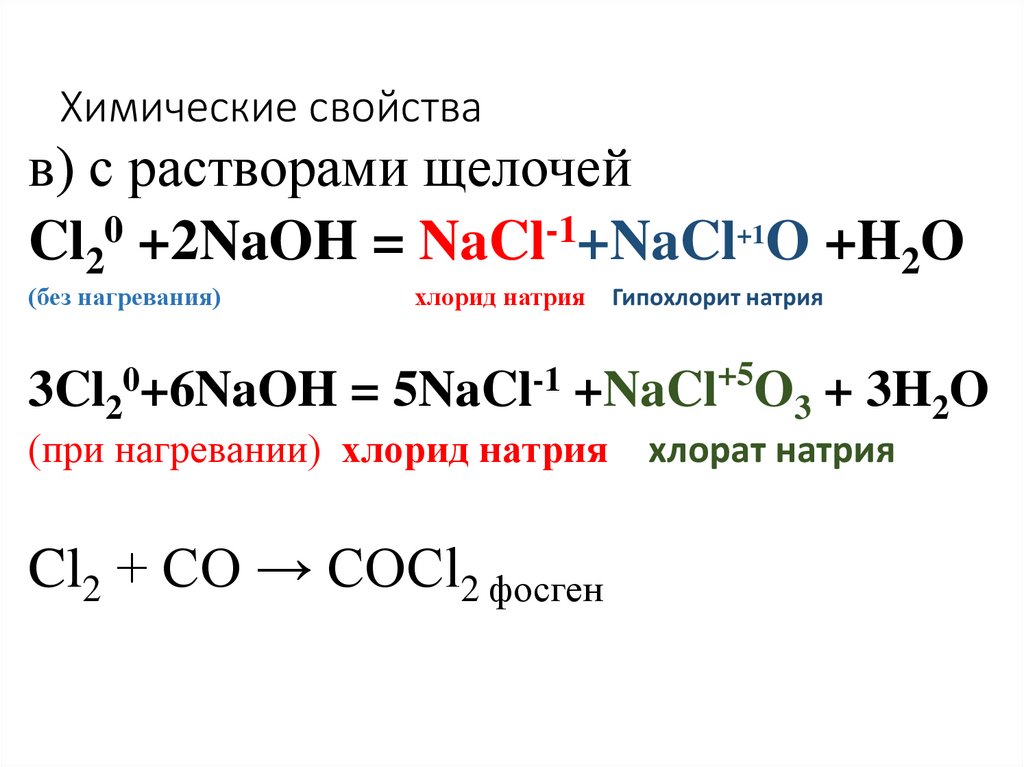
17. Химические свойства
Взаимодействуют со сложными веществами допишите возможныеуравнения реакций
а) с растворами солей
Cl2 + 2КF =
Cl2 + КBr =
Br2 + КI =
Br2 + КCl =
Окислительные свойства вниз по группе уменьшаются
18.
3.Взаимодействие с водойCI2 + H2O = HCI + HCIO
Соляная
кислота
Хлорноватистая
кислота
2F2 + 2Н2 О = 4НF + О2
плавиковая кислота
19. Химические свойства
в) с растворами щелочейCl20 +2NaOH = NaCl-1+NaCl+1O +H2O
(без нагревания)
0+6NaOH
3Cl2
хлорид натрия
=
5NaCl-1
Гипохлорит натрия
+5
+NaCl O3 + 3H2O
(при нагревании) хлорид натрия
Cl2 + CO → COCl2 фосген
хлорат натрия
20.
1. В промышленности: электролиз расплава илираствора хлорида натрия
2NaCl
2Na + Cl2
2NaCl + 2H2O H2 + Cl2 + 2NaOH
2. В лаборатории:
4 HСl + MnO2
16 HСl + 2KMnO4
MnCl2 + Cl2 + 2H2O
2KСl + 2MnCl2 + 5Cl2 + 8H2O
21.
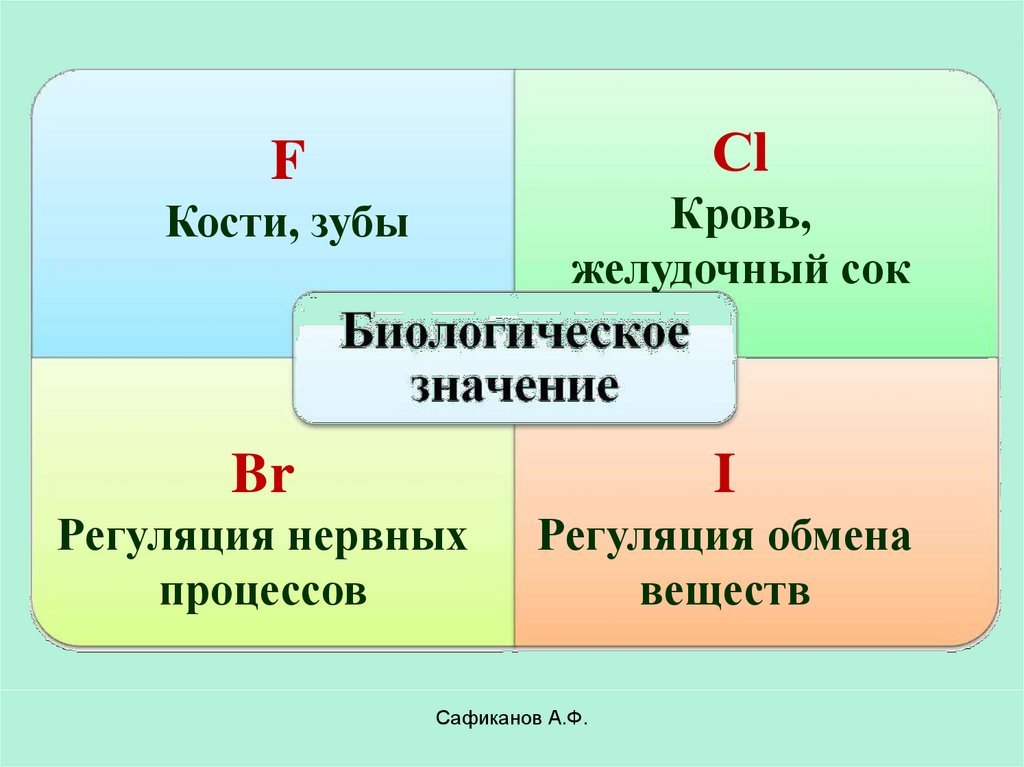
22.
СlF
Кровь,
желудочный сок
Кости, зубы
Br
I
Регуляция нервных
процессов
Регуляция обмена
веществ
Сафиканов А.Ф.
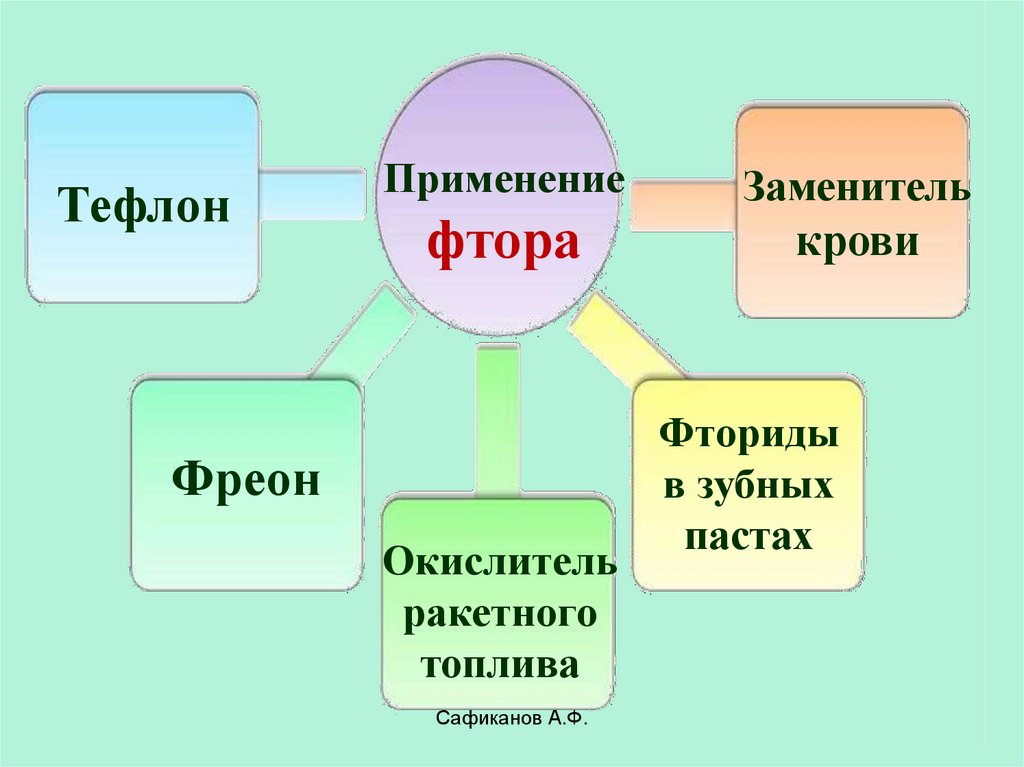
23.
ТефлонПрименение
фтора
Фреон
Окислитель
ракетного
топлива
Сафиканов А.Ф.
Заменитель
крови
Фториды
в зубных
пастах
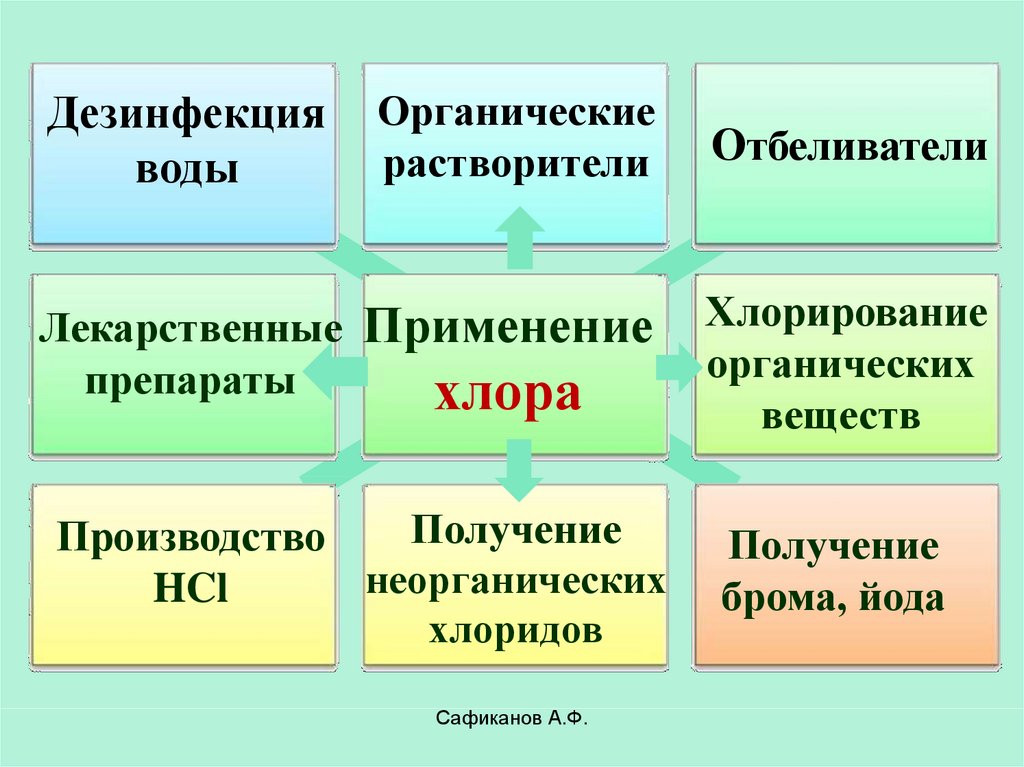
24.
Дезинфекцияводы
Органические
растворители
Лекарственные
препараты
Применение
хлора
Получение
Производство
неорганических
HCl
хлоридов
Сафиканов А.Ф.
Отбеливатели
Хлорирование
органических
веществ
Получение
брома, йода
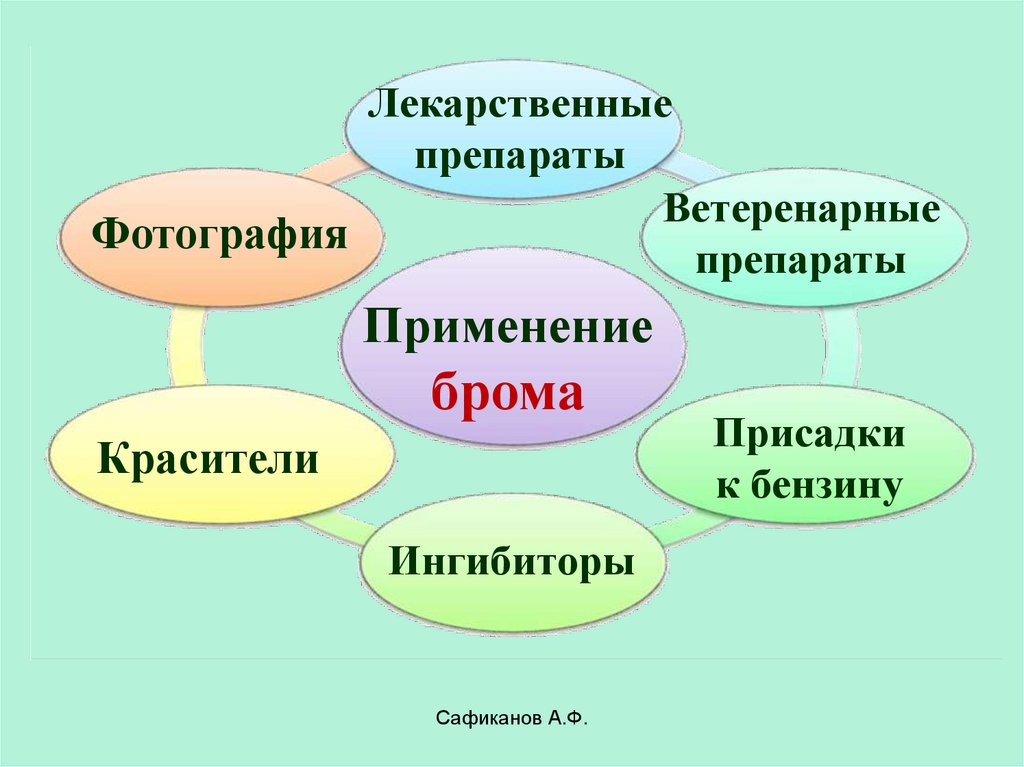
25.
Лекарственныепрепараты
Ветеренарные
Фотография
препараты
Применение
брома
Красители
Ингибиторы
Сафиканов А.Ф.
Присадки
к бензину
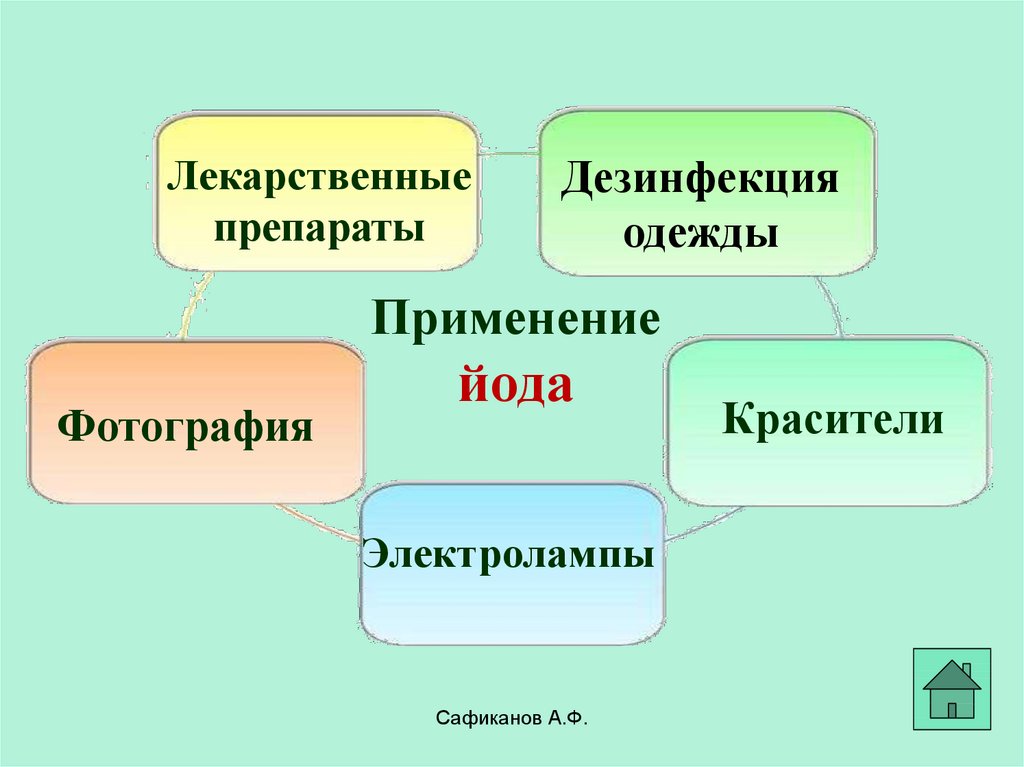
26.
Лекарственныепрепараты
Дезинфекция
одежды
Применение
Фотография
йода
Электролампы
Сафиканов А.Ф.
Красители
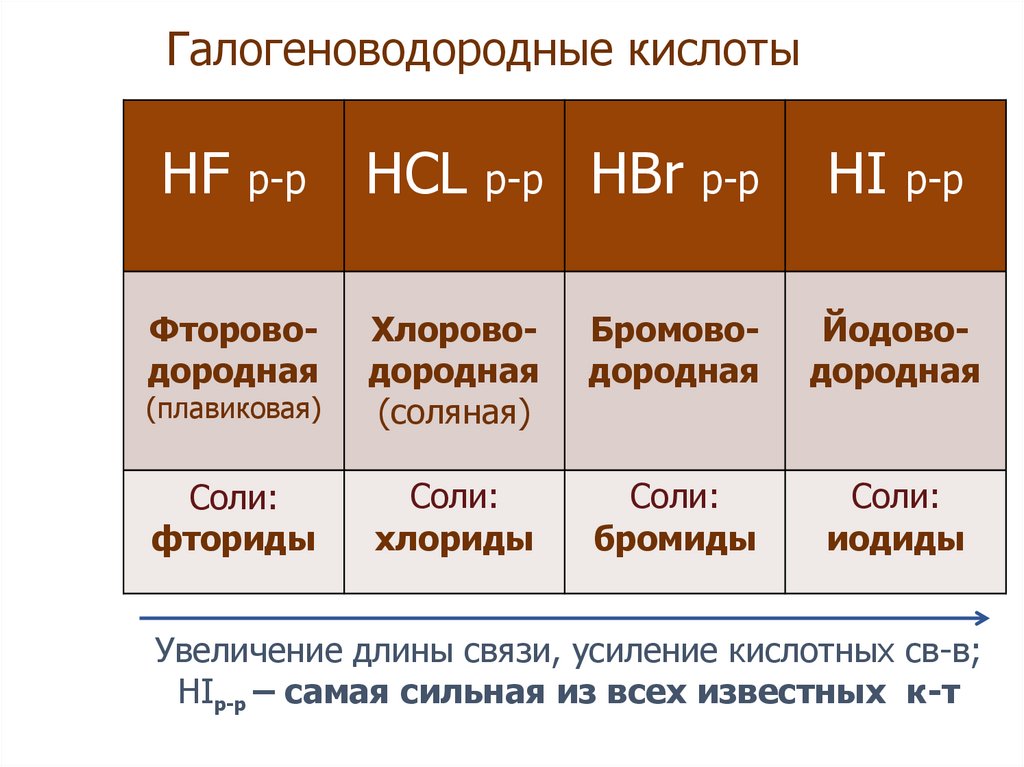
27. Галогеноводородные кислоты
HFр-р
HCL
р-р
HBr
р-р
HI
р-р
Фтороводородная
(плавиковая)
Хлороводородная
(соляная)
Бромоводородная
Йодоводородная
Соли:
фториды
Соли:
хлориды
Соли:
бромиды
Соли:
иодиды
Увеличение длины связи, усиление кислотных св-в;
HIр-р – самая сильная из всех известных к-т
28.
Применение галогеновДезинфицирующие реагенты
на основе хлора
29. Соляная кислота
30.
Соляная кислота (HCl)Классификация
Соляная кислота по:
наличию кислорода:
бескислородная
основности:
растворимости в воде:
одноосновная
растворимая
летучести:
летучая
степени электролитической диссоциации:
сильная
стабильности:
стабильная
31.
Физические свойства хлороводородаХлороводород – это газ с резким запахом, без цвета, очень хорошо растворим
в воде (500 объемов HCl в 1 объеме воды), на воздухе «дымит», так как взаимодействует с парами воды и образует капельки соляной кислоты. Раствор хлороводорода в воде и называют соляной кислотой.
32.
Физические свойства соляной кислотыСоляная кислота – бесцветная дымящаяся на воздухе жидкость
(в продажу поступает 36%-ный раствор хлороводорода в воде),
Несколько тяжелее воды (плотность 1,19 г/мл).
33. Химические свойства соляной кислоты
1. Действие соляной кислоты на индикаторы2. Взаимодействие с металлами
3. Взаимодействие с основными оксидами
4. Реакция нейтрализации
5. Взаимодействие с солями
34.
Действие кислот на индикаторыСоляная кислота необратимо диссоциирует в водном растворе.
Составьте уравнение диссоциации соляной кислоты. HCl = H+ + Cl¯
Растворы кислот изменяют цвет индикаторов:
лакмуса – в
красный
метилового оранжевого – в
красный
фенолфталеина
не изменяет
35.
1.Кислоты взаимодействуют с щелочами( а также с нерастворимымиоснованиями, если получающая соль растворима в воде) с
образованием солей и воды
( реакция нейтрализации):
• NaOH+HCl= NaCl+H20
гидроксид Na + соляная кислота= хлорид натрия+ вода
Na++OH-+H++Cl-→Na++Cl-+H20
OH- +H+→ H20
Zn(OH)2 + 2HCl →ZnCl2+ 2H2O
Гидроксид цинка +соляная кислота =хлорид цинка вода
Zn(OH)2 + 2H++2Cl- →Zn2++2Cl- + 2H2O
Zn(OH)2 + 2H+→Zn2++ 2H2O
36.
Взаимодействие соляной кислоты с основными оксидамиСоставьте уравнения реакций соляной кислоты с оксидом кальция и
оксидом железа (III). Рассмотрите с т.зр. ТЭД.
2HCl + CaO = CaCl2 + H2O
2H+ +2Cl¯ +CaO =Ca2+ +2Cl¯+H2O
2H+ + CaO = Ca 2+ + H2O
6HCl + Fe2O3 = 2FeCl3 + 3H2O
6H++6Cl¯+Fe2O3=2Fe3++6Cl¯+3H2O
6H+ + Fe2O3 = 2Fe3+ + 3H2O
37.
Взаимодействие соляной кислоты с солямиСоставьте уравнения реакций соляной кислоты c карбонатом натрия
натрия. Рассмотрите с т.зр. ТЭД.
2HCl+Na2CO3=2NaCL +H2O+CO2
2H++2Cl−+2Na++CO32−=2Na++Cl−+H2O+CO2
2H+ + CO32− = H2O + CO2
Составьте уравнение реакции соляной кислоты с раствором соли, идущей с
образованием осадка.
HCl +AgNO3 = AgCl + HNO3
Ag+ + Cl− = AgCl
Качественная реакция на хлорид-ион
38.
В) образуется кислота в осадке2HСl + Na2SiO3 → H2SiO3↓+ 2NaСl
соляная кислота + силикат Na =кремневая кислота + хлорид Na
2H+ + SiO3-2 → H2SiO3↓
39. Соляная кислота реагирует с металлами до водорода с вытеснением водорода
6HCl +2Al= 2AlCl3 + 3H2Т.П.Сараева 210-987-172
40.
+4-1
+2
0
МnO2 + 4HCI = MnCI2 + CI2 + 2H2O
Mn+4 + 2e → Mn+2
2CI-1 – 2e → CI20
окислитель
восстановитель,
41.
Применение соляной кислоты1. Получение солей
2. Производство пластмасс и других
синтетических материалов
3. Приготовление лекарств
4. При паянии
5. Очистка поверхности металлов в
гальваностегии
6. Производство красок
42.
HCl1
2
3
4
5
6








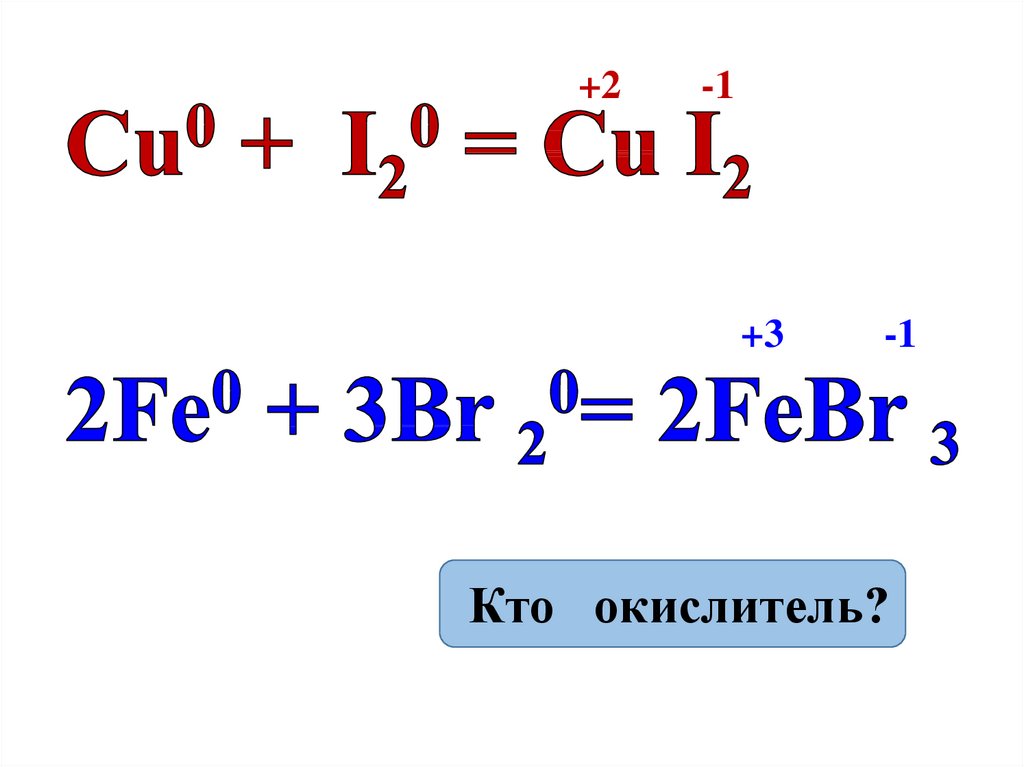





















 chemistry
chemistry








