Similar presentations:
Галогены. Строение атомов фтора и хлора
1. Галогены
2.
• К элементам VII группы, главной подгруппы относятсяфтор F, хлор Cl, бром Br, иод I, астат At
• Общее название - галогены (греч. «солеобразующие») большинство их соединений с металлами представляют собой
типичные соли (KCl, NaCl и т.д.).
3. Строение атомов фтора и хлора
F1s22s22p5
+9
2 , 7
Cl
1s22s22p63s23p5
+ 17
2 , 8 , 7
4. Строение атома
Степени окисления:F: только -1;0
Cl, Br, I:-1; 0; +1; +3; +5; +7
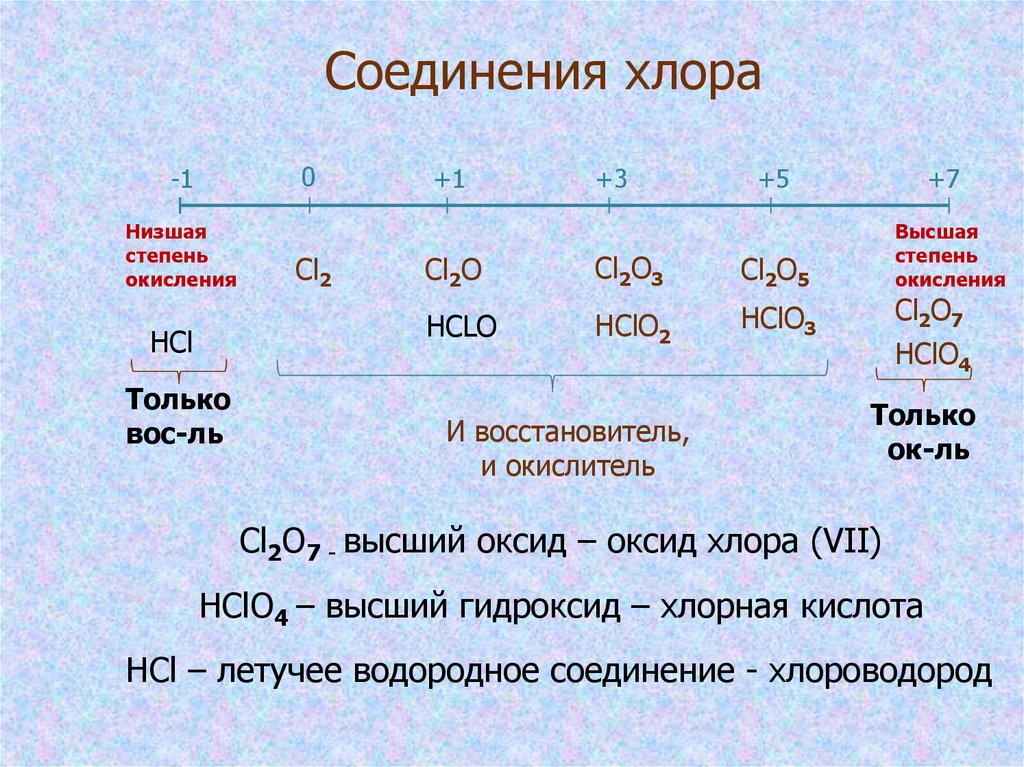
5. Соединения хлора
0-1
Низшая
степень
окисления
HCl
Только
вос-ль
Cl2
+1
+3
+5
+7
Cl2O
Cl2O3
Cl2O5
Высшая
степень
окисления
HCLO
HClO2
HClO3
Cl2O7
И восстановитель,
и окислитель
HClO4
Только
ок-ль
Cl2O7 - высший оксид – оксид хлора (VII)
HClO4 – высший гидроксид – хлорная кислота
HCl – летучее водородное соединение - хлороводород
6.
• Молекулы галогенов состоят из двух атомов• F2; Cl2; Br2; I2
Cl + Cl → Cl Cl
• Связь – ковалентная неполярная
7. Существуют только в связанном состоянии стр.172
8. Простые вещества - галогены
ГалогенF2
CL2
Br2
I2
Агрегатное
состояние
цвет
запах
газ
Светложёлтый
Резкий,
раздражающий
газ
Жёлтозелёный
Резкий
удушливый
Жидкость
Краснобурый
резкий
зловонный
Твёрдое
Тёмносерый
резкий
9. Химические свойства
Сильные окислители (+е)1. Взаимодействуют с металлами:
2Na + Cl2 = 2NaCl
Zn + Br2 =
Fe + Cl2 =
Al + I2 =
10. Химические свойства
2. Взаимодействуют с неметаллами:Cl2 + H2 =
Cl2 + S =
Cl2 + P =
С кислородом не реагируют!
11. Химические свойства
3. Взаимодействуют со сложными веществами:а) с растворами солей
Cl2 + 2NaI = 2NaCl + I2
Cl2 + NaBr =
Br2 + NaI =
Окислительные свойства вниз по группе
уменьшаются
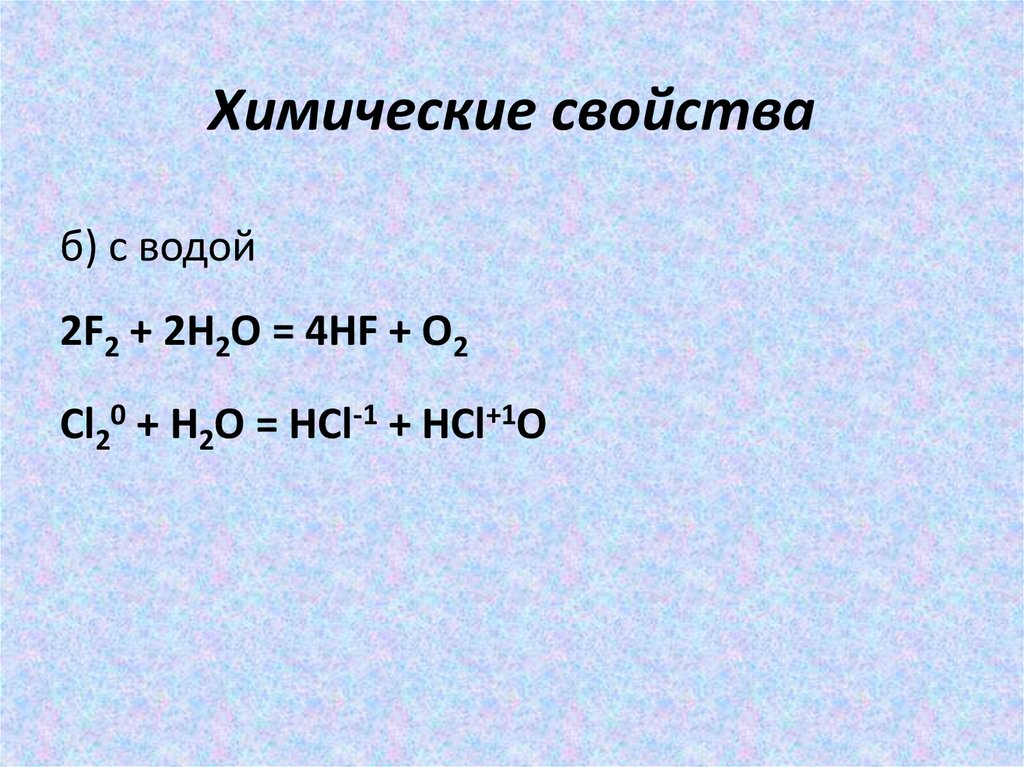
12. Химические свойства
б) с водой2F2 + 2H2O = 4HF + O2
Cl20 + H2O = HCl-1 + HCl+1O
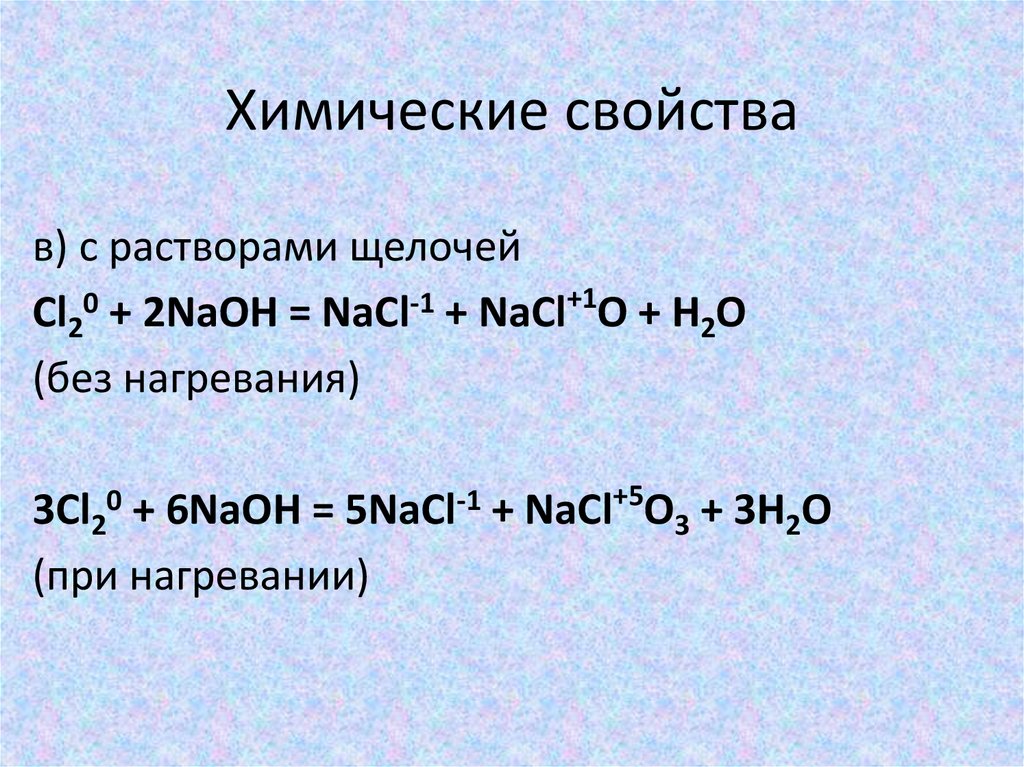
13. Химические свойства
в) с растворами щелочейCl20 + 2NaOH = NaCl-1 + NaCl+1O + H2O
(без нагревания)
+5
0
-1
3Cl2 + 6NaOH = 5NaCl + NaCl O3 + 3H2O
(при нагревании)
14.
Качественные реакции нагалогенид-ионы:
NaCl + AgNO3 = AgCl + NaNO3
NaBr + AgNO3 = AgBr + NaNO3
KI + AgNO3 = AgI + KNO3
NaF + CaCl2 = CaF2 + 2NaCl
15.
1. В промышленности: электролиз расплава илираствора хлорида натрия
2NaCl
2Na + Cl2
2NaCl + 2H2O H2 + Cl2 + 2NaOH
2. В лаборатории:
4 HСl + MnO2
16 HСl + 2KMnO4
MnCl2 + Cl2 + 2H2O
2KСl + 2MnCl2 + 5Cl2 + 8H2O
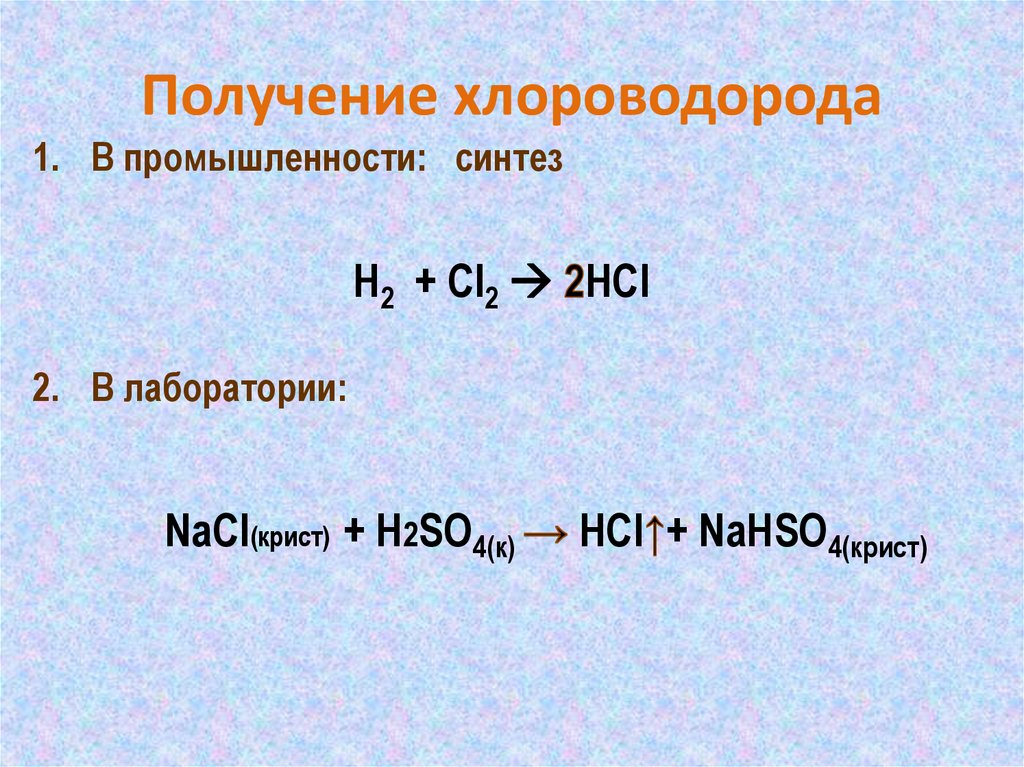
16. Получение хлороводорода
1. В промышленности: синтезH2 + Cl2 HСl
2. В лаборатории:
NaСl(крист) + H2SO4(к)
HСl + NaHSO4(крист)
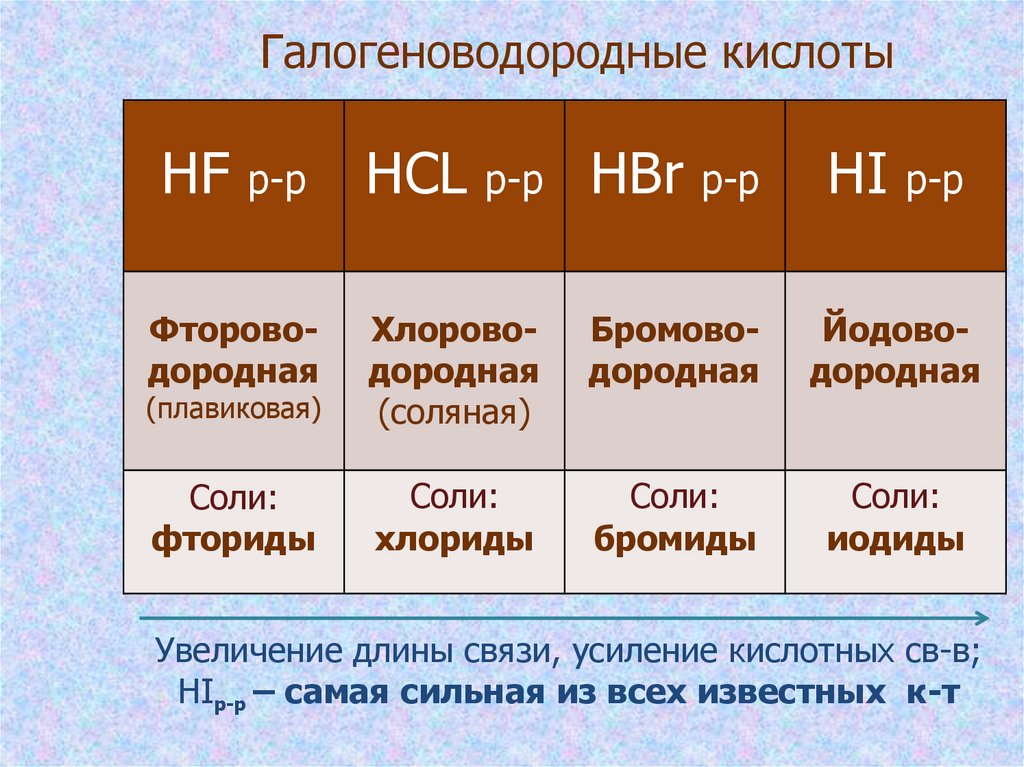
17. Галогеноводородные кислоты
HF р-рHCL р-р HBr р-р
HI р-р
Фтороводородная
(плавиковая)
Хлороводородная
(соляная)
Бромоводородная
Йодоводородная
Соли:
фториды
Соли:
хлориды
Соли:
бромиды
Соли:
иодиды
Увеличение длины связи, усиление кислотных св-в;
HIр-р – самая сильная из всех известных к-т
18.
Свойства плавиковой кислоты:SiO2 + 4HF = SiF4 + 2H2O
19.
§ 22 – 24 (письменный опрос)Упр.2-4 стр.173 письменно














 chemistry
chemistry








