Similar presentations:
Галогены. Общая характеристика
1. Галогены (солеобразующие)
2.
• Общая характеристика галогеновГалогены – это естественная группа
элементов , расположенных в главной
подгруппе 7 группы.
Фтор (F), хлор(Cl), бром (Br), йод (I), астат
(At)
Галогены имеют степень окисления
+1,+3,+5,+7, -1
У фтора только -1
В природе наиболее распространён- хлор.
Астат получен искусственным путём.
3.
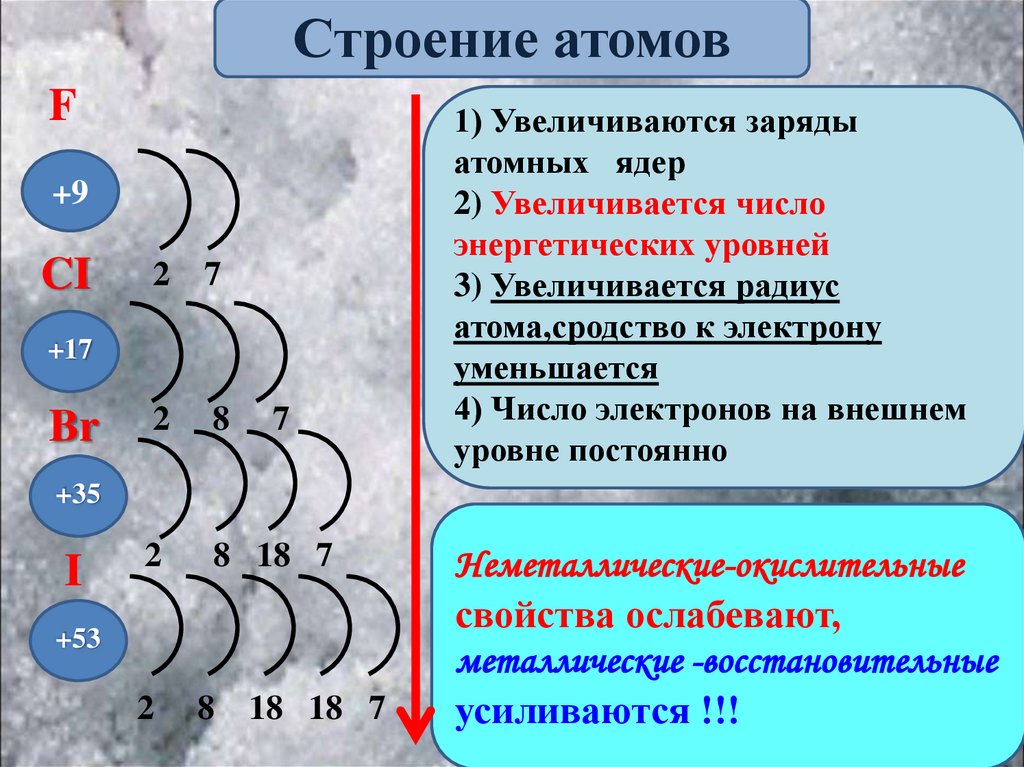
Строение атомовF
+9
CI
2
7
2
8
2
8 18 7
2
8
+17
Br
7
1) Увеличиваются заряды
атомных ядер
2) Увеличивается число
энергетических уровней
3) Увеличивается радиус
атома,сродство к электрону
уменьшается
4) Число электронов на внешнем
уровне постоянно
+35
I
+53
18 18 7
Неметаллические-окислительные
свойства ослабевают,
металлические -восстановительные
усиливаются !!!
4.
Электронные формулыF 1S22S22P5
2
2S
2P
5
CI 1S22S22P63S23P5
Br …4S24P5 Вывод:
I
галогены - р - элементы
На внешнем энергетическом
уровне 7 электронов, один из них
5
неспаренный .
…5S25P
5.
Определите степени окисленияатомов галогенов в веществах :
0
-1
-1
+5
+7
+3
-1
-1
+1
6.
Br2Простые
вещества
F2
I2
CI2
7.
?Химическая связь
.. ..
.. ..
.
.
:Г
+
Г:
→
:Г(:)
Г:
.. ..
.. ..
Кристаллическая
решетка
молекулярная
8.
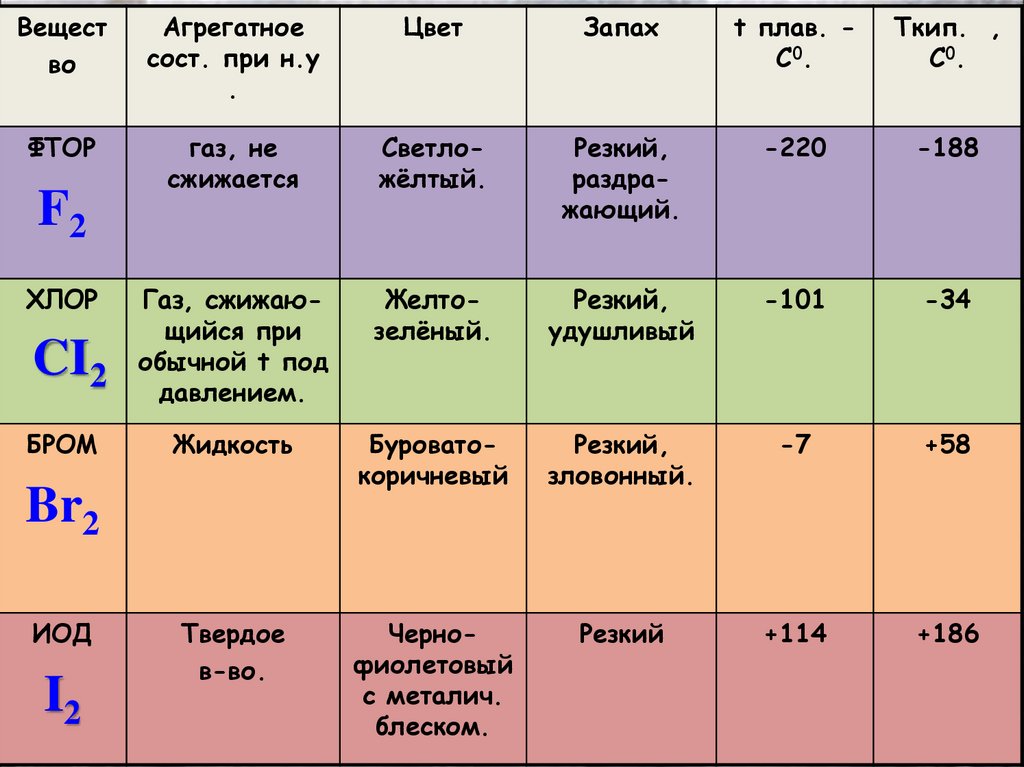
Вещество
Агрегатное
сост. при н.у
.
Цвет
Запах
t плав. C0.
Tкип. ,
C0.
ФТОР
газ, не
сжижается
Cветложёлтый.
Резкий,
раздражающий.
-220
-188
Газ, сжижающийся при
обычной t под
давлением.
Желтозелёный.
Резкий,
удушливый
-101
-34
Жидкость
Буроватокоричневый
Резкий,
зловонный.
-7
+58
Твердое
в-во.
Чернофиолетовый
с металич.
блеском.
Резкий
+114
+186
F2
ХЛОР
CI2
БРОМ
Br2
ИОД
I2
9.
Химические свойства галогенов1.Взаимодействие с металлами
+1
-1
2 Na0 + CI20 = 2 NaCI
CI20 окислитель
Получаются соли:
фториды,хлориды,бромиды,иодиды.
10.
+2-1
+3
-1
Кто окислитель?
11.
2.Взаимодействие с водородом+1 -1
Н20 + Г20 = 2Н Г
+1 -1
Н20 + F20 = 2Н F + Q
Н20 + CI20 = 2Н CI + Q
Н20 + Br20 = 2НBr
Н20 + I20 = 2Н I - Q
12.
3.Взаимодействие с водойCI2 + H2O = HCI + HCIO
Соляная
кислота
Хлорноватистая
кислота
2F2 + 2Н2 О = 4НF + О2
плавиковая кислота
13.
4.Взаимодействие с растворами солейгалогенов:
F2
CI2
Br2
I2
CI2 + 2NaBr = 2 NaCl + Br2
CI2 + 2NaI = 2 NaCl + I2
Br2 + 2NaI = 2 NaBr + I2
14. Получение
В лаборатории*+4
-1
+2
0
МnO2 + 4HCI = MnCI2 + CI2 + 2H2O
Mn+4 + 2e → Mn+2 окислитель
восстанавливается
(О.В.)
2CI-1 – 2e → CI20 восстановитель,
окисляется
(В.О.)
15.
В промышленностиПолучают электролизом расплавов или
растворов их солей.
2NaCl
Расплав
элект ролиз
2Na+Cl2
16.
Применение галогеновДезинфицирующие реагенты
на основе хлора







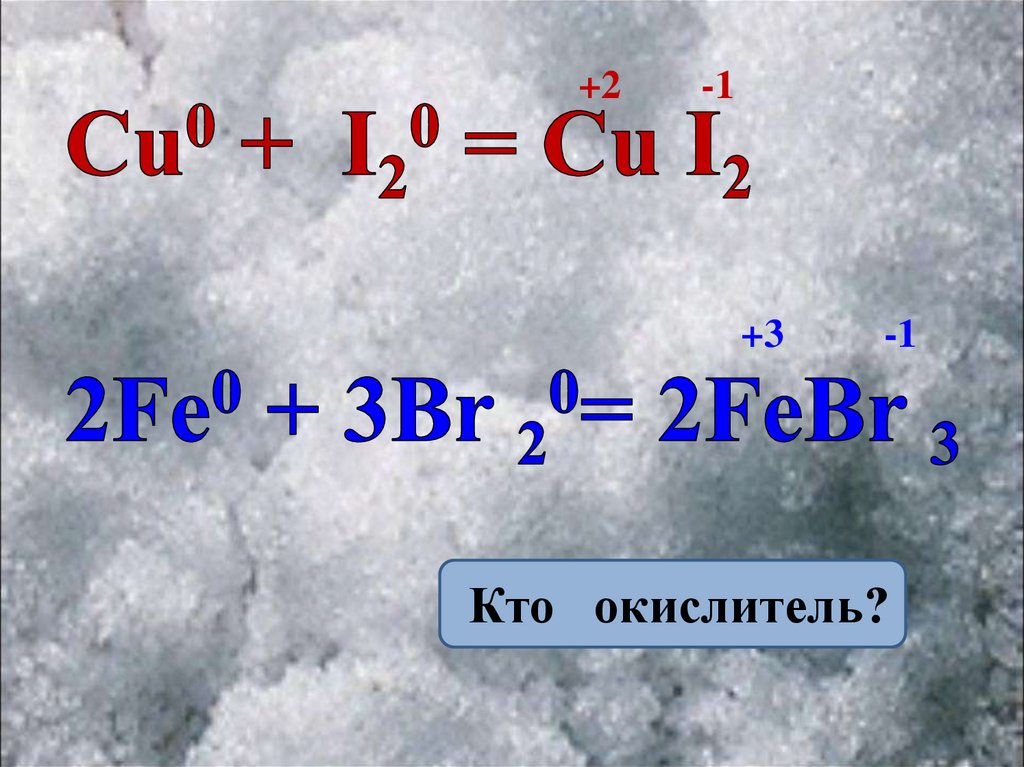






 chemistry
chemistry








