Similar presentations:
Галогены. Общая характеристика галогенов
1. Галогены. Общая характеристика галогенов.
ГАЛОГЕНЫ.ОБЩАЯ ХАРАКТЕРИСТИКА ГАЛОГЕНОВ.
2. Галогены расположены в главной подгруппе VII группы ПСХЭ Д.И. Менделеева
ГАЛОГЕНЫ РАСПОЛОЖЕНЫ В ГЛАВНОЙПОДГРУППЕ VII ГРУППЫ ПСХЭ Д.И.
МЕНДЕЛЕЕВА
IV
V
VI
VII
VIII
He
C
N
O
F
Ne
Si
P
S
CI
Ar
Ti
V
Ge
Zr
Cr
As
Nb
Sn
Hf
Se
Mo
Sb
Ta
Pb
Mn
Br
Tc
Te
W
Bi
Fe
Ru
I
Re
Po
Kr
Xe
Os
At
Rn
3. Галогены
ГАЛОГЕНЫ«рождающие соли»
4. Распространенность галогенов в природе
РАСПРОСТРАНЕННОСТЬ ГАЛОГЕНОВ ВПРИРОДЕ
5.
Фтор в природефлюорит
чечевица
лук
6.
Хлор в природедобыча соли
галит
сильвин
морская вода
7.
Бром в природеморская вода
подземные воды
водоросли морские животные
воды горных озёр
8.
Йод в природеморская вода
ламинария
креветки
горбуша
кальмар
камбала
9.
Астат в природеВ поверхностном слое земной коры толщиной
1,6 км содержится всего 70 мг астата.
Астат – «призрак».
Применяется для лечения заболеваний
щитовидной железы.
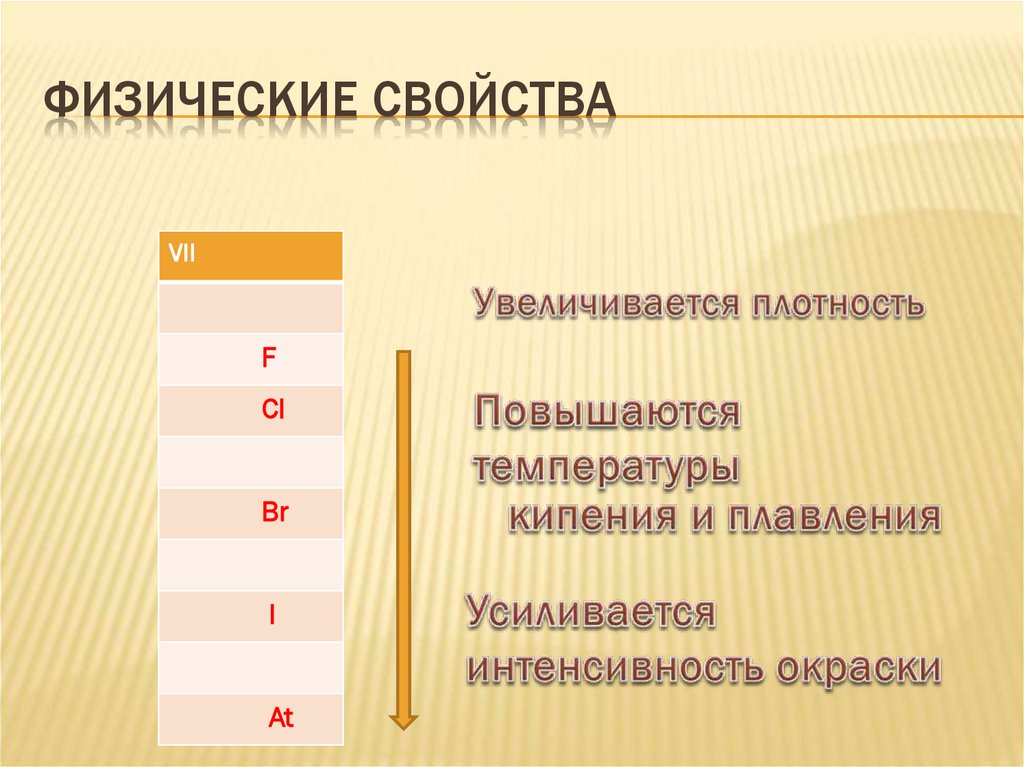
10. Физические свойства
ФИЗИЧЕСКИЕ СВОЙСТВАVII
F
CI
Br
I
At
11. Физические свойства
ФИЗИЧЕСКИЕ СВОЙСТВАVII
F
CI
Br
I
At
12. Физические свойства
ФИЗИЧЕСКИЕ СВОЙСТВАVII
F
CI
Br
I
At
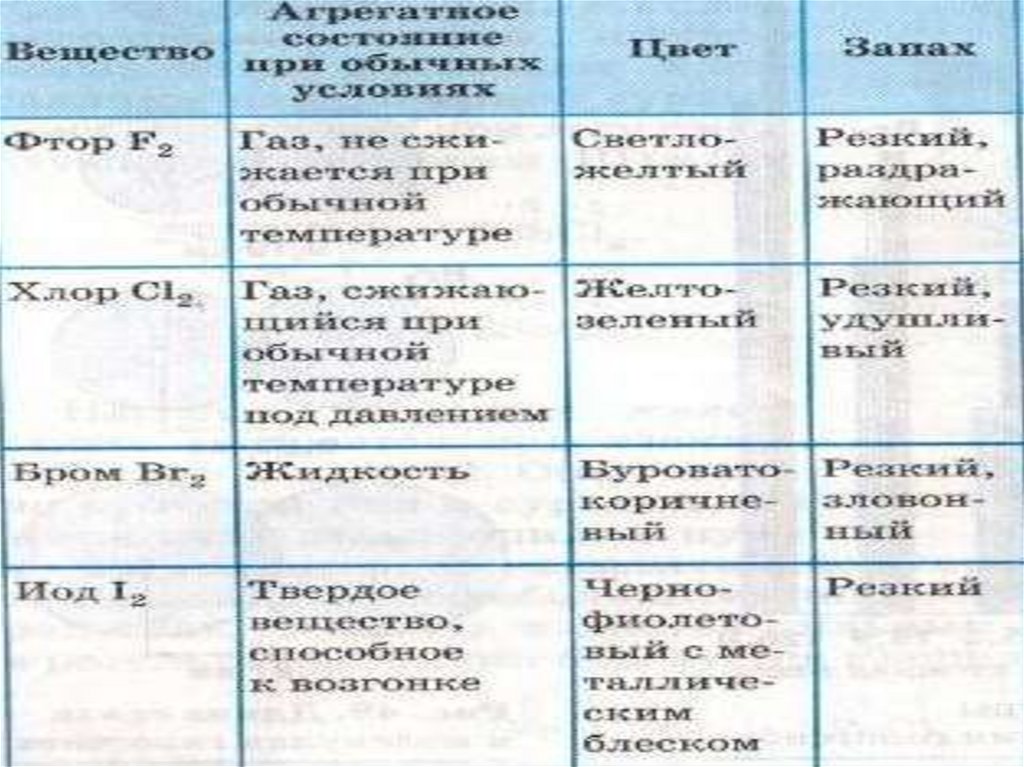
13. Фтор
ФТОРF 2
Ядовитый
газ
светлозелёного
цвета
14. Хлор
CI2 Ядовитыйгаз
жёлтозеленого
цвета
ХЛОР
15. Бром
БРОМBr2
Токсичная
тяжёлая
жидкость
красно- бурого
цвета
16. йод
I2 –Твёрдое кристаллическое
вещество
с металлическим
блеском
При нагревании образует
пары фиолетового цвета
ЙОД
17.
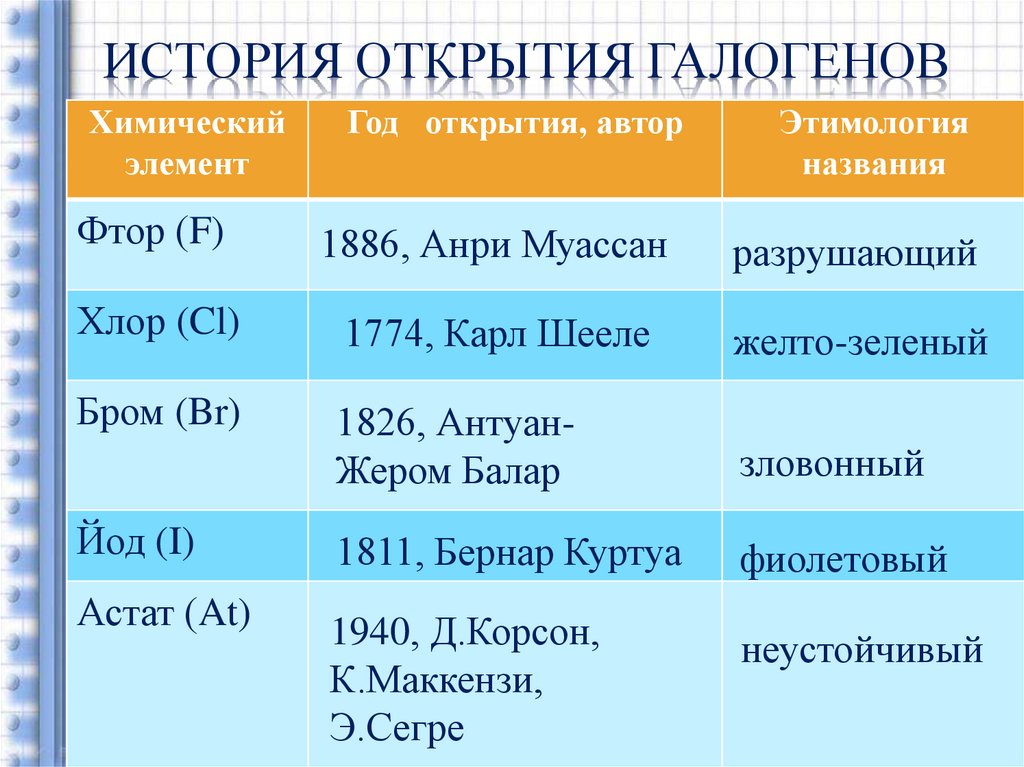
18. История открытия галогенов
ИСТОРИЯ ОТКРЫТИЯ ГАЛОГЕНОВХимический
элемент
Год открытия, автор
Этимология
названия
Фтор (F)
1886, Анри Муассан
разрушающий
Хлор (Cl)
1774, Карл Шееле
желто-зеленый
Бром (Br)
1826, АнтуанЖером Балар
зловонный
Йод (I)
1811, Бернар Куртуа
фиолетовый
Астат (At)
1940, Д.Корсон,
К.Маккензи,
Э.Сегре
неустойчивый
19.
Внимание! Все галогены являютсяядовитыми веществами.
Вдыхание паров галогенов вызывает
раздражение дыхательных органов, в
больших количествах они могут
вызвать удушье, вплоть до летального
исхода. Кроме того, фтор и хлор
вызывают ожоги кожи.
20. Повторение:
ПОВТОРЕНИЕ:На внешнем энергетическом уровне
галогены содержат 7 электронов.
В главной подгруппе с увеличением зарядов
ядер, увеличиваются радиусы атомов,
нарастают восстановительные свойства.
Возможные степени окисления: -1, +7.
Ковалентная неполярная связь
Молекулярная кристаллическая решетка.
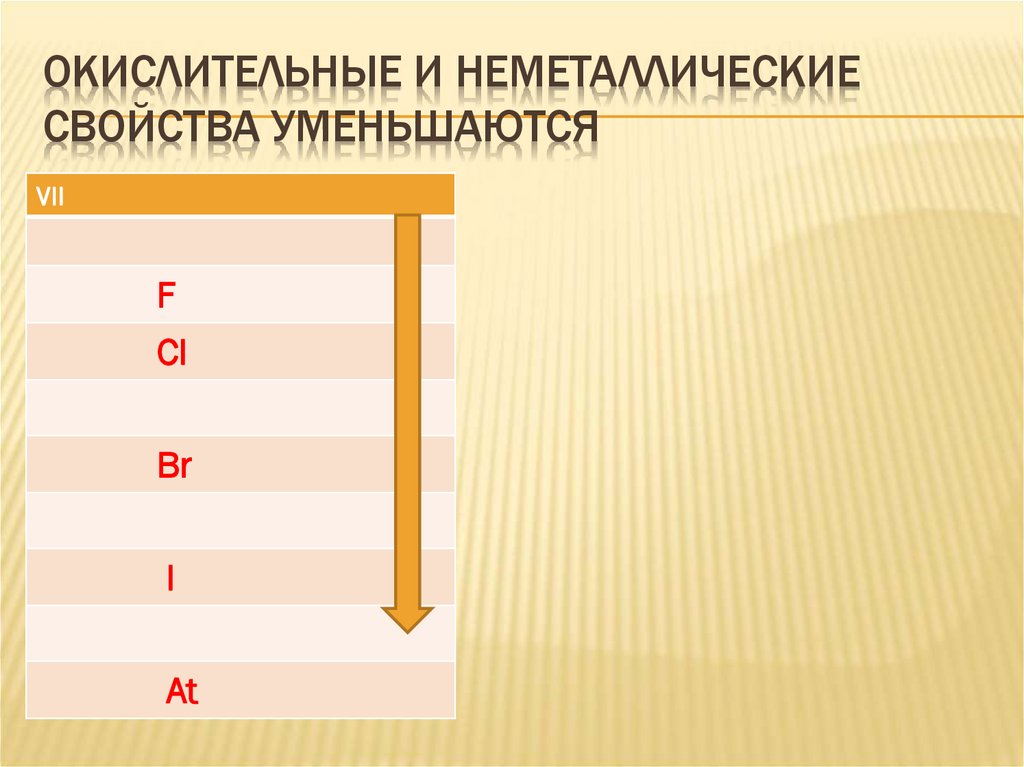
21. Окислительные и неметаллические свойства уменьшаются
ОКИСЛИТЕЛЬНЫЕ И НЕМЕТАЛЛИЧЕСКИЕСВОЙСТВА УМЕНЬШАЮТСЯ
VII
F
CI
Br
I
At
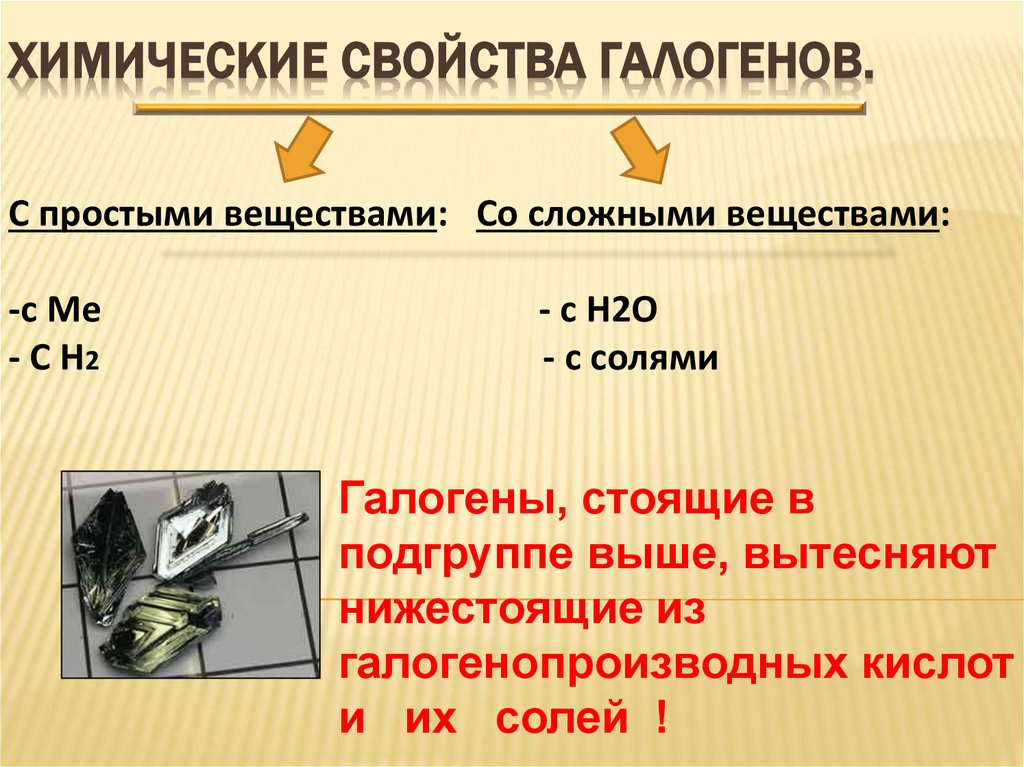
22. Химические свойства галогенов.
ХИМИЧЕСКИЕ СВОЙСТВА ГАЛОГЕНОВ.С простыми веществами: Со сложными веществами:
-с Ме
- С Н2
- с Н2О
- с солями
Галогены, стоящие в
подгруппе выше, вытесняют
нижестоящие из
галогенопроизводных кислот
и их солей !
23. Более активный галоген вытесняет менее активный из его соединений с металлами и водородом
БОЛЕЕ АКТИВНЫЙ ГАЛОГЕН ВЫТЕСНЯЕТМЕНЕЕ АКТИВНЫЙ ИЗ ЕГО СОЕДИНЕНИЙ С
МЕТАЛЛАМИ И ВОДОРОДОМ
2KI + Br2
= 2 KBr + I2 ,
но KBr + I2
24. Летучие водородные соединения
ЛЕТУЧИЕ ВОДОРОДНЫЕ СОЕДИНЕНИЯHF HCI HBr HI
25. Получение:
ПОЛУЧЕНИЕ:Промышленный способ:
все галогены можно получить электролизом
расплавов или растворов их солей.
элетро .ток
2NaCl = 2Na +Cl2
расплав
элетро .ток
2NaCl+2H2O = H2+Cl2+ 2NaOH
раствор
26. Лабораторный способ получения
ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯсуществуют различные
способы получения
галогенов в лаборатории
MnO2+4HCl
= MnCl2+Cl2+2H2O
или
2KMnO4+16HCl=2MnCl2+5Cl2+2KCl+8H2O
27.
Фтор-F21.Для получения HF
2 Для получения фреона
3 Для получения веществ, иcполь. в
борьбе с вредителями с/х
4. Для получения тефлона
Хлор-Cl2
1 Для получения медикаментов,
пластмасс, красителей.
2.Для отбеливания тканей и
бумаги
3. Для обеззараживания
питьевой воды.
Бром-Br2
1.Для получения различных
лекарств, исполь. при лечении
нервных заболеваний
2.Для изготовления
фотобумаги.
Иод-J2
Используют в медицине для
борьбы с заболеваниями
щитовидной железы и получения
иодной настойки (5-10% р-ра
иода в спирте)
28. Подготовиться к самостоятельной работе по Презентации, § 11 , письменно упражнения 6а стр. 67.
Домашнее заданиеПОДГОТОВИТЬСЯ К САМОСТОЯТЕЛЬНОЙ
РАБОТЕ ПО ПРЕЗЕНТАЦИИ, § 11 , ПИСЬМЕННО
УПРАЖНЕНИЯ 6А СТР. 67.






















 chemistry
chemistry








