Similar presentations:
Галогены. Общая характеристика галогенов
1. Галогены. Общая характеристика галогенов.
2. Цель урока:
Повторить свойства металлов и неметалловИзучить строениеатомов, свойства галогенов на
основании их сравнительной характеристики.
3.
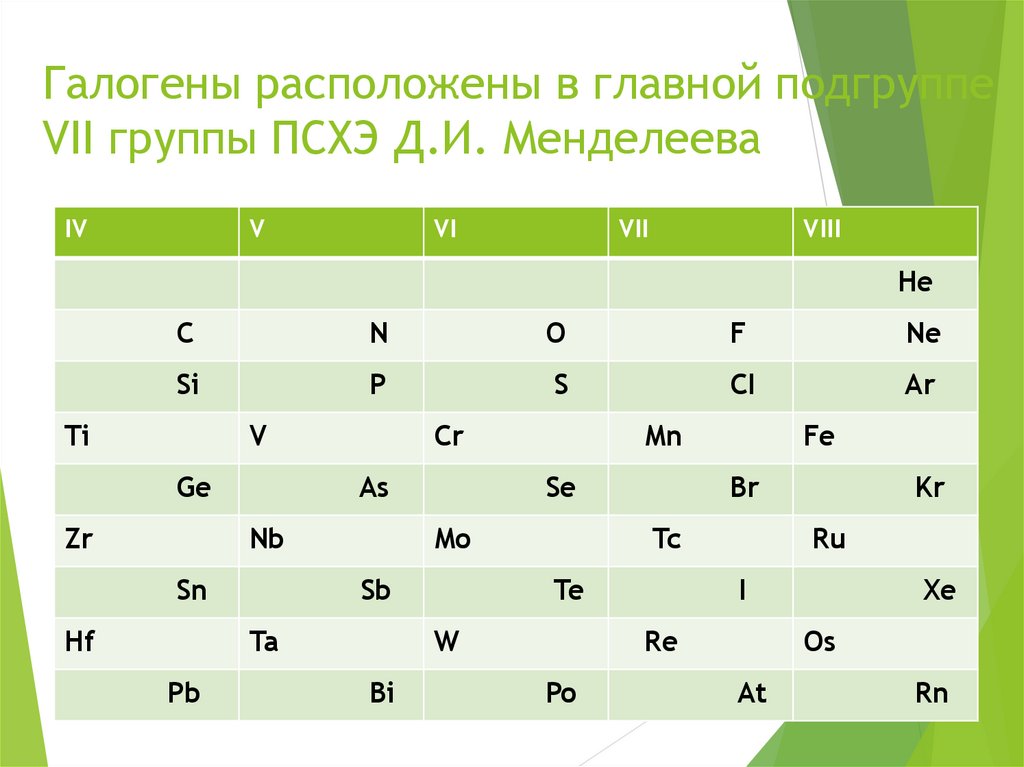
4. Галогены расположены в главной подгруппе VII группы ПСХЭ Д.И. Менделеева
IVV
VI
VII
VIII
He
C
N
O
F
Ne
Si
P
S
CI
Ar
Ti
V
Ge
Zr
Cr
As
Nb
Sn
Hf
Se
Mo
Sb
Ta
Pb
Mn
Br
Tc
Te
W
Bi
Fe
Ru
I
Re
Po
Kr
Xe
Os
At
Rn
5. Галогены
«рождающие соли»6. Распространенность галогенов в природе
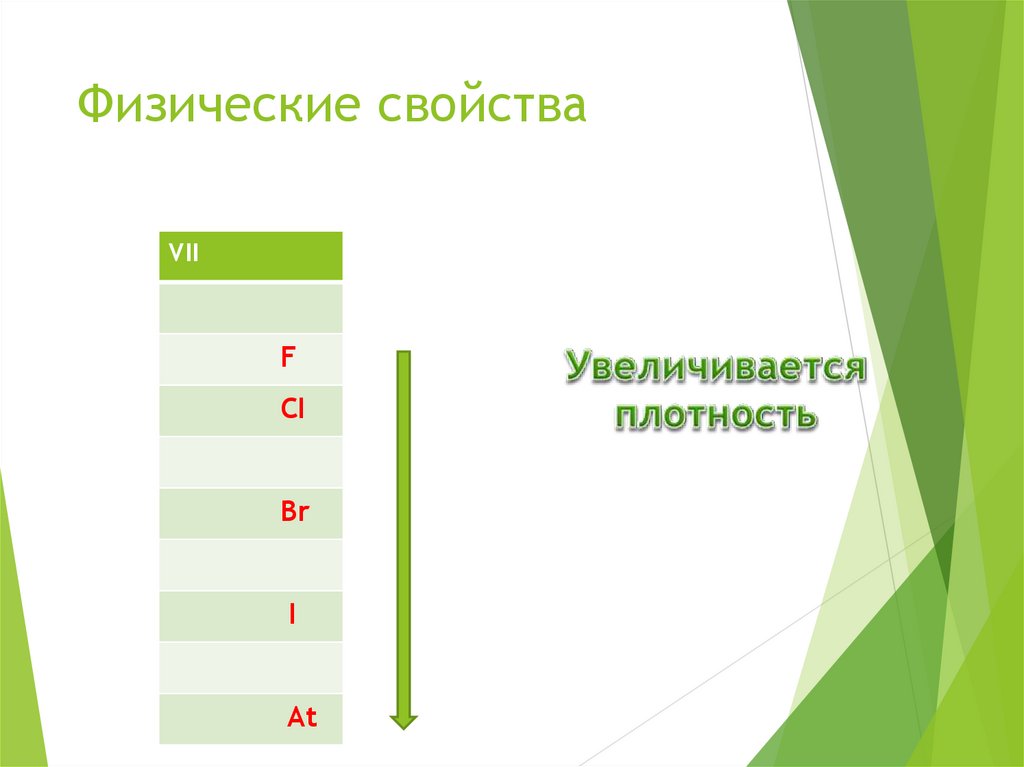
7. Физические свойства
VIIF
CI
Br
I
At
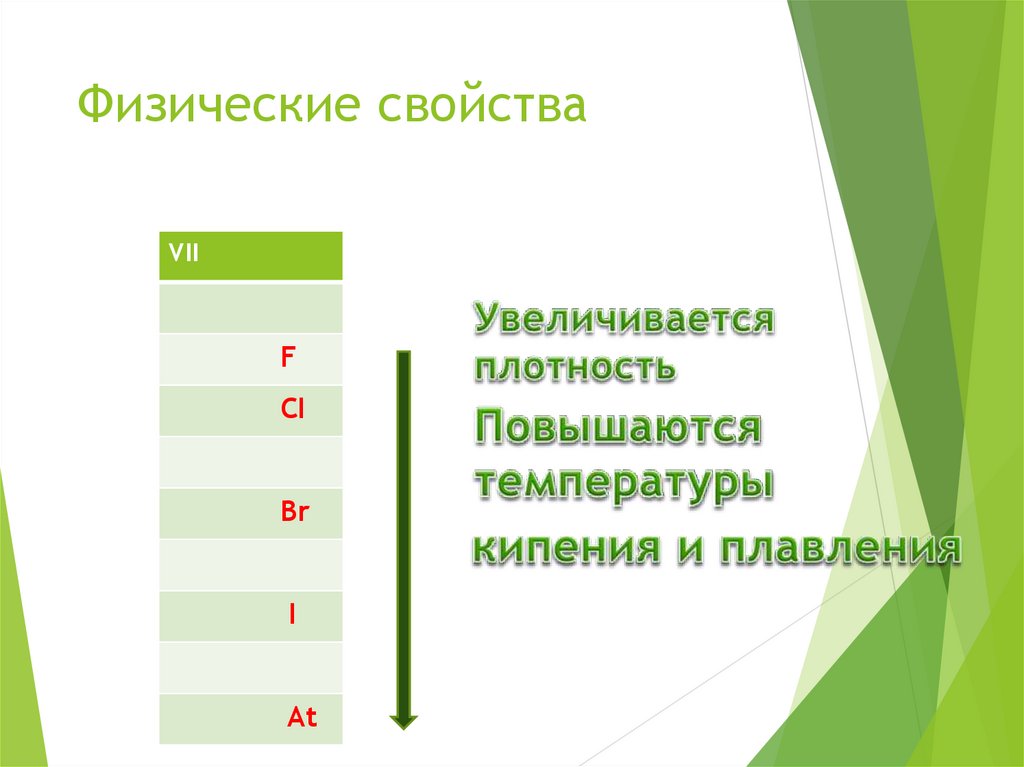
8. Физические свойства
VIIF
CI
Br
I
At
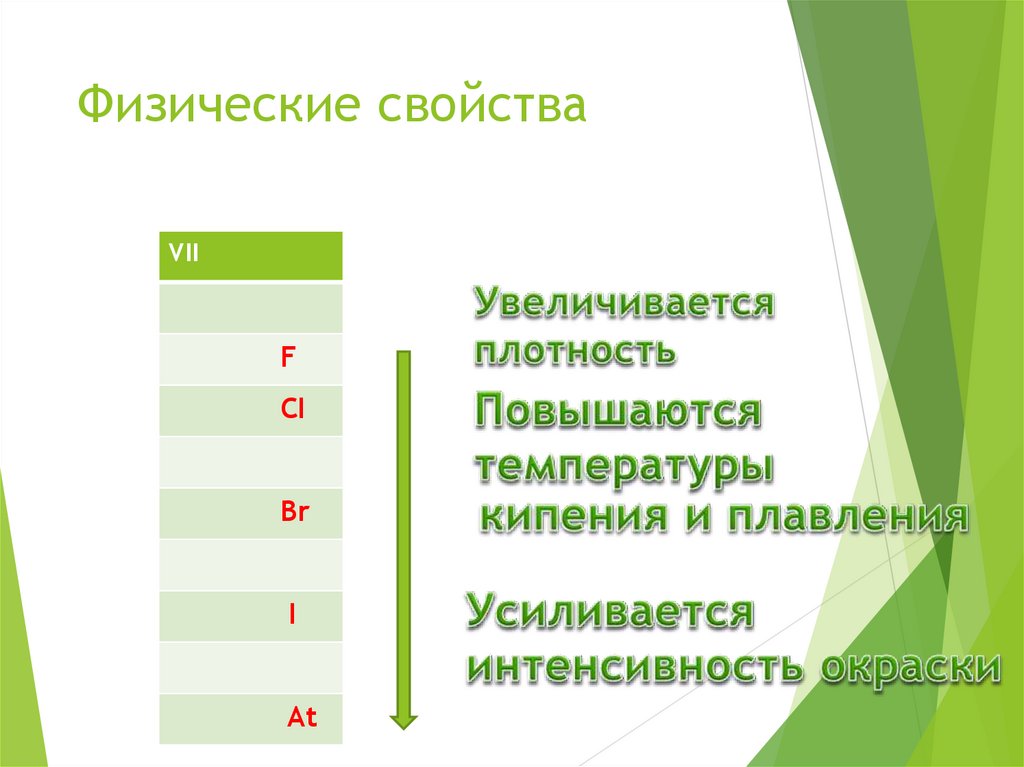
9. Физические свойства
VIIF
CI
Br
I
At
10. Фтор
F2Ядовитый
газ
светлозелёного
цвета
11. Хлор
CI2Ядовитый
газ
жёлтозеленого цвета
12. Бром
Br2
Токсичная
тяжёлая
жидкость
краснобурого
цвета
13. йод
I2 –Твёрдое
кристаллическое
вещество
с металлическим
блеском
При нагревании
образует пары
фиолетового цвета
14. Ответьте на вопросы.
Число электронов на внешнем энергетическомуровне атома;
Изменение радиуса атомов и окислительновосстановительных свойств галогенов в подгруппе;
Возможные степени окисления.
Тип химической связи
Тип кристаллической решетки
15. Проверка:
На внешнем энергетическом уровне галогенысодержат 7 электронов.
В главной подгруппе с увеличением зарядов ядер,
увеличиваются радиусы атомов, нарастают
восстановительные свойства.
Возможные степени окисления: -1, +7.
Ковалентная неполярная связь
Молекулярная кристаллическая решетка.
16. Химические свойства
17. Окислительные и неметаллические свойства уменьшаются
Окислительные инеметаллические
свойства
VII
уменьшаются
F
CI
Br
I
18. Более активный галоген вытесняет менее активный из его соединений с металлами и водородом
2KI + Br2= 2 KBr + I2
но KBr + I2
,
19. Летучие водородные соединения
HF HCI HBr HI20. Л. О. №2 Вытеснение одних галогенов другими из их соединений Оформите результаты работы в виде таблицы
Что делаю?Что наблюдаю?
Запишите уравнения реакций
Сделайте вывод . Как изменяются
окислительные свойства галогенов?
21. Л. О. №3 Растворимость йода в органических растворителях Оформите результаты работы в виде таблицы
Что делаю ?Что наблюдаю?
Запишите уравнения реакций.
Сделайте вывод о растворимости
галогенов.
22. Вопросы и задания
Перечислите галогены.Где в ПСХЭ располагаются галогены?
Чему равно число валентных электронов в атомах
галогенов ?
23. Вопросы и задания
Сопоставьте :Хлор
красно – бурая жидкость
Бром
светло – зеленый газ
Йод
жёлто – зелёный газ
Фтор
твёрдый с металлическим
блеском пары фиолетового цвета
24. Вопросы и задания
Дополните:Самый сильный неметалл –
Самая сильная бескислородная кислота –
Как изменяются окислительные свойства галогенов?
25. Источники информации
Изображение хлора и брома:http://ru.wikipedia.org/wiki/
Изображение периодической системы д.И.
Менделеева:
http://steelbros.ru/threads/%D…
Изображение морского прибоя:
http://misterforex.ru/gdefon/w…
Изображение флюорита:
http://geo.web.ru/




















 chemistry
chemistry








