Similar presentations:
Тема 1.11-1
1.
Тема 1.11Гидроксикислоты.
2. Классификация. Номенклатура.
Гидроксикислоты – производные карбоновых кислот, у которыходин или несколько атомов водорода в радикале замещены на
гидроксильную группу –ОН.
Классификация.
I. В зависимости от строения радикала различают
алифатические (спиртокислоты) и ароматические(фенолокислоты)
II. По взаимному расположению карбоксильных и гидроксильных
групп различают α, β, γ, δ и т.д. гидроксикислоты
III. По количеству карбоксильных групп различают основность
гидроксикислот (одно-, двух-, трехосновные)
IV. По количеству гидроксильных групп различают атомность
гидроксикислот (одно-, двух-, трех-, четырехатомные)
3. Классификация. Номенклатура.
Номенклатура.1) По заместительной номенклатуре ИЮПАК название
производят от названия соответствующей карбоновой
кислоты с префиксом «гидрокси», отмечая положение
ОН-группы арабской цифрой.
2) Используют тривиальные названия
3) Используют локанты α, β, γ и т.д. (в настоящее время
применяется редко).
4. Отдельные представители
Отдельные представители:1. Молочная кислота (2-гидроксипропановая кислота,
α-гидроксипропионовая кислота)
CH3
CH
OH
COOH
Алифатическая, одноосновная, двухатомная.
Соли – лактаты.
Молочная кислота образуется в результате молочнокислого
брожения углеводов, содержится в кислом молоке, квашеной
капусте, различных солениях. L(+) молочная кислота при
интенсивной физической работе накапливается в мышцах.
Лактаты кальция и железа(II) применяются в качестве
лекарственных препаратов при заболевания, связанных с
недостатком кальция в организме и при анемиях.
5. Отдельные представители
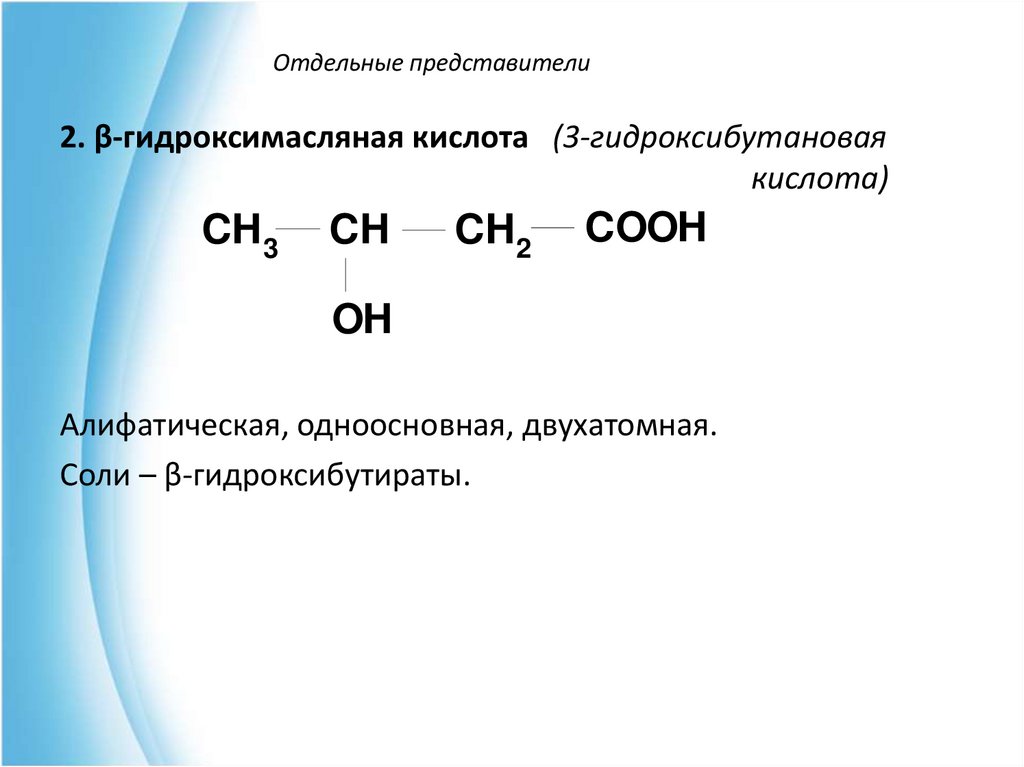
2. β-гидроксимасляная кислота (3-гидроксибутановаякислота)
CH3
CH
CH2
COOH
OH
Алифатическая, одноосновная, двухатомная.
Соли – β-гидроксибутираты.
6. Отдельные представители
3. Яблочная кислота (2-гидроксибутандиовая кислота,α-гидроксиянтарная кислота)
HOOC
CH
CH2
COOH
OH
Алифатическая, двухосновная, трехатомная.
Соли – малаты.
Содержится в незрелых яблоках, ягодах рябины, клюквы,
малины.
В природе встречается L(-) яблочная кислота. В живых
организмах образуется в процессе обмена углеводов, принимает
участие в цикле трикарбоновых кислот(цикл Кребса).
7. Отдельные представители
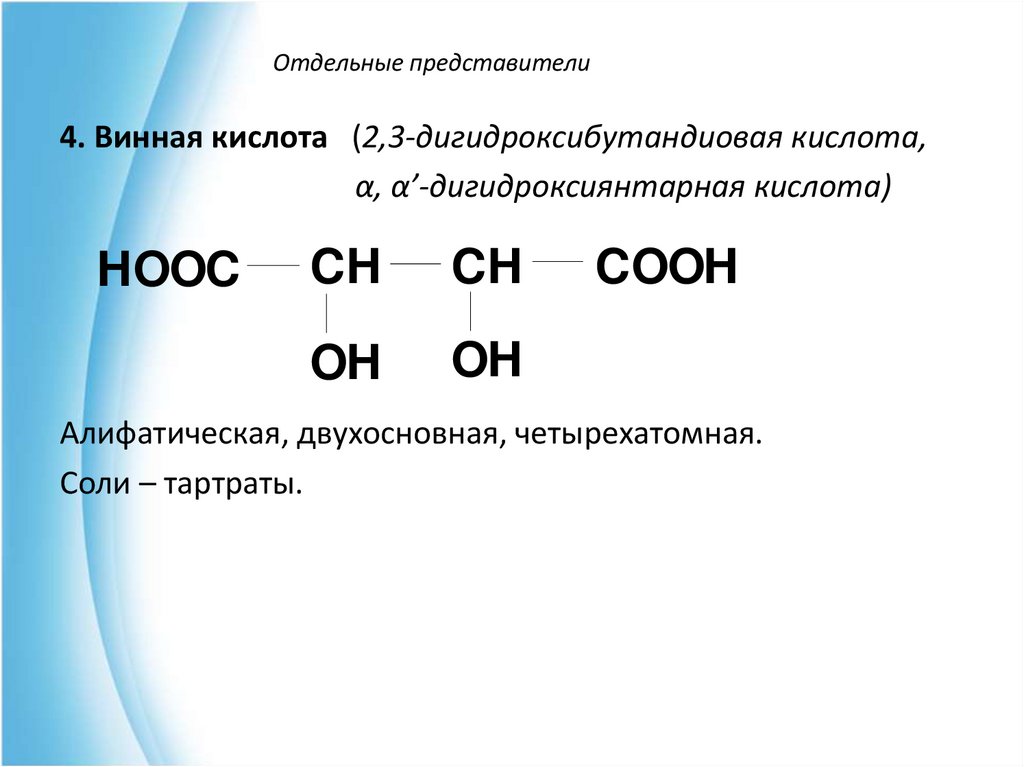
4. Винная кислота (2,3-дигидроксибутандиовая кислота,α, α’-дигидроксиянтарная кислота)
HOOC
CH
CH
OH
OH
COOH
Алифатическая, двухосновная, четырехатомная.
Соли – тартраты.
8. Отдельные представители
Калиево-натриевая соль винной кислоты называетсясегнетовой (сеньетовой) солью:
При взаимодействии с гидроксидом меди (II) в щелочной среде
сегнетовая соль образует комплекс ярко-синего цвета,
получивший название реактив Фелинга, применяемый для
качественного обнаружения альдегидной группы.
9. Отдельные представители
5. Лимонная кислота(2-гидроксипропан-1,2,3-трикарбоновая кислота)
CH 2
HO
C
CH 2
COOH
COOH
COOH
Алифатическая, трехосновная, четырехатомная.
Соли - цитраты.
Широко используются в пищевой промышленности и медицине,
например, тринатриевая соль - цитрат натрия применяется в
медицине для консервирования донорской крови.
10. Отдельные представители
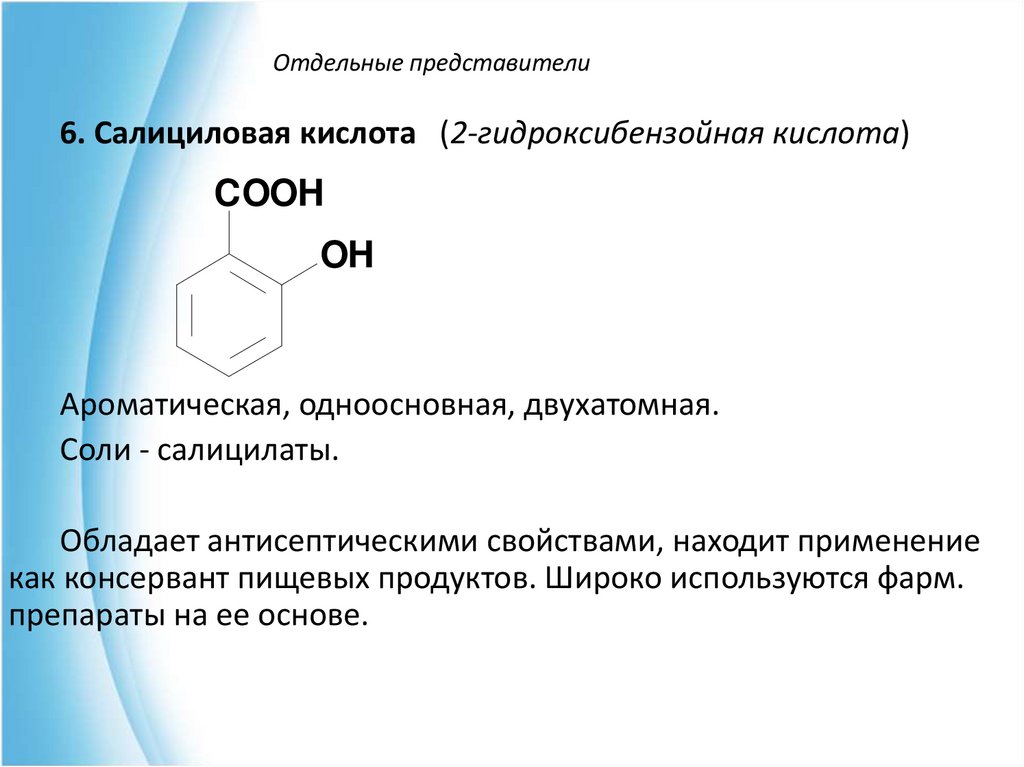
6. Салициловая кислота (2-гидроксибензойная кислота)COOH
OH
Ароматическая, одноосновная, двухатомная.
Соли - салицилаты.
Обладает антисептическими свойствами, находит применение
как консервант пищевых продуктов. Широко используются фарм.
препараты на ее основе.
11. Химические свойства.
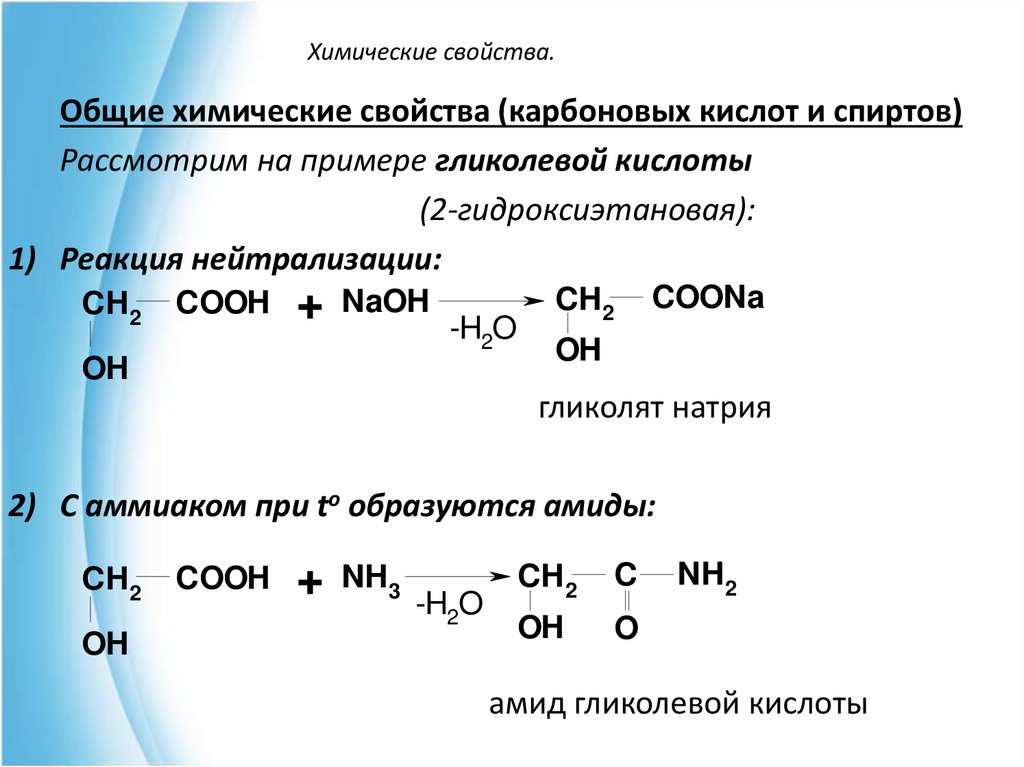
Общие химические свойства (карбоновых кислот и спиртов)Рассмотрим на примере гликолевой кислоты
(2-гидроксиэтановая):
1) Реакция нейтрализации:
CH2
COOH
+ NaOH -H O
2
OH
CH2
COONa
OH
гликолят натрия
2) С аммиаком при to образуются амиды:
CH2
COOH
+ NH3 -H O
2
OH
CH2
C
OH
O
NH2
амид гликолевой кислоты
12. Химические свойства.
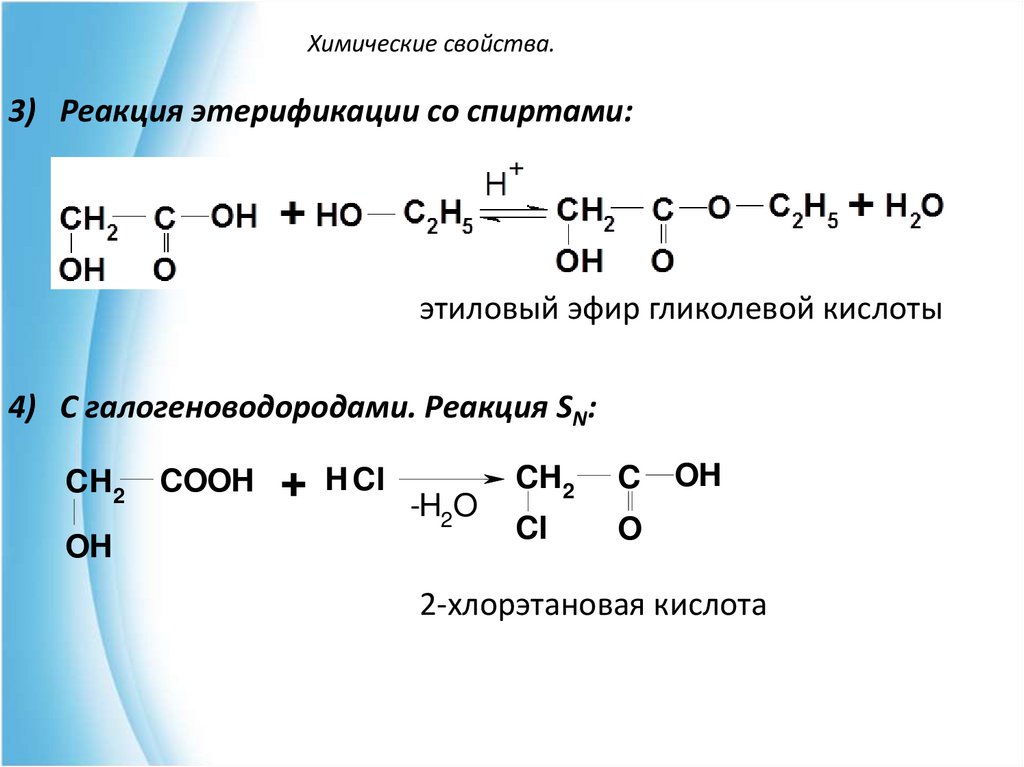
3) Реакция этерификации со спиртами:этиловый эфир гликолевой кислоты
4) С галогеноводородами. Реакция SN:
CH2
COOH
+ H Cl -H O
2
OH
CH2
C
Cl
O
OH
2-хлорэтановая кислота
13. Химические свойства.
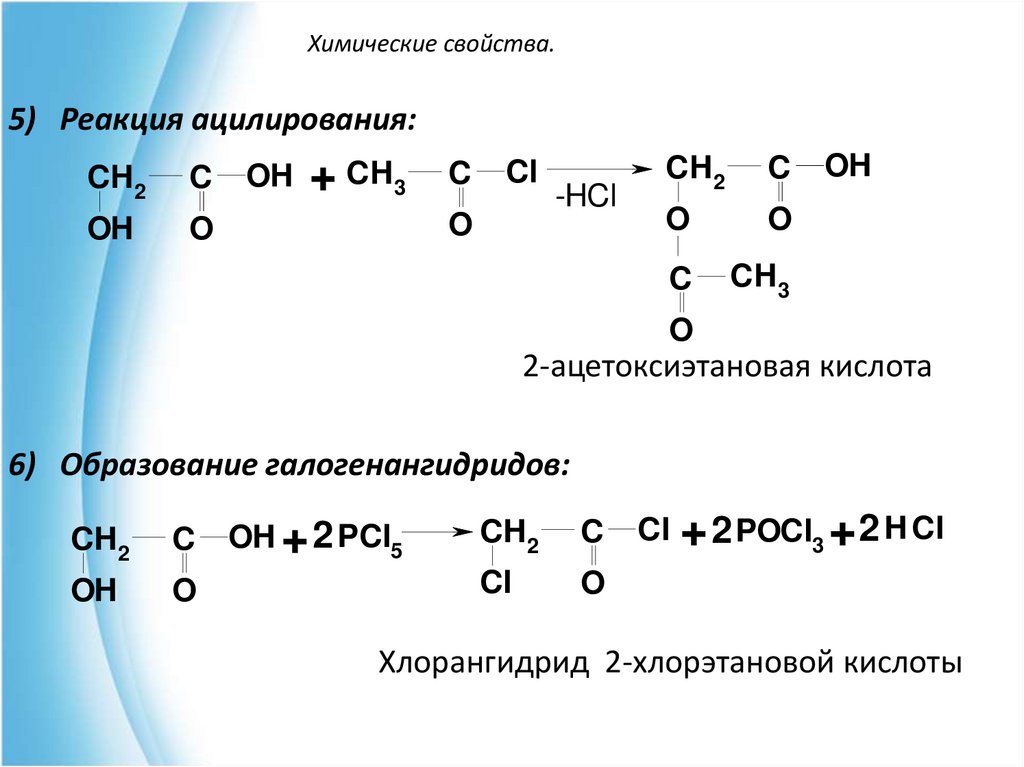
5) Реакция ацилирования:CH 2
C
OH
O
OH + CH 3
C
Cl
O
-HCl
CH 2
C
O
O
C
CH 3
OH
O
2-ацетоксиэтановая кислота
6) Образование галогенангидридов:
CH2
C
OH
O
OH + 2 PCl5
CH2
C
Cl
O
Cl + 2 POCl3 + 2 H Cl
Хлорангидрид 2-хлорэтановой кислоты
14. Химические свойства.
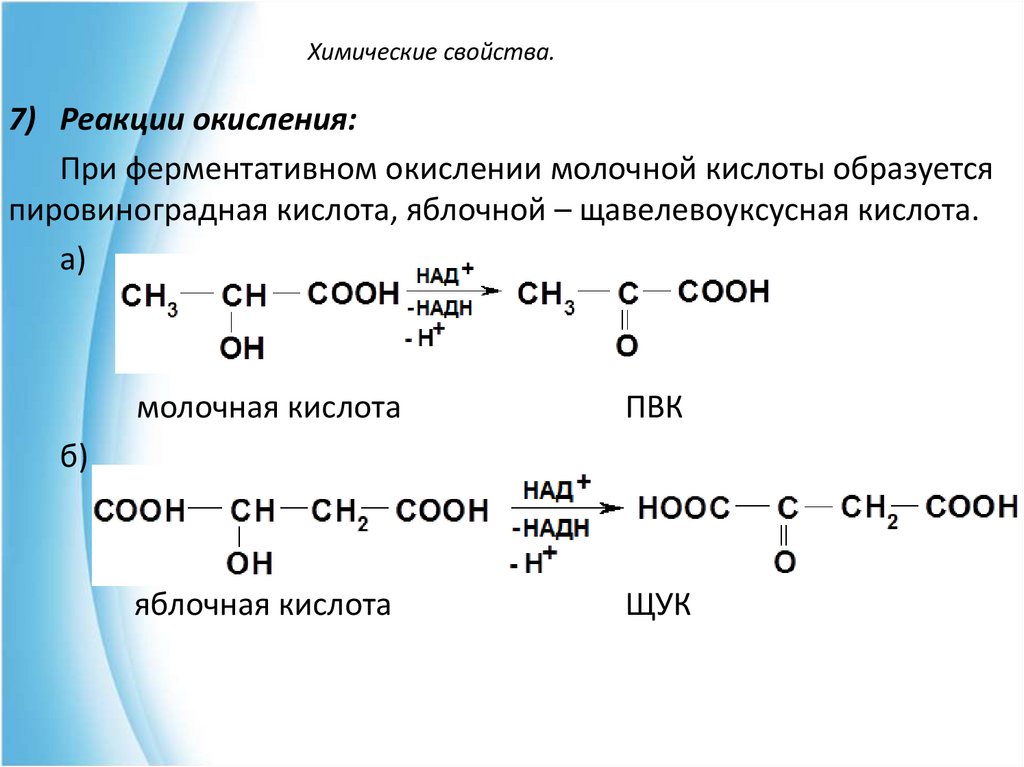
7) Реакции окисления:При ферментативном окислении молочной кислоты образуется
пировиноградная кислота, яблочной – щавелевоуксусная кислота.
а)
молочная кислота
ПВК
яблочная кислота
ЩУК
б)
15. Специфические свойства гидроксикислот.
Специфические свойства гидроксикислот(отношение к нагреванию).
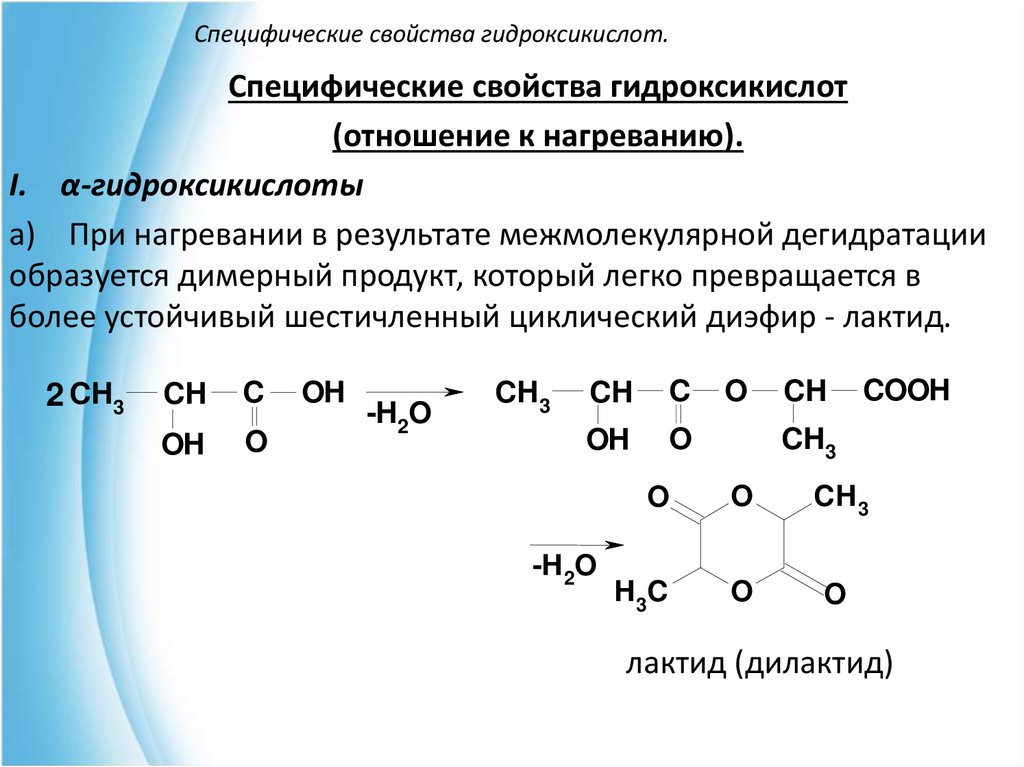
I. α-гидроксикислоты
a) При нагревании в результате межмолекулярной дегидратации
образуется димерный продукт, который легко превращается в
более устойчивый шестичленный циклический диэфир - лактид.
2 CH3
CH
C
OH
O
OH
-H2O
CH3
CH
C
OH
O
-H 2O
O
CH
COOH
CH3
O
O
CH 3
H 3C
O
O
лактид (дилактид)
16. Специфические свойства гидроксикислот.
Лактидами называются циклические эфиры, построенные издвух и более остатков гидроксикислот (не обязательно αгидроксикислот).
Название лактидов включает основу тривиального названия
гидроксикислоты, суффикс -ид и умножающий префикс ди-, три- и
т.д., указывающий число молекул, образующих лактид.
Например: Дигликолид – от гликолевой кислоты
Дилактид – от молочной кислоты
17. Специфические свойства гидроксикислот.
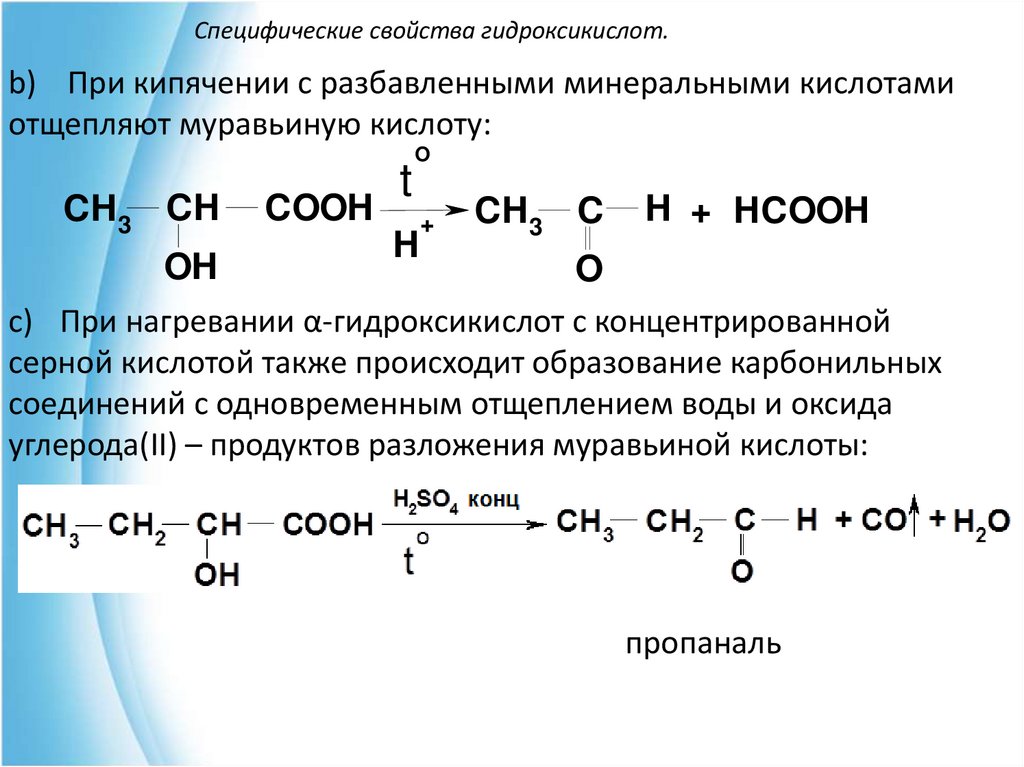
b) При кипячении с разбавленными минеральными кислотамиотщепляют муравьиную кислоту:
CH3 CH
OH
COOH
t
O
H
+
CH3 C
H + HCOOH
O
c) При нагревании α-гидроксикислот с концентрированной
серной кислотой также происходит образование карбонильных
соединений с одновременным отщеплением воды и оксида
углерода(II) – продуктов разложения муравьиной кислоты:
пропаналь
18. Специфические свойства гидроксикислот.
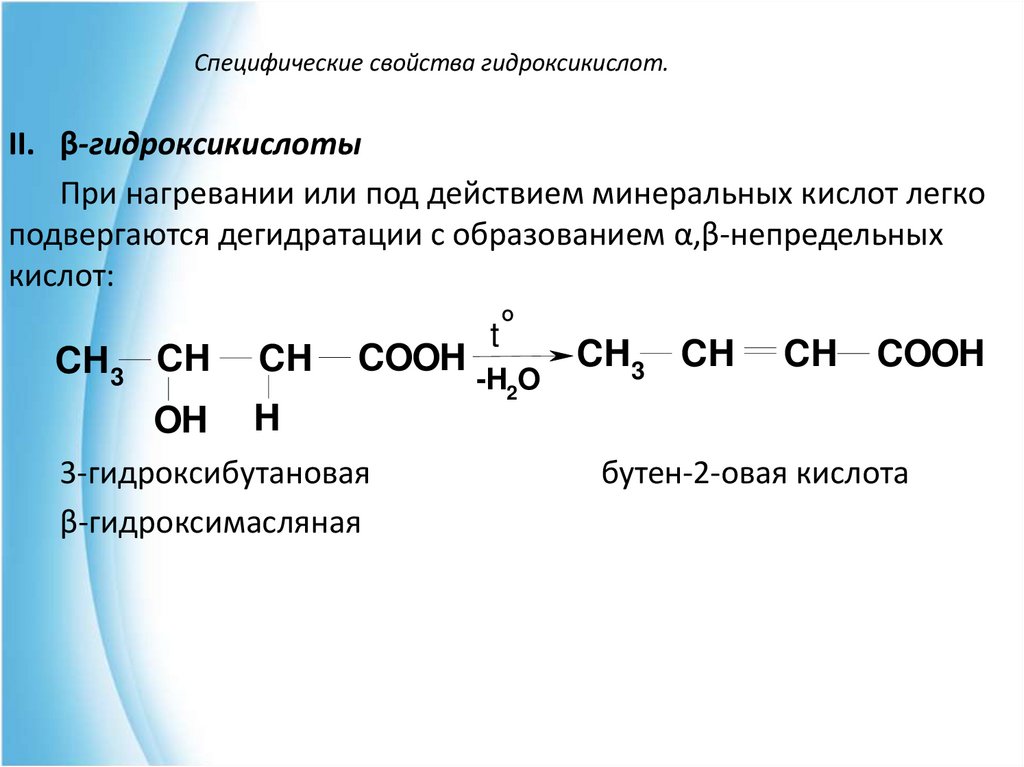
II. β-гидроксикислотыПри нагревании или под действием минеральных кислот легко
подвергаются дегидратации с образованием α,β-непредельных
кислот:
CH3 CH
OH
CH
COOH
t
O
-H2O
CH3 CH
CH
COOH
H
3-гидроксибутановая
β-гидроксимасляная
бутен-2-овая кислота
19. Специфические свойства гидроксикислот.
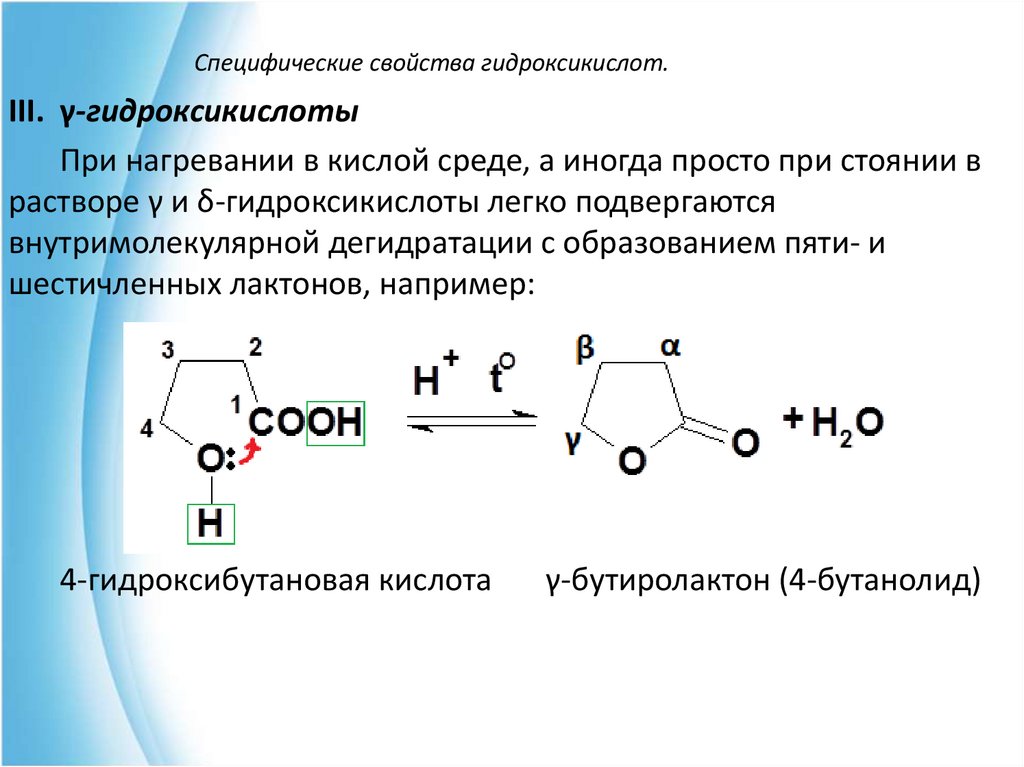
III. γ-гидроксикислотыПри нагревании в кислой среде, а иногда просто при стоянии в
растворе γ и δ-гидроксикислоты легко подвергаются
внутримолекулярной дегидратации с образованием пяти- и
шестичленных лактонов, например:
4-гидроксибутановая кислота
γ-бутиролактон (4-бутанолид)
20. Специфические свойства гидроксикислот.
Лактонами называются внутренние сложные эфирыгидроксикислот.
По номенклатуре ИЮПАК лактоны, образованные из
алифатических кислот, называют, добавляя суффикс – олид к
названию углеводорода с тем же числом атомов углерода. Цифрой
обозначают место замыкания цикла, начиная нумерацию от
карбонильного атома углерода.
Легкость образования лактонов из γ и δ-гидроксикислот
объясняется повышенной термодинамической устойчивостью пятии шестичленных циклических соединений. Циклы меньшего или
большего размера в этих условиях не образуются.
Лактоны, подобно сложным эфирам, при нагревании в кислой и
щелочной среде легко гидролизуются до соответствующих
гидроксикислот. Реакция гидролиза в щелочной среде необратима.
Наибольшую устойчивость к гидролизу проявляют δ-лактоны.
21. Ароматические гидроксикислоты.
Ароматические гидроксикислоты (фенолокислоты)Это производные ароматических карбоновых кислот, у которых
один или несколько атомов в ароматическом кольце заменены на
гидроксильные группы –ОН.
Наиболее важными для фармации являются:
1) Галловая кислота:
COOH
HO
HO
OH
3,4,5-тригидроксибензойная
кислота
Входит в состав дубильных веществ (дубовой коре, листьях чая и
др.). Водные растворы танинов – гликозидов галловой кислоты
обладают способностью свертывать и осаждать белки. На этом
основано применение танина в качестве кровоостанавливающего
средства.
22. Ароматические гидроксикислоты.
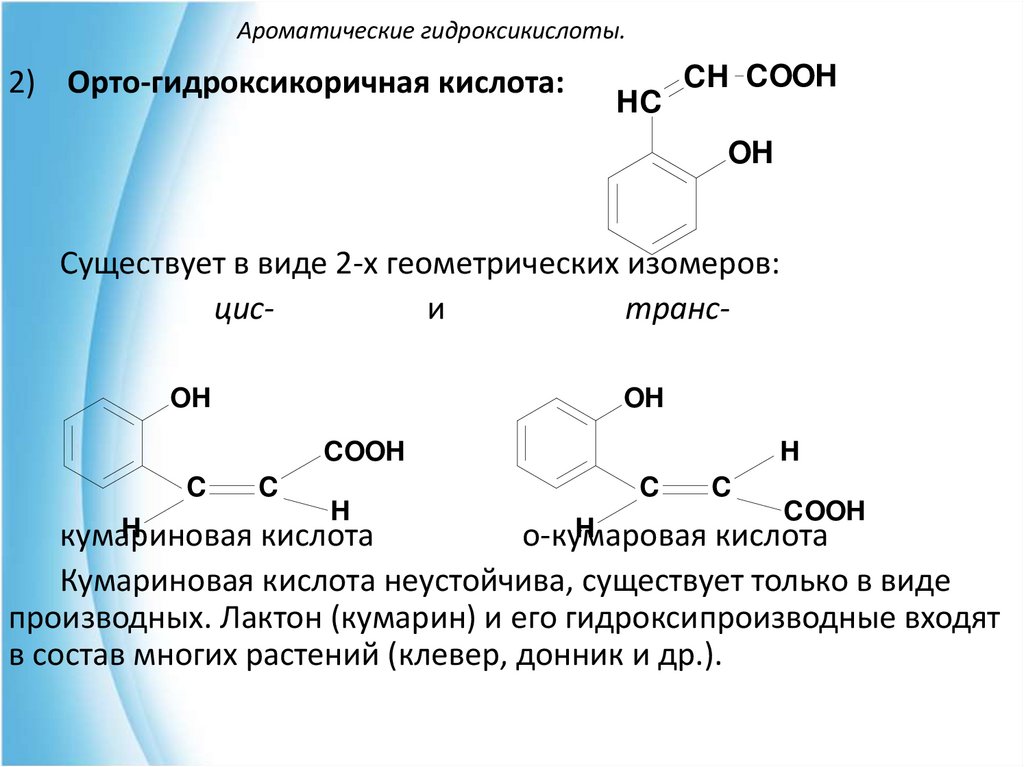
2) Орто-гидроксикоричная кислота:HC
CH COOH
OH
Существует в виде 2-х геометрических изомеров:
циси
трансOH
OH
COOH
C
C
H
H
кумариновая кислота
H
C
C
COOH
H
о-кумаровая кислота
Кумариновая кислота неустойчива, существует только в виде
производных. Лактон (кумарин) и его гидроксипроизводные входят
в состав многих растений (клевер, донник и др.).
23. Ароматические гидроксикислоты.
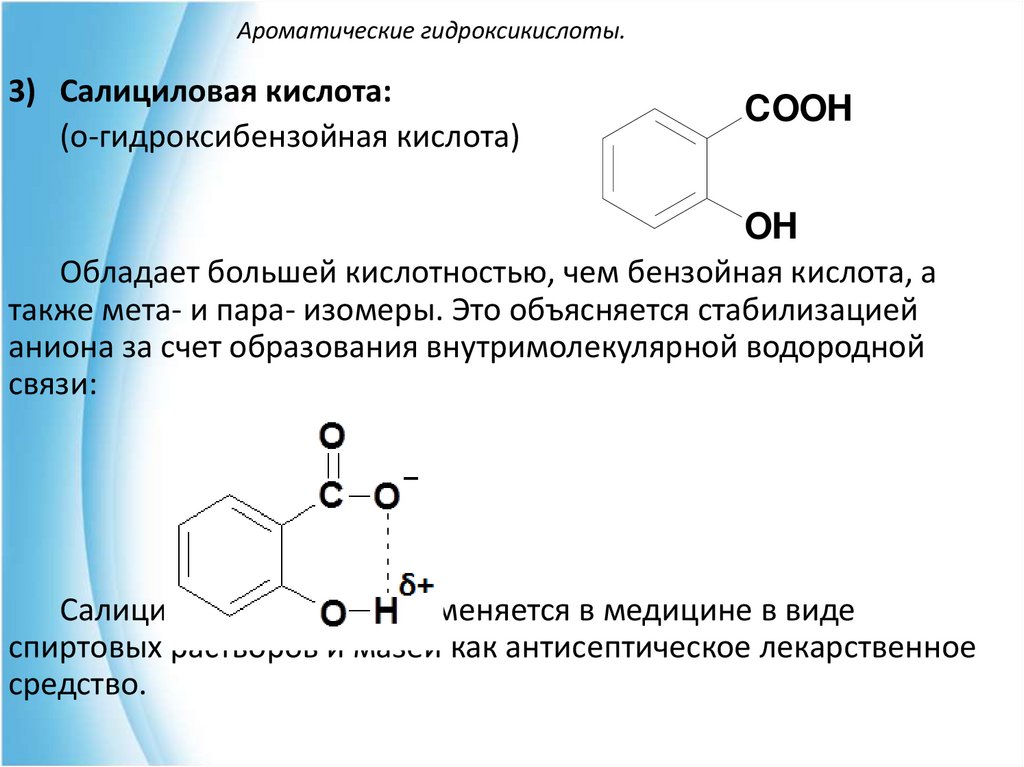
3) Салициловая кислота:(о-гидроксибензойная кислота)
COOH
OH
Обладает большей кислотностью, чем бензойная кислота, а
также мета- и пара- изомеры. Это объясняется стабилизацией
аниона за счет образования внутримолекулярной водородной
связи:
Салициловая кислота применяется в медицине в виде
спиртовых растворов и мазей как антисептическое лекарственное
средство.
24. Ароматические гидроксикислоты.
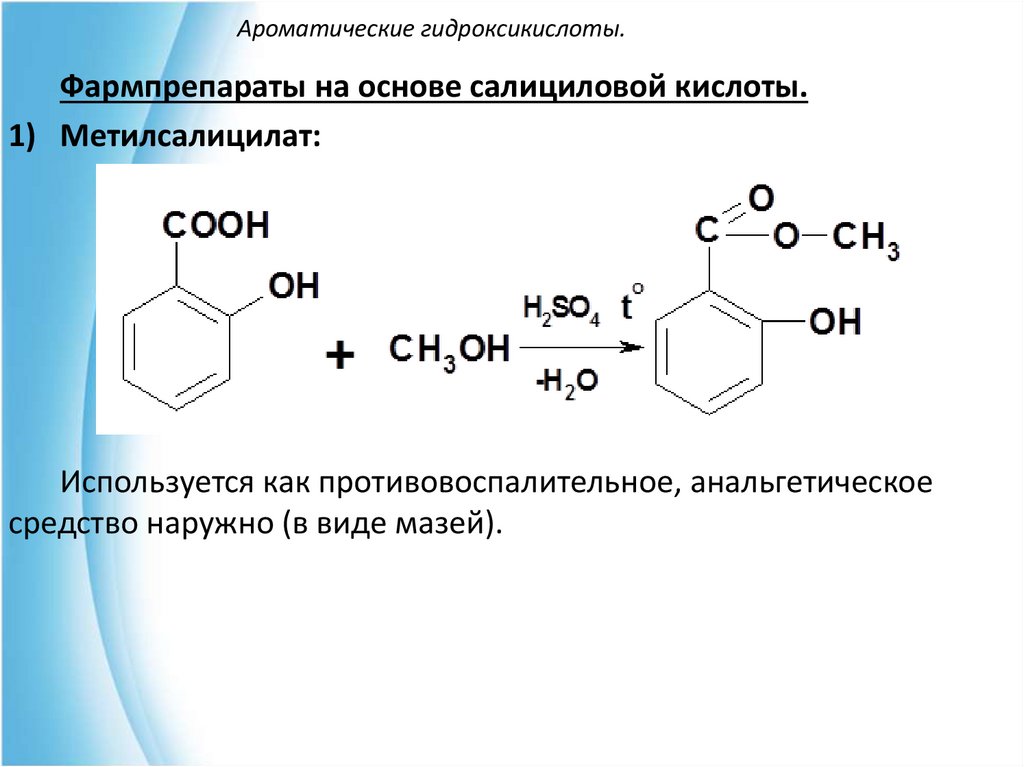
Фармпрепараты на основе салициловой кислоты.1) Метилсалицилат:
Используется как противовоспалительное, анальгетическое
средство наружно (в виде мазей).
25. Ароматические гидроксикислоты.
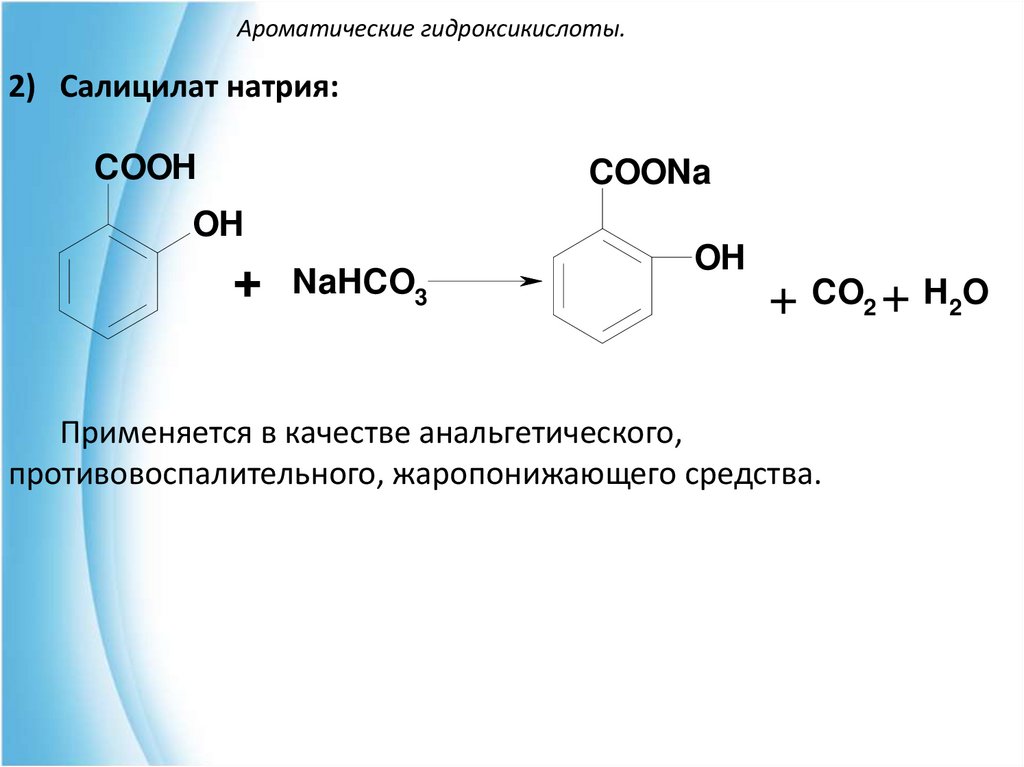
2) Салицилат натрия:COOH
COONa
OH
+ NaHCO3
OH
+ CO2 + H2O
Применяется в качестве анальгетического,
противовоспалительного, жаропонижающего средства.
26. Ароматические гидроксикислоты.
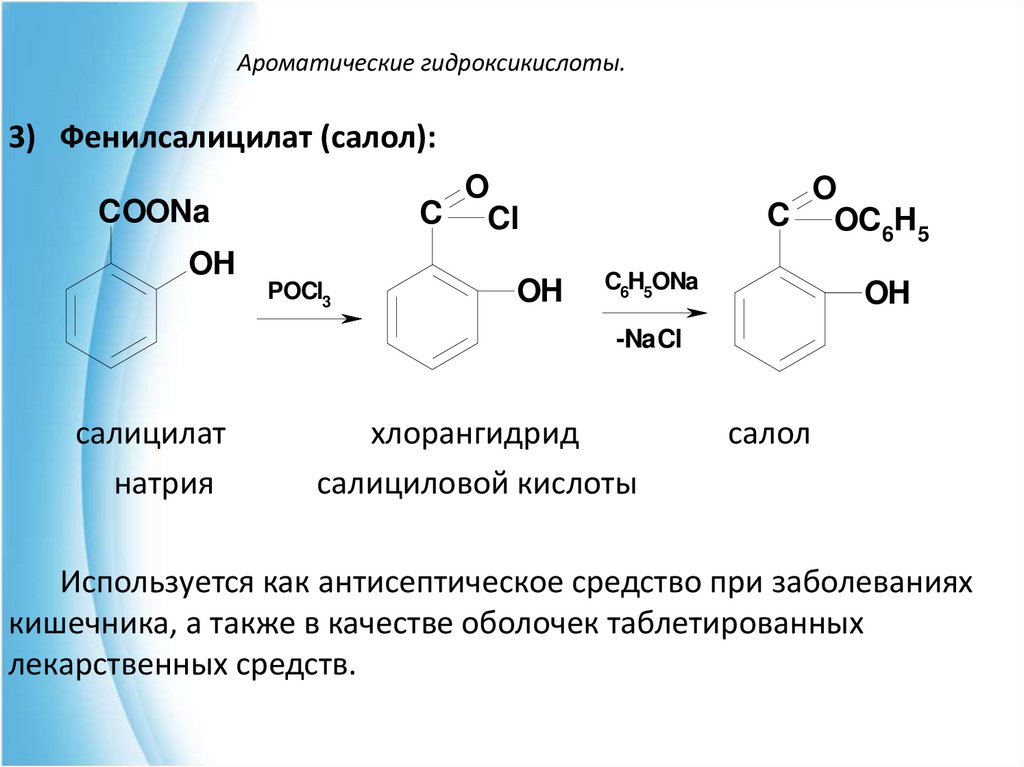
3) Фенилсалицилат (салол):O
C Cl
COONa
OH
POCl3
OH
O
C OC H
6 5
C6H5ONa
OH
-NaCl
салицилат
натрия
хлорангидрид
салициловой кислоты
салол
Используется как антисептическое средство при заболеваниях
кишечника, а также в качестве оболочек таблетированных
лекарственных средств.
27. Ароматические гидроксикислоты.
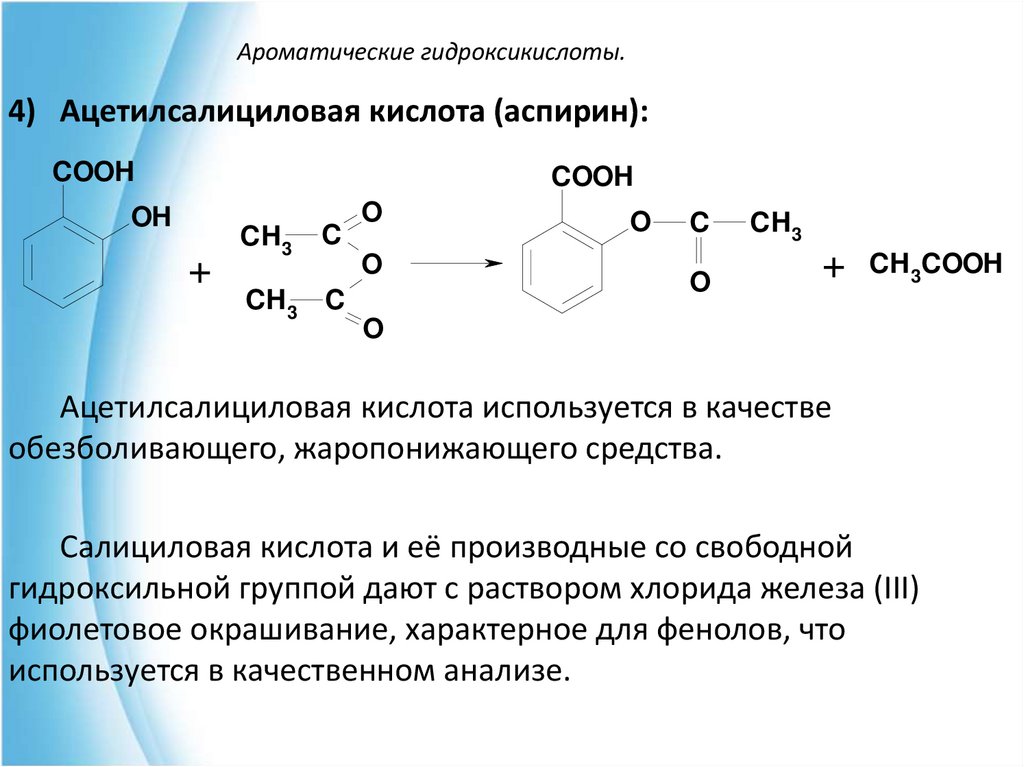
4) Ацетилсалициловая кислота (аспирин):COOH
COOH
OH
+
CH 3
C
CH 3 C
O
O
O
C
O
CH 3
+ CH3COOH
O
Ацетилсалициловая кислота используется в качестве
обезболивающего, жаропонижающего средства.
Салициловая кислота и её производные со свободной
гидроксильной группой дают с раствором хлорида железа (III)
фиолетовое окрашивание, характерное для фенолов, что
используется в качественном анализе.










 chemistry
chemistry








