Similar presentations:
Гидроксикислоты
1.
Гидроксокислоты2.
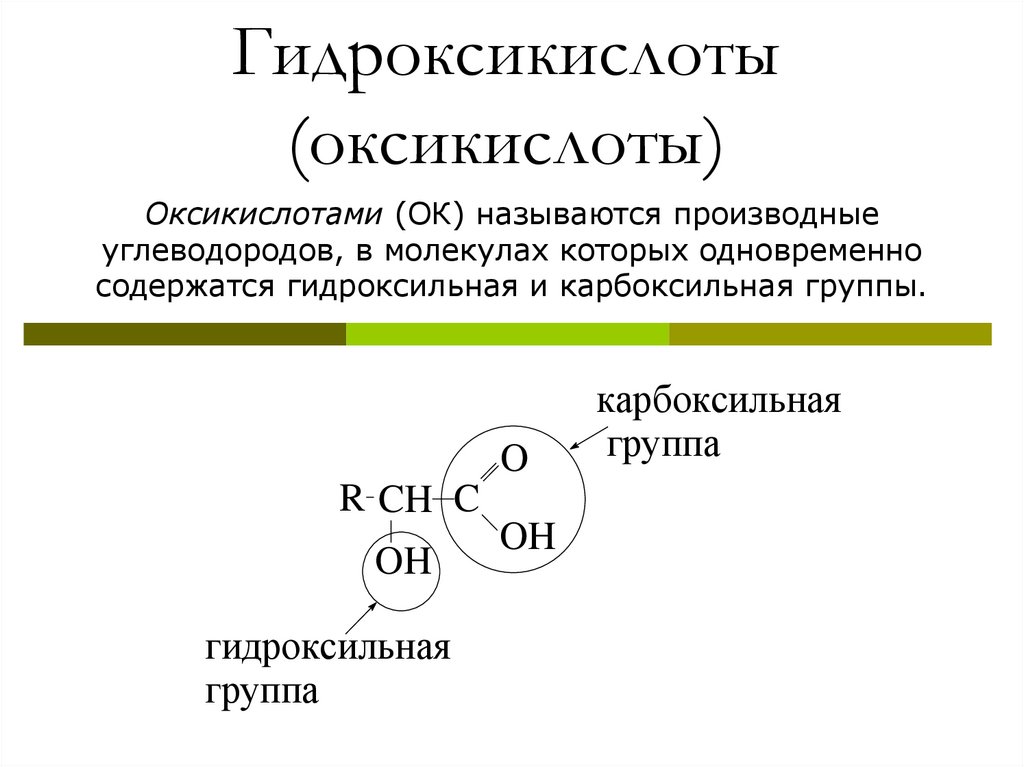
Гидроксикислоты(оксикислоты)
Оксикислотами (ОК) называются производные
углеводородов, в молекулах которых одновременно
содержатся гидроксильная и карбоксильная группы.
O
R CH C
OH
гидроксильная
группа
OH
карбоксильная
группа
3.
Классификация ОК1. По строению углеводородного радикала:
алифатические и ароматические
2. По взаимному расположению функциональных
групп различают α-, β-, γ- и т.д. ОК
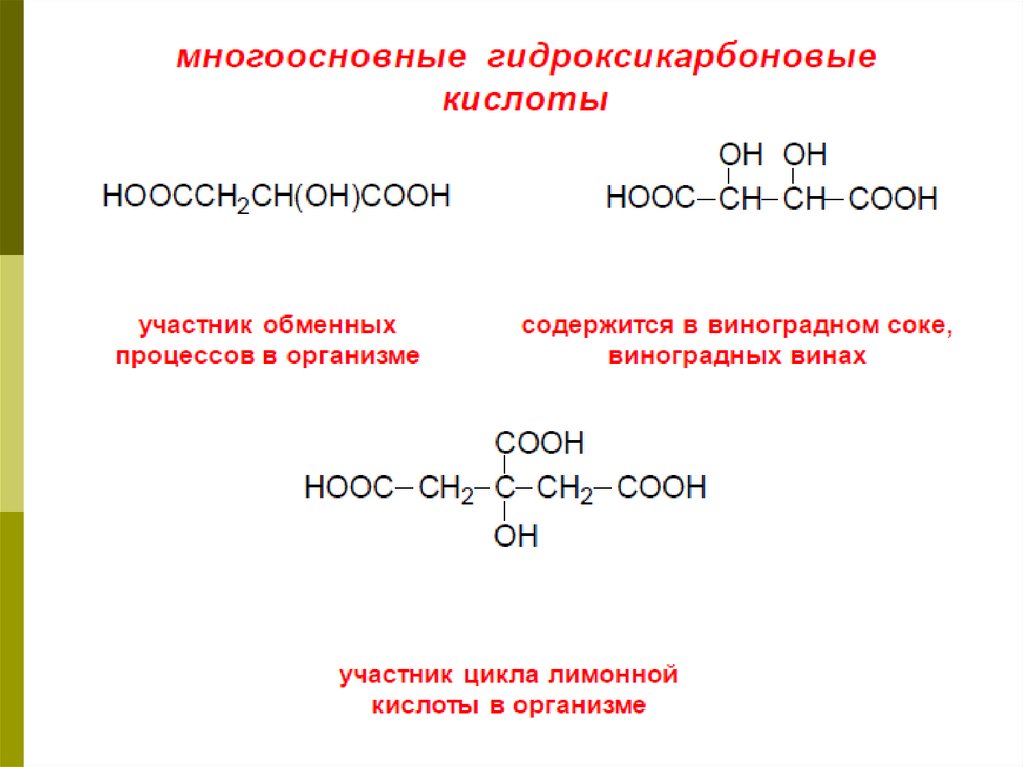
3. В зависимости от количества карбоксильных
групп различают одно-, двух- и многоосновные
ОК, а от числа гидроксильных групп (включая
гидроксильную, входящую в состав
карбоксильной) – двух-, трех- и много атомные
кислоты
4.
Номенклатура.1) По заместительной номенклатуре ИЮПАК
название производят от названия
соответствующей карбоновой кислоты с
префиксом «гидрокси», отмечая положение
ОН-группы арабской цифрой.
2) Используют тривиальные названия
3) Используют локанты α, β, γ и т.д. (в
настоящее время применяется редко).
5.
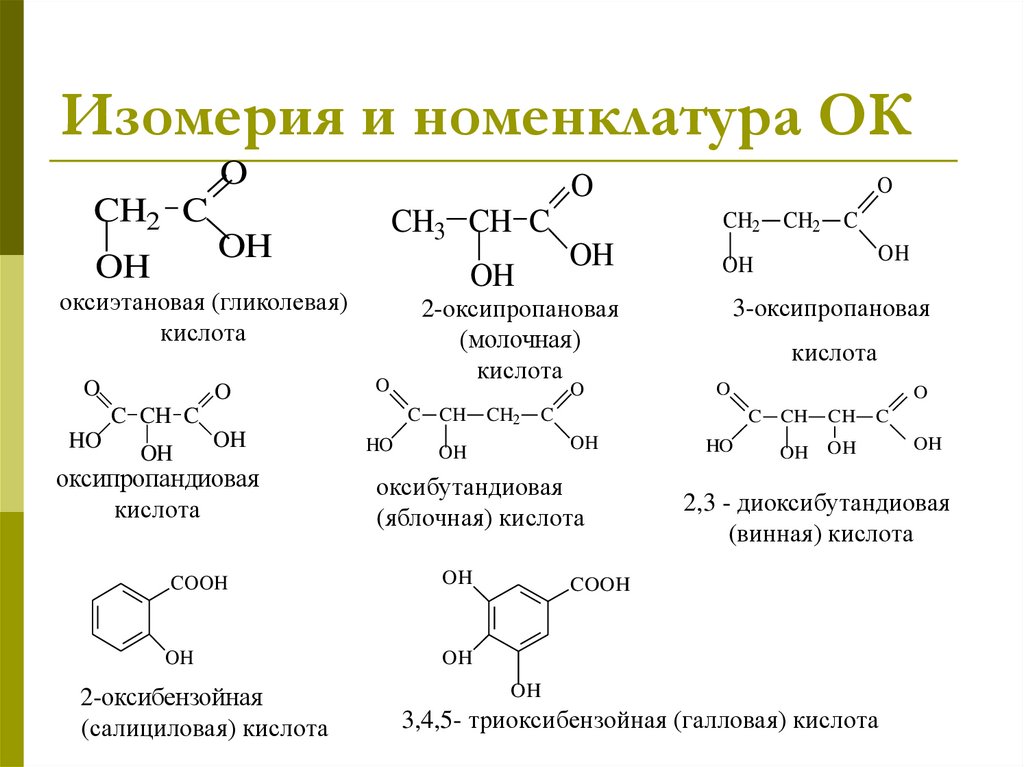
Изомерия и номенклатура ОКO
CH2 C
OH
O
CH3 CH C
OH
OH
оксиэтановая (гликолевая)
кислота
O
O
O
HO
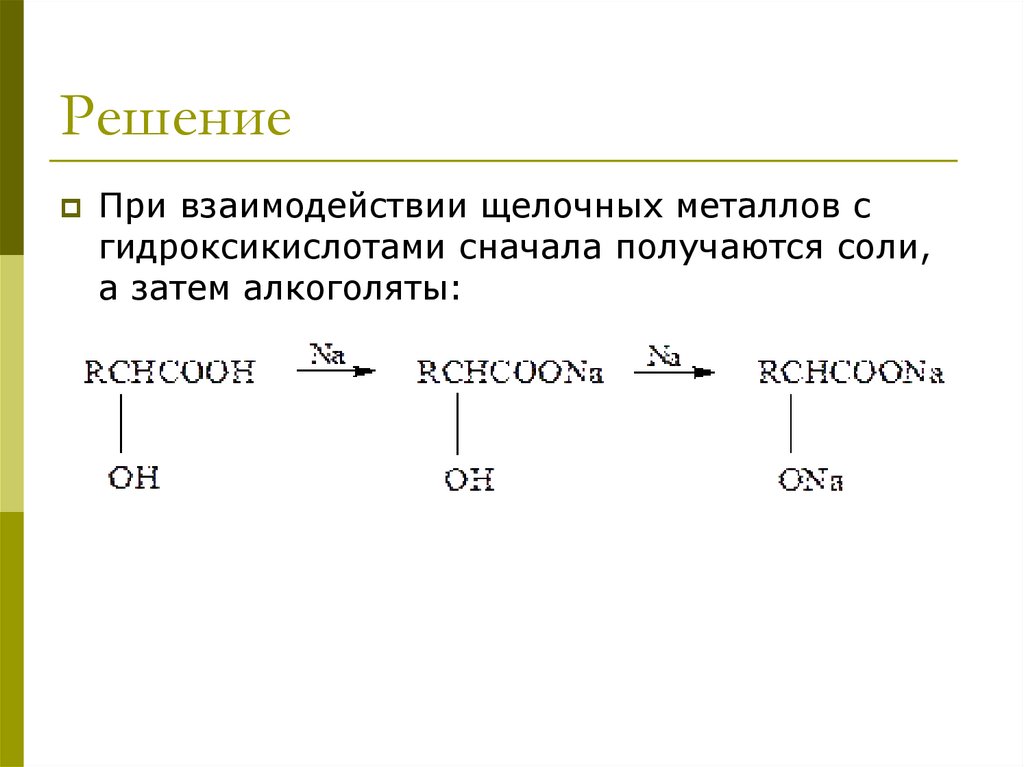
OH
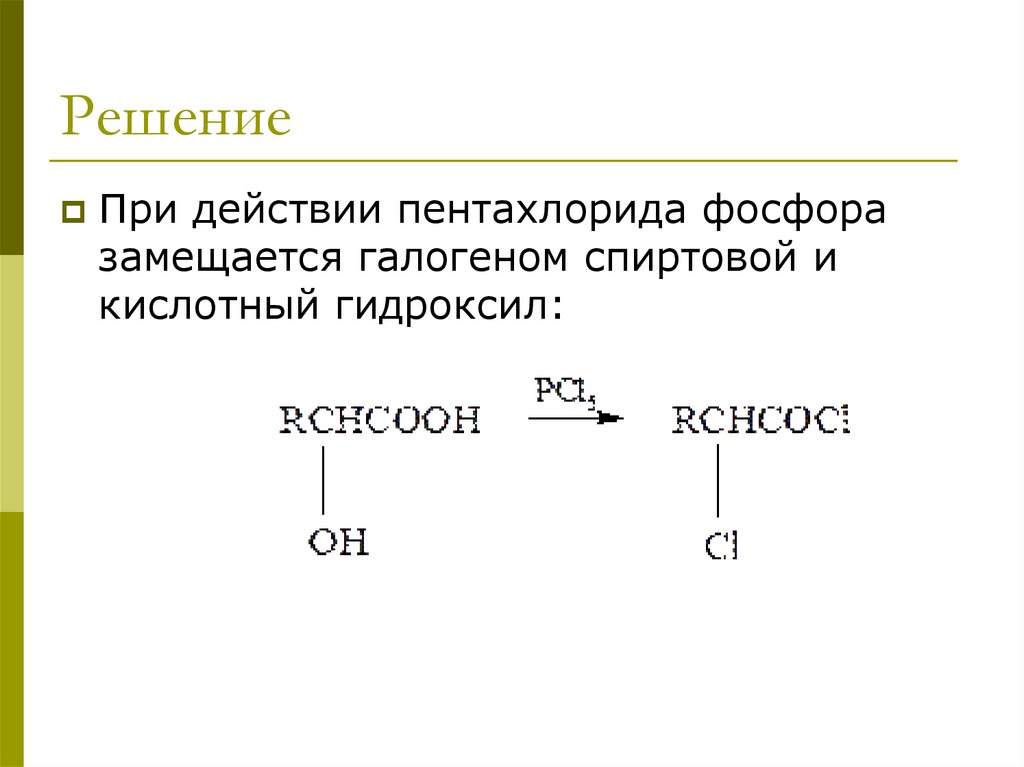
OH
оксипропандиовая
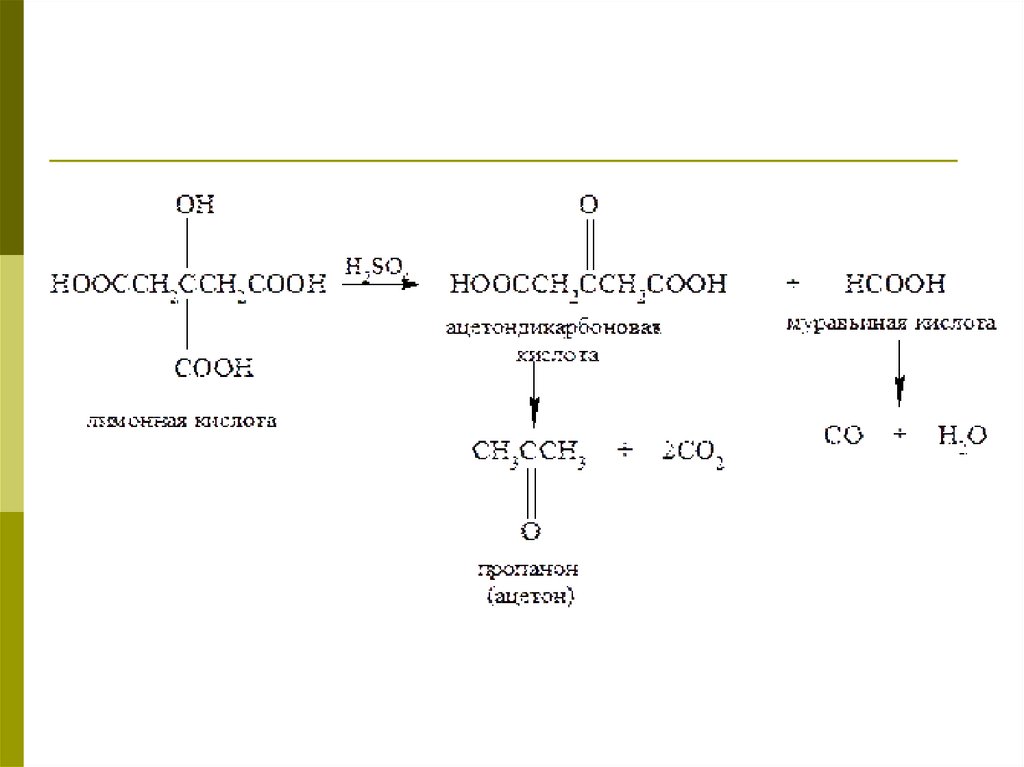
кислота
HO
OH
O
CH2
оксибутандиовая
(яблочная) кислота
OH
OH
OH
C
OH
3-оксипропановая
кислота
O
O
C
OH
CH2
OH
C
OH
COOH
2-оксибензойная
(салициловая) кислота
CH2
2-оксипропановая
(молочная)
кислота
C CH
C CH C
O
HO
CH
CH
OH
OH
C
OH
2,3 - диоксибутандиовая
(винная) кислота
COOH
OH
3,4,5- триоксибензойная (галловая) кислота
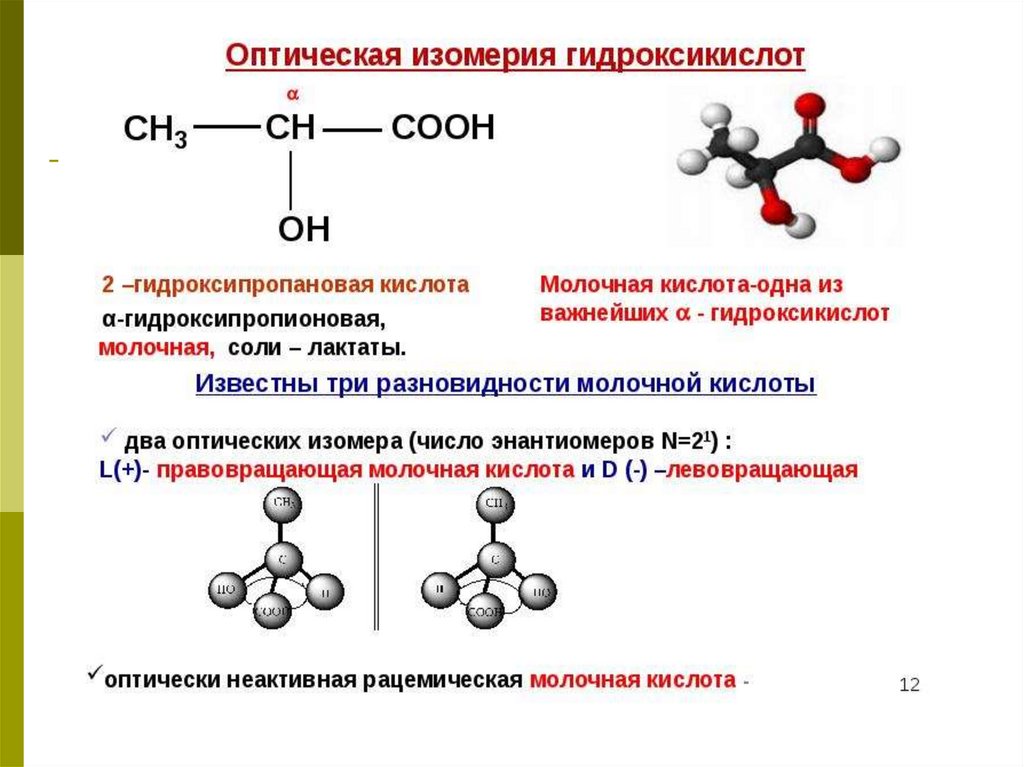
6.
7.
8.
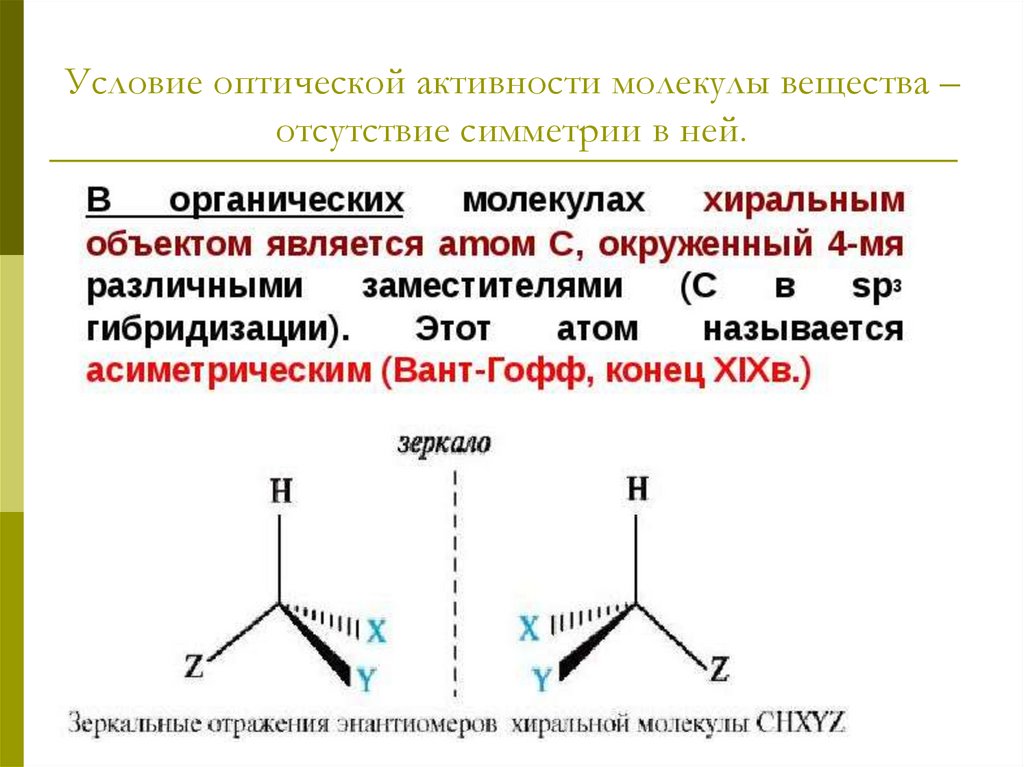
Кроме рассмотренных видов изомерии (углеродногоскелета, положению и количеству функциональных
групп), для ОК характерна оптическая изомерия.
9.
Хиральными называют объекты, не имеющие элементовсимметрии (оси, плоскости). Название происходит от
греческого слова «рука».
10.
Условие оптической активности молекулы вещества –отсутствие симметрии в ней.
11.
12.
13.
14.
15.
Получение α-оксикислот1. Щелочной или кислотный гидролиз галогенпроизводных кислот (α-галогенпроизводные
легко доступны). В условиях щелочного гидролиза получается соль, которую затем
переводят в кислоту; при кислотном гидролизе срезу получается оксикислота:
CH3
CH COOH
HOH
o
H t
CH3
CH COOH
HCl
OH
Cl
2-хлорпропановая кислота
2-оксипропановая кислота (молочная к-та)
2. Кислотный гидролиз циангидридов (осксинитрилов), которые получают из альдегидов
или кетонов и синильной кислоты:
O
H3C - C - H
H+CN
H3C - CH - CN
OH
2H2O, H+ H C - CH - COOH
3
- NH3
OH
молочная кислота
16.
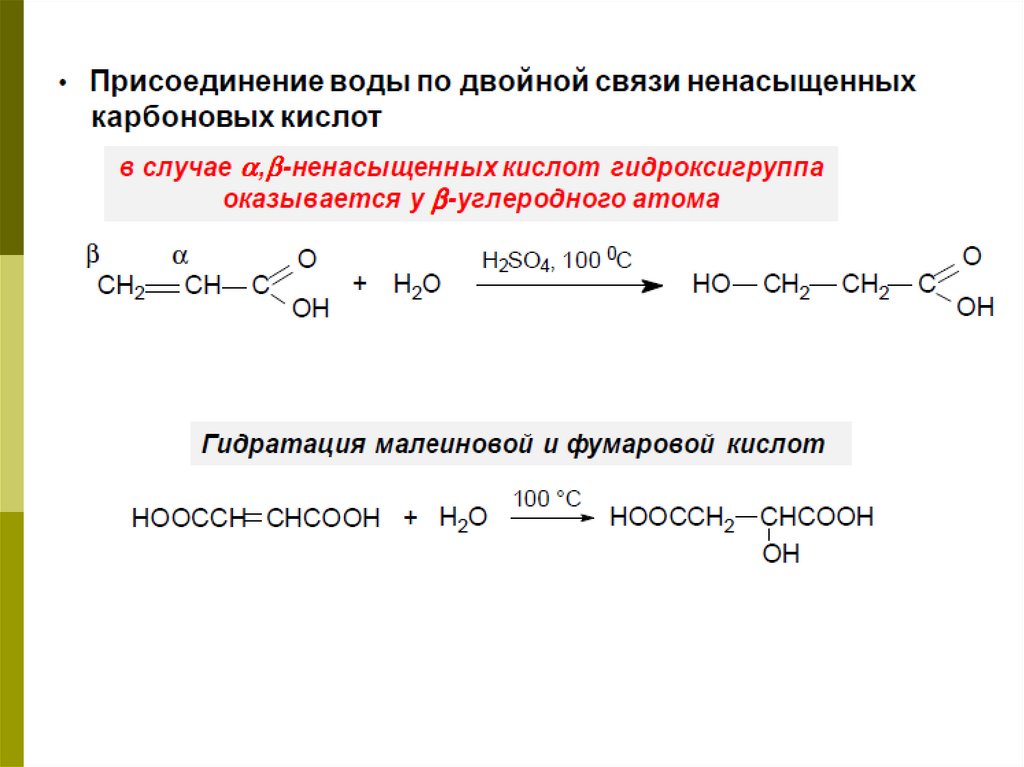
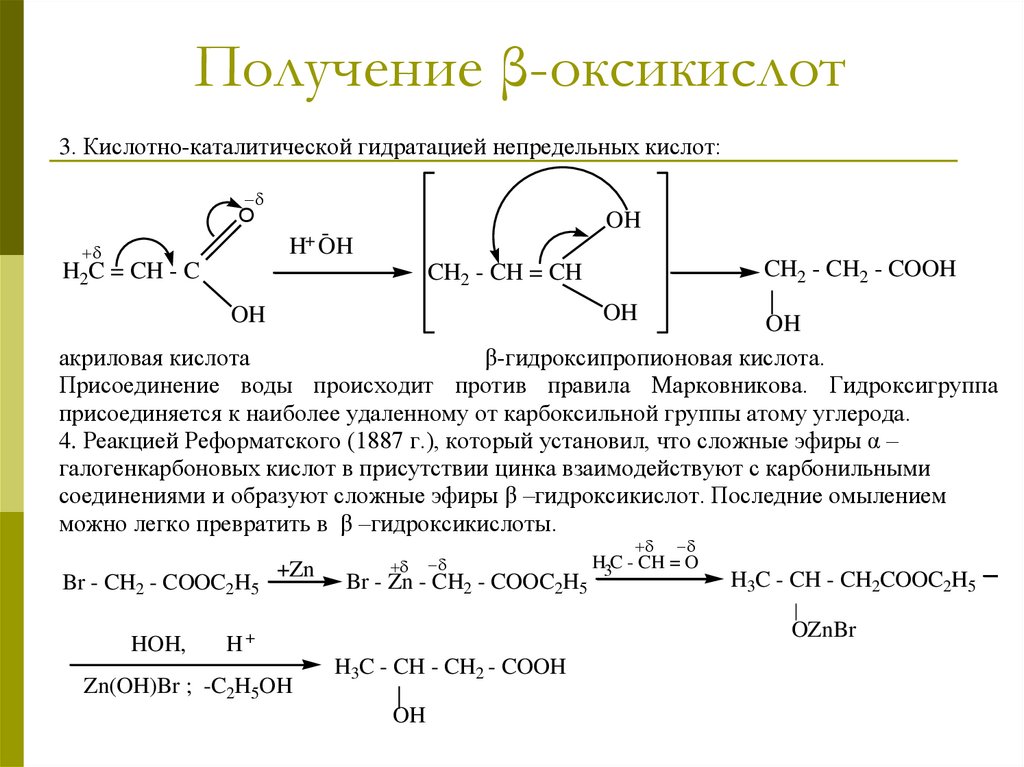
Получение β-оксикислот3. Кислотно-каталитической гидратацией непредельных кислот:
O
H2C = CH - C
OH
H+ OH
CH2 - CH2 - COOH
|
OH
OH
OH
акриловая кислота
β-гидроксипропионовая кислота.
Присоединение воды происходит против правила Марковникова. Гидроксигруппа
присоединяется к наиболее удаленному от карбоксильной группы атому углерода.
4. Реакцией Реформатского (1887 г.), который установил, что сложные эфиры α –
галогенкарбоновых кислот в присутствии цинка взаимодействуют с карбонильными
соединениями и образуют сложные эфиры β –гидроксикислот. Последние омылением
можно легко превратить в β –гидроксикислоты.
CH2 - CH = CH
Br - CH2 - COOC2H5
+Zn
Br - Zn - CH2 - COOC2H5
H3C - CH = O
H3C - CH - CH2COOC2H5
|
HOH,
OZnBr
H+
Zn(OH)Br ; -C2H5OH
H3C - CH - CH2 - COOH
|
OH
17.
Технический способ полученияоксикислот - брожение
Ферментативное брожение глюкозы является техническим способом получения
гидроксикислот. Результат реакции зависит от природы используемого фермента (энзима)
Так, при действии плесневых грибов лимоннокислого брожения получается лимонная
кислота:
COOH
enzim
CO2
C6H12O6
HOOC CH2 C CH2 COOH
OH
Для образования систематического названия
лимонной кислоты за основу берётся пропан –
три центральных атома углерода в структуре:
2-гидроксипропан-1,2,3-трикарбоновая кислота
.
18.
Химические свойства ОКГидрокислоты содержат две функциональные группы, и их химические свойства
определяются присутствием как карбоксильной, так и гидроксильной групп. Поэтому
гидроксикислоты одновременно проявляют свойства карбоновых кислот и спиртов.
Причем карбоксильная и гироксильная группы могут участвовать в химических реакциях
отдельно, независимо одна от другой, или обе вместе. Так, гидроксикислоты, как
карбоновые кислоты, в водных растворах диссоциируют:
R - CH - COO + H3O+
R - CH - COOH + H2O
OH
OH
Гидроксикислоты, и в первую очередь α – гидроксикислоты, имеют более сильные
кислотные свойства, чем соответствующие им карбоновые кислоты. Причиной усиления
кислотных свойств гидроксикислот является (–) I – эффект спиртовой ОН-группы, которая
обуславливает смещение электронов по системе σ – связей.
δ
CH3
CH
O
δ
C
O H
OH
19.
Свойства карбоксильной группыГидроксикислоты, как и карбоновые кислоты, образуют соли, сложные эфиры, амиды и т.д.
Например:
+ NaOH
C2H5OH H C - CH - COOH
H3C - CH -COONa
H3C - CH - COOC2H5
3
- H2O
- H2O
OH
OH
OH
этиловый эфир
молочная
молочнокислый
молочной кислоты
кислота
натрий
(этиллактат)
(лактат натрия)
20.
Свойства спиртовой группыГидроксикислоты, вступая в реакции как спирты, образуют алкоголяты, простые эфиры,
замещают гидроксил на галоген. Так, при взаимодействии гидроксикислот со щелочными
металлами сначала образуются соли этих кислот. Которые далее реагируют с этими же
веществами и образуют алкоголяты:
O
H3C - CH - C
+Na
-1/2 H2
O
+Na
H3C - CH -COONa
-1/2 H2
H3C - CH - C
ONa
ONa
OH
Nа-соль
алкоголят молочной
молочной
кислоты (и одноврекислоты
менно соль)
При действии на гидроксикислоты галогенводородов спиртовый гидроксил их молекул
замещается на галоген и образуются соответствующие галогенкислоты:
H2O
H3C - CH - COOH +
HCl
+
H3C - CH - COOH
OH
OH
молочная
кислота
OH
α –гидроксипропионовая
кислота (молочная)
Cl
α-хлорпропионовая
кислота
21.
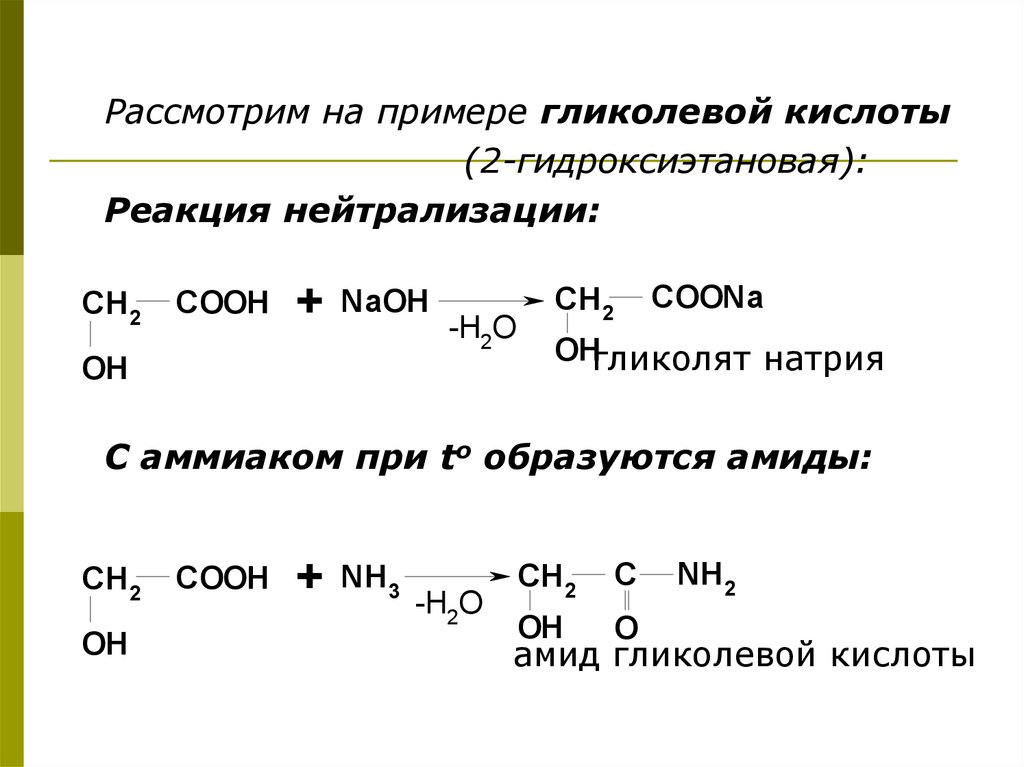
Рассмотрим на примере гликолевой кислоты(2-гидроксиэтановая):
Реакция нейтрализации:
CH2
COOH
+ NaOH -H O
2
OH
CH2
COONa
OHгликолят натрия
С аммиаком при to образуются амиды:
CH2
COOH
+ NH3 -H O
2
OH
CH2
C
OH
O
NH2
амид гликолевой кислоты
22.
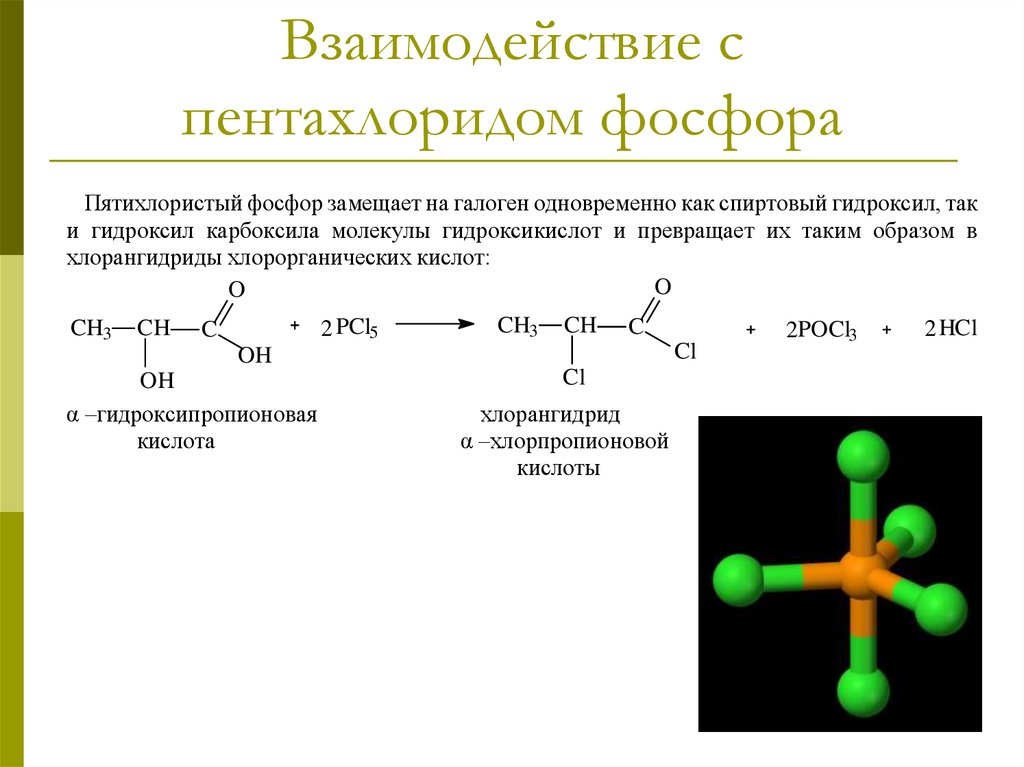
Взаимодействие спентахлоридом фосфора
Пятихлористый фосфор замещает на галоген одновременно как спиртовый гидроксил, так
и гидроксил карбоксила молекулы гидроксикислот и превращает их таким образом в
хлорангидриды хлорорганических кислот:
O
O
CH3
CH
2 PCl5
C
CH3
CH
C
Cl
OH
OH
α –гидроксипропионовая
кислота
Cl
хлорангидрид
α –хлорпропионовой
кислоты
2POCl3
2 HCl
23.
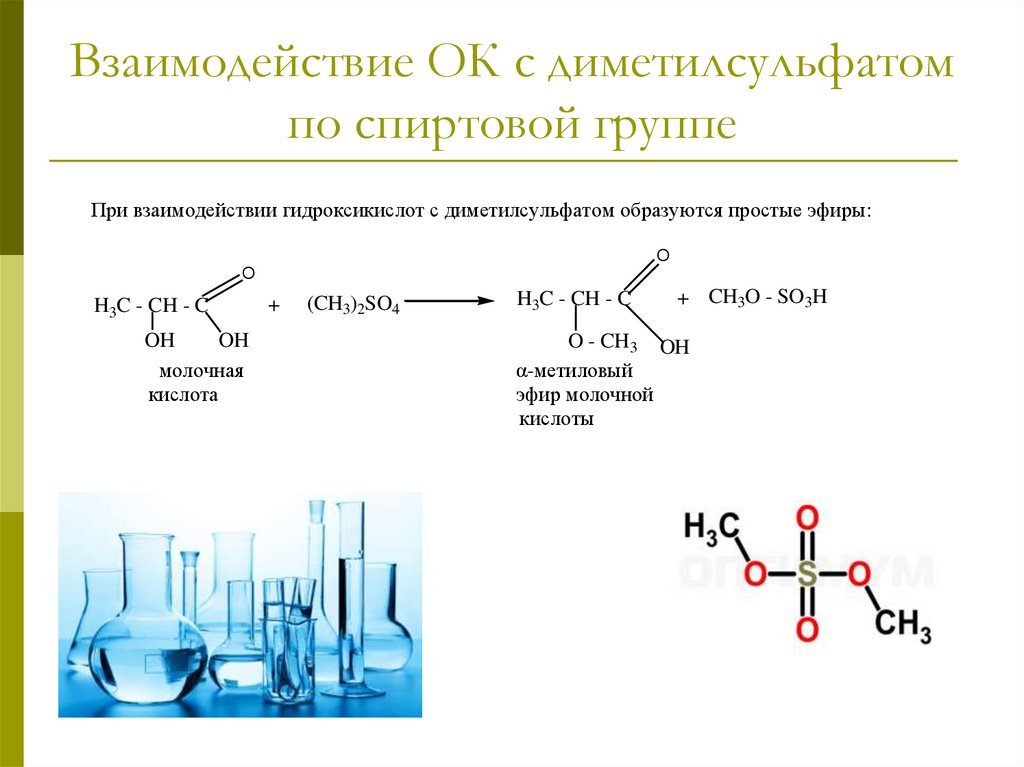
Взаимодействие ОК с диметилсульфатомпо спиртовой группе
При взаимодействии гидроксикислот с диметилсульфатом образуются простые эфиры:
O
O
H3C - CH - C
OH
OH
молочная
кислота
+
(CH3)2SO4
H3C - CH - C
+ CH3O - SO3H
O - CH3 OH
α-метиловый
эфир молочной
кислоты
24.
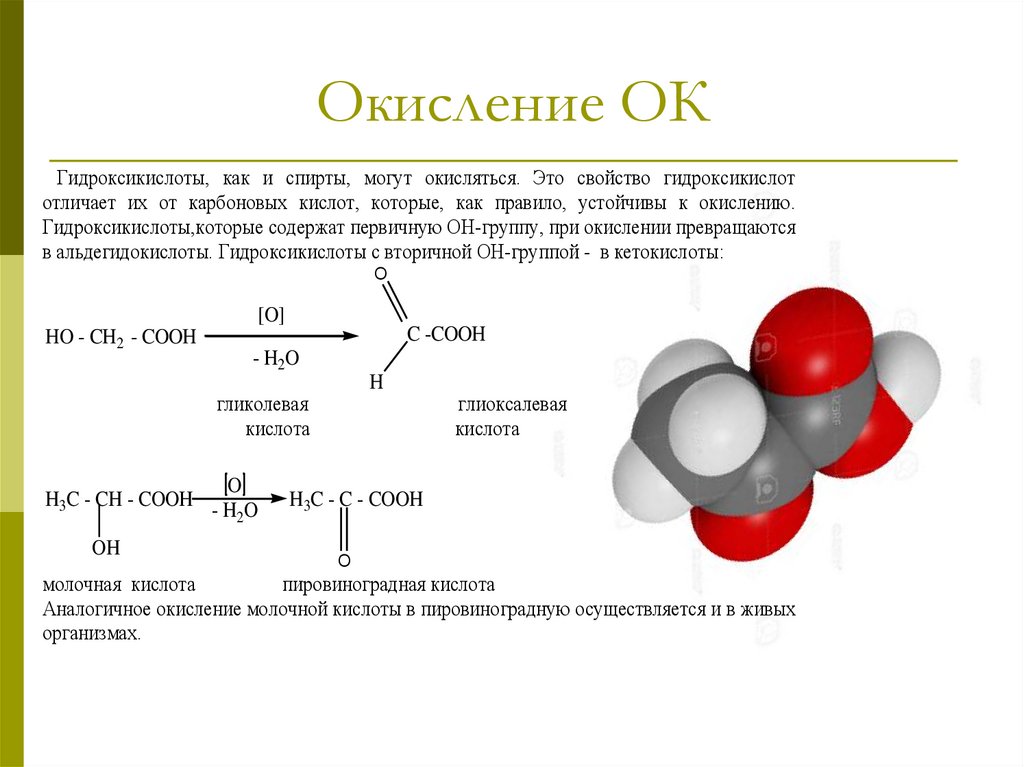
Окисление ОКГидроксикислоты, как и спирты, могут окисляться. Это свойство гидроксикислот
отличает их от карбоновых кислот, которые, как правило, устойчивы к окислению.
Гидроксикислоты,которые содержат первичную ОН-группу, при окислении превращаются
в альдегидокислоты. Гидроксикислоты с вторичной ОН-группой - в кетокислоты:
O
[O]
HO - CH2 - COOH
C -COOH
- H2O
H
гликолевая
кислота
H3C - CH - COOH
OH
O
- H2O
глиоксалевая
кислота
H3C - C - COOH
O
молочная кислота
пировиноградная кислота
Аналогичное окисление молочной кислоты в пировиноградную осуществляется и в живых
организмах.
25.
Специфические реакцииКроме реакций, которые осуществляются с участием карбоксильной и спиртовой групп,
гидроксикислотам свойственны также специфические реакции, обусловленные взаимным
влиянием двух функциональных групп в их молекулах. Так, α-, β- ,γ- ,δ- и ε гидроксикислоты по-разному превращаются при нагревании. Гидроксикислоты при
повышенных температурах дегидратируются, но в зависимости от взаимного расположения
спиртовой и карбоксильной групп дегидратация их происходит по-разному и с
образованием разных продуктов реакции.
26.
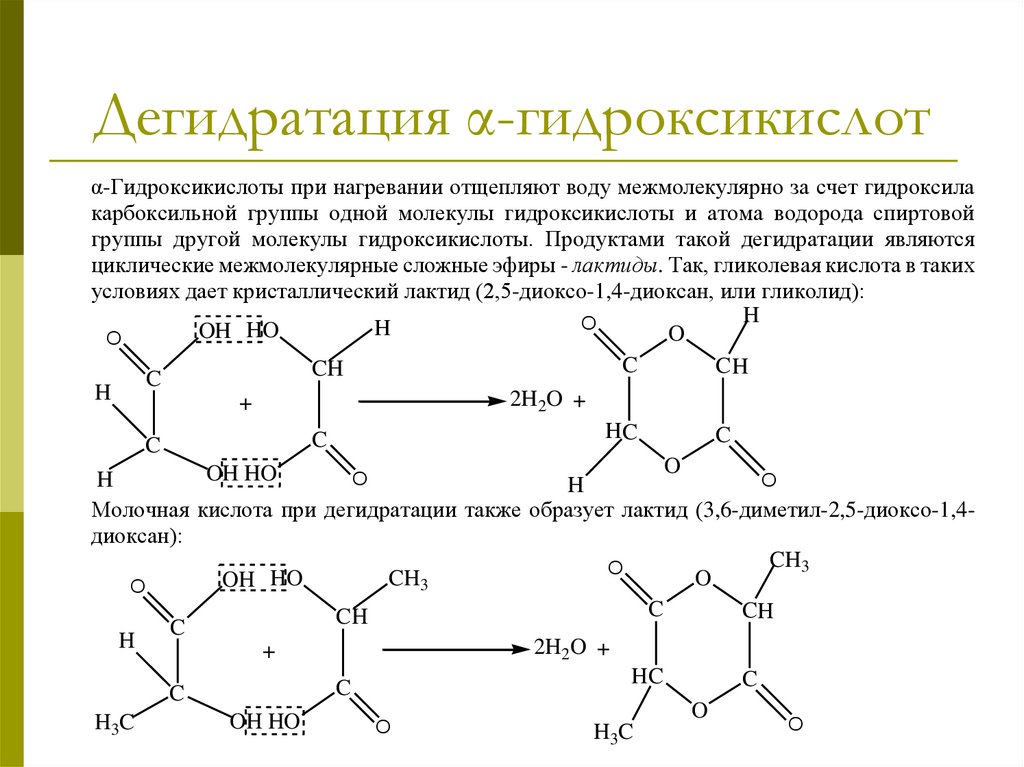
Дегидратация α-гидроксикислотα-Гидроксикислоты при нагревании отщепляют воду межмолекулярно за счет гидроксила
карбоксильной группы одной молекулы гидроксикислоты и атома водорода спиртовой
группы другой молекулы гидроксикислоты. Продуктами такой дегидратации являются
циклические межмолекулярные сложные эфиры - лактиды. Так, гликолевая кислота в таких
условиях дает кристаллический лактид (2,5-диоксо-1,4-диоксан, или гликолид):
H
O
H
HO
OH
O
O
C
CH
CH
C
H
2H2O +
+
HC
C
C
C
O
OH HO
O
H
O
H
Молочная кислота при дегидратации также образует лактид (3,6-диметил-2,5-диоксо-1,4диоксан):
CH3
O
HO
CH
O
OH
3
O
C
CH
CH
C
H
2H O +
+
2
H3C
HC
C
C
OH HO
O
C
O
H3C
O
27.
Дегидратация β-гидроксикислотβ-Гидроксикислоты при нагревании дегидратируются внутримолекулярно. Вода при этом
отщепляется за счет спиртового гидроксила и весьма подвижного α-водородного атома
метиленовой группы. В результате образуются α-, β - непредельные кислоты. Так, βгидроксипропионовая кислота при этом превращается в акриловую кислоту:
H2C - CH - COOH - H O
2
HO H
H2C = CH - COOH
28.
Дегидратация γ- и δгидроксикислотγ - и δ-гидроксикислоты при нагревании вступают во внутримолекулярную этерификацию
между спиртовым гидроксилом и карбоксильной группой, образуя внутримолекулярные
циклические сложные эфиры, которые называют лактонами. Так, γ-гидроксимасляная
кислота при дегидратации превращается в бутиролактон (tкип.=204оС ):
O
H2C - CH2 - CH2 - C
- H2O
OH
OH
H2C
CH2
H2C
C=O
O
Реакцию лактонизации гидроксикислот открыл в 1873 г. А.М. Зайцев. Лактоны являются
биологически активными веществами и используются для синтеза кровезаменителей.
Некоторые лактоны имеют приятный запах и их используют в парфюмерии.
ε -Гидроксикислоты и гидроксикислоты с еще более удаленной спиртовой группой при
нагревании вступают в реакции конденсации и образуют при этом линейные полимеры.
29.
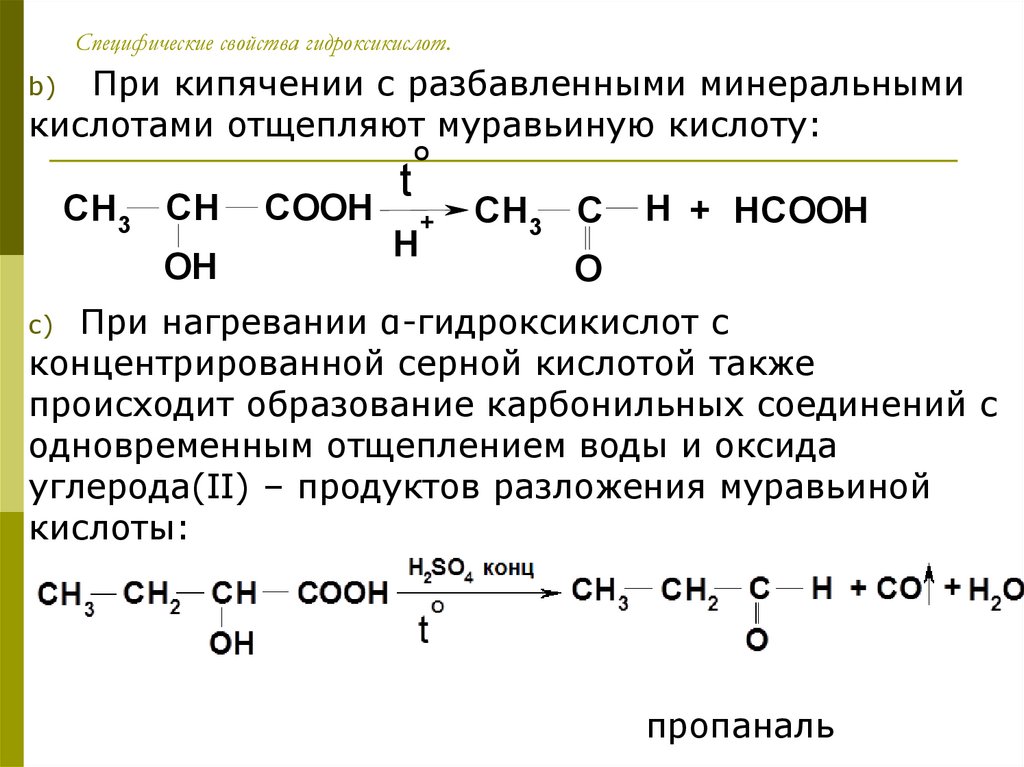
Специфические свойства гидроксикислот.При кипячении с разбавленными минеральными
кислотами отщепляют муравьиную кислоту:
b)
CH 3 CH
OH
COOH
t
O
H
+
CH3 C
H + HCOOH
O
При нагревании α-гидроксикислот с
концентрированной серной кислотой также
происходит образование карбонильных соединений с
одновременным отщеплением воды и оксида
углерода(II) – продуктов разложения муравьиной
кислоты:
c)
пропаналь
30.
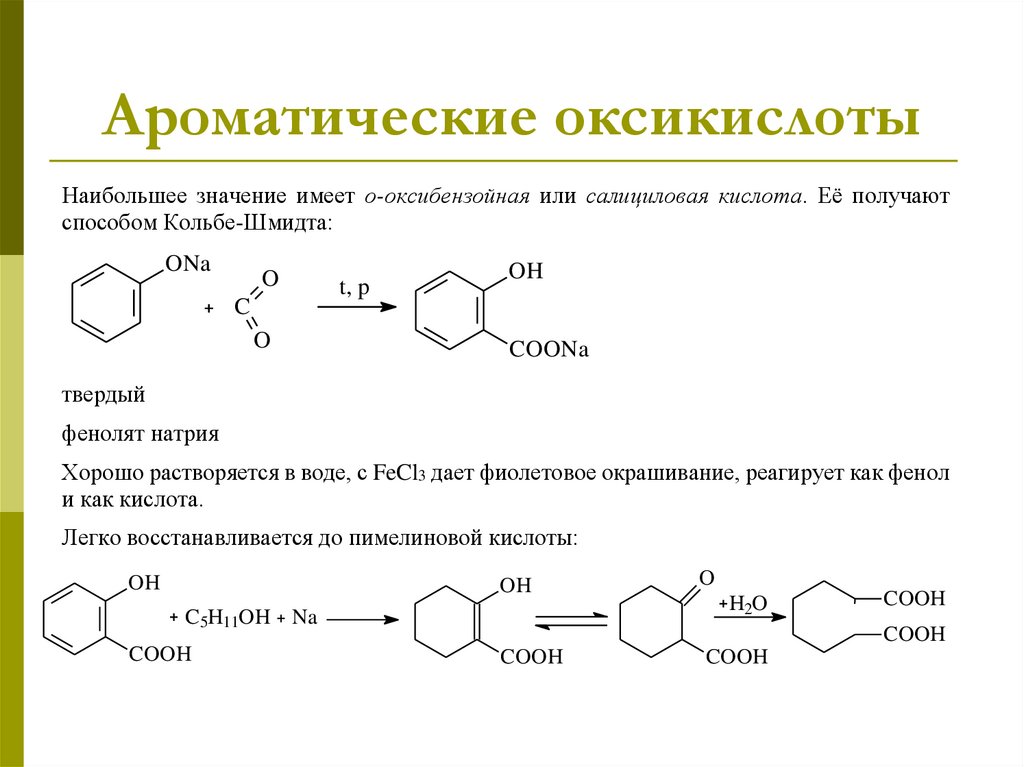
Ароматические оксикислотыНаибольшее значение имеет о-оксибензойная или салициловая кислота. Её получают
способом Кольбе-Шмидта:
ONa
O
C
O
t, p
OH
COONa
твердый
фенолят натрия
Хорошо растворяется в воде, с FeCl3 дает фиолетовое окрашивание, реагирует как фенол
и как кислота.
Легко восстанавливается до пимелиновой кислоты:
OH
OH
C5H11OH Na
COOH
O
H2O
COOH
COOH
COOH
COOH
31.
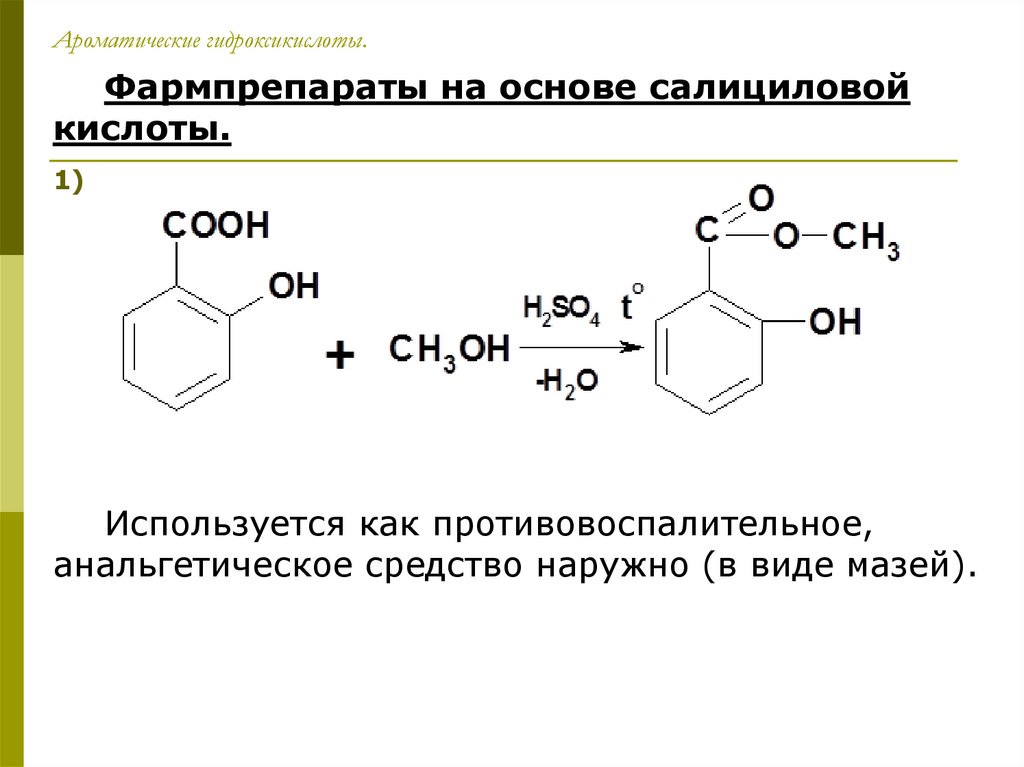
Ароматические гидроксикислоты.Фармпрепараты на основе салициловой
кислоты.
1) Метилсалицилат:
Используется как противовоспалительное,
анальгетическое средство наружно (в виде мазей).
32.
Ароматические гидроксикислоты.2)
Салицилат натрия:
COOH
COONa
OH
+ NaHCO3
OH
+ CO2 + H2O
Применяется в качестве анальгетического,
противовоспалительного, жаропонижающего средства.
33.
Ароматические гидроксикислоты.3)
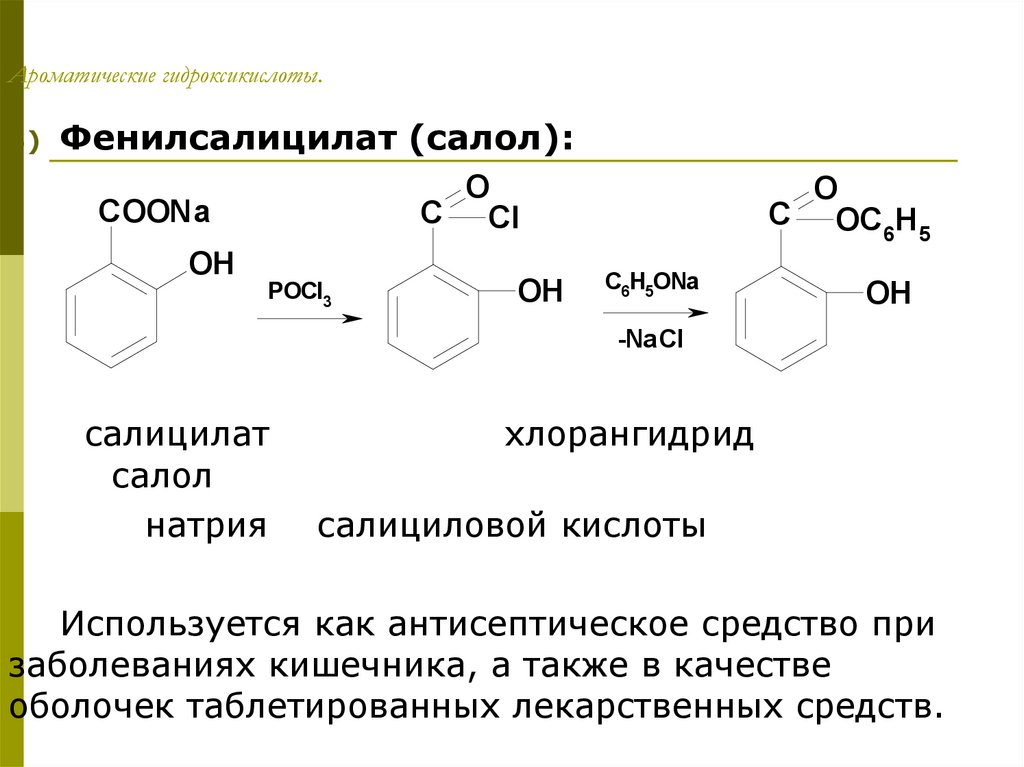
Фенилсалицилат (салол):
O
C Cl
COONa
OH
POCl3
OH
O
C OC H
6 5
C6H5ONa
OH
-NaCl
салицилат
салол
натрия
хлорангидрид
салициловой кислоты
Используется как антисептическое средство при
заболеваниях кишечника, а также в качестве
оболочек таблетированных лекарственных средств.
34.
Ароматические гидроксикислоты.4)
Ацетилсалициловая кислота (аспирин):
COOH
COOH
OH
+
CH 3
C
CH 3 C
O
O
O
C
O
CH 3
+ CH3COOH
O
Ацетилсалициловая кислота используется в
качестве обезболивающего, жаропонижающего
средства.
Салициловая кислота и её производные со
свободной гидроксильной группой дают с раствором
хлорида железа (III) фиолетовое окрашивание,
характерное для фенолов, что используется в
качественном анализе.
35.
36.
37.
38.
39.
40.
41.
42.
43.
Задача 1.Предложите схему синтеза молочной
кислоты из 2-хлорпропановой кислоты.
Обладает ли полученная кислота
оптической активностью? Какой продукт
образуется при нагревании молочной
кислоты? Напишите схему реакции.
44.
Решение:Гидроксикислоты получают из
галогенкарбоновых кислот в результате
обработки их щелочью с последующим
взаимодействием образующейся соли
гидроксикислоты с кислотой:
Благодаря наличию в молекуле
асимметрического атома углерода она может
существовать в виде двух оптически активных
энантиомеров:
Так как молочная кислота относится к αгидроксикислотам, то она при нагревании
образует устойчивый шестичленный
циклический диэфир-лактид:
45.
Задача 2.Какое соединение образуется при
нагревании 3-гидроксибутановой
кислоты? Объясните, почему при
нагревании этой кислоты невозможна
внутри- и межмолекулярная
этерификация?
46.
Решение3-гидроксибутановая кислота относится к β-
гидроксикислотам, а этим кислотам при
нагревании или под действием минеральных
кислот характерны реакции дегидратации с
образованием α,β-ненасыщенных кислот:
Внутри- или межмолекулярная этерификация в
этом случае невозможна, так как она привела
бы к образованию неустойчивого четырех- или
восьмичленного цикла (лактона и лактида
соответственно).
Направленность реакции определяется
большей подвижностью атома водорода в αположении по сравнению с γ-положением.
47.
Задача 3.Напишите схему реакций
взаимодействия β-гидроксикислоты с
гидроксидом натрия, этанолом и
аммиаком. Назовите продукты реакции.
48.
РешениеНаличие в молекуле гидроксикислот
карбоксильной и гидроксильной групп
приводит к тому, что эти соединения
вступают в реакции, свойственные как
спиртам, так и кислотам. С гидроксидом
натрия, этанолом и аммиаком реакции
идут по карбоксильной группе:
49.
Задача 4Напишите схему реакций
взаимодействия α-гидрокислоты с
натрием и пентахлоридом фосфора
50.
РешениеПри взаимодействии щелочных металлов с
гидроксикислотами сначала получаются соли,
а затем алкоголяты:
51.
РешениеПри действии пентахлорида фосфора
замещается галогеном спиртовой и
кислотный гидроксил:
52.
Задача 5.Напишите схему расщепления
лимонной кислоты под действием
концентрированной серной кислоты.
Какое карбонильное соединение
получается в результате? Напишите
схему соответствующей реакции.
53.
РешениеНагревание с серной кислотой приводит
к расщеплению лимонной кислоты на
ацетондикарбоновую и муравьиную
кислоты, которые распадаются далее с
выделением соответственно диоксида и
монооксида углерода:
Процесс распада ацетондикарбоновой
кислоты приводит к образованию
ацетона
































 chemistry
chemistry








