Similar presentations:
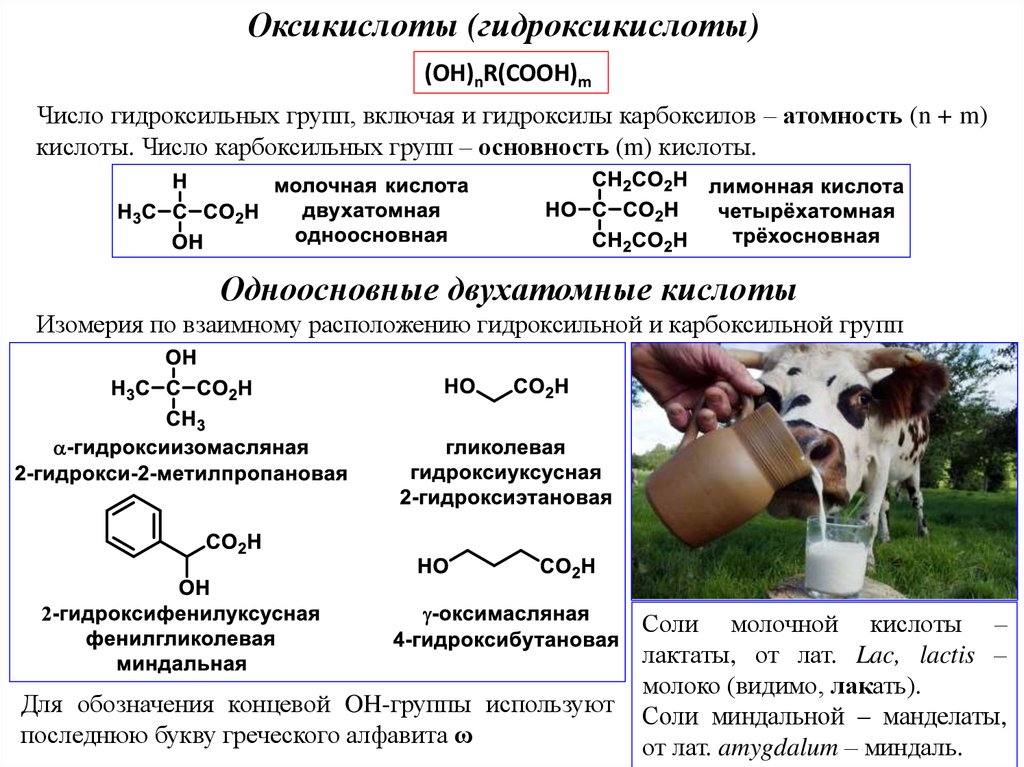
Оксикислоты (гидроксикислоты)
1.
Оксикислоты (гидроксикислоты)(OH)nR(COOH)m
Число гидроксильных групп, включая и гидроксилы карбоксилов – атомность (n + m)
кислоты. Число карбоксильных групп – основность (m) кислоты.
Одноосновные двухатомные кислоты
Изомерия по взаимному расположению гидроксильной и карбоксильной групп
Для обозначения концевой OH-группы используют
последнюю букву греческого алфавита ω
Соли молочной кислоты –
лактаты, от лат. Lac, lactis –
молоко (видимо, лакать).
Соли миндальной – манделаты,
от лат. amygdalum – миндаль.
2.
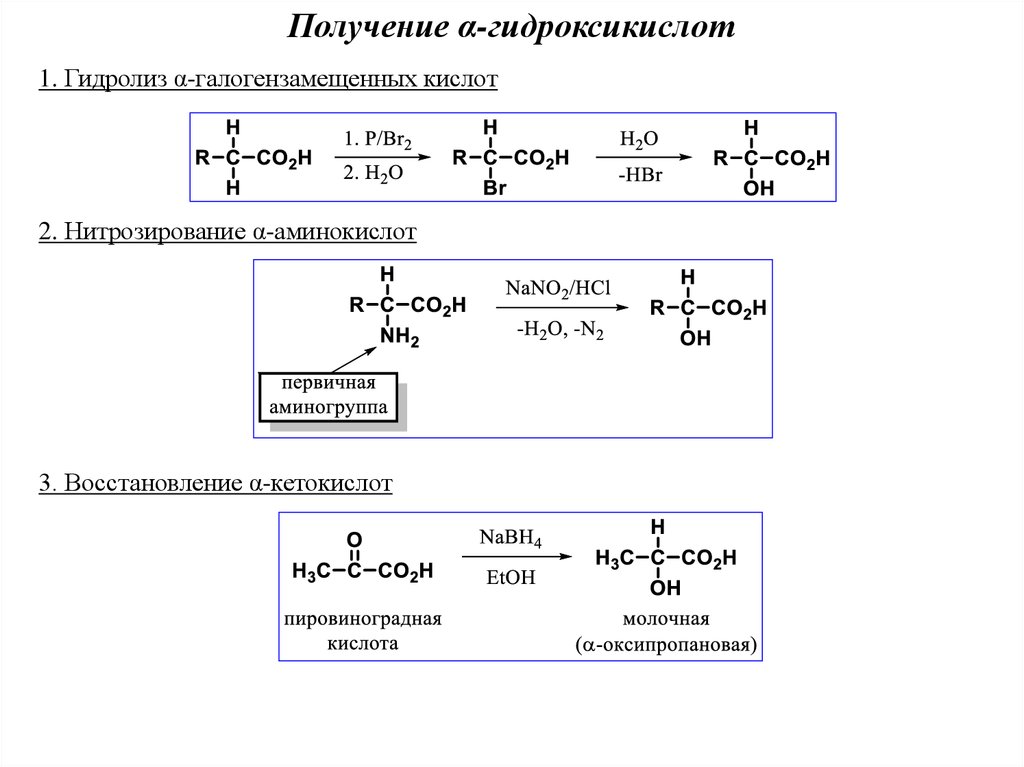
Получение α-гидроксикислот1. Гидролиз α-галогензамещенных кислот
2. Нитрозирование α-аминокислот
3. Восстановление α-кетокислот
3.
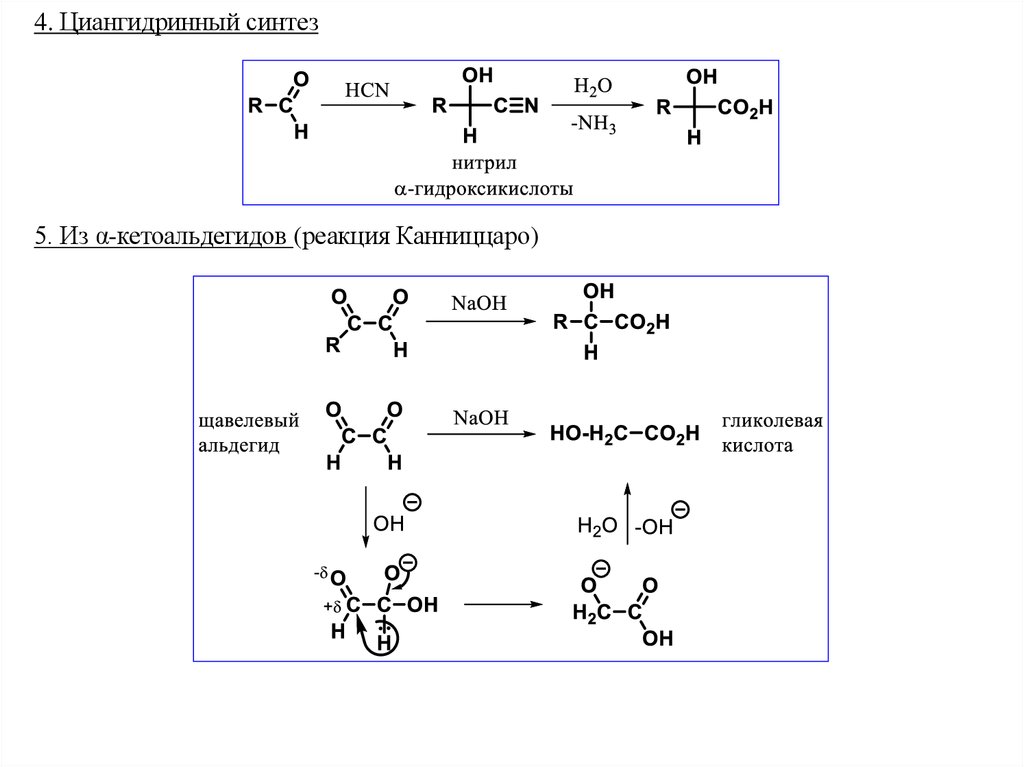
4. Циангидринный синтез5. Из α-кетоальдегидов (реакция Канниццаро)
4.
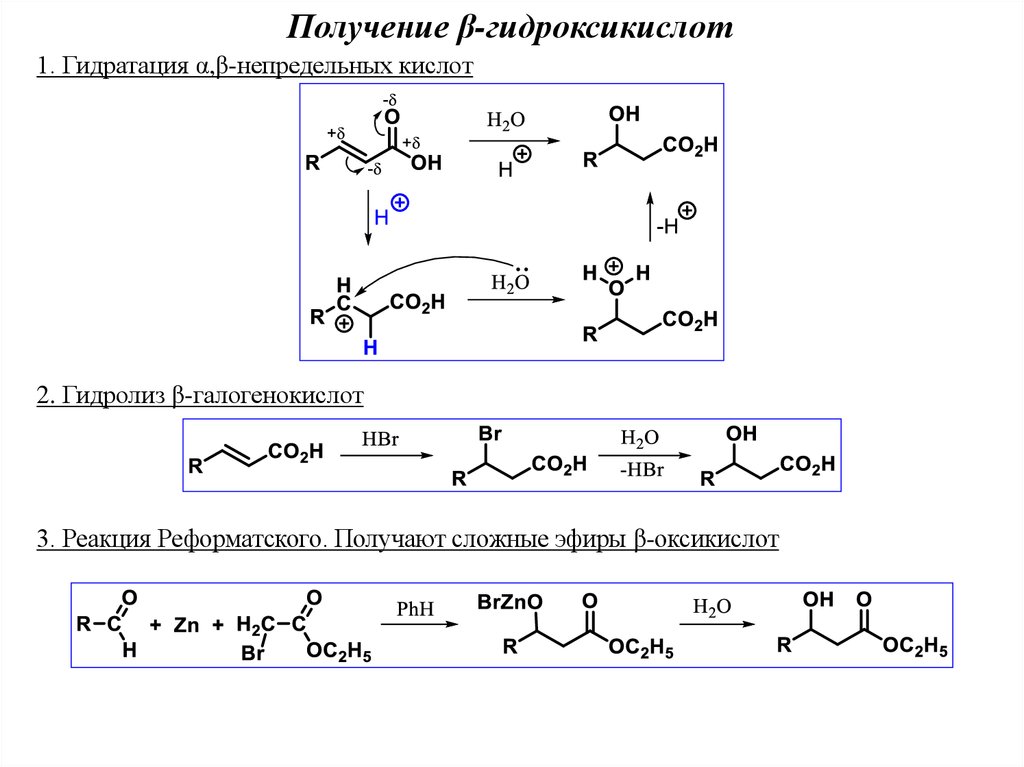
Получение β-гидроксикислот1. Гидратация α,β-непредельных кислот
2. Гидролиз β-галогенокислот
3. Реакция Реформатского. Получают сложные эфиры β-оксикислот
5.
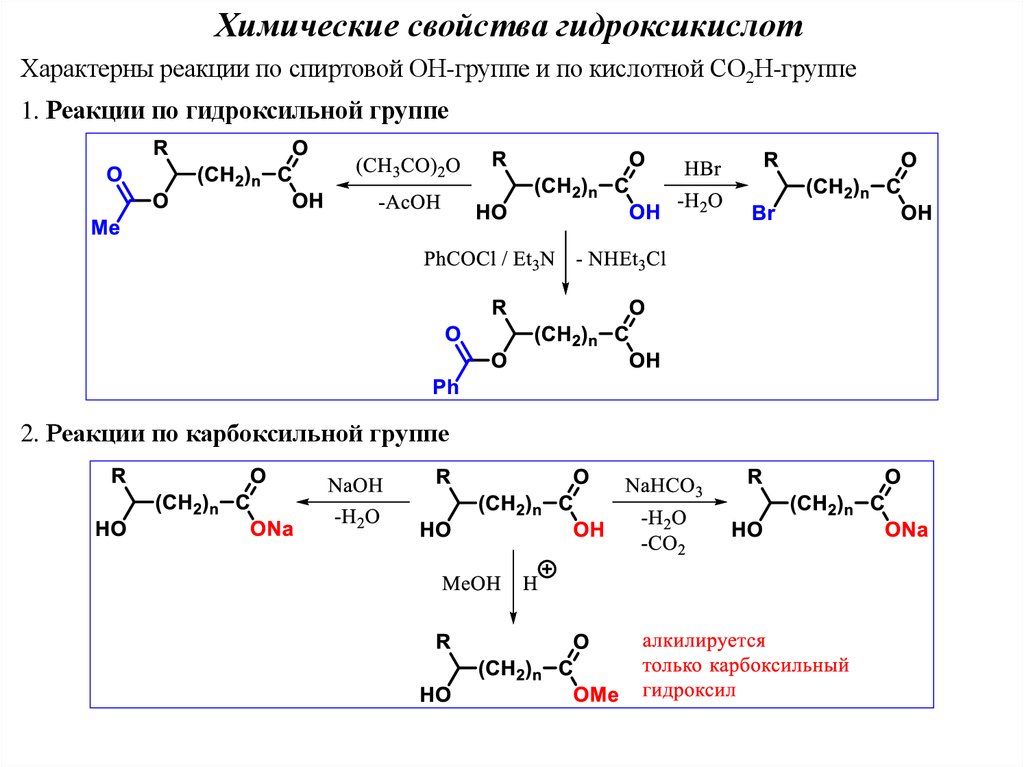
Химические свойства гидроксикислотХарактерны реакции по спиртовой ОН-группе и по кислотной СО2Н-группе
1. Реакции по гидроксильной группе
2. Реакции по карбоксильной группе
6.
Химические свойства3. Реакции по обеим функциональным группам
7.
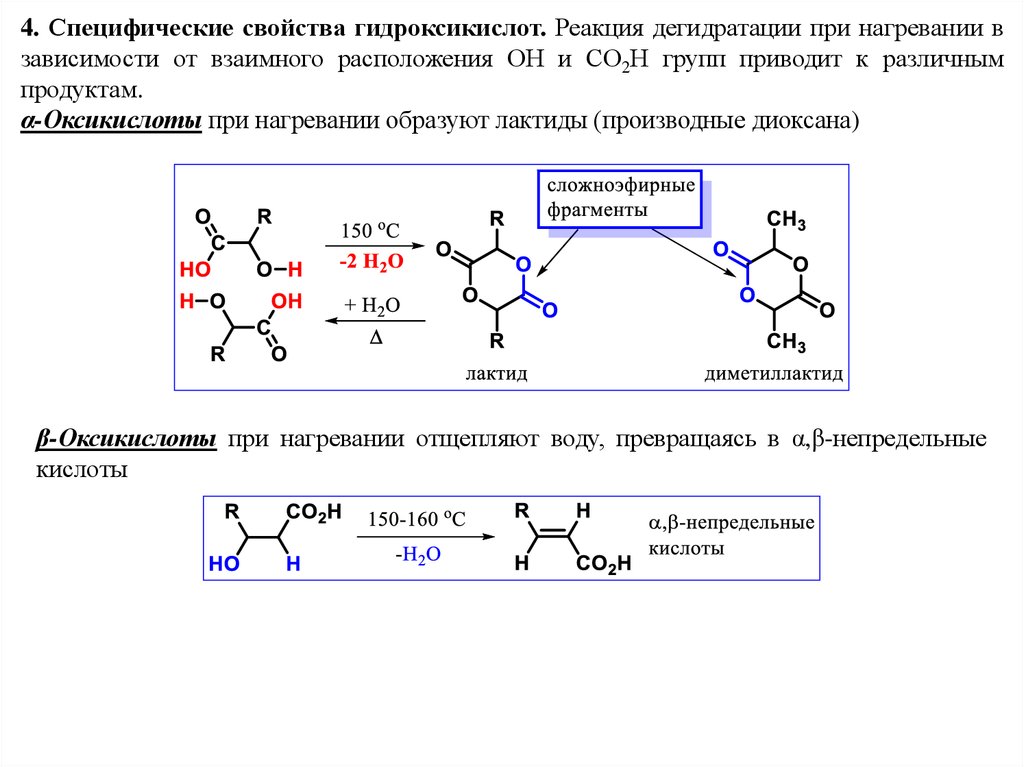
4. Специфические свойства гидроксикислот. Реакция дегидратации при нагревании взависимости от взаимного расположения ОН и СО2Н групп приводит к различным
продуктам.
α-Оксикислоты при нагревании образуют лактиды (производные диоксана)
β-Оксикислоты при нагревании отщепляют воду, превращаясь в α,β-непредельные
кислоты
8.
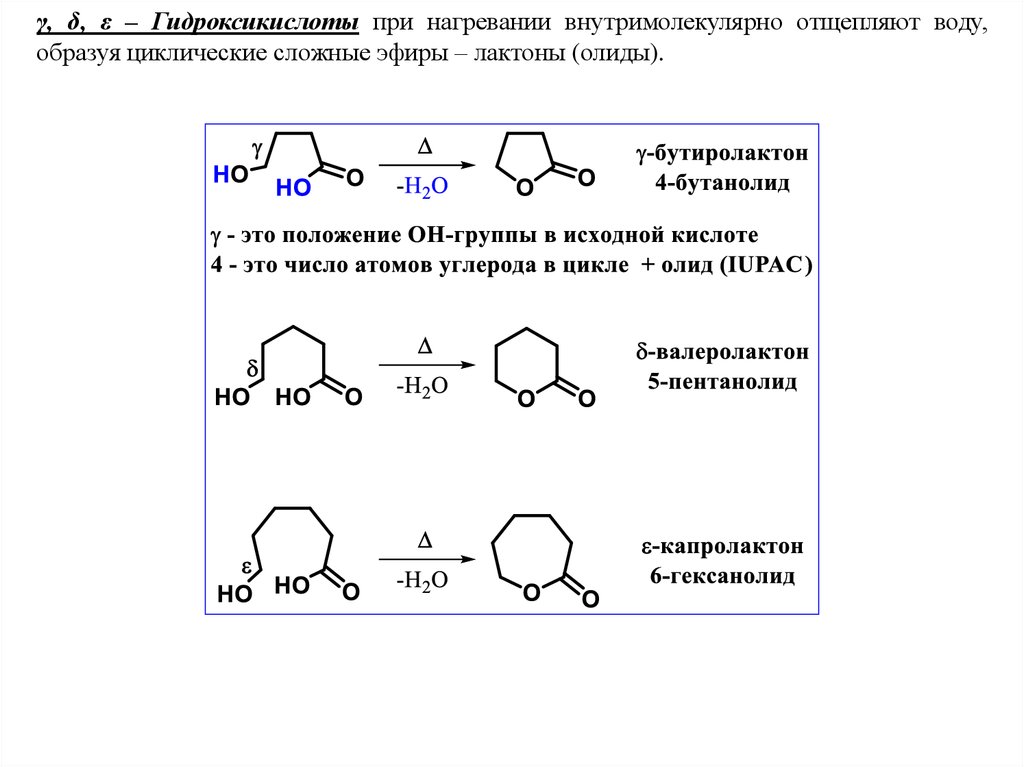
γ, δ, ε – Гидроксикислоты при нагревании внутримолекулярно отщепляют воду,образуя циклические сложные эфиры – лактоны (олиды).
9.
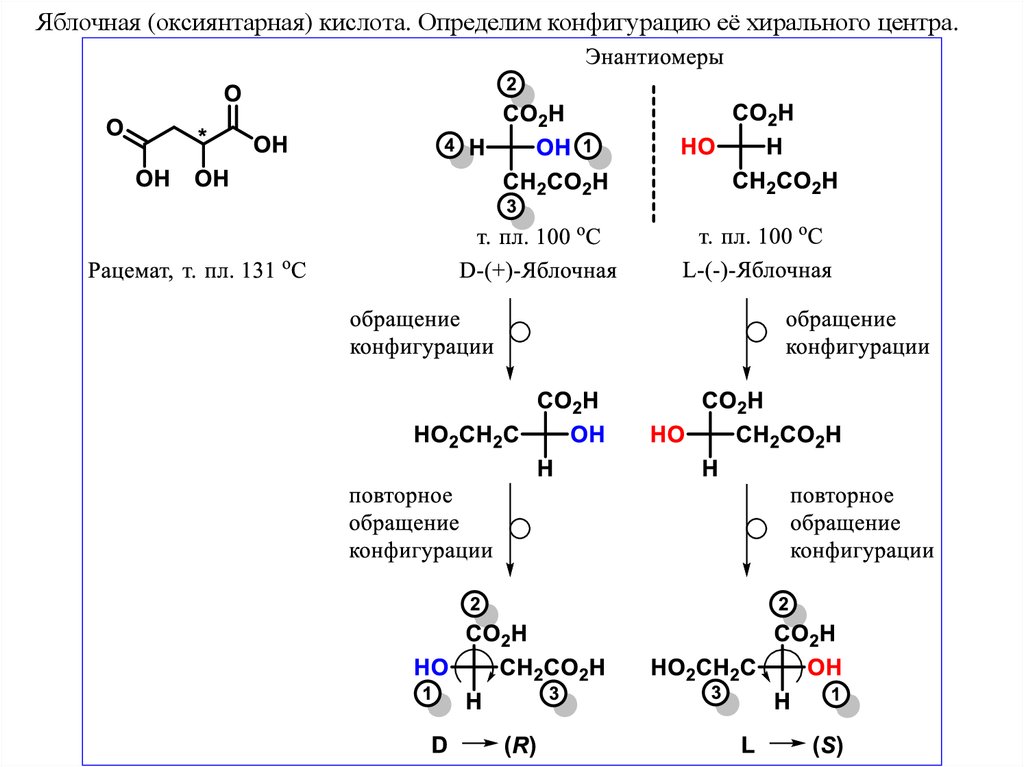
Яблочная (оксиянтарная) кислотаДвухосновная трехатомная оксикислота. Получается из янтарной, малеиновой или
фумаровой кислот. Соли – малаты (от лат. malum - яблоко).
10.
Винная кислотаДвухосновная тетраатомная оксикислота. Получают гидроксилированием малеиновой и
фумаровой кислот по Вагнеру. Соли – тартраты, от лат. tartarum - винный камень.
Виноградная и мезовинная кислоты являются диастереоизомерами (диастереомерами).
Отличаются конфигурацией (расположением заместителей при атоме С помеченного
звездочкой) одного асимметрического центра.
11.
Лимонная кислотаТрехосновная тетраатомная кислота. Можно получить лимоннокислым брожением
сахаристых веществ. Химически получают из ацетона. Соли - цитраты от лат. Citrus
limon – лимон.
12.
Оптическая изомерияОптическая изомерия характерна для sp3-гибридизованного атома углерода, имеющего 4
разных заместителя. Такой атом углерода называется асимметрическим или
хиральным (от греч. heir – рука). Молекула, содержащая хиральный углерод не имеет
элементов симметрии и может существовать в виде пары зеркальных изомеров,
называемых энантиомерами (от греч. enantios – противоположный).
Эти молекулы нельзя совместить в пространстве. Они
имеют разную конфигурацию, то есть разное
расположение заместителей у хирального атома
углерода. Следовательно, это изомеры - оптические
изомеры.
Вещества имеющие асимметрический атом углерода, при прохождении через их
растворы плоскополяризованного света, могут изменять плоскость поляризации.
Изменение плоскости поляризации называется оптическим вращением. Способность
вещества вызывать оптическое вращение называют оптической активностью.
Оптическую активность выражают в виде удельного оптического вращения [α].
13.
Поляризованный свет - световые волны, электромагнитные колебания которых происходятв одной плоскости, получают пропусканием света через призму Николя или поляроид.
14.
Иоганн Вислиценус выделил (1863-75 гг.) из природных объектов две молочныекислоты: оптически неактивную, образующуюся в скисшем молоке (молочная
кислота брожения), и правовращающую, которая выделяется в работающей мышце
(мясомолочная кислота).
Сейчас известно, что молочная
кислота
(2-гидроксипропановая,
СН3С*Н(ОН)СО2Н) существует в виде
двух оптических антиподов:
L-(+)-молочная кислота;
D-( )-молочная
(мясо-молочная)
кислота (т. пл. 53 °С, [α]D20 +2.26°, c =
1.24% H2O).
Молочная
кислота
брожения
представляет, оптически не активную
рацемическую смесь D-( )- и L-(+)энантиомеров в отношении 50/50 (т.
пл. 18 °С). Рацематы отличаются по
физическим
свойствам
от
составляющих их энантиомеров.
15.
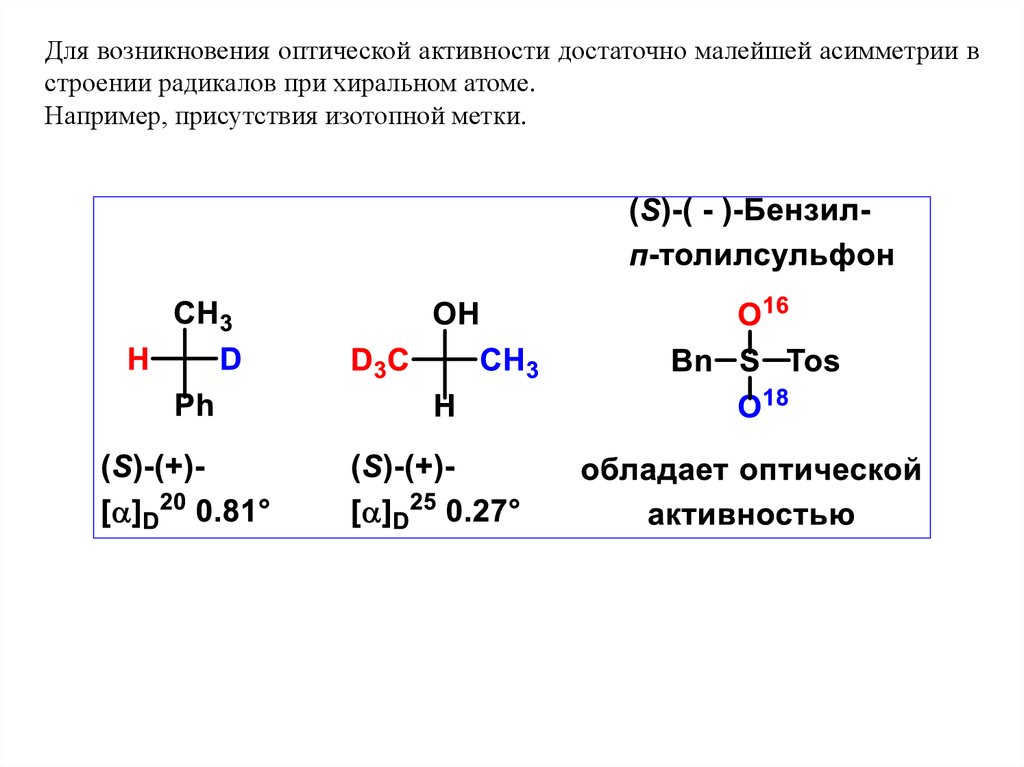
Для возникновения оптической активности достаточно малейшей асимметрии встроении радикалов при хиральном атоме.
Например, присутствия изотопной метки.
16.
Оптическая изомерияХиральные объекты в природе
Charonia tritonis
17.
Проекционные формулы Фишера (1891 г.)Для изображения асимметрического атома на плоскости пользуются проекционными
формулами Фишера.
Различные способы записи проекционных формул энантиомеров молочной кислоты
Энантиомеры, или зеркальные изомеры, обладают
одинаковыми физическими и химическими свойствами,
отличаются лишь направлением вращения плоскости
поляризации света: один вращает вправо (+), второй на тот
же угол влево (-).
Эмиль Герман
Фишер —
немецкий химик,
лауреат
Нобелевской
премии по химии
1902 года
18.
Поляриметр, показывая знак и величину вращения, не дает ответа на главный вопрос,какую конфигурацию имеет рассматриваемый хиральный центр.
В стереохимии различают два типа конфигураций – абсолютную и относительную.
Абсолютная конфигурация устанавливается независимым путем, например, с
помощью рентгено-структурного анализа. Получают фотографию молекулы.
Относительная конфигурация устанавливается относительно какого-то стандарта,
конфигурации какого-то выбранного вещества.
Фишер выбрал в качестве стандарта для своей системы D-глицериновый альдегид,
которому приписал абсолютную конфигурацию изображённую выше. Его
предположение оказалось верным.
Эти соединения имеют одну и ту же относительную конфигурацию. В этом ряду
установлена абсолютная конфигурация одного из членов ряда, что автоматически даёт
абсолютные конфигурации других членов ряда. Нет прямых корреляций между
знаком вращения и конфигурацией вещества. Два соединения с одной и той же
относительной конфигурацией могут иметь противоположные знаки вращения и,
наоборот, сходные соединения с одним и тем же знаком вращения могут иметь
противоположные относительные конфигурации.
19.
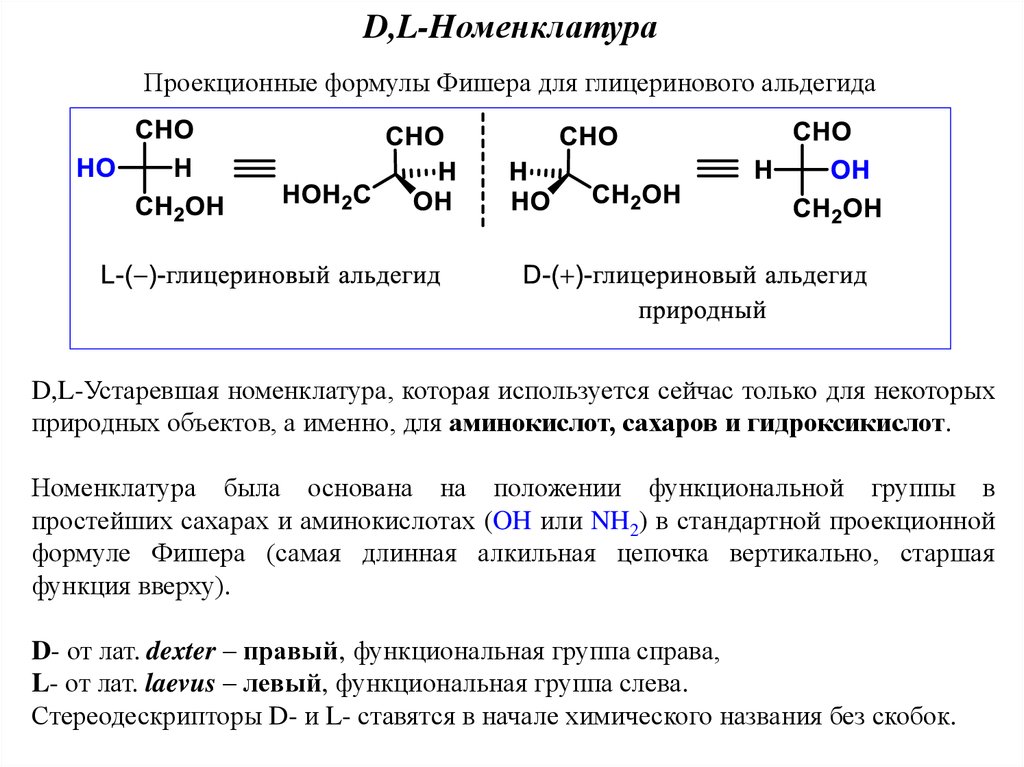
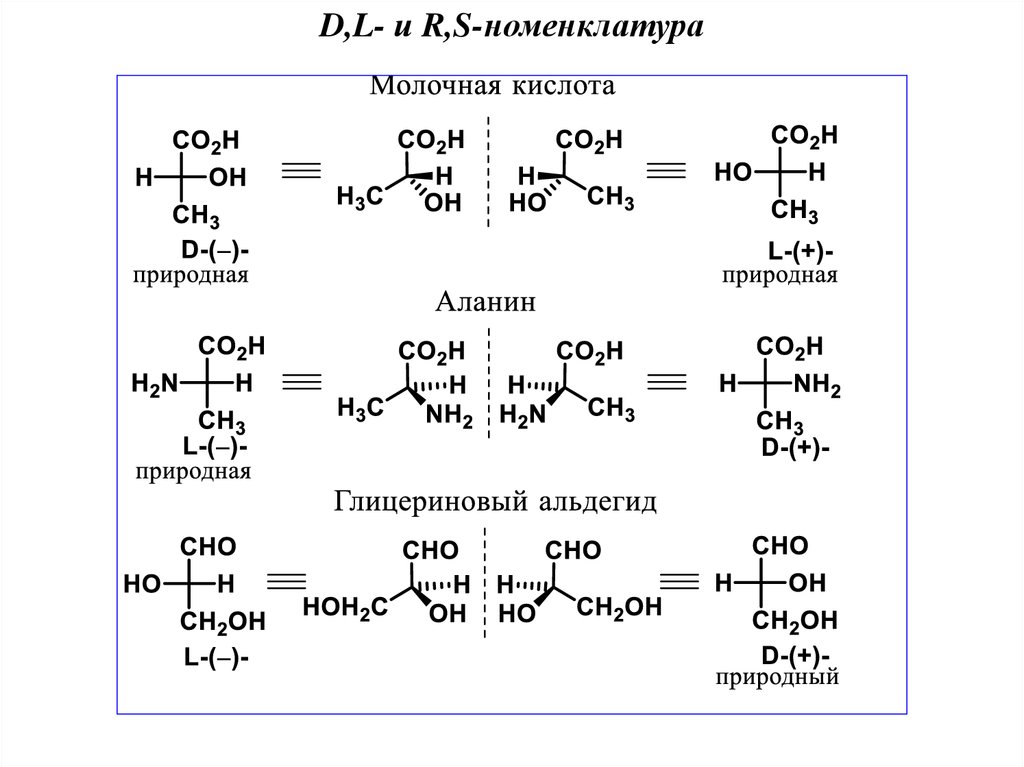
D,L-HоменклатураПроекционные формулы Фишера для глицеринового альдегида
D,L-Устаревшая номенклатура, которая используется сейчас только для некоторых
природных объектов, а именно, для аминокислот, сахаров и гидроксикислот.
Номенклатура была основана на положении функциональной группы в
простейших сахарах и аминокислотах (OH или NH2) в стандартной проекционной
формуле Фишера (самая длинная алкильная цепочка вертикально, старшая
функция вверху).
D- от лат. dexter – правый, функциональная группа справа,
L- от лат. laevus – левый, функциональная группа слева.
Стереодескрипторы D- и L- ставятся в начале химического названия без скобок.
20.
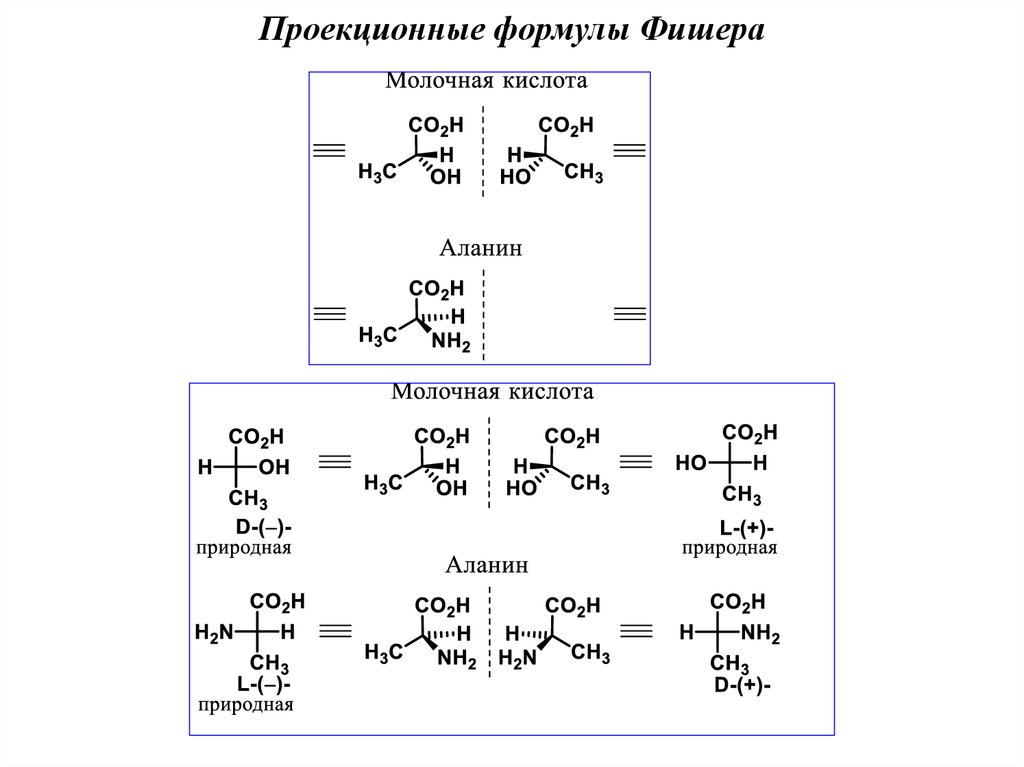
Проекционные формулы Фишера21.
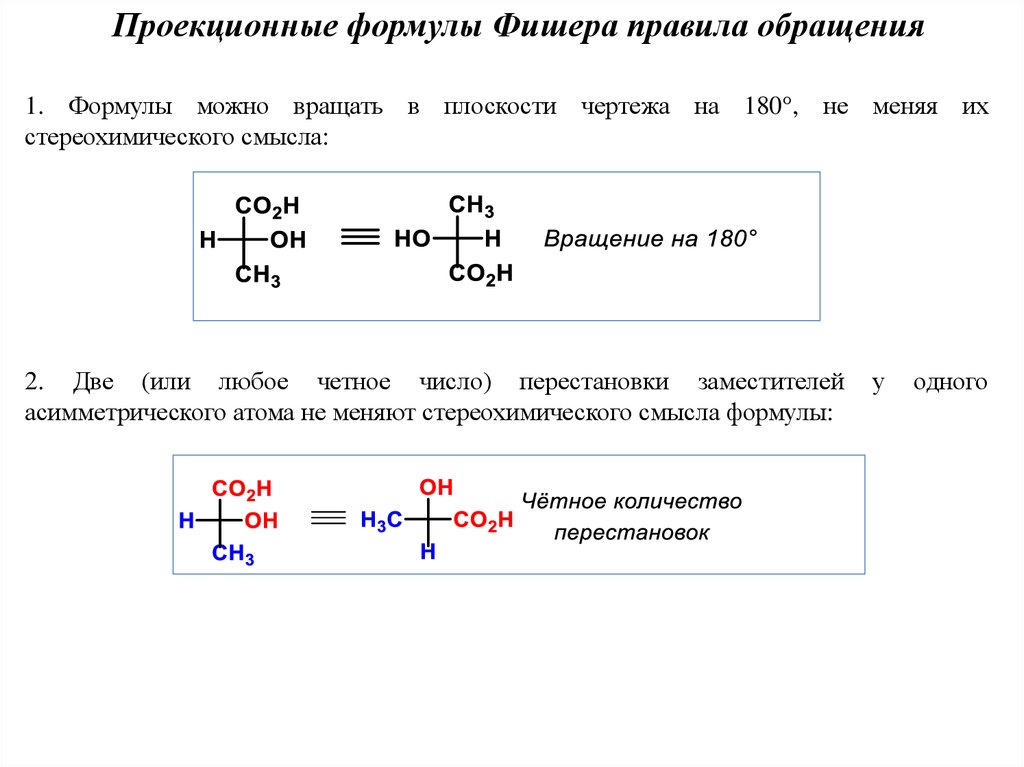
Проекционные формулы Фишера правила обращения1. Формулы можно вращать в плоскости чертежа на 180°, не меняя их
стереохимического смысла:
2. Две (или любое четное число) перестановки заместителей
асимметрического атома не меняют стереохимического смысла формулы:
у
одного
22.
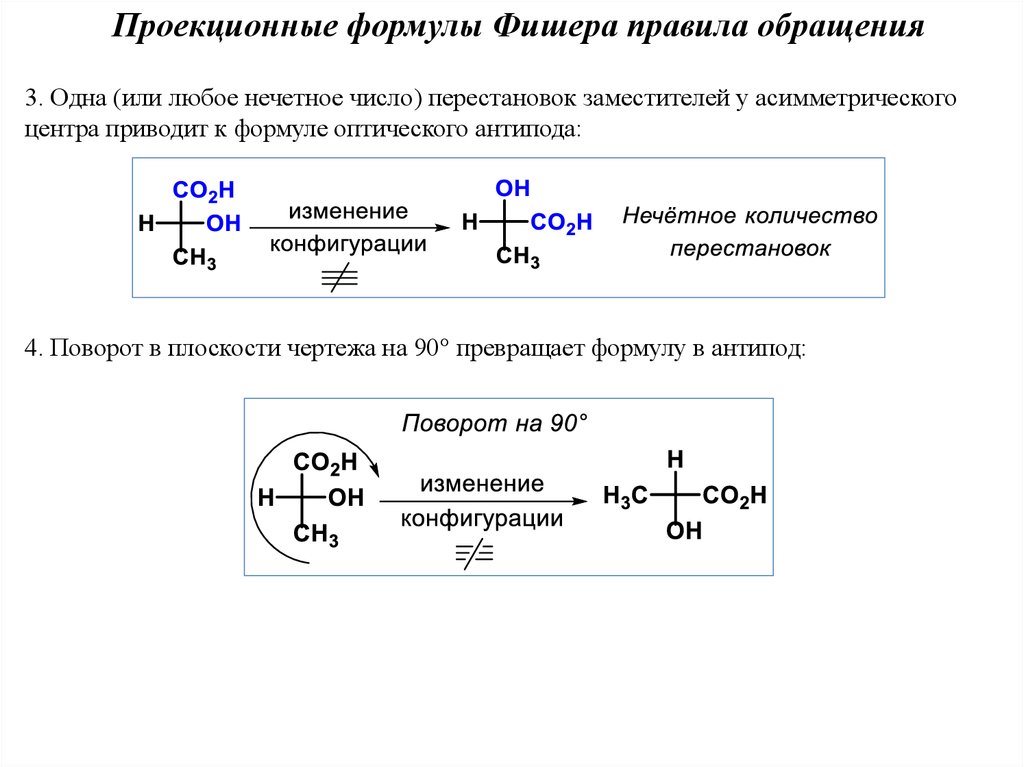
Проекционные формулы Фишера правила обращения3. Одна (или любое нечетное число) перестановок заместителей у асимметрического
центра приводит к формуле оптического антипода:
4. Поворот в плоскости чертежа на 90° превращает формулу в антипод:
23.
Проекционные формулы Фишера правила обращения5. Вместо перестановок проекционные формулы можно преобразовывать путем
вращения любых трех заместителей по часовой стрелке или против нее; четвертый
заместитель при этом положения не меняет (такая операция эквивалентна двум
перестановкам):
6. Проекционные формулы нельзя выводить из плоскости чертежа (т.е. нельзя,
например, рассматривать их “на просвет” с обратной стороны бумаги при этом
стереохимический смысл формулы изменится).
24.
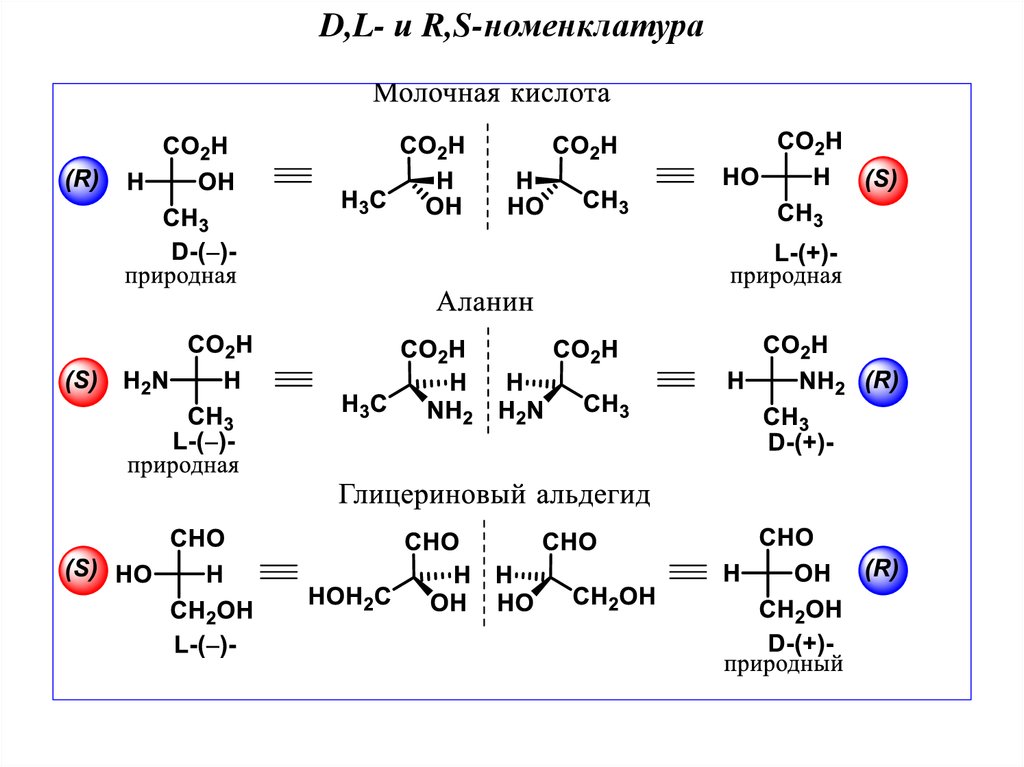
Абсолютная конфигурация. Система Кана-Ингольда-Прелога(КИП) или R,S - система
Номенклатура была предложена в 1951-56 гг. коллективом химиков: Робертом
Каном, Кристофером Ингольдом (Англия) и Владимиром Прелогом (Швейцария).
Для оптических изомеров были введены обозначения:
S (от лат. sinister – левый),
R (лат. rectus – правый).
R,S-номенклатуру можно использовать для любых типов соединений
Рацемат по номенклатуре КИП обозначают символом (R,S).
Следует отметить, что буквы R,S указывают лишь на строение молекулы (“правое”
или “левое” расположение определенных химических групп) и не связаны ни с
D,L-номенклатурой, ни с направлением оптического вращения. Последнее
обозначают знаками плюс и минус, например, D-(–)-фруктоза, D-(+)-глюкоза.
Конфигурационные дескрипторы ставятся перед названием соединения, выделятся
курсивом, заключаются в круглые скобки и отделяются от основного названия
дефисом – (R)-миндальная кислота. Если в соединении несколько
асимметрических атомов углерода, то перед дескриптором ставится номер атома
углерода: (2R,3S)-2-хлор-3-гидроксибутановая кислота.
25.
Номенклатура оптических изомеров КИП, (R,S)-номенклатура26.
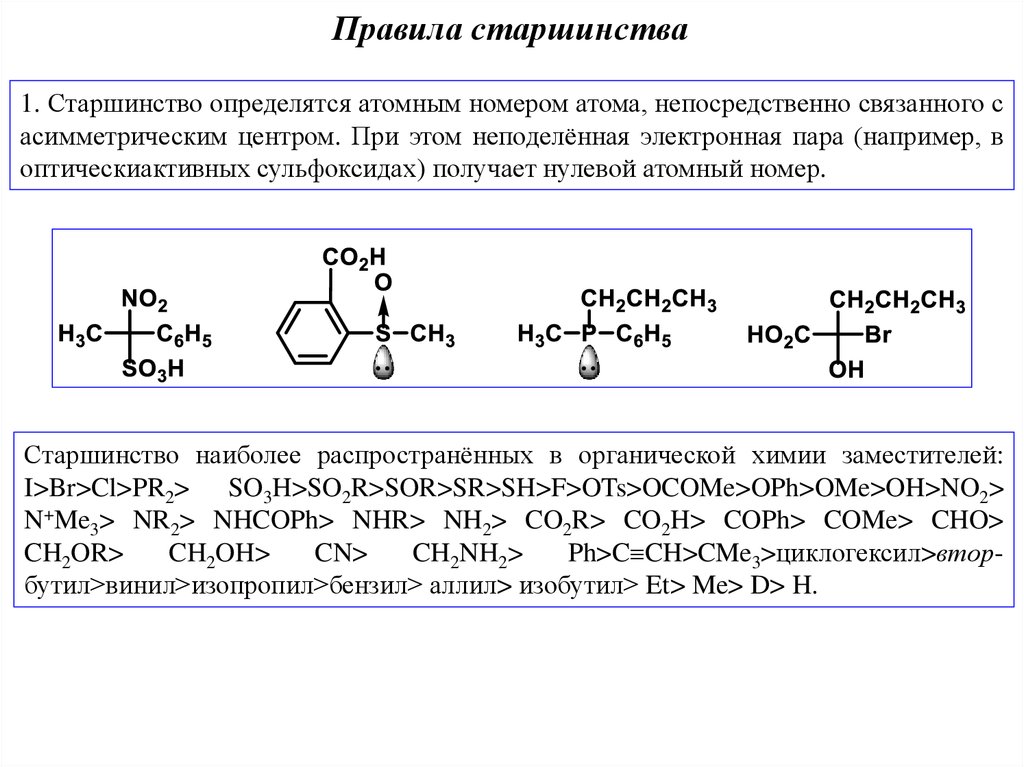
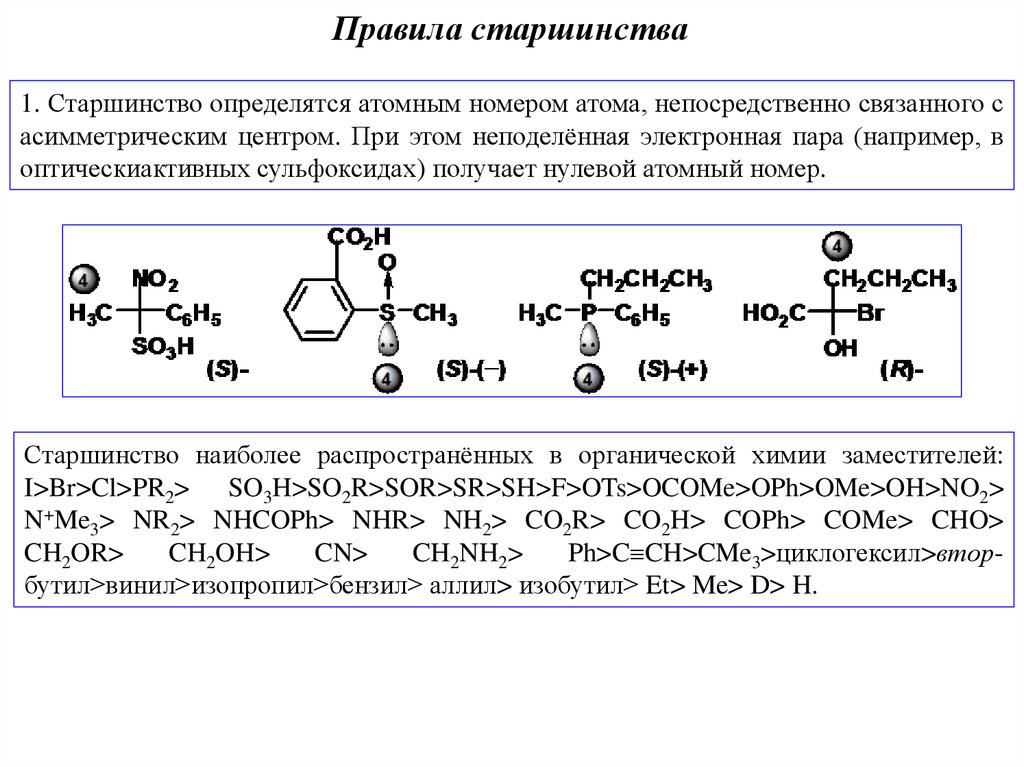
Правила старшинства1. Старшинство определятся атомным номером атома, непосредственно связанного с
асимметрическим центром. При этом неподелённая электронная пара (например, в
оптическиактивных сульфоксидах) получает нулевой атомный номер.
Старшинство наиболее распространённых в органической химии заместителей:
I>Br>Cl>PR2> SO3H>SO2R>SOR>SR>SH>F>OTs>OCOMe>OPh>OMe>OH>NO2>
N+Me3> NR2> NHCOPh> NHR> NH2> CO2R> CO2H> COPh> COMe> CHO>
CH2OR>
CH2OH>
CN>
CH2NH2>
Ph>C CH>CMe3>циклогексил>вторбутил>винил>изопропил>бензил> аллил> изобутил> Et> Me> D> H.
27.
Правила старшинства1. Старшинство определятся атомным номером атома, непосредственно связанного с
асимметрическим центром. При этом неподелённая электронная пара (например, в
оптическиактивных сульфоксидах) получает нулевой атомный номер.
Старшинство наиболее распространённых в органической химии заместителей:
I>Br>Cl>PR2> SO3H>SO2R>SOR>SR>SH>F>OTs>OCOMe>OPh>OMe>OH>NO2>
N+Me3> NR2> NHCOPh> NHR> NH2> CO2R> CO2H> COPh> COMe> CHO>
CH2OR>
CH2OH>
CN>
CH2NH2>
Ph>C CH>CMe3>циклогексил>вторбутил>винил>изопропил>бензил> аллил> изобутил> Et> Me> D> H.
28.
Правила старшинства2. Если два атома, связанные непосредственно с асимметрическим центром,
одинаковы, то переходят к рассмотрению следующего “слоя” атомов. Т.е. переходят
к рассмотрению атомов отстоящих от хирального на две связи. Если и они
одинаковы, то процедуру распространяют на атомы, отстоящие от хирального на
три, четыре и т.д. связи. Перед тем как перейти к следующему слою атомов
рассматривают все атомы предыдущего.
29.
Правила старшинства3. При наличии кратных связей,
они
“раскрываются”,
превращаются в ординарные.
Причём к каждому атому
присоединяются
дополнительные “фантомные”
(комплементарные) атомы (один
в случае раскрытия двойной
связи, два – для тройной). Эти
дополнительные
атомы
заключают в круглые скобки и
считают, что они не несут
никаких
заместителей
в
следующем слое. Так же
поступают с циклическими и
ароматическими соединениями.
Фантомный атом углерода - (С)
считается младше, чем реальный
атом углерода - С, но старше,
чем реальный атом с более
низким атомным номером.
30.
Правила старшинства3. При наличии кратных связей, они “раскрываются”, превращаются в ординарные.
Причём к каждому атому присоединяются дополнительные “фантомные”
(комплементарные) атомы (один в случае раскрытия двойной связи, два – для
тройной).
4
(O)
C=O
C O
(C)
C=CH 2
C N
C CH
(C)
(C)
CHO
(H 3CO) 2HC
COCH3
CO2 H
C CH2
1
(N)
(C)
C N
(C)
(N)
4
H3 C
С
HC
CN
CH2 NO 2
2
CH2 N(CH 3 )2
H3 C
(C) N
(N)
1
H C
C N (C)
(N)
(N) (C) (S)CH2 NO 2
3
(C) (C) (C) (C) (C)
C C
H H
(C)
H H
C C
N CH2 N(CH 3 )2
HC
(C) (C)
C C H
(C) (C)
HC
2
O-(C)
H
C (O)
3
H 3C O
CH 3
H C
C O-(C)
H 3 C O C OH (O)
(R)(O) O-(C)
C C (C)
H H
H H
C C (C)
(C) (C) (C) (C) (C)
31.
D,L- и R,S-номенклатура32.
D,L- и R,S-номенклатура33.
Яблочная (оксиянтарная) кислота. Определим конфигурацию её хирального центра.34.
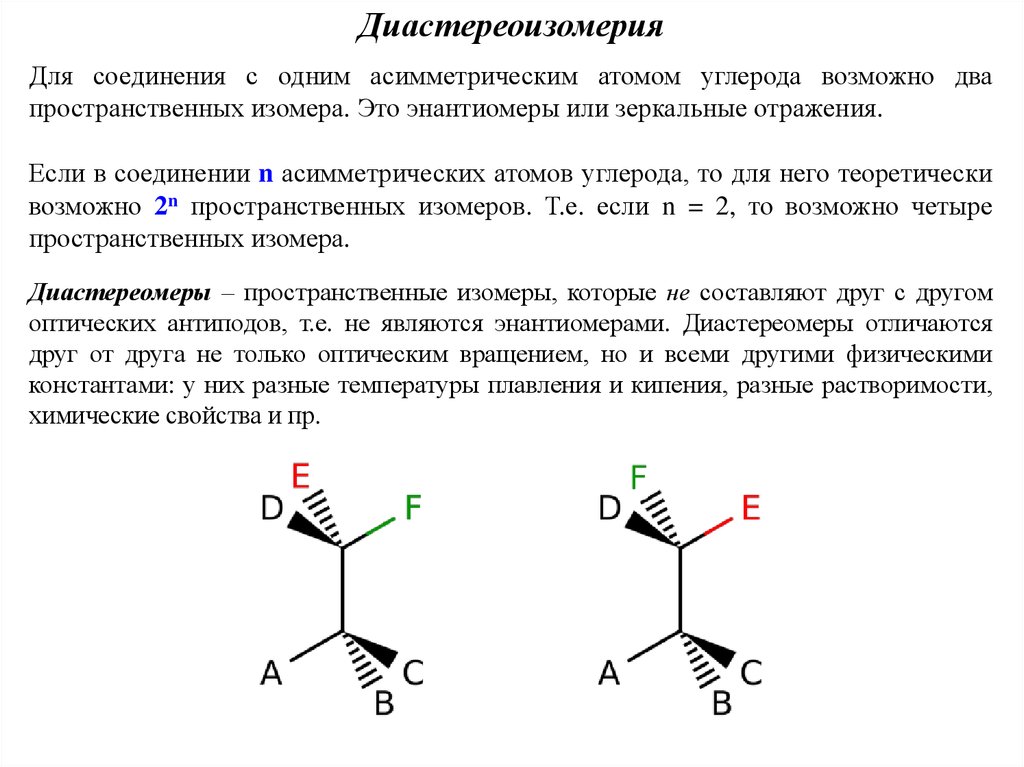
ДиастереоизомерияДля соединения с одним асимметрическим атомом углерода возможно два
пространственных изомера. Это энантиомеры или зеркальные отражения.
Если в соединении n асимметрических атомов углерода, то для него теоретически
возможно 2n пространственных изомеров. Т.е. если n = 2, то возможно четыре
пространственных изомера.
Диастереомеры – пространственные изомеры, которые не составляют друг с другом
оптических антиподов, т.е. не являются энантиомерами. Диастереомеры отличаются
друг от друга не только оптическим вращением, но и всеми другими физическими
константами: у них разные температуры плавления и кипения, разные растворимости,
химические свойства и пр.
35.
ДиастереоизомерияПространственные изомеры хлоряблочной кислоты (n = 2)
Названия эритро- и трео- происходят от названий углеводов эритрозы и треозы.
36.
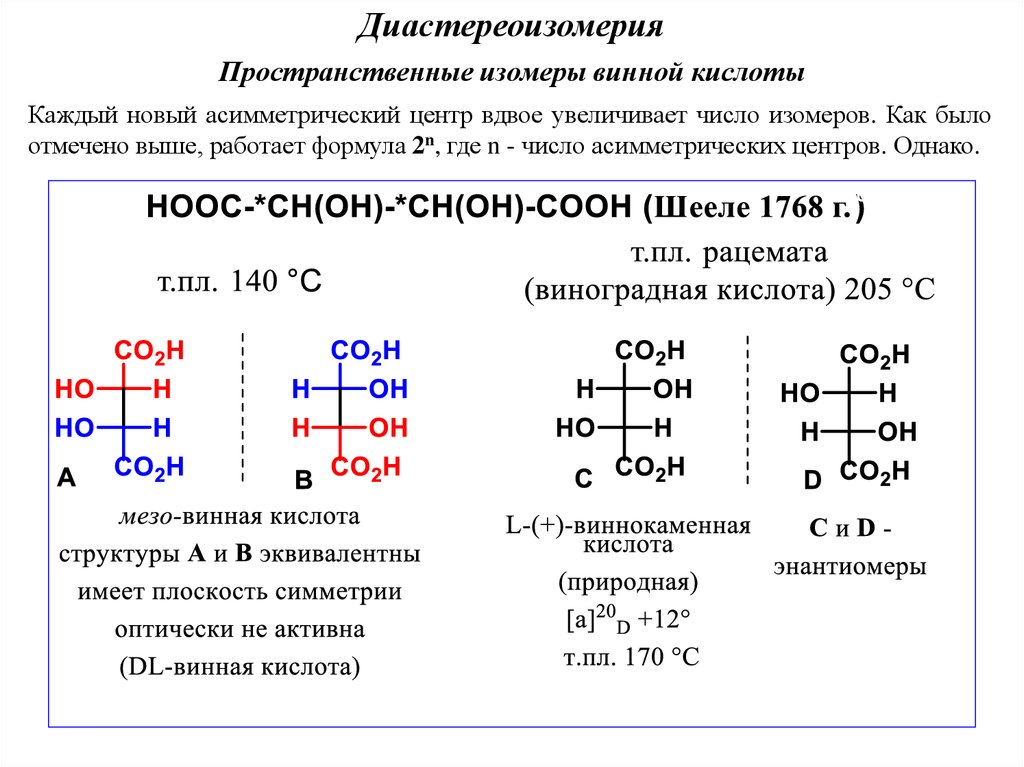
ДиастереоизомерияПространственные изомеры винной кислоты
Каждый новый асимметрический центр вдвое увеличивает число изомеров. Как было
отмечено выше, работает формула 2n, где n - число асимметрических центров. Однако.
37.
ДиастереоизомерияДавайте теперь установим конфигурацию хиральных центров винных кислот по R,Sсистеме. Делаем последовательно две перестановки заместителей у второго (С2) и
третьего (С3) атомов углерода.
Значит конфигурация D-(+)-винной кислоты (2R,3R)-. Соответственно у D-(-)-винной
кислоты – (2S,3S)-. Это оптические антиподы.
38.
ДиастереоизомерияОпределим аналогично конфигурации хиральных центров мезовинной кислоты:
Таким образом, мезовинная кислота имеет (2R,3S) - конфигурацию
39.
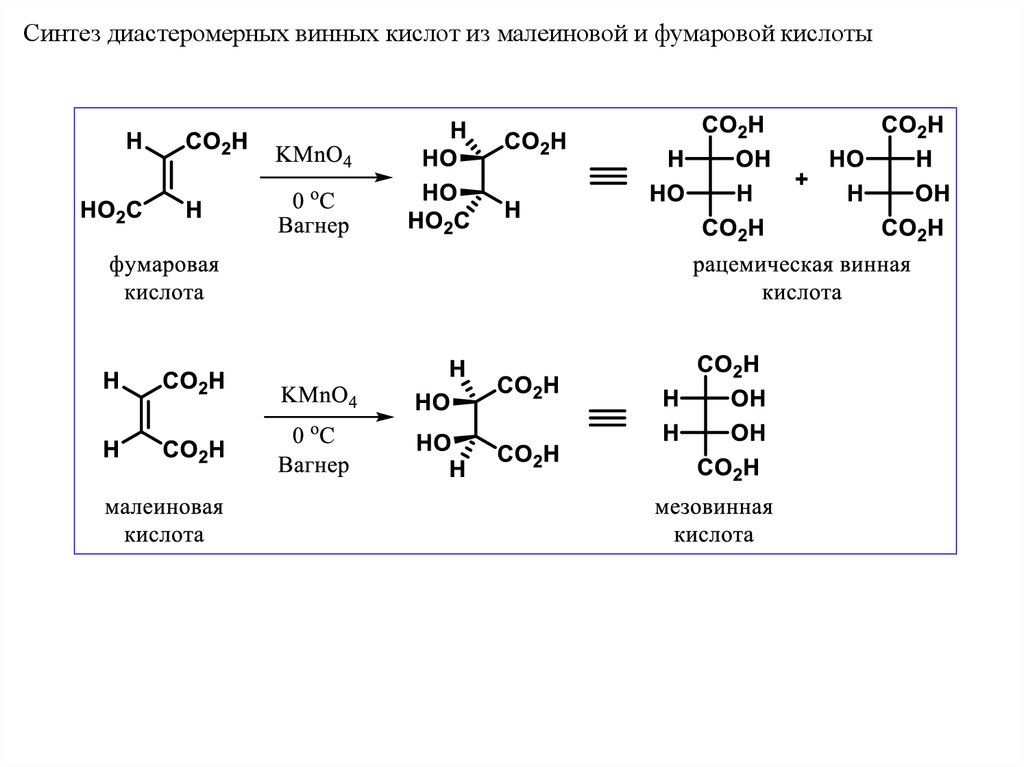
Синтез диастеромерных винных кислот из малеиновой и фумаровой кислоты40.
Способы выделения индивидуальных энантиомеровиз рацематов
Во всех химических реакциях без участия хиральных молекул образуются
рацемические смеси.
1) Механический. Метод Пастера. Энантиомеры кристаллизуются в виде
конгломерата – механической смеси лево- и правовращающих кристаллов. Такие
кристаллы являются зеркальным отражением друг друга, имеют гемиэдрические
грани по которым можно различить оптические антиподы. Такую смесь можно
механически разобрать, пользуясь микроскопом и пинцетом.
2) Разделение с помощью хроматографии на оптически активных сорбентах
3) Микробиологический метод. Определенный вид природных субстанций (грибки,
ферменты, бактерии) взаимодействует лишь с одним антиподом, в то время как
второй остаётся неизменным.
4) Химический. Суть метода заключается в том, что энантиомеры превращают в
диастереомеры, которые уже обладают различной растворимостью. Например, для
разделения кислот используют один из антиподов оптически активной кислоты
(чаще всего D-камфорсульфокислота). Полученные соли будут диастереомерами,
то есть будут иметь различную растворимость. Их разделяют многократной
кристаллизацией, а действием минеральной кислоты в первом случае или




















 chemistry
chemistry








