Similar presentations:
1_Сера_соед серы вприроде
1.
Сера,соединения серы
2.
Немало сера знаменита,И в древности её Гомер воспел,
С ней много тысяч лет прожито,
И человек в ней пользу разглядел.
3.
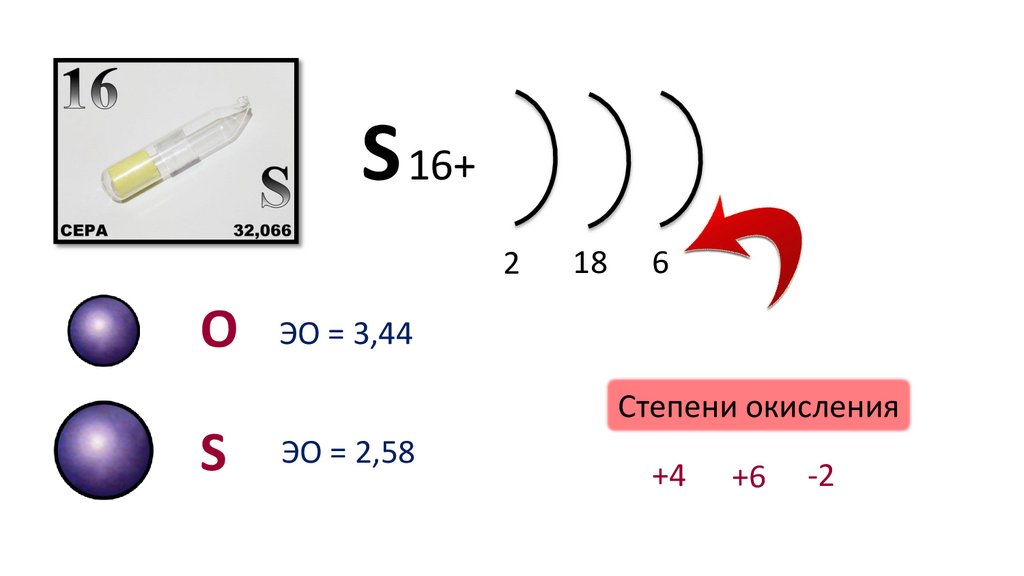
S 16+2
O
18
6
ЭО = 3,44
Степени окисления
S
ЭО = 2,58
+4
+6
-2
4.
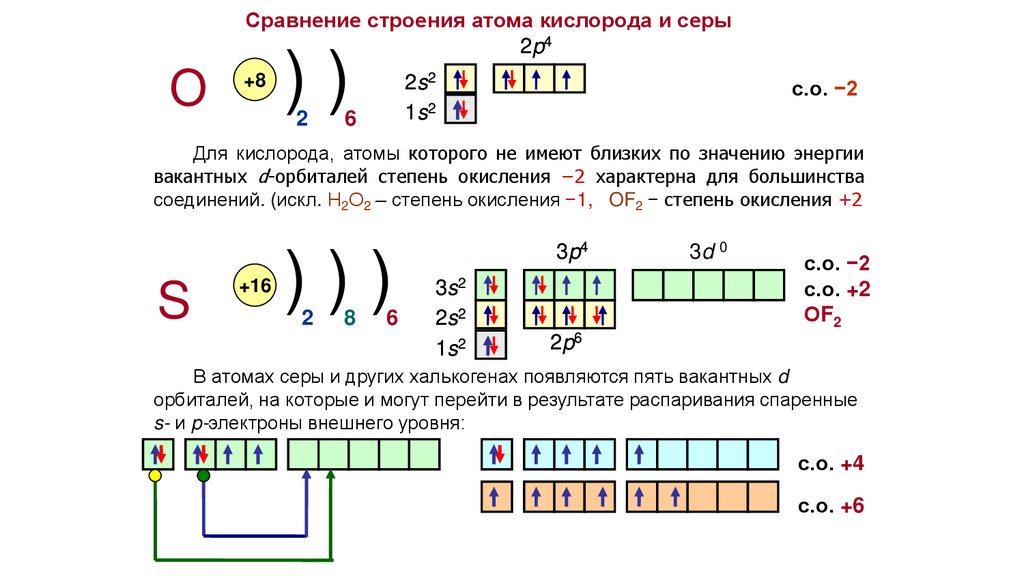
Сравнение строения атома кислорода и серы2p4
О
+8
))
2
2s2
1s2
6
с.о. −2
Для кислорода, атомы которого не имеют близких по значению энергии
вакантных d-орбиталей степень окисления −2 характерна для большинства
соединений. (искл. Н2О2 – степень окисления −1, OF2 − степень окисления +2
S
+16
)))
2
8
6
3p4
3s2
2s2
1s2
3d 0
с.о. −2
с.о. +2
ОF2
2p6
В атомах серы и других халькогенах появляются пять вакантных d
орбиталей, на которые и могут перейти в результате распаривания спаренные
s- и p-электроны внешнего уровня:
с.о. +4
с.о. +6
5.
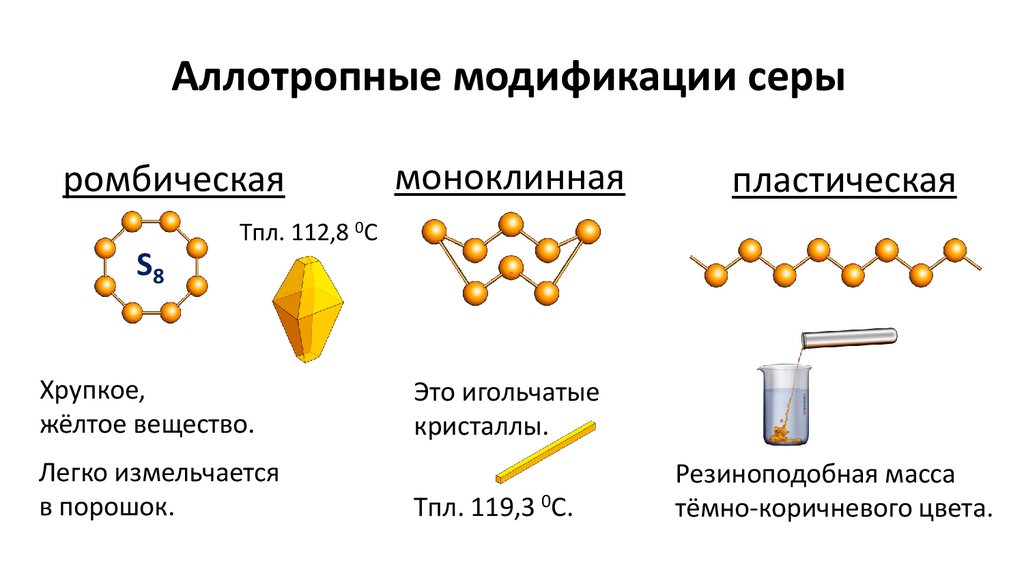
Аллотропные модификации серыромбическая
моноклинная
пластическая
Tпл. 112,8 0С
S8
Хрупкое,
жёлтое вещество.
Легко измельчается
в порошок.
Это игольчатые
кристаллы.
Tпл. 119,3 0С.
Резиноподобная масса
тёмно-коричневого цвета.
6.
Сера не растворяется в воде.Кристаллы серы в воде тонут, а
порошок плавает по поверхности.
Сера хорошо растворима в
сероуглероде.
7.
Сера не растворяется в воде.Кристаллы серы в воде тонут, а
порошок плавает по поверхности.
Сера хорошо растворима в
сероуглероде.
8.
Сера не растворяется в воде.Кристаллы серы в воде тонут, а
порошок плавает по поверхности.
Сера хорошо растворима в
сероуглероде.
9.
«Сира» означает светло-желтыйВ Древнем Египте сера
применялась для приготовления
красок, беления тканей,
изготовления косметических
средств
10.
«Сира» означает светло-желтыйВ Древнем Египте сера
применялась для приготовления
красок, беления тканей,
изготовления косметических
средств
11.
в Древнем Риме серу применяли длялечения кожных болезней.
В Древней Греции ее сжигали с
целью дезинфекции воздуха в
помещении.
12.
в Древнем Риме серу применяли длялечения кожных болезней.
В Древней Греции ее сжигали с
целью дезинфекции воздуха в
помещении.
13.
Сера и роман А. Дюма «Граф Монте-Кристо».В романе Дюма «Граф Монте-Kристо» аббат Фариа притворился, что у него кожная
болезнь. Ему для лечения дали серу, которую он в дальнейшем использовал для
изготовления пороха.
14.
Взаимодействие серы сметаллами
15.
t0
0
Ca + S = Ca+2S-2
Ca0 -2ē
= Ca+2 2
S0 + 2ē =
S-2
2
2
1 Ca0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
16.
t0
0
Ca + S = Ca+2S-2
Ca0 -2ē
= Ca+2 2
S0 + 2ē =
S-2
2
2
1 Ca0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
17.
t0
0
Ca + S = Ca+2S-2
Ca0 -2ē
= Ca+2 2
S0 + 2ē =
S-2
2
2
1 Ca0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
18.
t0
0
Ca + S = Ca+2S-2
Ca0 -2ē
= Ca+2 2
S0 + 2ē =
S-2
2
2
1 Ca0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
19.
t0
0
Ca + S = Ca+2S-2
Ca0 -2ē
= Ca+2 2
S0 + 2ē =
S-2
2
2
1 Ca0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
20.
t0
0
Ca + S = Ca+2S-2
Ca0 -2ē
= Ca+2 2
S0 + 2ē =
S-2
2
2
1 Ca0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
21.
t0
0
Ca + S = Ca+2S-2
Ca0 -2ē
= Ca+2 2
S0 + 2ē =
S-2
2
2
1 Ca0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
22.
Взаимодействие серы сртутью
23.
t0
0
Hg + S = Hg+2S-2
Hg0 -2ē
= Hg+2 2
S0 + 2ē =
S-2
2
2
1 Hg0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
Демеркуризация — удаление и обезвреживание ртути и её
соединений с помощью серы.
24.
t0
0
Hg + S = Hg+2S-2
Hg0 -2ē
= Hg+2 2
S0 + 2ē =
S-2
2
2
1 Hg0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
Демеркуризация — удаление и обезвреживание ртути и её
соединений с помощью серы.
25.
t0
0
Hg + S = Hg+2S-2
Hg0 -2ē
= Hg+2 2
S0 + 2ē =
S-2
2
2
1 Hg0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
Демеркуризация — удаление и обезвреживание ртути и её
соединений с помощью серы.
26.
t0
0
Hg + S = Hg+2S-2
Hg0 -2ē
= Hg+2 2
S0 + 2ē =
S-2
2
2
1 Hg0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
Демеркуризация — удаление и обезвреживание ртути и её
соединений с помощью серы.
27.
t0
0
Hg + S = Hg+2S-2
Hg0 -2ē
= Hg+2 2
S0 + 2ē =
S-2
2
2
1 Hg0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
Демеркуризация — удаление и обезвреживание ртути и её
соединений с помощью серы.
28.
t0
0
Hg + S = Hg+2S-2
Hg0 -2ē
= Hg+2 2
S0 + 2ē =
S-2
2
2
1 Hg0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
Демеркуризация — удаление и обезвреживание ртути и её
соединений с помощью серы.
29.
t0
0
Hg + S = Hg+2S-2
Hg0 -2ē
= Hg+2 2
S0 + 2ē =
S-2
2
2
1 Hg0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
Демеркуризация — удаление и обезвреживание ртути и её
соединений с помощью серы.
30.
t0
0
Hg + S = Hg+2S-2
Hg0 -2ē
= Hg+2 2
S0 + 2ē =
S-2
2
2
1 Hg0 –вос-ль, ок-ся
1 S0 –ок-ль, вос-ся
Демеркуризация — удаление и обезвреживание ртути и её
соединений с помощью серы.
31.
Взаимодействие серы сводородом
32.
t0
0
H2 + S = H2+S-2
H20 -2ē
= 2H +
S0 + 2ē = S-2
2 1 H20 –вос-ль, ок-ся
2
2 1 S0 –ок-ль, вос-ся
33.
t0
0
H2 + S = H2+S-2
H20 -2ē
= 2H +
S0 + 2ē = S-2
2 1 H20 –вос-ль, ок-ся
2
2 1 S0 –ок-ль, вос-ся
34.
t0
0
H2 + S = H2+S-2
H20 -2ē
= 2H +
S0 + 2ē = S-2
2 1 H20 –вос-ль, ок-ся
2
2 1 S0 –ок-ль, вос-ся
35.
t0
0
H2 + S = H2+S-2
H20 -2ē
= 2H +
S0 + 2ē = S-2
2 1 H20 –вос-ль, ок-ся
2
2 1 S0 –ок-ль, вос-ся
36.
t0
0
H2 + S = H2+S-2
H20 -2ē
= 2H +
S0 + 2ē = S-2
2 1 H20 –вос-ль, ок-ся
2
2 1 S0 –ок-ль, вос-ся
37.
t0
0
H2 + S = H2+S-2
H20 -2ē
= 2H +
S0 + 2ē = S-2
2 1 H20 –вос-ль, ок-ся
2
2 1 S0 –ок-ль, вос-ся
38.
Взаимодействие серы скислородом
39.
t0
0
O2 + S = S+4O2-2
O20 +4ē
= 2O -2 4
S0 - 4ē =
S+4
4
4
1 O20 – ок-ль, вос-ся
1 S0 –вос-ль, ок-ся
40.
t0
0
O2 + S = S+4O2-2
O20 +4ē
= 2O -2 4
S0 - 4ē =
S+4
4
4
1 O20 – ок-ль, вос-ся
1 S0 –вос-ль, ок-ся
41.
t0
0
O2 + S = S+4O2-2
O20 +4ē
= 2O -2 4
S0 - 4ē =
S+4
4
4
1 O20 – ок-ль, вос-ся
1 S0 –вос-ль, ок-ся
42.
t0
0
O2 + S = S+4O2-2
O20 +4ē
= 2O -2 4
S0 - 4ē =
S+4
4
4
1 O20 – ок-ль, вос-ся
1 S0 –вос-ль, ок-ся
43.
t0
0
O2 + S = S+4O2-2
O20 +4ē
= 2O -2 4
S0 - 4ē =
S+4
4
4
1 O20 – ок-ль, вос-ся
1 S0 –вос-ль, ок-ся
44.
t0
0
O2 + S = S+4O2-2
O20 +4ē
= 2O -2 4
S0 - 4ē =
S+4
4
4
1 O20 – ок-ль, вос-ся
1 S0 –вос-ль, ок-ся
45.
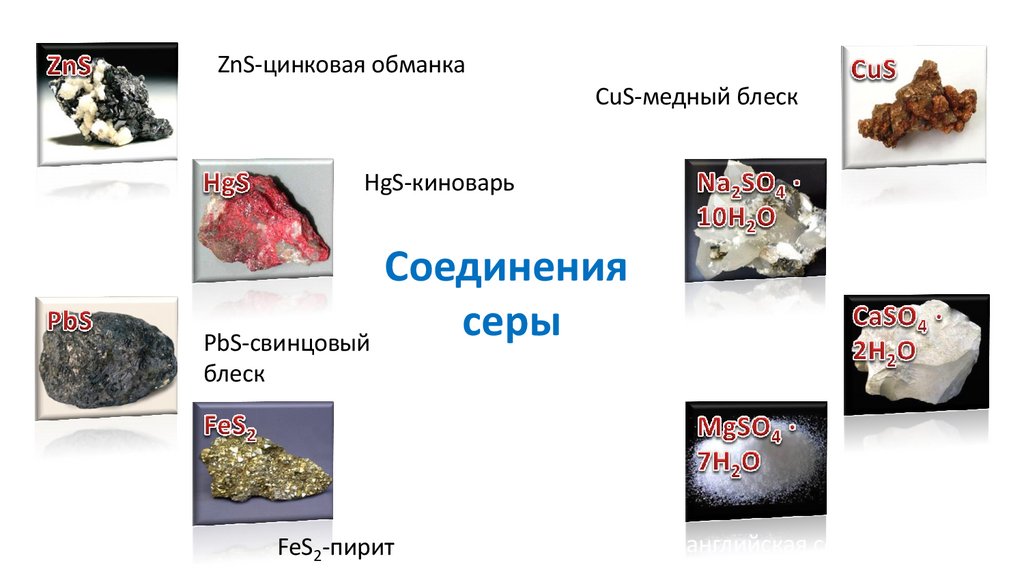
ZnS-цинковая обманкаCuS-медный блеск
HgS-киноварь
глауберова соль
Соединения
серы CaSO ·2H O-гипс
PbS-свинцовый
4
блеск
FeS2-пирит
2
английская соль
46.
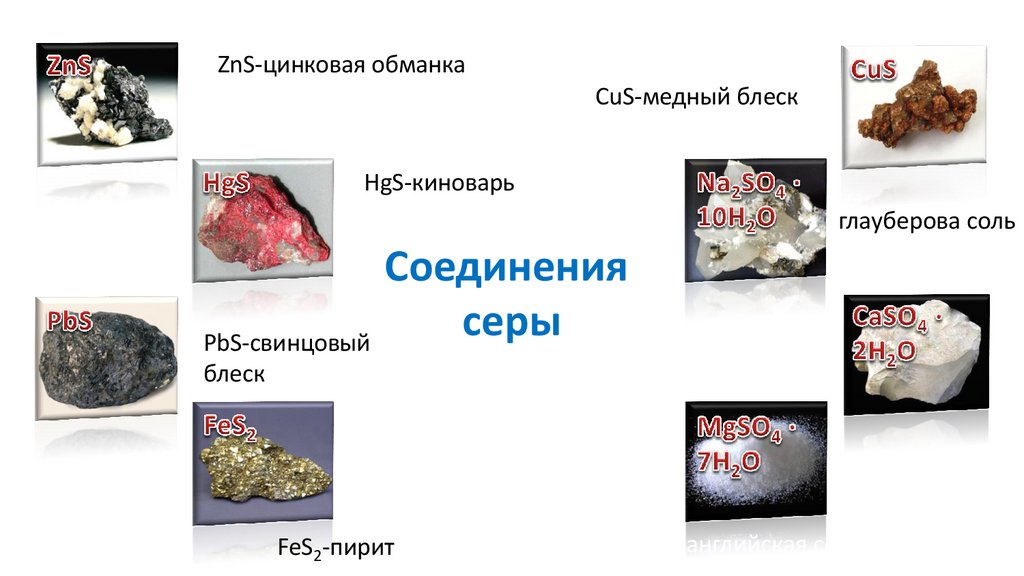
ZnS-цинковая обманкаCuS-медный блеск
HgS-киноварь
глауберова соль
Соединения
серы CaSO ·2H O-гипс
PbS-свинцовый
4
блеск
FeS2-пирит
2
английская соль
47.
ZnS-цинковая обманкаCuS-медный блеск
HgS-киноварь
глауберова соль
Соединения
серы CaSO ·2H O-гипс
PbS-свинцовый
4
блеск
FeS2-пирит
2
английская соль
48.
ZnS-цинковая обманкаCuS-медный блеск
HgS-киноварь
глауберова соль
Соединения
серы CaSO ·2H O-гипс
PbS-свинцовый
4
блеск
FeS2-пирит
2
английская соль
49.
ZnS-цинковая обманкаCuS-медный блеск
HgS-киноварь
глауберова соль
Соединения
серы CaSO ·2H O-гипс
PbS-свинцовый
4
блеск
FeS2-пирит
2
английская соль
50.
ZnS-цинковая обманкаCuS-медный блеск
HgS-киноварь
глауберова соль
Соединения
серы CaSO ·2H O-гипс
PbS-свинцовый
4
блеск
FeS2-пирит
2
английская соль
51.
ZnS-цинковая обманкаCuS-медный блеск
HgS-киноварь
глауберова соль
Соединения
серы CaSO ·2H O-гипс
PbS-свинцовый
4
блеск
FeS2-пирит
2
английская соль
52.
ZnS-цинковая обманкаCuS-медный блеск
HgS-киноварь
глауберова соль
Соединения
серы CaSO ·2H O-гипс
PbS-свинцовый
4
блеск
FeS2-пирит
2
английская соль
53.
ZnS-цинковая обманкаCuS-медный блеск
HgS-киноварь
глауберова соль
Соединения
серы CaSO ·2H O-гипс
PbS-свинцовый
4
блеск
FeS2-пирит
2
английская соль
54.
Сера входит в состав белков.Сера входит в состав гормонов и витаминов.
Сера участвует в окислительно-восстановительных
процессах организма.
55.
Применение серы56.
Сероводород57.
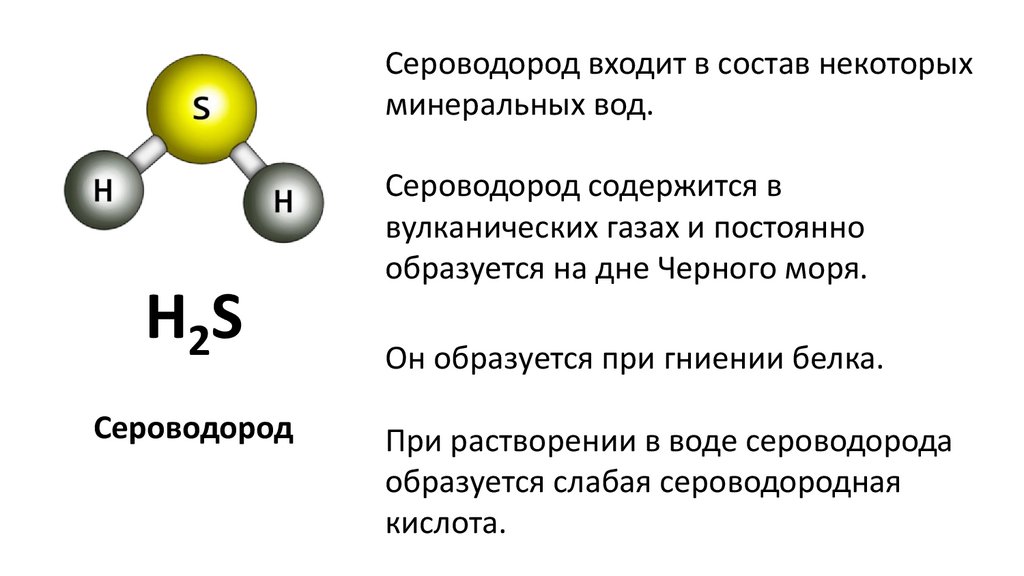
Сероводород представляет собойбесцветный газ с резким запахом.
Он ядовит и вызывает отравление даже
при незначительном содержании в
воздухе.
H2S
Сероводород
В одном объёме воды растворяется
2,5 объёма сероводорода.
Сероводород может накапливаться в
организме.
58.
Сероводород входит в состав некоторыхминеральных вод.
Сероводород содержится в
вулканических газах и постоянно
образуется на дне Черного моря.
H2S
Сероводород
Он образуется при гниении белка.
При растворении в воде сероводорода
образуется слабая сероводородная
кислота.
59.
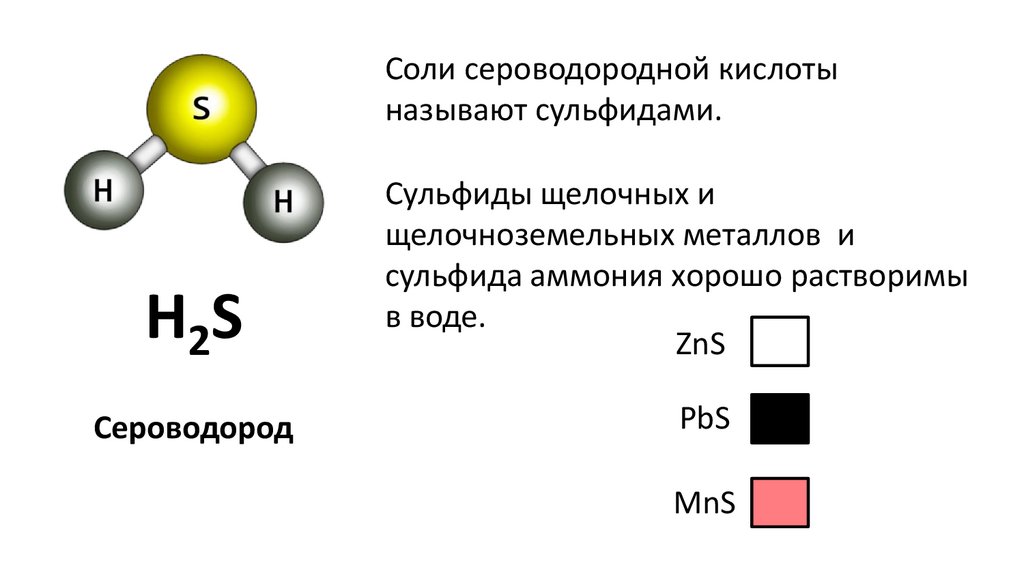
Соли сероводородной кислотыназывают сульфидами.
H2S
Сероводород
Сульфиды щелочных и
щелочноземельных металлов и
сульфида аммония хорошо растворимы
в воде.
ZnS
PbS
MnS
60.
Получение сероводорода влаборатории
61.
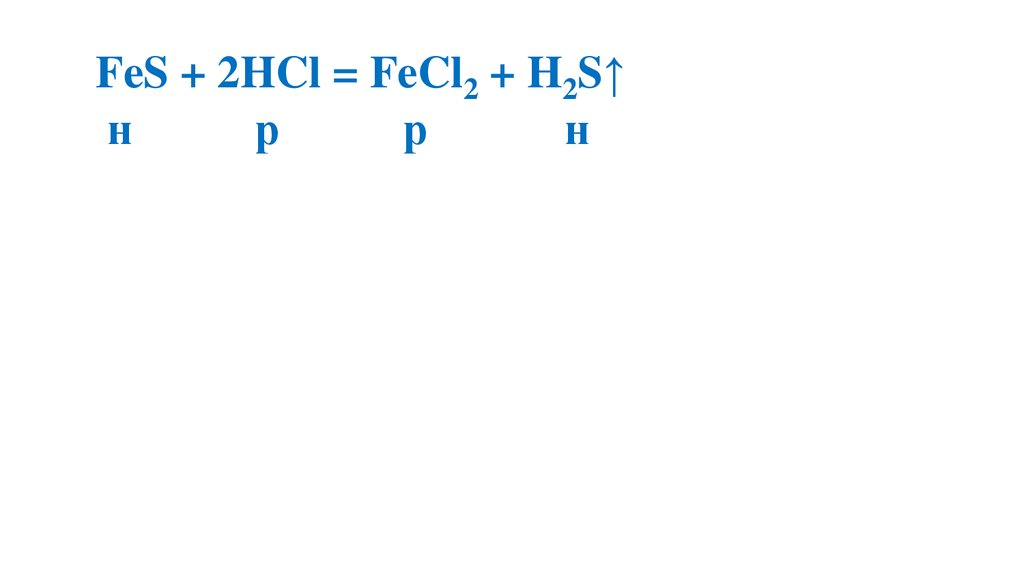
FeS + 2HCl = FeCl2 + H2S↑н
р
р
н
FeS + 2H++2Cl- = Fe+2+2Cl- + H2S↑
FeS + 2H+= Fe+2+ H2S↑
62.
FeS + 2HCl = FeCl2 + H2S↑н
р
р
н
FeS + 2H++2Cl- = Fe+2+2Cl- + H2S↑
FeS + 2H+= Fe+2+ H2S↑
63.
FeS + 2HCl = FeCl2 + H2S↑н
р
р
н
FeS + 2H++2Cl- = Fe+2+2Cl- + H2S↑
FeS + 2H+= Fe+2+ H2S↑
64.
FeS + 2HCl = FeCl2 + H2S↑н
р
р
н
FeS + 2H++2Cl- = Fe+2+2Cl- + H2S↑
FeS + 2H+= Fe+2+ H2S↑
65.
FeS + 2HCl = FeCl2 + H2S↑н
р
р
н
FeS + 2H++2Cl- = Fe+2+2Cl- + H2S↑
FeS + 2H+= Fe+2+ H2S↑
66.
FeS + 2HCl = FeCl2 + H2S↑н
р
р
н
FeS + 2H++2Cl- = Fe+2+2Cl- + H2S↑
FeS + 2H+= Fe+2+ H2S↑
67.
Горение сероводорода68.
2H2S-2 + 3O20 = 2H2O-2 + 2S+4O2↑6
2 S-2 – вос-ль,ок-ся
S-2 -6ē = S+4
12
0 – ок-ль,вос-ся
0
-2
3
4
O
O2 +4ē = 2O
2
69.
2H2S + O2 = 2H2O + 2S↓70.
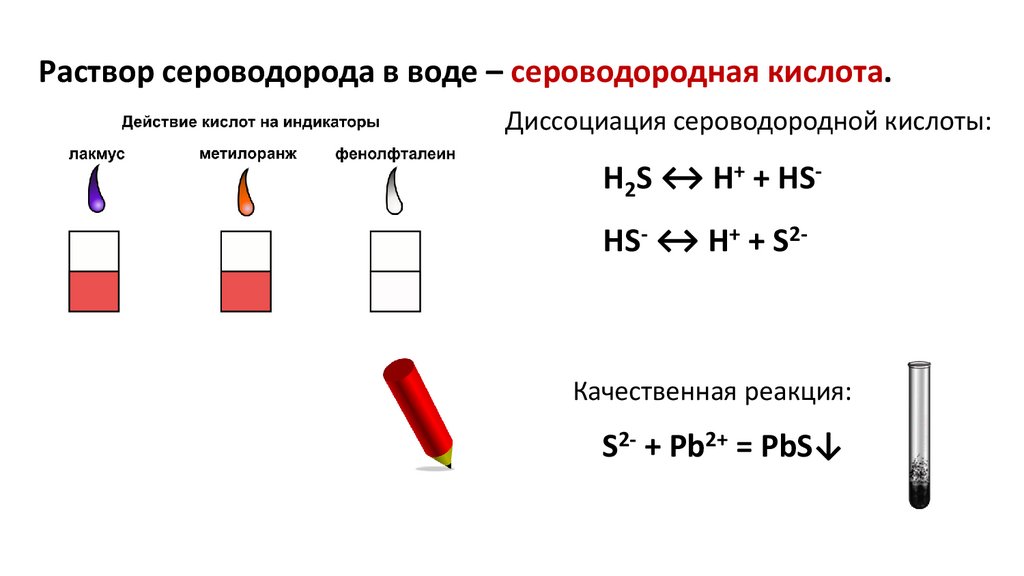
Раствор сероводорода в воде – сероводородная кислота.Диссоциация сероводородной кислоты:
H2S ↔ H+ + HSHS- ↔ H+ + S2-
Качественная реакция:
S2- + Pb2+ = PbS↓
71.
Оксид серы (IV)72.
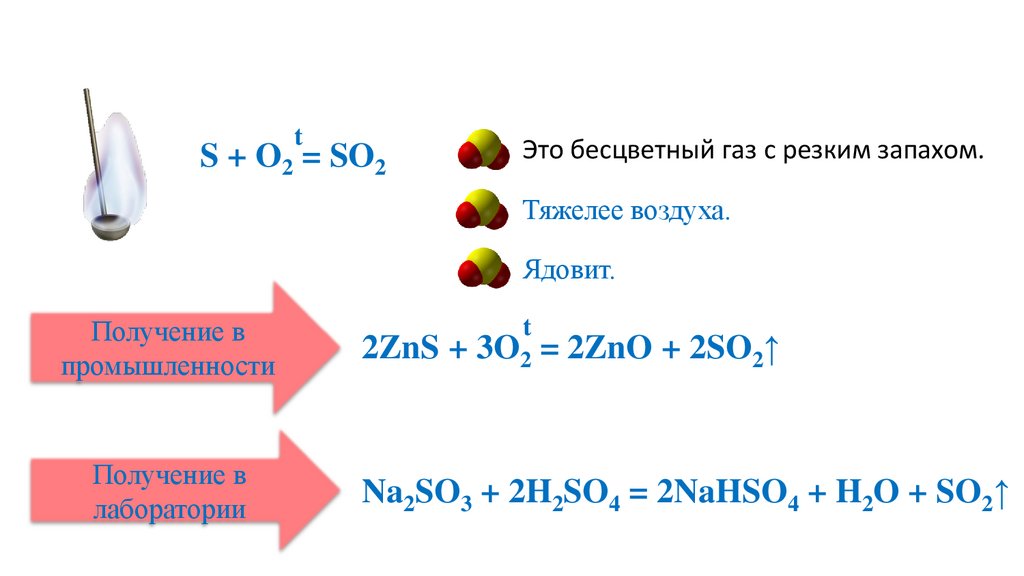
tS + O2 = SO2
Это бесцветный газ с резким запахом.
Тяжелее воздуха.
Ядовит.
Получение в
промышленности
Получение в
лаборатории
t
2ZnS + 3O2 = 2ZnO + 2SO2↑
Na2SO3 + 2H2SO4 = 2NaHSO4 + H2O + SO2↑
73.
Оксид серы (IV) – кислотный оксид.При растворении в воде образует сернистую
кислоту.
H2O + SO2 ↔ H2SO3
Соли сернистой кислоты называются
сульфитами.
Сернистая кислота может образовывать средние и
кислые соли.
Na2SO3 – сульфит натрия
NaHSO3 – гидросульфит натрия
74.
Обобщение75.
Сера – элемент VIA группы.У серы 6 электронов на внешнем энергетическом уровне.
В соединениях сера проявляет степени окисления +4, +6,
-2.
Сера проявляет восстановительные и окислительные
свойства.
Для серы характерны аллотропные модификации.
76.
Сера в природе находится в свободном состоянии и ввиде соединений.
Наиболее распространёнными соединениями серы
является оксид серы (IV) и сероводород.
Сера и её соединения находят широкое применение во
многих областях народного хозяйства.











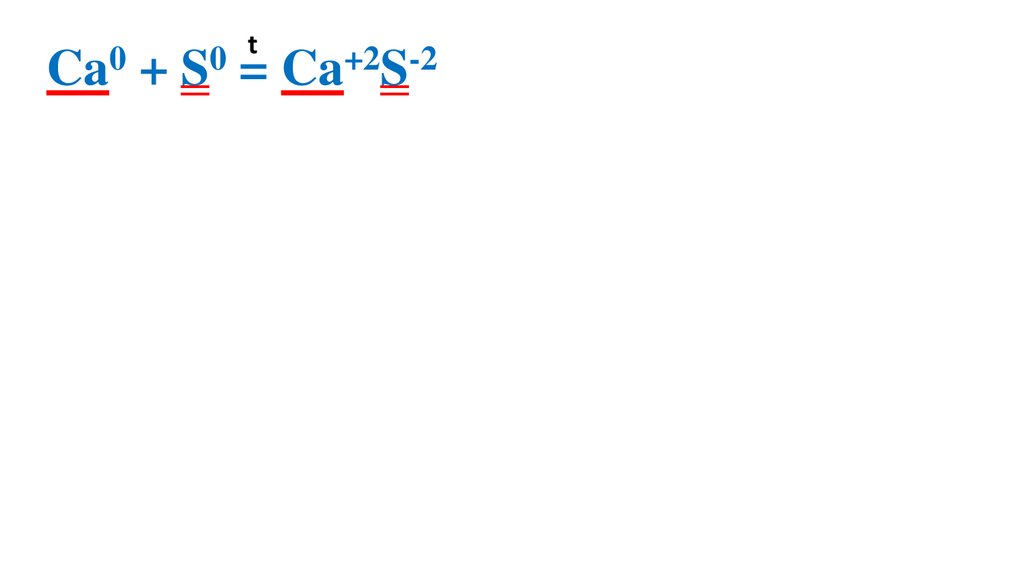
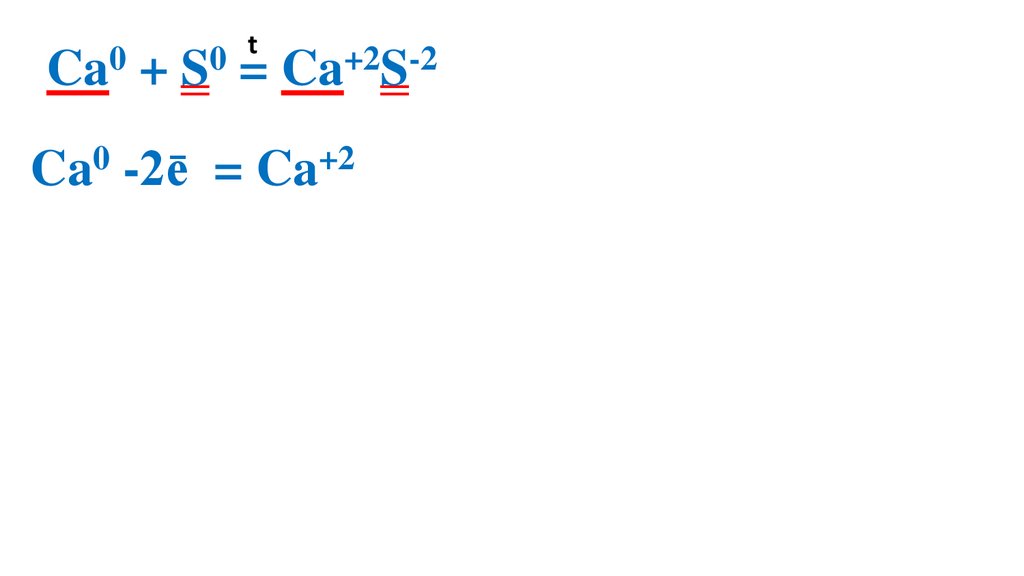
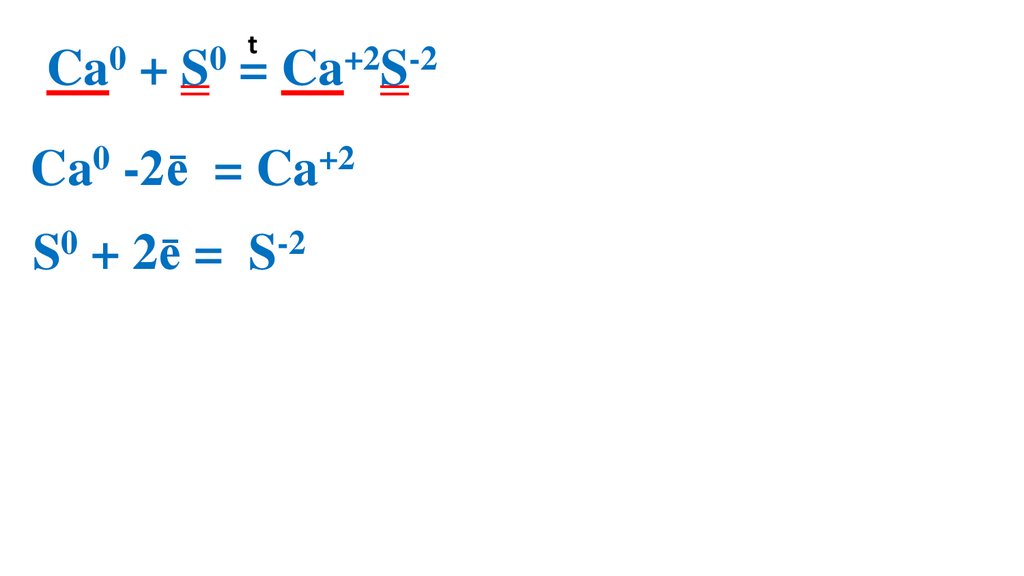
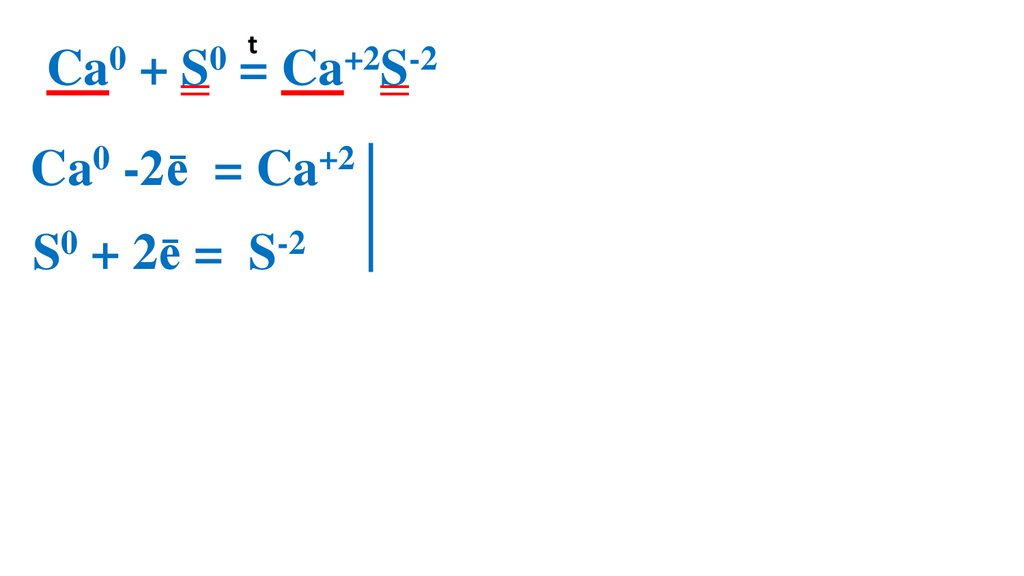
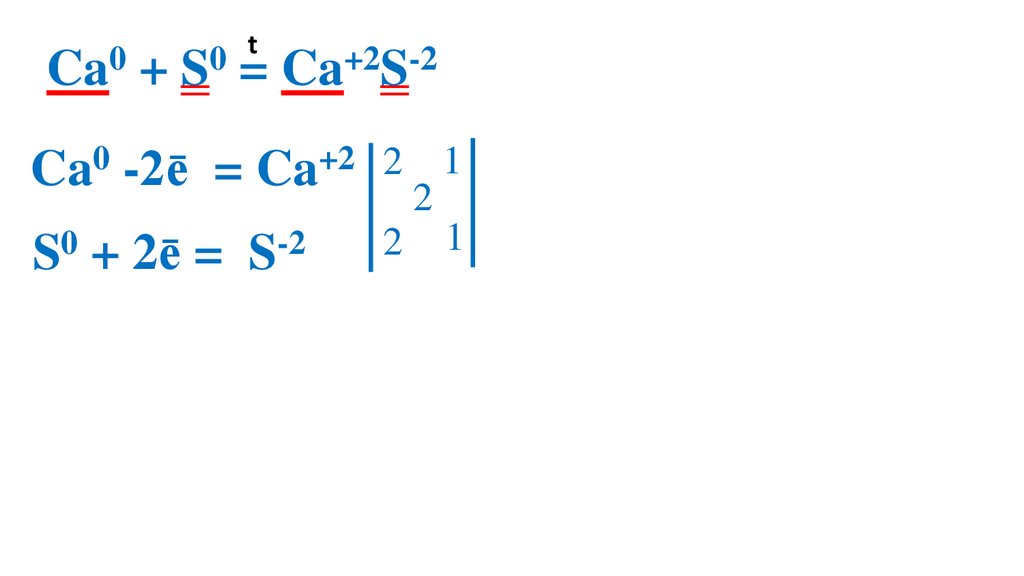
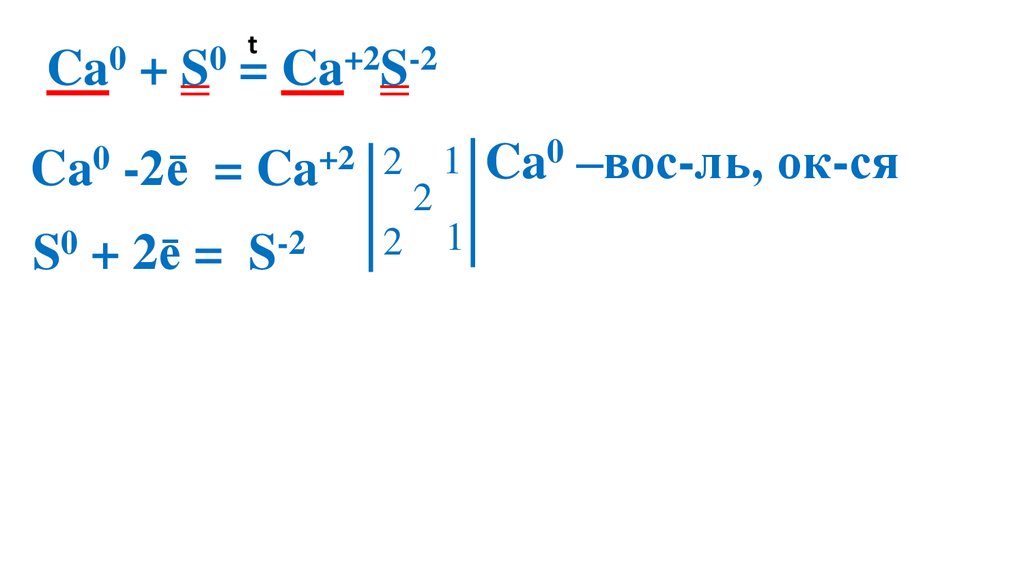
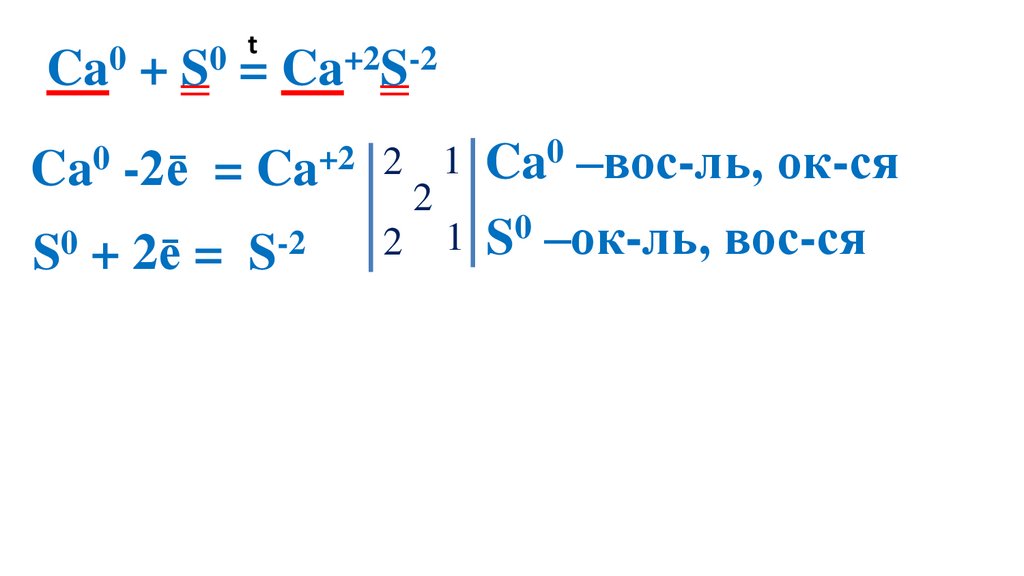

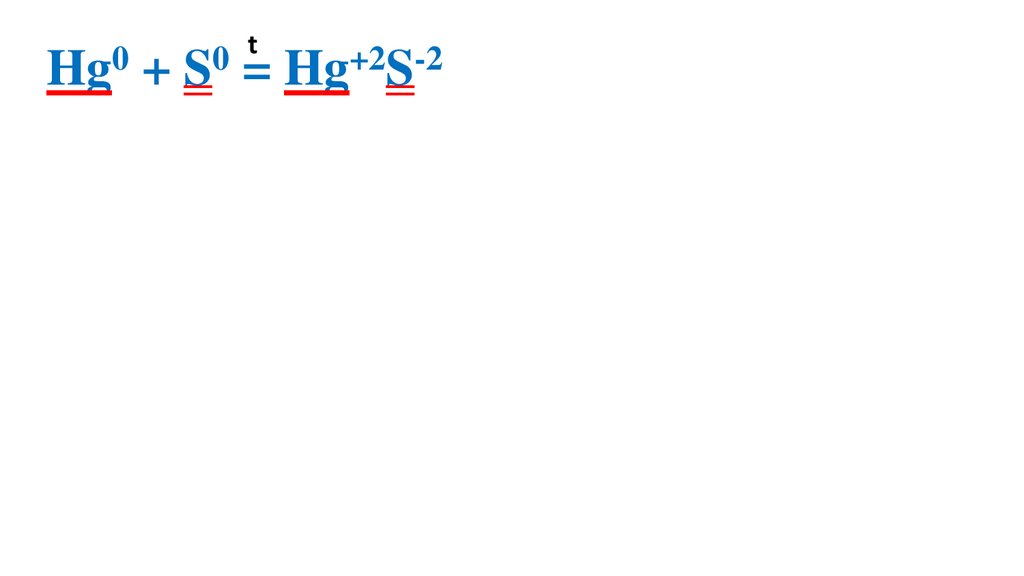
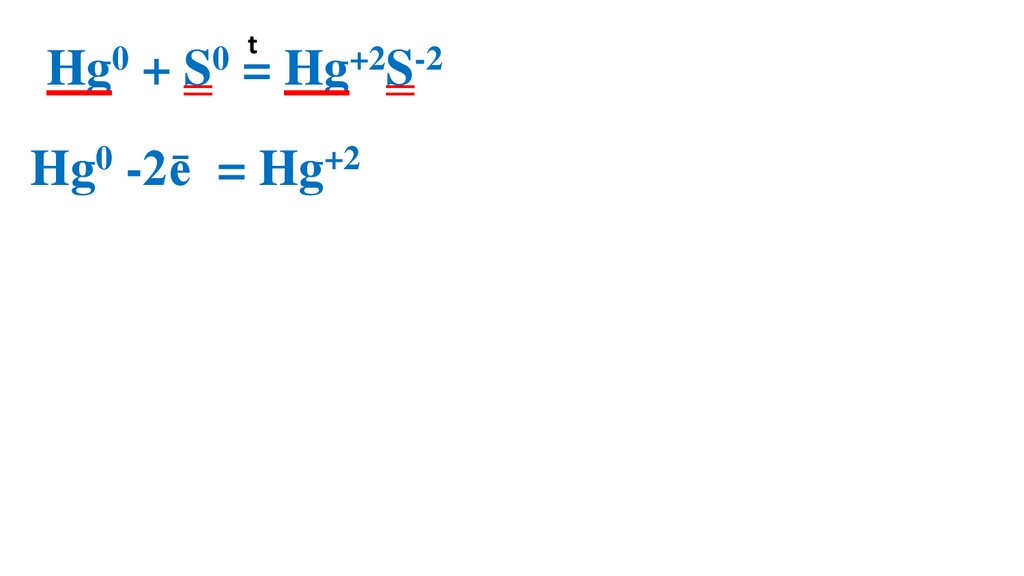
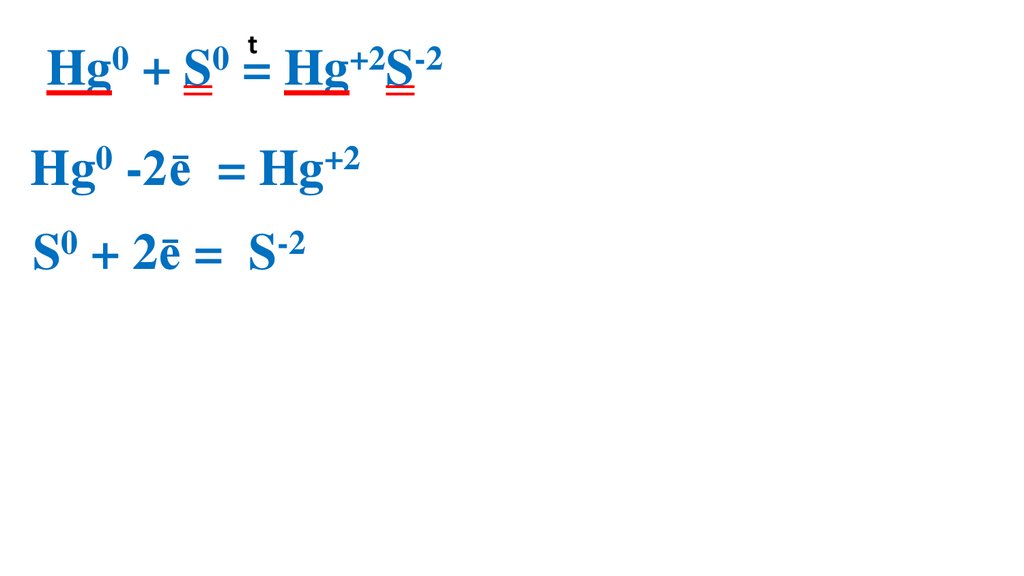
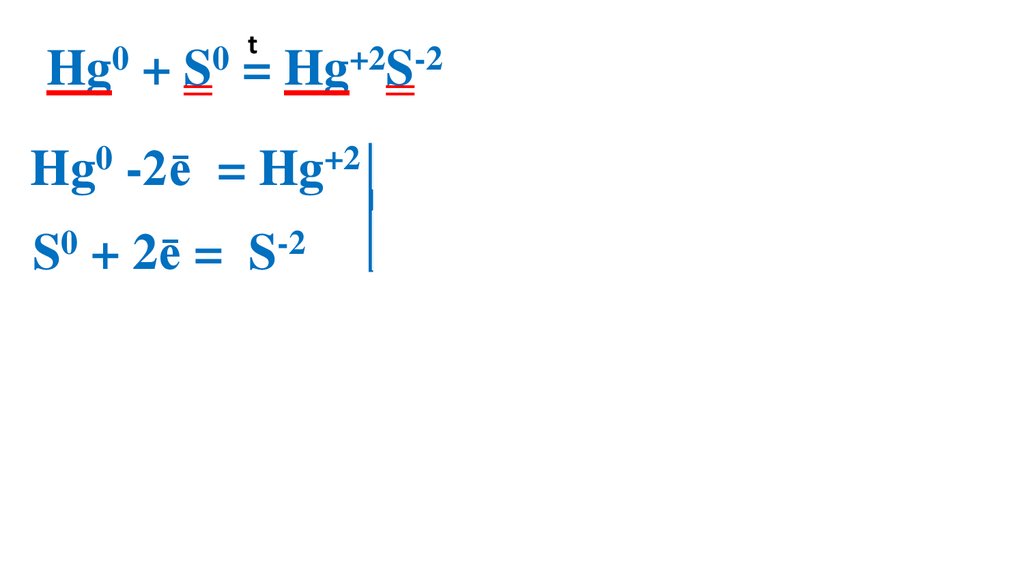
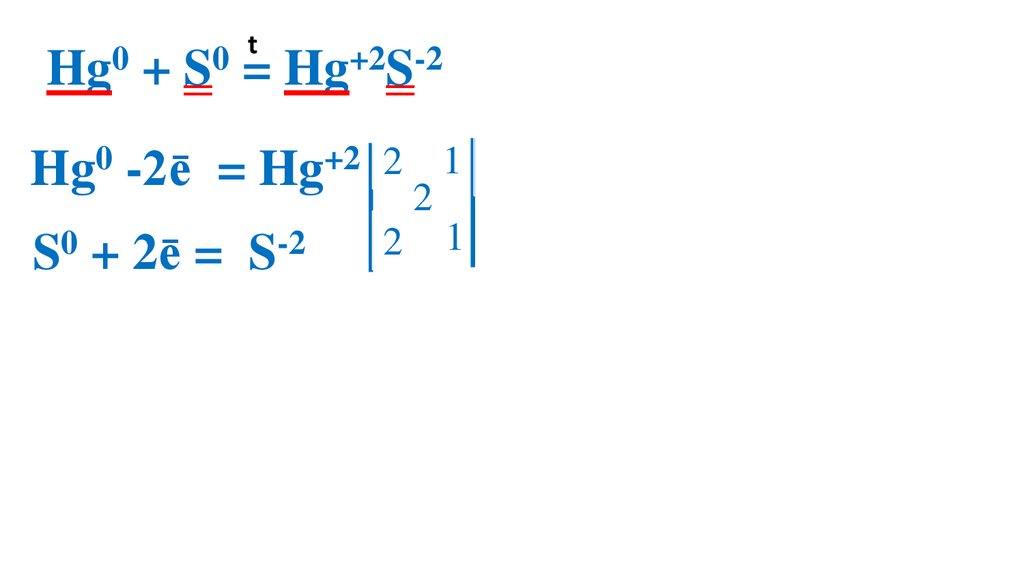
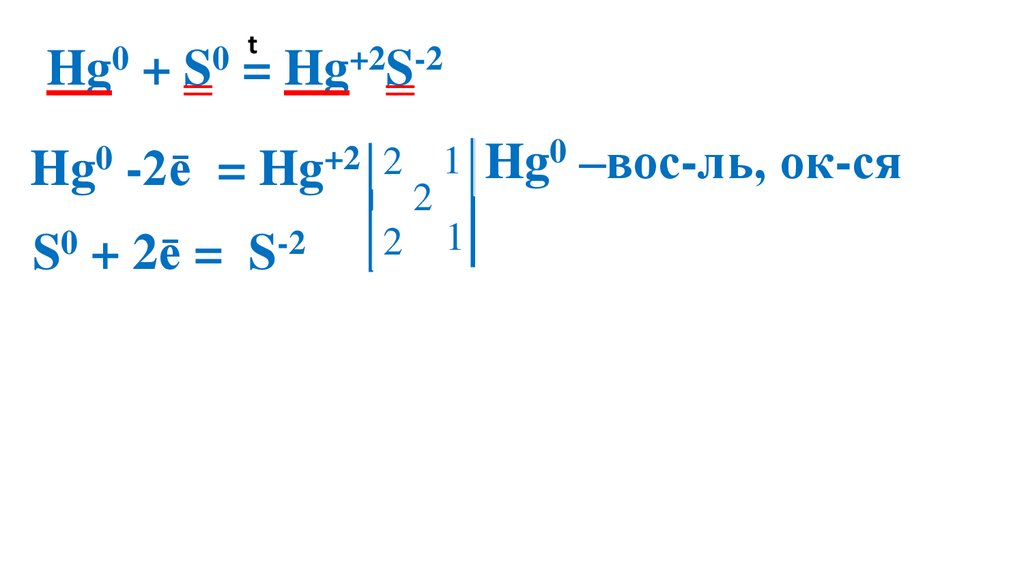
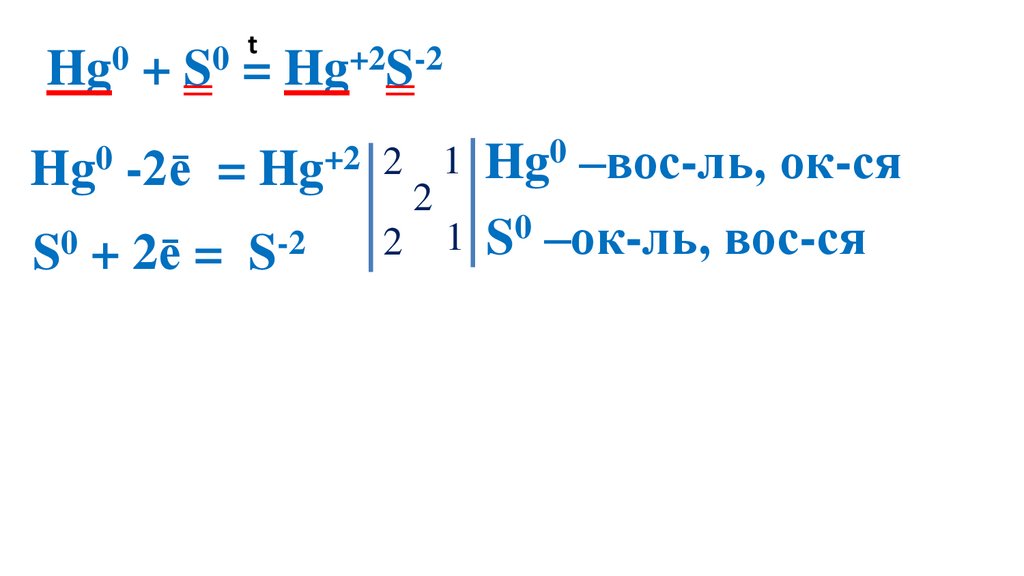


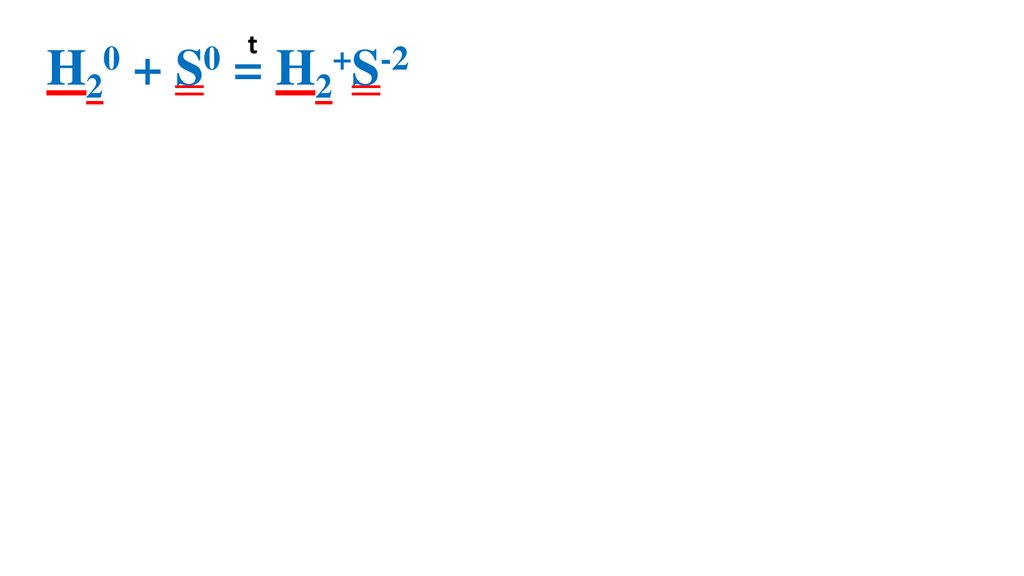
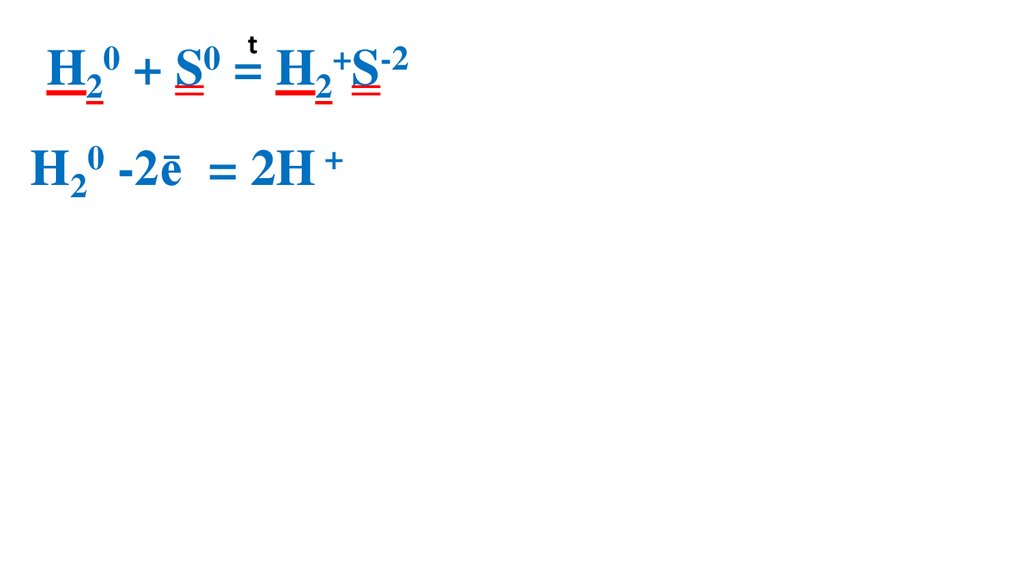
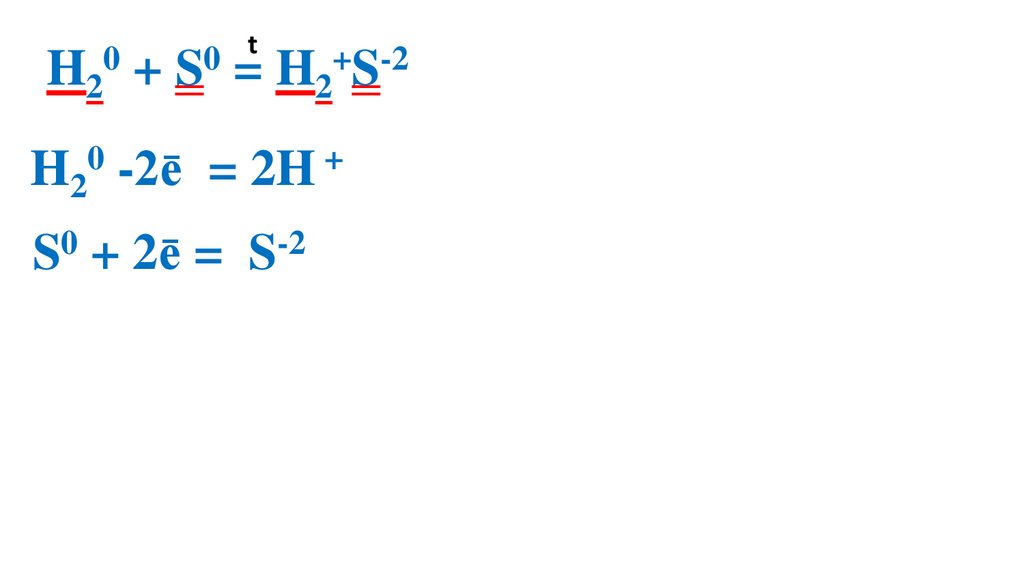
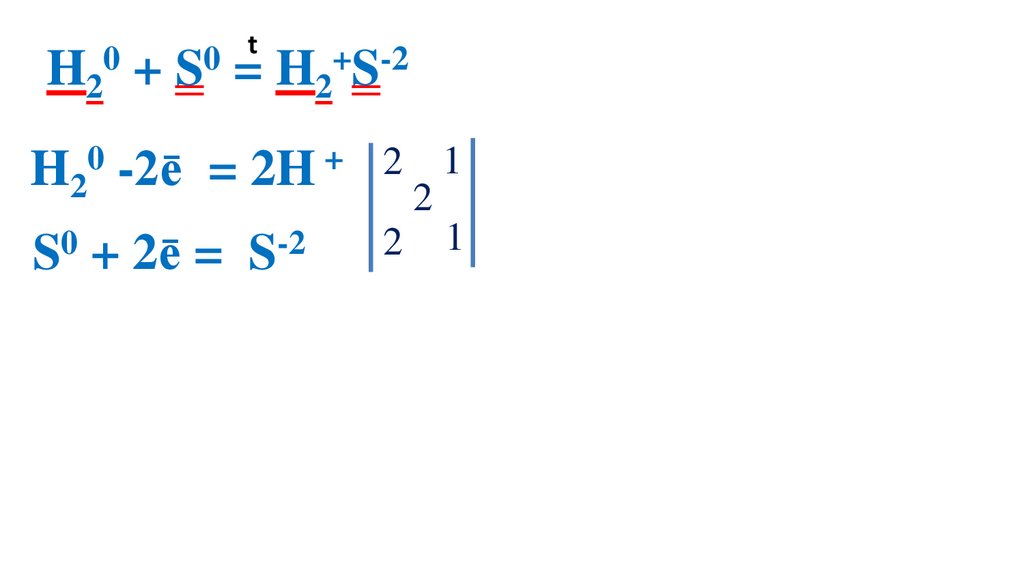
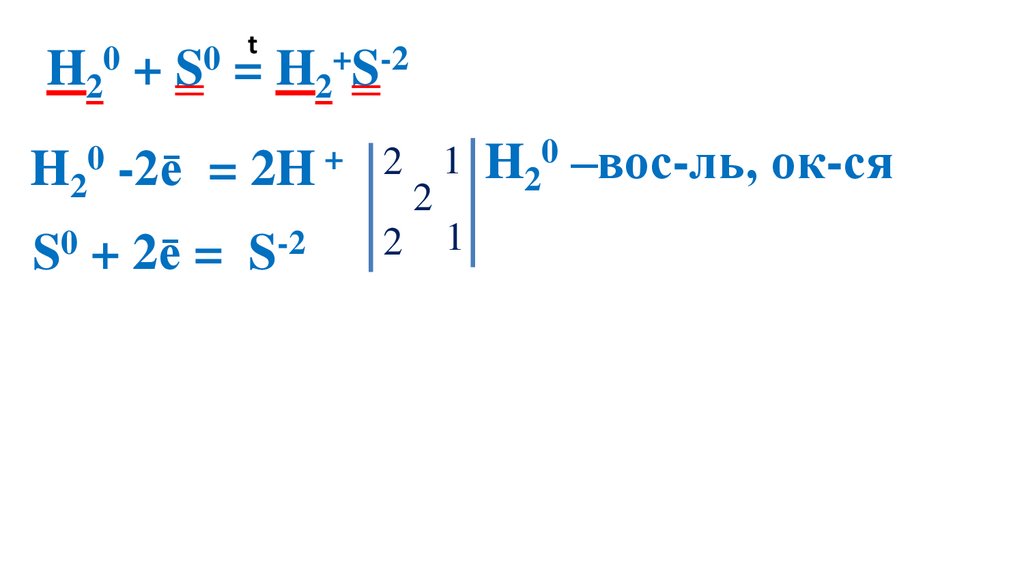


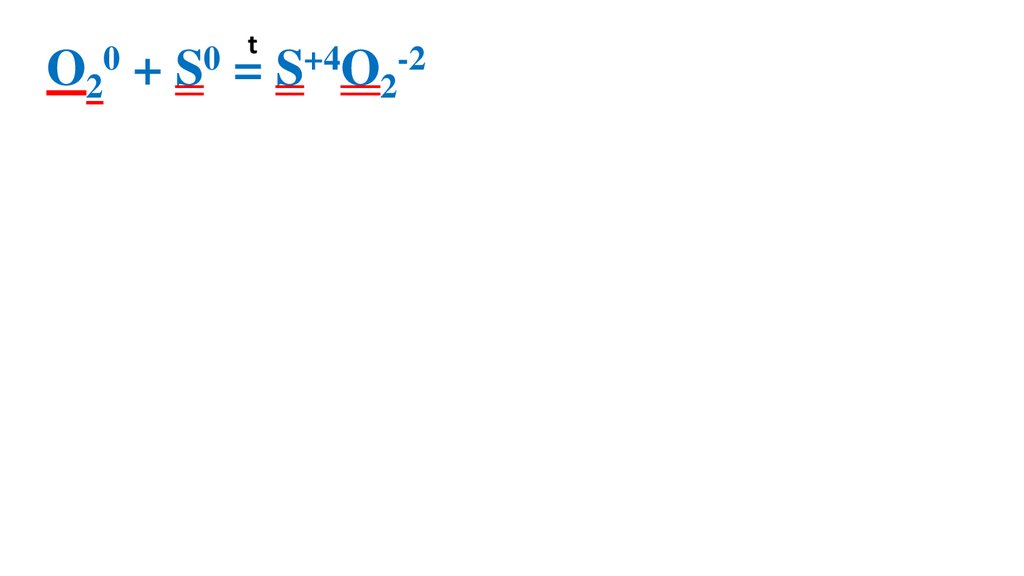
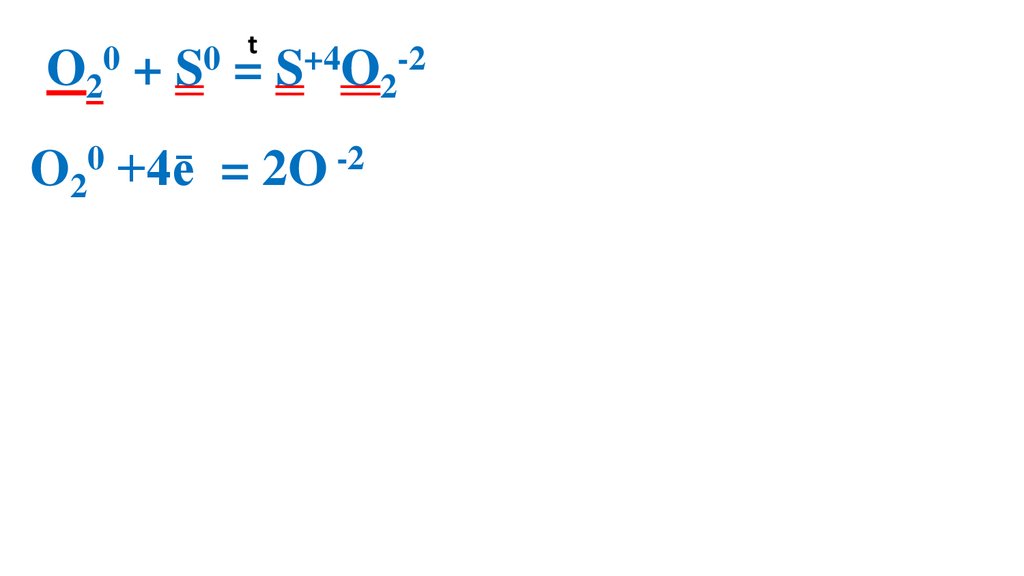
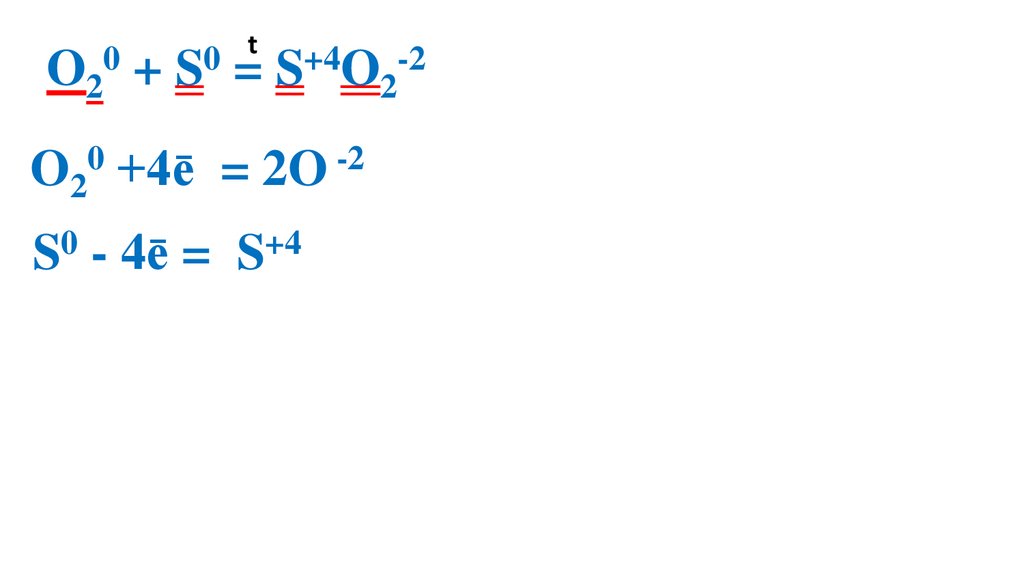
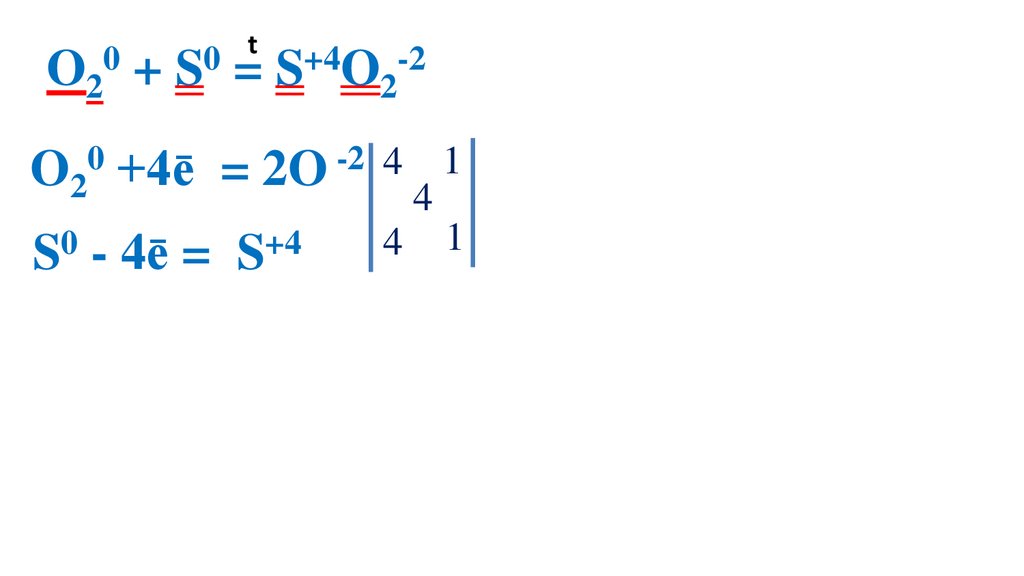
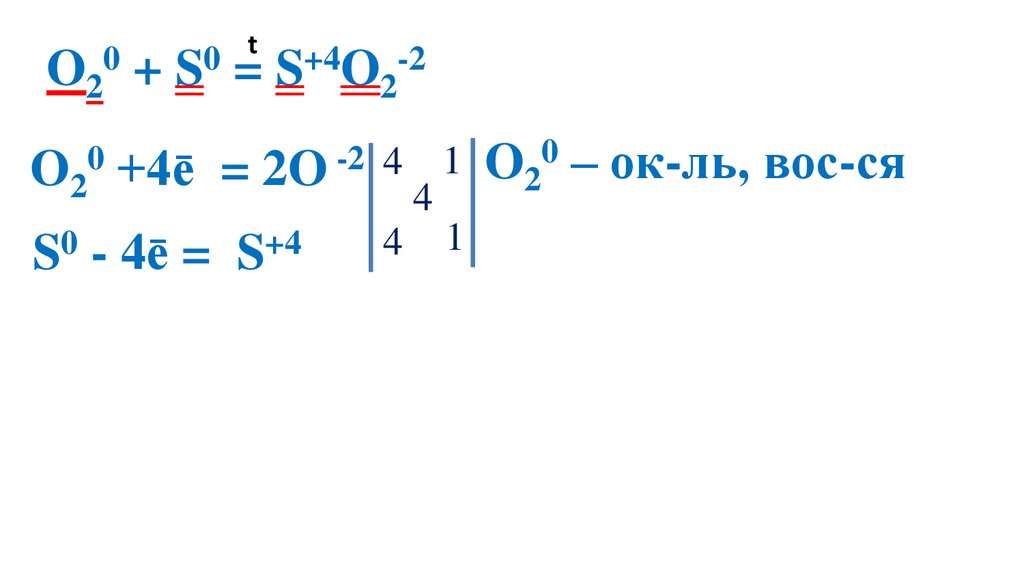
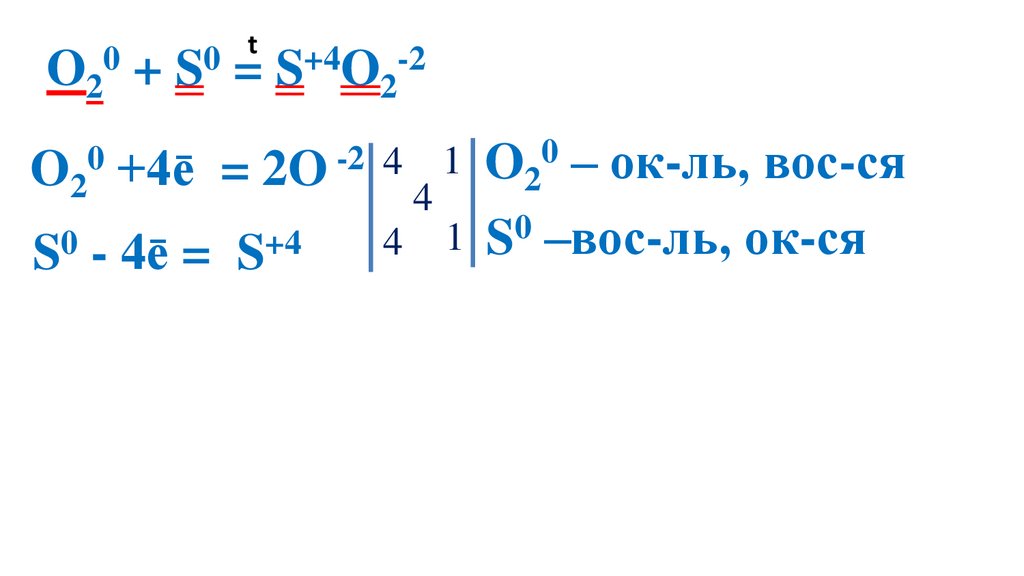













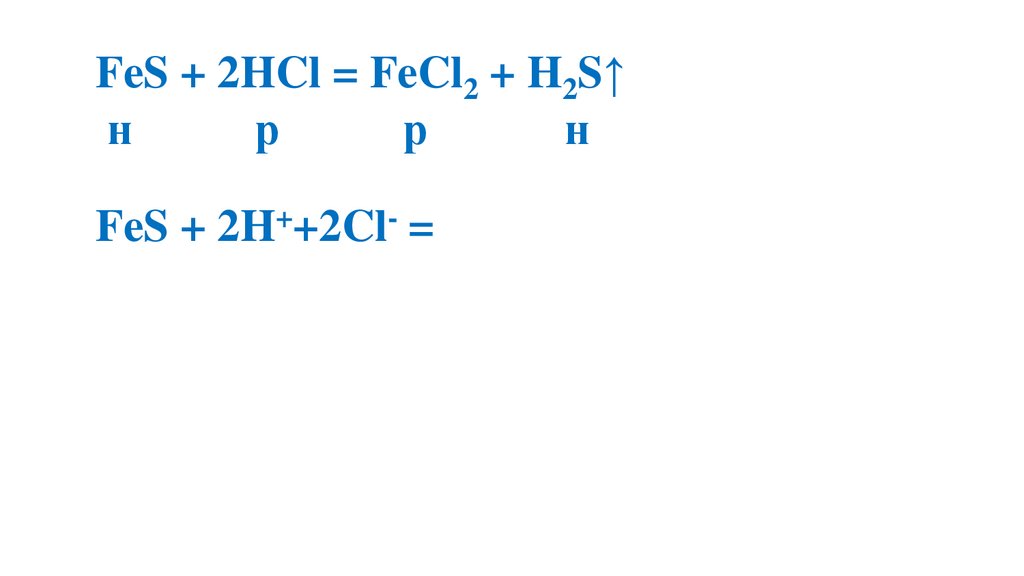
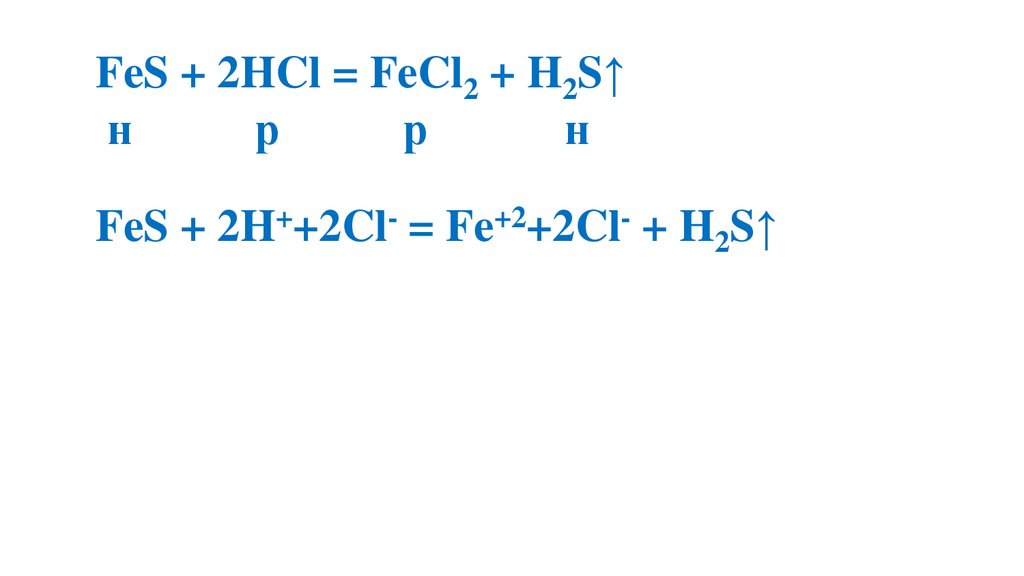
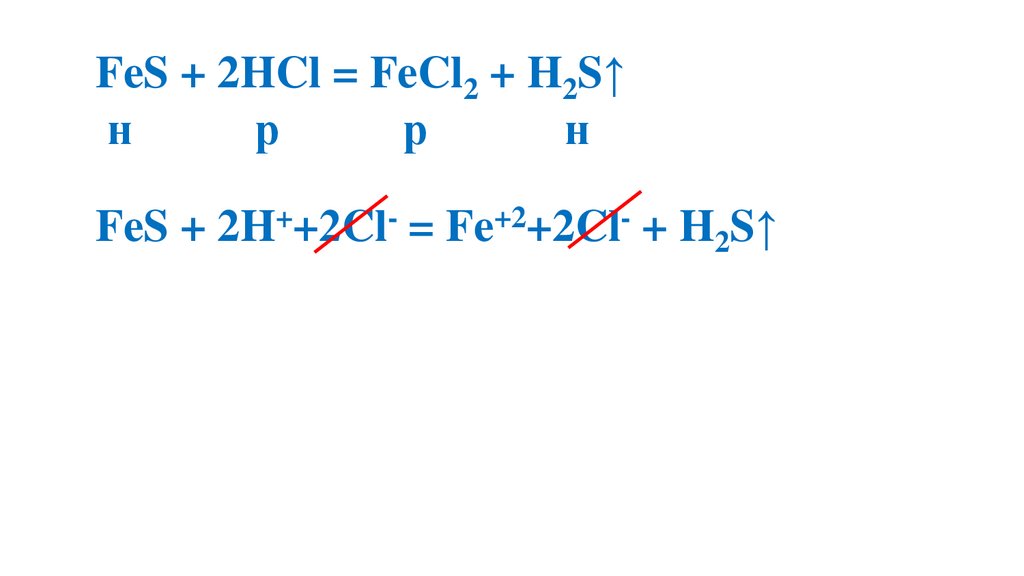
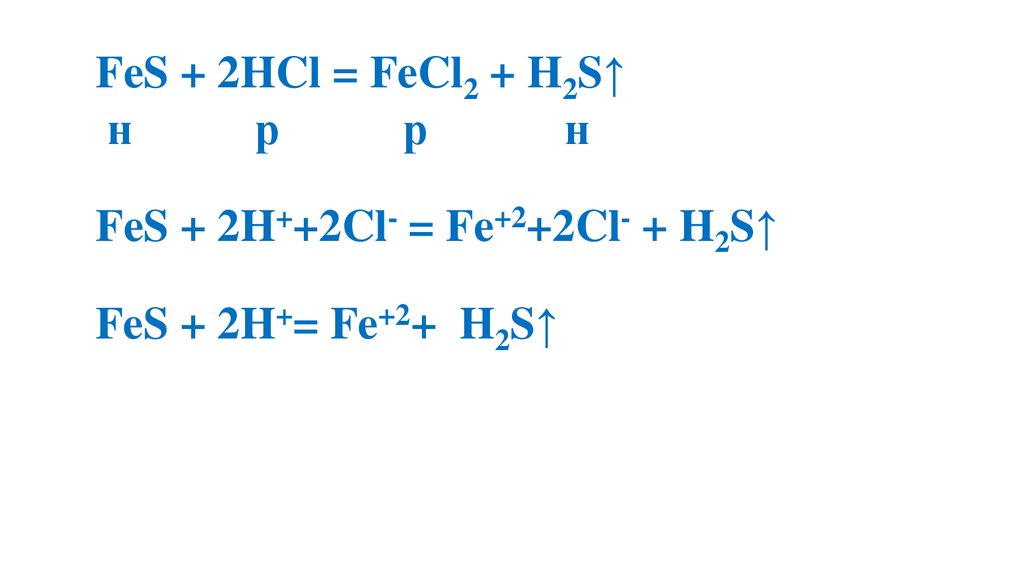

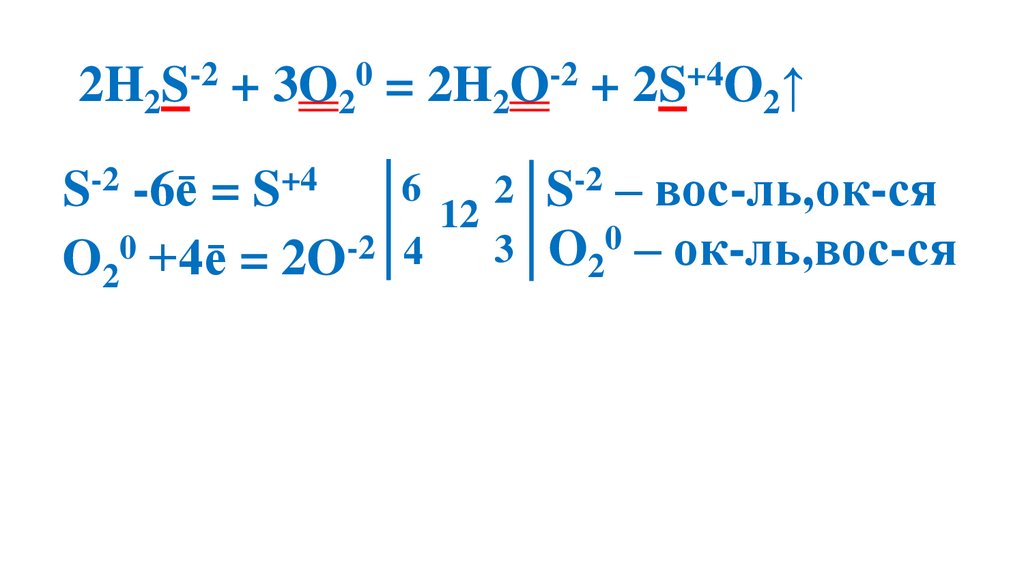
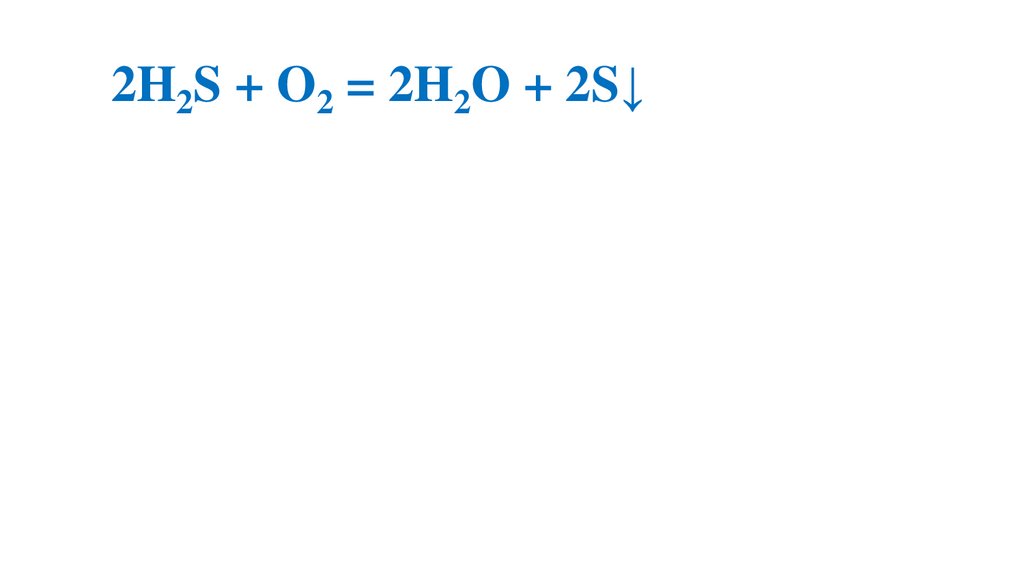





 chemistry
chemistry








