Similar presentations:
Метод электронного баланса для уравнивания окислительно-восстановительных реакций
1. Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Метод электронногобаланса для уравнивания
окислительновосстановительных
реакций
2. Вспомним!
Степень окисления – это условныйзаряд, который приобрел бы атом в
молекуле, если бы все электронные
пары его химических связей
сместились в сторону более
электроотрицательных атомов.
3.
1. Степень окисления атомов в простыхвеществах равна нулю:
0
0
0
H2, Cl2, Na .
2. В сложных веществах О-2.
3. В сложных веществах Н+1.
4. С.О. металлов всегда положительна,
максимальное значение С.О. металлов
главных подгрупп обычно совпадает с
номером группы, в которой расположен
металл.
4.
Алгебраическая сумма степенейокисления всех атомов в соединении
всегда равна нулю:
+1 -2
H2SO4
(+1)·2 + (+6)·1 + (–2)·4 = 0
5.
В реакциях ионного обмена составныечасти веществ переходили в состав других
веществ без изменений, степени
окисления элементов и заряды ионов не
менялись:
+1 +5 -2
+1 -1
+1 -1
+1 +5 -2
AgNO3 + HCl = AgCl + HNO3
6.
Однако существует огромноемножество реакций, в ходе которых
меняются степени окисления
элементов:
0
0
+2 -2
Fe + S = FeS
7.
Химические реакции, в результатекоторых происходит изменение
степеней окисления атомов
химических элементов или ионов,
образующих реагирующие вещества,
называют окислительновосстановительными реакциями
(ОВР).
8.
Элемент, отдающий электроны,называется восстановителем, а
принимающий электроны окислителем.
Процесс отдачи электронов
называется окислением, а принятия восстановлением.
В процессе окисления степень
окисления повышается, в процессе
восстановления - понижается.
9.
Эти процессы неразрывносвязаны между собой, число
принятых окислителем
электронов должно быть равно
числу отданных
восстановителем электронов. На
этом основании составляется
электронный баланс и
расставляются коэффициенты.
10. Чтобы составить схему о-в процесса, необходимо:
1. Определить степень окисления элементов.2. Определить элементы, изменившие степень
окисления.
3. Составить схему: определить элемент,
теряющий, и элемент, принимающий
электроны.
4. Составить электронный баланс (число
отданных электронов всегда должно равняться
числу электронов, принятых).
5. Расставить коэффициенты в уравнении по
электронному балансу, определить окислитель
и восстановитель.
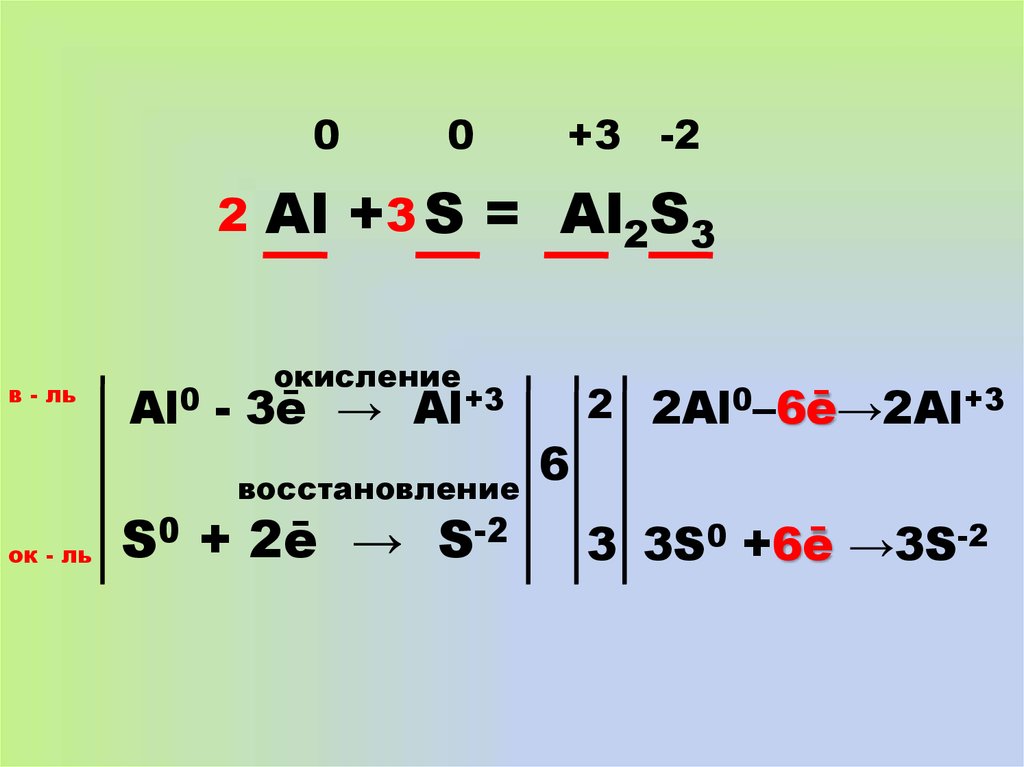
11. 0 0 +3 -2
02
в - ль
0
-2
Al +3 S = Al2S3
окисление
Al0 - 3ē → Al+3
восстановление
ок - ль
+3
S0 + 2ē → S-2
6
2 2Al0–6ē→2Al+3
3 3S0 +6ē →3S-2
12.
00
+2 -2
2 Mg + O2 = 2MgO
в - ль
окисление
Mg0 - 2ē → Mg+2
восстановление
ок - ль
O20 + 4 ē → 2 O-2
4
2 2Mg0-4ē→2Mg+2
1 O20 +4ē → 2O-2
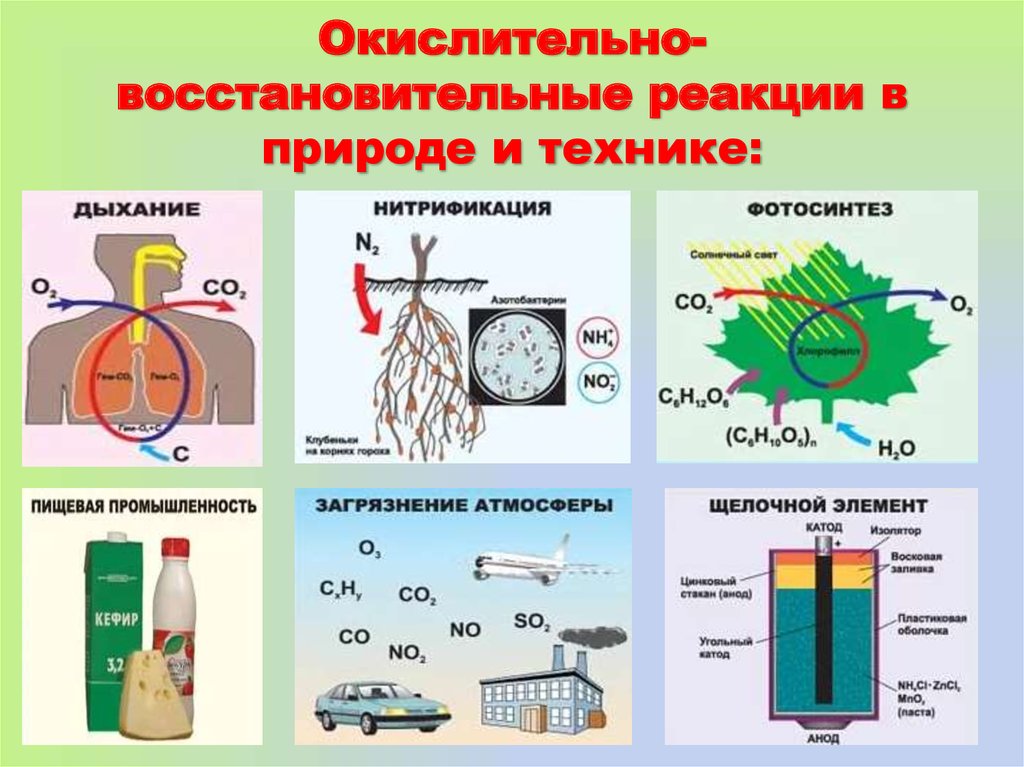
13. Окислительно-восстановительные реакции в природе и технике:
Окислительновосстановительные реакции вприроде и технике:
14. Задание 1.
Определите степени окисления всеххимических элементов, входящих в
состав веществ:
NaOH, MgCl2, K2CO3, AlCl3, H3PO4,
K2SO4, HNO3, CuSO4, Fe, Zn(NO3)2.
15. Задание 2.
Расставьте коэффициенты методомэлектронного баланса в следующих
уравнениях реакций:
1)
2)
3)
4)
5)
HgO = Hg + O2
H2S + O2 = SO2 + H2O
KClO3 = KCl + O2
CuS + O2 = CuO + SO2
N2 + H2 = NH3
16. Домашнее задание:
Расставьте коэффициенты вуравнениях методом электронного
баланса:
1)
2)
3)
4)
5)
Fe + Cl2 → FeCl3
Zn + HCl → ZnCl2
HBr + O2 → H2O + Br2
NH3 + O2 → NO + H2O
Zn + HNO3 → Zn(NO3)2 + N2 + H2O










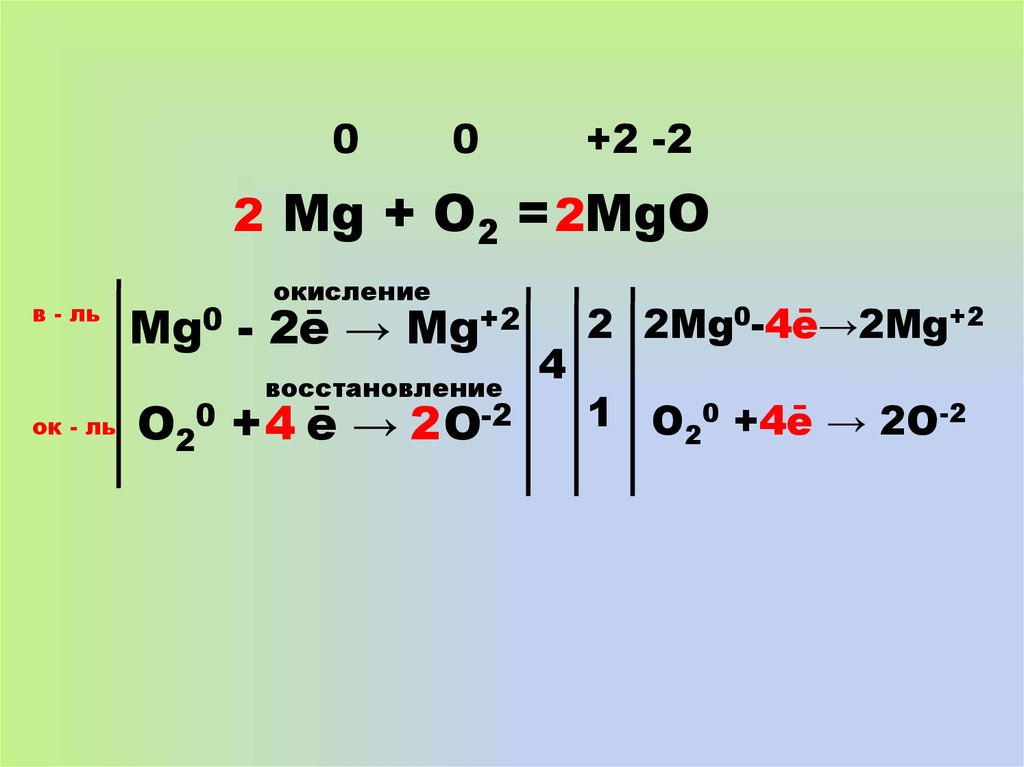



 chemistry
chemistry








