Similar presentations:
№5_Тұз_ерітінділерінің_және_балқымаларының_электролизі_
1.
Тақырыбы: Тұз ерітінділерінің және балқымаларыныңэлектролизі. Көрсетілім №4 «Өнеркәсіптік үдерістер
электролизінің бейне көрсетілімдері: мыс, алюминий, натрий
гидроксиді және хлоридінің өнеркәсіптік өндірісі»
10 – сынып
ҚГБ
Химия пәні мұғалімі
2.
22
2
1
2
2
1
2
3.
Оқу мақсатыерітінді және балқыма арқылы электр тоғы өткен кезде
жүретін үдерістерді оқу және түсіндіру;
электролит
ерітінділерін
және
балқымаларын
электролиздеу кезінде электродтарда түзілетін электролиз
өнімдерін болжау;
Бағалау критерийлері
ерітінді және балқыма арқылы электр тоғы өткен кезде
жүретін үдерістерді оқу және түсіндіреді
электролит ерітінділерін және балқымаларын
электролиздеу кезінде электродтарда түзілетін
электролизөнімдерін болжау;
3
4.
ЭлектрохимияТотығу
–
тотықсыздану
реакциясын
пайдаланып
химия
өнеркәсібінде, техникада маңызды заттар – таза металдар, аммиак,
сілті, қышқылдар алады. Осы реакциялар көмегімен химиялық
энергия электр энергиясына айналады. Химиялық процестер
кезінде электр
тоғы түзілетін болса,
ондай
процестерді
электрохимиялық дейді. Электрохимиялық процестерге гальвани
элементтерінде, электролиз, металдар коррозиясы кезінде жүретін
тотығу – тотықсыздану реакциялары жатады.
Егер тотықтырғыш пен тотықсыздандырғыш кеңістіктерін
бөліп, электрондарды металл өткізгіш бойымен жүргізетін болсақ,
мұнда гальвани элементін аламыз. Яғни, гальвани элементі тотығу
- тотықсыздану кезінде түзілетін химиялық энергияны электр тоғы
энергиясына айналдырады. Мысалы Даниэль – Якоби элементінің
жұмыс істеу принципін қарастырайық. Екі құты алып, оларға
мырыш және мыс тұздары ерітіндісін құяды, оларға өздерінің металл
пластинкасын батырады.
4
5.
ЭлектрохимияЕкі құтыны ерітінді толтырылған түтікше арқылы
жалғастырады. Мырыш пен мыс пластинкалары металл
өткізгішпен қосқан кезде жүйеде электр тоғы пайда болады.
Мырыш тұзына батырылған мырыш электроды тотығады,
ол еріп ерітіндіге өте бастайды.
Zn0 – 2e = Zn 2+ (тотығу – (анод процесі)
Мырыштан бөлінген электрондар металл өткізгіш бойымен
мыс арқылы CuSO4 - ке беріліп, мыс тотықсызданады:
Cu2+ + 2 e
- = Cu
0
(тотықсыздану процесі – ( катод процесі)
4
6.
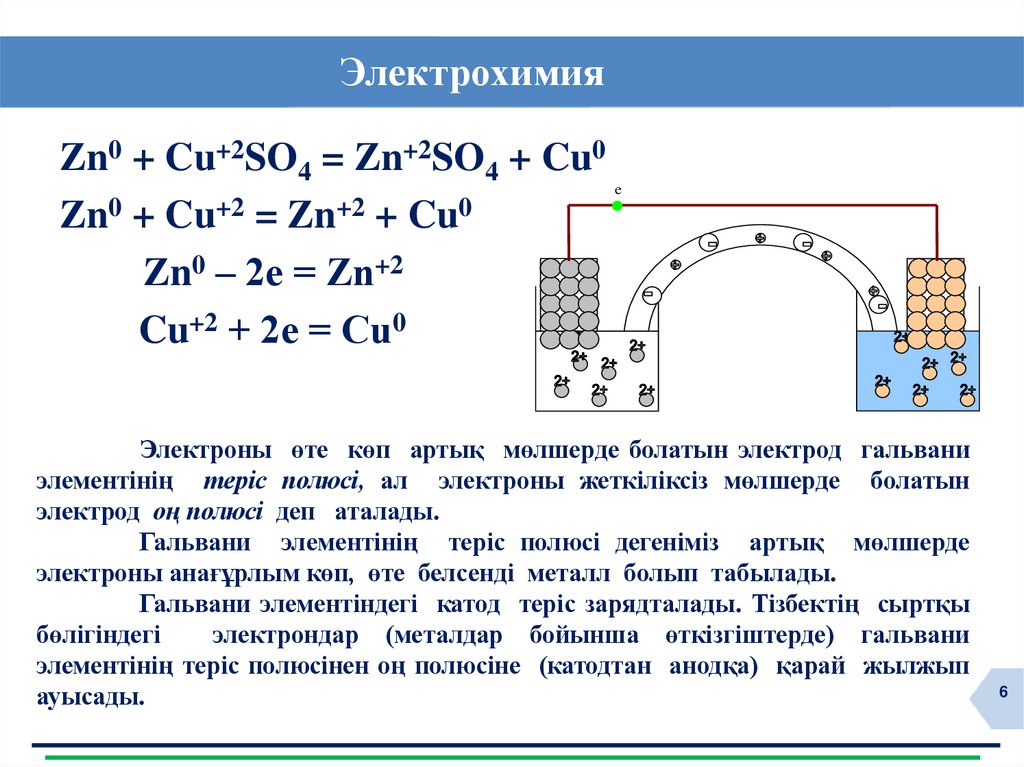
ЭлектрохимияZn0 + Cu+2SO4 = Zn+2SO4 + Cu0
Zn0 + Cu+2 = Zn+2 + Cu0
Zn0 – 2е = Zn+2
Cu+2 + 2е = Cu0
e
Электроны өте көп артық мөлшерде болатын электрод гальвани
элементінің теріс полюсі, ал электроны жеткіліксіз мөлшерде болатын
электрод оң полюсі деп аталады.
Гальвани элементінің теріс полюсі дегеніміз артық мөлшерде
электроны анағұрлым көп, өте белсенді металл болып табылады.
Гальвани элементіндегі катод теріс зарядталады. Тізбектің сыртқы
бөлігіндегі
электрондар (металдар бойынша өткізгіштерде) гальвани
элементінің теріс полюсінен оң полюсіне (катодтан анодқа) қарай жылжып
ауысады.
6
7.
Тұз ерітінділерінің және балқымаларының электролизіМеталл мен ерітінді арасында біршама потенциал айырмасы
түзіледі. Металл иондарының ерітіндіге бөлінуі қайтымды процесс. Бір кезде
динамикалық тепе - теңдік орнайды. Оны былай қысқаша жазуға болады:
Ме Mеn+ + ne
Мұнда, n – металдың заряды.
Тепе – теңдік орнаған кездегі металл мен оны қоршаған ерітінді
арасында пайда болған потенциалдар айырмасын электродтық потенциал
дейді. Металдардың
стандартты электродтық қатары олардың химиялық
қасиетін көрсетеді. Металдың стандартты электродтық потенциалының
алгебралық мәні неғұрлым кіші болса, оның соғұрлым тотықсыздандырғыш
қасиеті жоғары, тотықтырғыш қасиеті төмен болады.
Ең күшті
тотықсыздандырғыш литий (Е0 = -3,045) , ал алтын әлсіз (Е0 = + 1,438)
Сондықтан алтын ионы Au+3 ең күшті тотықтырғыш, ал литий ионы Li + ең
әлсіз.
7
8.
Тұз ерітінділерінің және балқымаларының электролизіСалыстырмалы электрод ретінде стандарт сутегі электроды
қолданылады. Осы сутегі электродына басқа металл электродтарды жалғау
арқылы олардың стандартты электродтық потенциалдарын табады. Мұнда
сутегінен активті металдар оған электрон береді де электродтық потенциал
мәндері «теріс», ал сутегіне қарағанда активсіз металдар электрон қабылдап,
олардың электродтық потенциалдарының мәндері «оң» болады.
- Е0 металдарда арту қатарына байланысты оларда (сулы ерітіндіде
тотықсыздандырғыш қабілеті азаяды):
Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H2) Cu Hg Ag Pt Au
8
9. Балқыма электролизі
1. NaCl = Na+ + Cl• К-: Na+ + e = Na02
• А+: 2Cl- - 2e = Cl2 1
Процестер жиынтығы:
2Na+ + 2Cl- = 2Na0+ Cl2
2. LiH = Li+ + H• К: Li+ + e = Li
2
• А: 2H- - 2e = H2
1
Процестер жиынтығы: 2Li+ + 2H- = 2Li + H2
Жиынтық теңдеуі:
2LiH = 2Li + H2
3. Rb2CO3 = 2Rb+ + CO32• К: Rb+ + e = Rb
4
• А: 2CO32- - 4e = 2CO2 + O2 1
Процестер жиынтығы: 4Rb+ + 2CO32- = 4Rb + 2CO2 + O2
Жиынтық теңдеуі:
2Rb2CO3 = 4Rb + 2CO2 + O2
9
10.
Ерітінді электролизі• К: 2Н2О + 2е = Н2 + 2ОНкатод –
Мn+ + ne = M
• А: 2Н2О – 4е = О2 + 4Н+
Anm- – me = An
+ анод
Диссоциация: KI ↔ K+ + I•Катод: 2Н2О + 2е = Н2 + 2ОН•Анод: 2l- - 2e = l2
•электролиз: 2KI + 2Н2О = H2 + 2KOH + + I2
10
11.
Ерітінді электролизіДиссоциация:
NaCl = Na+ + Cl Катод: 2Н2О + 2е = Н2 + 2ОН Анод: 2Сl- - 2e = Cl2
Жалпы: NaCl + 2H2O = H2 + Cl2 + NaOH
Диссоциация: CuSO4 ↔ Cu2+ + SO42•Катод: Cu2+
+ 2e = Cu0
2
•Анод: 2Н2О – 4е = О2 + 4Н+ 1
•электролиз: 2CuSO4 + 2Н2О = 2Cu0 + О2 + 2H2SO4
11
12.
Бекіту тапсырмасыТапсырма 1
Сулы ерітінділер электролизында инертті электродтарды қолданған кезде
анодта бөлінетін өнім мен электролизге ұшырайтын заттың арасындағы
сәйкестікті көрсетіңіз:
Заттың формуласы
А) NaCl
B) NaClO4
C) NaOH
D) NaBr
Анодтағы өнімдер
1) Cl2
2) Cl2 , O2
3) O2
4) H2 , Br2
5) O2, Br2
6) Br2
Тапсырма 2
Натрий хлориді ерітіндісінің электролизі теңдеуін жазып, катод пен
анодта бөлінетін өнімдерді көрсетіңіз.
12
13.
Дұрыс жауапЗаттың формуласы
А) NaCl
B) NaClO4
C) NaOH
D) NaBr
Анодтағы өнімдер
1) Cl2
2) Cl2 , O2
3) O2
4) H2 , Br2
5) O2, Br2
6) Br2
13
14.
Тапсырма №3.1.Мыс хлориді ерітіндісінің электролизі кезінде анодта 8,96л газ
бөлінді. Катодта қандай зат бөлінді? Оның массасын табыңдар.
Шешуі: CuCl2 = Cu + Cl2
64г---- 22,4л
Х ------- 8,96л
Х = 64г*8,96л/22,4л
х = 25,6г.
2. Сынап (II) нитраты ерітіндісін электролиздегенде катодта 60,3
г сынап бөлінді. Анодта қандай зат бөлінді? Оның көлемін
табыңдар. Ерітіндіде қандай зат бөлінді? Оның массасын
табыңдар.
15.
16. Қорытынды
Бүгінгі сабақта:- ерітінді және балқыма арқылы электр тоғы өткен кезде жүретін
үдерістерді оқу және электролит ерітінділерін және балқымаларын
электролиздеу кезінде электродтарда түзілетін электролиз өнімдерін
құрастыруын қарастырдық
16















 chemistry
chemistry








