Similar presentations:
IIA топша элементтері
1. IIA топша элементтері
2.
76 сурет. Топ бойынша элементтер қасиеттерінің өзгеру заңдылықтары3.
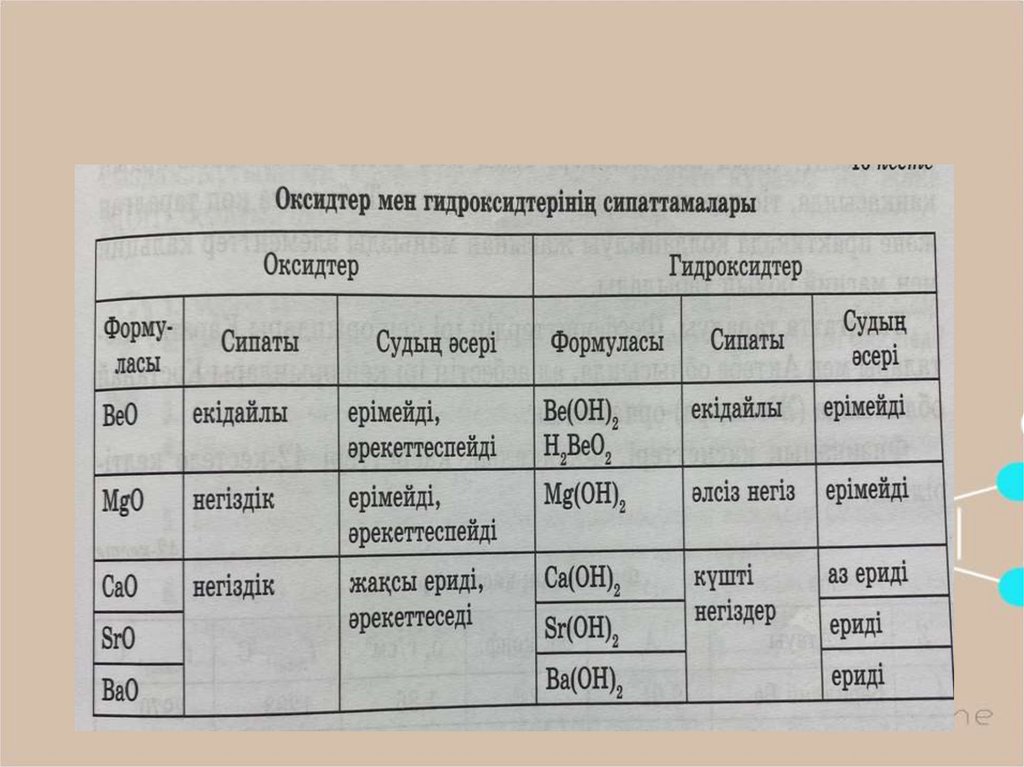
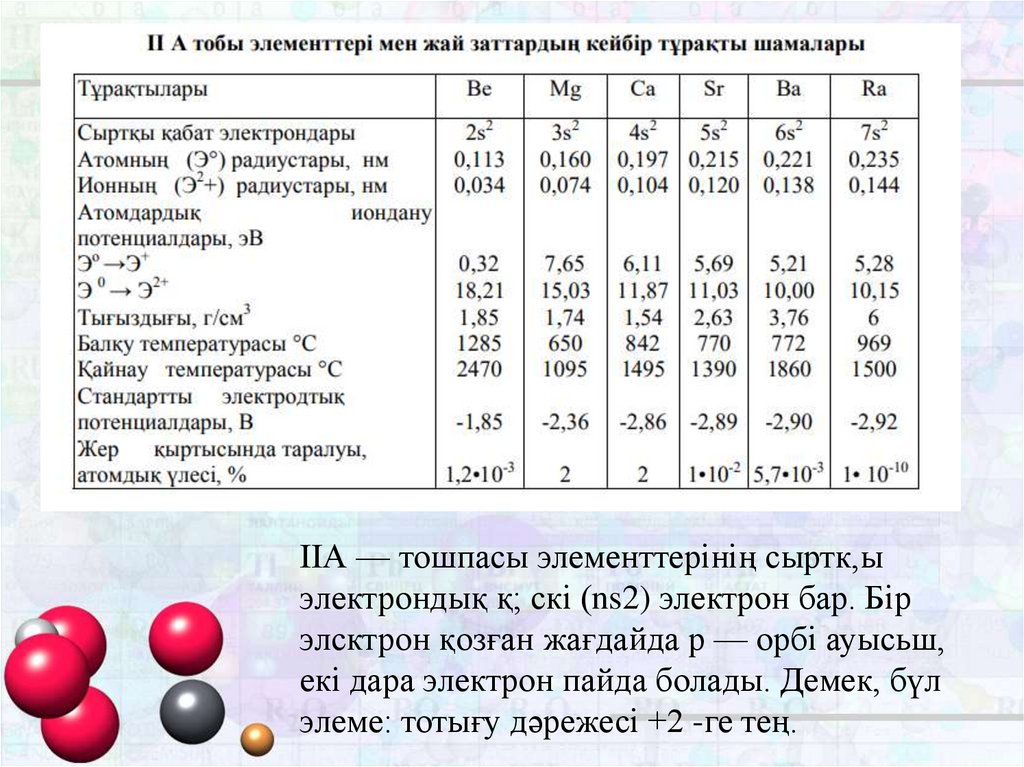
Периодтық жүйенің IIA топша элементтерінеBe, Mg, Ca,Sr, Ba, Ra жатады.
Бұлардың ішінде радий – радиоактивті элемент.
Бұл элементтер атомдарының сыртқы қабатында 2 электрон
болады. Сондықтан олар қосылыстарында +2 валенттілік
корсетеді.
Олардың барлығы да күшті тотықсыздандырғыштар.
Магнийден барийге қарай атомрадиусы
артқансайын,тотықсыздандырғыш қасиеті артады.
Бос күйінде жеңіл, онай балқитын күміс түсті металдар.
4.
5.
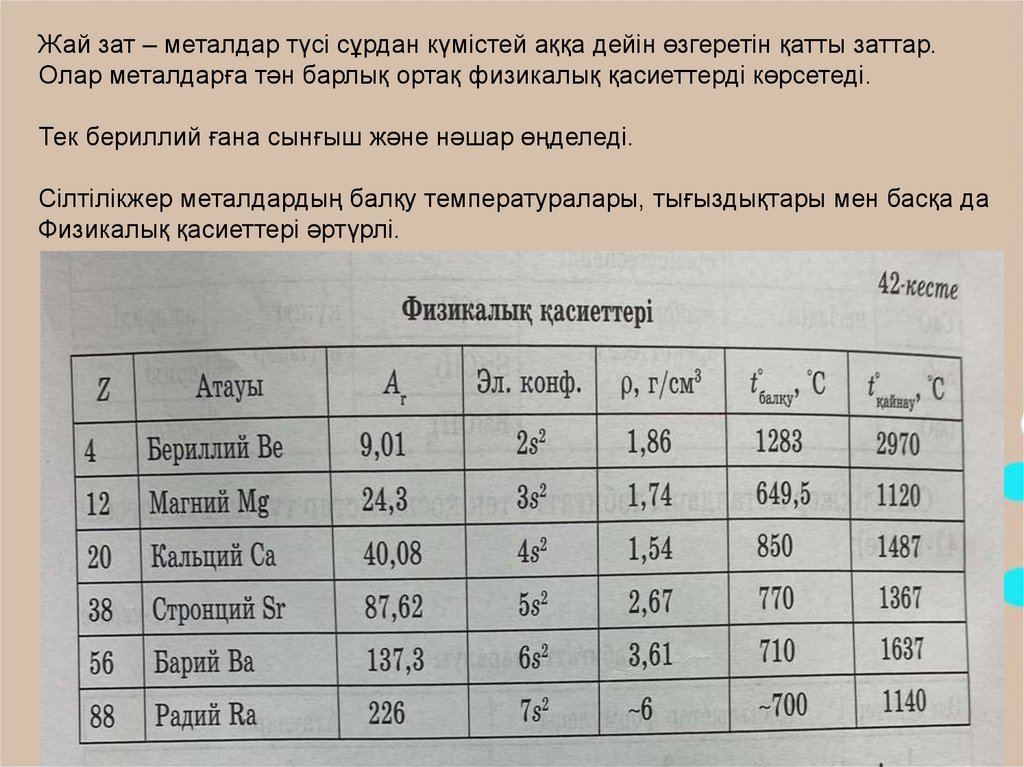
Жай зат – металдар түсі сұрдан күмістей аққа дейін өзгеретін қатты заттар.Олар металдарға тән барлық ортақ физикалық қасиеттерді көрсетеді.
Тек бериллий ғана сынғыш және нәшар өңделеді.
Сілтілікжер металдардың балқу температуралары, тығыздықтары мен басқа да
Физикалық қасиеттері әртүрлі.
6.
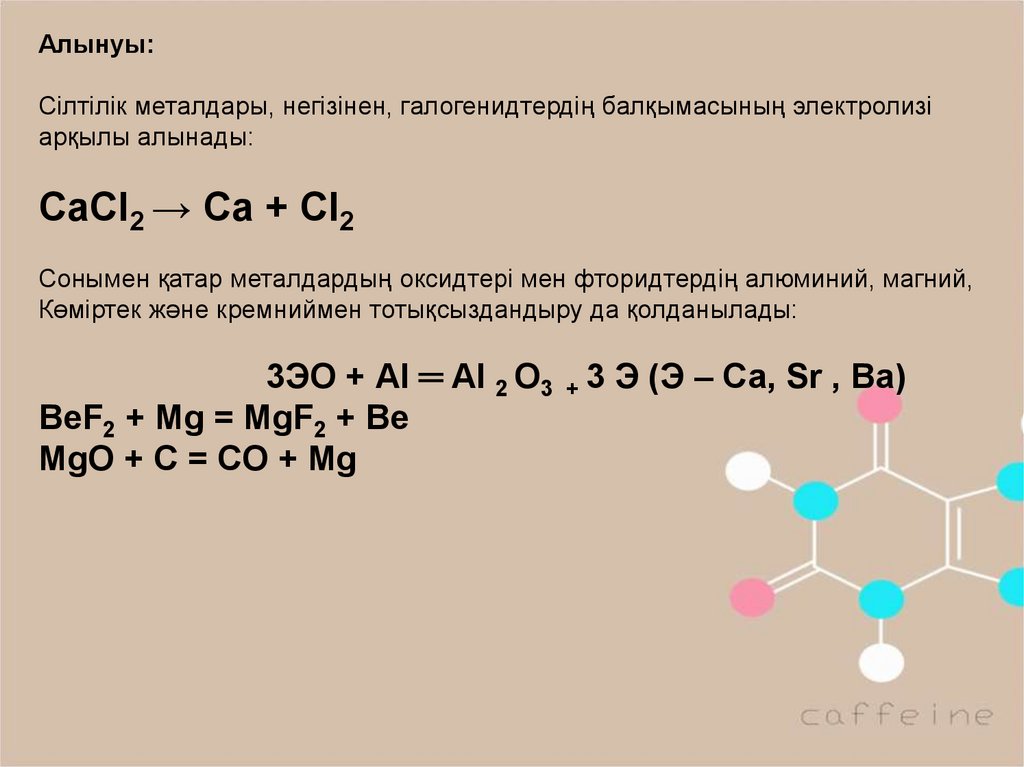
Алынуы:Сілтілік металдары, негізінен, галогенидтердің балқымасының электролизі
арқылы алынады:
CaCI2 → Ca + CI2
Сонымен қатар металдардың оксидтері мен фторидтердің алюминий, магний,
Көміртек және кремниймен тотықсыздандыру да қолданылады:
3ЭО + АІ ═ AІ 2 O3 + 3 Э (Э – Са, Sr , Ва)
BeF2 + Mg = MgF2 + Be
MgO + C = CO + Mg
7.
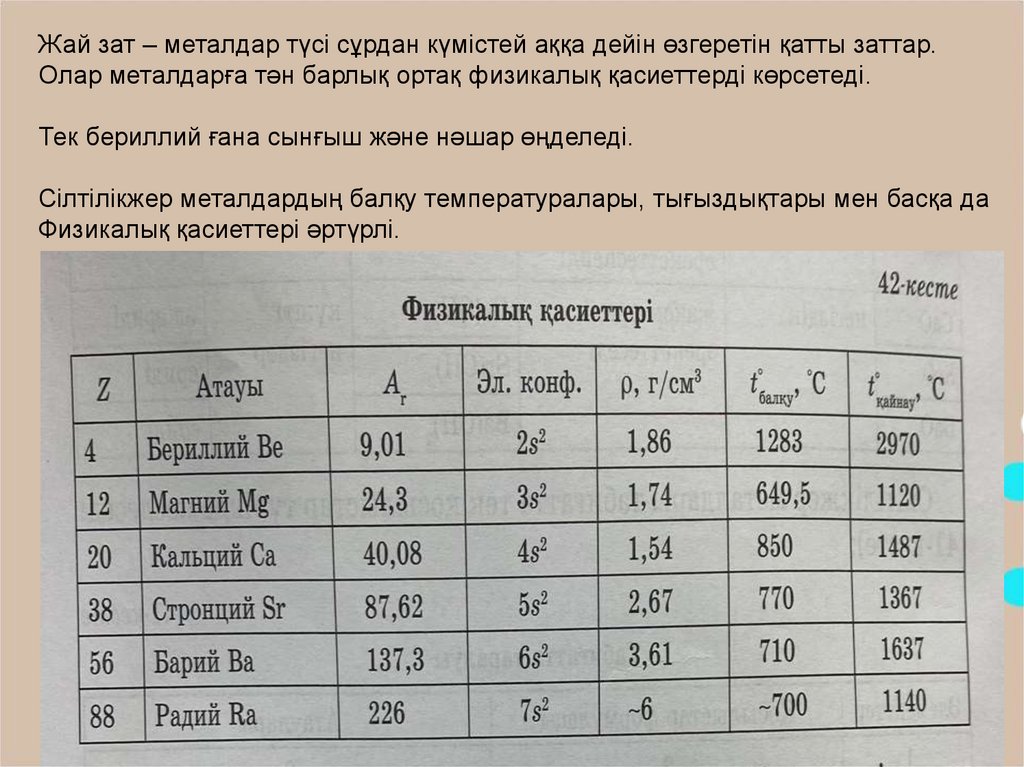
Жай зат – металдар түсі сұрдан күмістей аққа дейін өзгеретін қатты заттар.Олар металдарға тән барлық ортақ физикалық қасиеттерді көрсетеді.
Тек бериллий ғана сынғыш және нәшар өңделеді.
Сілтілікжер металдардың балқу температуралары, тығыздықтары мен басқа да
Физикалық қасиеттері әртүрлі.
8.
ІІА — тошпасы элементтерінің сыртк,ыэлектрондық қ; скі (ns2) электрон бар. Бір
элсктрон қозған жағдайда р — орбі ауысьш,
екі дара электрон пайда болады. Демек, бүл
элеме: тотығу дәрежесі +2 -ге тең.
9. Табиғатта таралуы және алынуы.
ІІА — топшасы элементтері активті болғандықтан, табиғатта тек қосылыс күйінде
кездеседі Олардың ішінде магний мен кальций кең тараған, қалғандары өте сирек.
Берилий берилл деген минерал құрамында болады Be3Al2(Si03)6.Магний, кальций,
стронций, барий табиғи сульфаттардың, карбонаттардың, фосфаттардың құрамында
болады.
• ІІА-топша элементтері өте активті металдар жөне бұлар, стандартты электрондық
потенциалдарының мәндері төмен болғандықтан оларды алудың бірден-бір жолы —
электролиз Әдетте, тұздарының балқымаларын электролиздейді. Оны сонымен қатар,
металлотермия әдісімен алуға болады.
ВеС12↔Ве2+ +2С1Катодта Ве2+ +2е=Ве
Анодта 2С1- -2е=С12
Термиялық әдіспен бериллий фторидын магниймен тотықсыздандыру арқылы таза
бериллий алады:
BeF2+Mg=Be+MgF2
Өнеркәсіпте магнийдің көп мөлшерін тазартылған карналлитті KC1•MgCl2•6Н2О
электролиздеу арқылы өндіреді:
MgCl2↔Mg2+ +2ClКатодта Mg2++2e =Mg°
Анодта 2С1—2е=С12
3SrO+2Alо =3Sr+Al2O3
3ВаО+2Аl o =3Ва°+Al2O3
10. Қасиеттері.
• Бос күйінде ІІА — топша элементтері Жеңіл,сілтілік металдарға қарағандақаттылау металдар. Олар қатты күйінде әр түрлі кристалл тор турінде
кристалданады. Сондықтан балқу температураларының өзгеруінде белгілі бір
заңдылық жоқ. Химиялық активтігі, тотықсыздандырғыш қасиеті жағынан
сілтілік-жер металдары сілтілік металдарға қарағанда әлсіздеу. Тек барийдің
активтігі сілтілік металдардікіне жақын. Олардың тотықсыздандырғыш
қасиеті рет номері өсуіне орай арта түседі. Берилий мен магний ауада
тотығып, оксид пленкасымен қапталса, қалған сілтілік жер-метадцары
оттегімен шабьітты әрекеттеседі. Оларды керосин астында сақтайды.
Отгегімен әрекеттесіп олар оксид түзеді ЭО. ЭО. Азотпен өтс жоғары
температурада әрекетгеседі де нитридтер түзеді:
3Э + N2 = Э3N2,
Бсрилийдсн басқа сілтілік-жер металдары сумен әрекеттесіп, тидроксид жөне
сутегін түзеді:
Э + 2Н2О = Э(ОН) 2 + Н2
Азот қышқылынан басқа сұйылтылған қышқылдардан сутегін ығыстырады:
Э+H2S04= ЭSO4+ Н2
Сілтілік жер металдары азот қышқылын аммоний ионына Дейің
тотықсыздандырады:
4Э + 10HNO, = NH4NО3 + 4Э(NО3)2 + 3H2О
11. Қасиеттері.
• Сілтілік-жер металдары барлық қосылыстарда + 2 тотығуДәрежесін көрсетеді. Олар сутегімен қосылып гидрид ЭН2,
оттегімсн оксидтер ЭО түзеді. Олардың оксидтері суды қосып
альіп гидроксидтерге айналады [Э(ОН)2]. Гидроксидтсрі
сілтшік қасиет көрсетеді (литий мен магнийден басқа). Сілтілікжер металдарының әртүрлі тұздары бар. Тұздарының суда
ерігіштігі. де түрліше. Нитраттары мен хлоридтері жақсы ериді.
карбонаттары мен фосфаттарының ерігіштігі шамалы. Берилий
элементінің ионында екі ғана электрон болғандықтан, басқа
сілтілік-жер металдарьшан ерекшелігі бар. Ол алюминий
элементіне ұқсас. Берилий алюминий сияқты амфотерлі қасиет
көрсетеді, қышқылдармен және сілтілермен де әрекеттеседі:
Be + КОН + 2Н20 - K2[Be(OH)4]+H2
Бұдан оның комплекс түзу қасиеті бар екендігі көрініп
Амфотерлік қасиет оның оксиді ВеО мен гидроксидіні тән.
12. Қасиеттері.
Берилийдің барлық қосылыстары улы. Жан-жануарберилий тозаңымен немесе түтінімен демалу кезінде
уланады. Ол өкпе тканьдерінде жиналып, ауыр
бронхитке соктырады. Сондай ақ сүйек тканьдерінде де
жиналады. Берилий көп жерде жайылған мал берилий
рахиті ауруымен ауырады. Сілтілік-жер металдары
көбінесе металлургияда, атом реакторында, құймалар
алуда қолданылады. Берилий реакторында нейтрон
тежегіш ретінде, тоттанбайтын құйма алуға
пайдаланылады. Магний қосылған құймалар ракеталар,
самолет машина жасауда өте пайдалы. Барий қосылған
құйма қорғасынмен бірге баспаханада қолданылады.
13. МАГНИЙ
• Магний активті элемент болғандықтан, табиғатта қосылыстүрінде кездеседі. Ол доломит MgC03 • СаС03, магнезит MgCO3
карналлит KCI • MgCl2 • 6Н20 , каинит KCl • MgSO4 • 3H2O
минералдары ның құрамында болады. Магний талы 3MgO
4Si02 • Н20 жөне асбест 3MgO • 4SiO, • СаО сияқты табиғи
силикаттардың құрамды бөлігі. Теңіз суы — онда магний
сульфаты болғандықтан MgS04 ащы келеді. Магний тұздары
топырақтың да құрамына кіреді. Ол бос күйінде күмістей ак,
жеңіл металл. Қыздырған кезде ауада көз қаратпайтын жарқыл
беріп жанады:
2Mg + О2 = 2MgO
Оның бүл қасиетін жарық беретін ракеталарда,
сурет түсіру жағатын снарядтар жасау үшін
пайдаланады.
14.
Кальцийдің қосылыстарыКальций оксиді — ақ түсті қиын балқитын зат. Техникада
оны "сөндірілмеген әк" деп атайды. Оны әктасты жоғары
температурада (1000 C0 шамасында) қыздырып, ыдырату
арқылы алады:
СаС03 =t= СаО + СО2↑- 180кДж
Кальций оксиді — нағыз негіздік оксид. Кальций сілтілік жер
металл болғандықтан, оның оксиді сумен оңай әрекеттесіп
кальций гидроксидін, яғни сілтісін түзеді: СаО + Н20 =
Са(ОН)2 + 70 кДж
Кальций гидроксиді.Кальций гидроксиді ерітіндіде иондарға
толық диссоциацияланады: Са(ОН)2 = Са+2 + 2ОН.Кальций
гидроксиді қышқылдармен және қышқылдық оксидтермен
әрекеттесіп бейтараптанады. Бұл реакцияны лабораторияда
көмірқышқыл газын анықтау үшін қолданады. Әқ суына көмір
қышқыл газын жібергенде, ол алдымен ерімейтін карбонат түзіп,
лайлана бастайды: Са(ОН)2 + CO2 = СаСО3↓ + Н2О Кальций
гидроксиді Газды одан өрі жібере берсе, лай көрінбей кетеді, өйткені
суда ерімейтін орта тұз ерімтал қышқыл тұзға айналады:
СаСО3 + Н2О + СО2 = Са(НСО3)2
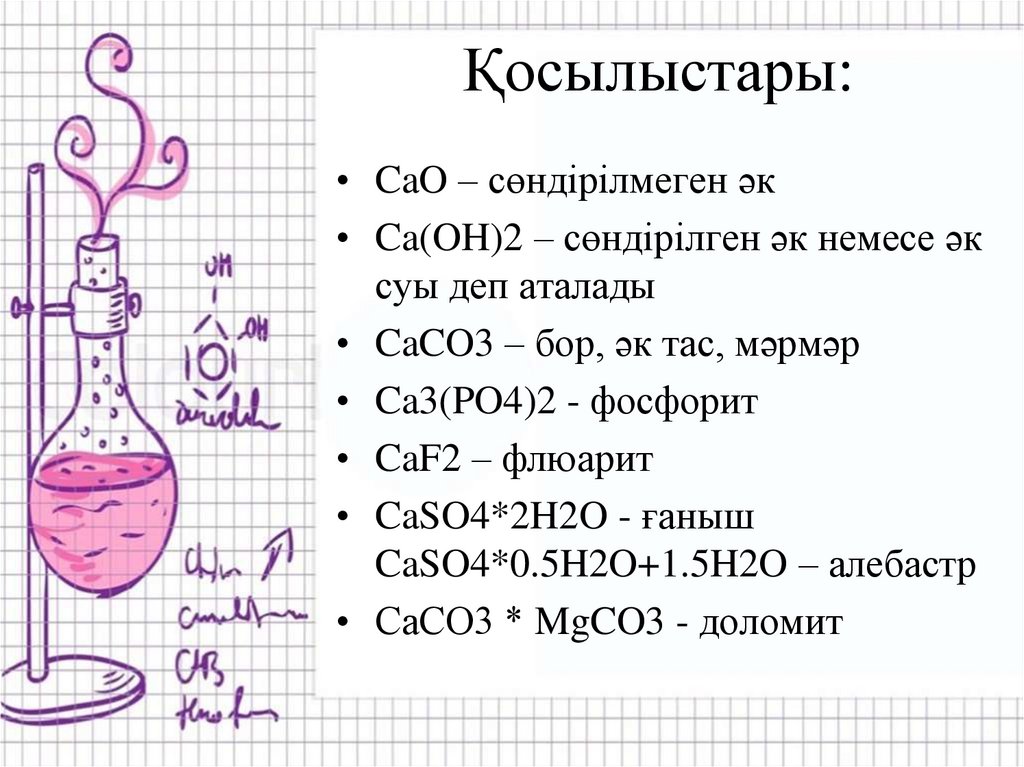
15. Қосылыстары:
• CaO – сөндірілмеген әк• Ca(OH)2 – сөндірілген әк немесе әк
суы деп аталады
• CaCO3 – бор, әк тас, мәрмәр
• Ca3(PO4)2 - фосфорит
• CaF2 – флюарит
• CaSO4*2H2O - ғаныш
CaSO4*0.5H2O+1.5H2O – алебастр
• СаСО3 * MgCO3 - доломит
16.
МАГНИЙКАЛЬЦИЙ
II ТОПТЫҢ
НЕГІЗГІ
ЭЛЕМЕНТТЕРІ
НІҢ БІРІ
17. Жалпы сипаттамалары
магнийкальций
• Д.И.Менделеевтің периодтық
жүйесінің II тобының негізгі
топшасының элементтерінің
екінші өкілі; оның реттік нөмері –
12, атомдық салмағы – 24,305.
Атом кұрылысының электрондык
формуласы – 1s22s22p63s2;
• Д. И.Менделеевтің периодтық
жүйесінің II тобының негізгі
элементтерінің үшінші өкілі; оның
реттік нөмері – 20, атомдық
салмағы – 40,08. Атом
құрылысының электрондық
формуласы –1s22s22p63s23p64s2
18. Табиғатта таралуы
Магний – табиғатта таралуы бойынша VIII орында , массалық үлесібойынша 1,9%. Ол 200-ге жуық минералдын құрамына кіреді:
магнезит және доломит, карналлит, оливин , форстерит, бруцит,
асбест. Магнийдің көп мөлшері мұхит, теңіз және тұзды көлдердің
суларында бар. Орташа есеппен 1м³ суда 1 кг шамасында магний
болады.
Кальций көп таралған элементке жатады. Жер қыртысындағы
құрамы бойынша ол V орында, оның массалық үлесі - 3,4%.
Табиғатта кальций қосылыстарын кез келген жерде кездестіруге
болады: кальций тұздарынан таулы массивтер және сазды тау
жыныстары түзілген, ол теңіз, өзен суларының, өсімдік , жануар
және адам организмдерінің құрамына кіреді.
19. Алынуы
Металдық магнийді алғаш ашқан1828 ж. француз химигі А. Бюсси.
Оны алудың басты жолы –
электролиз немесе MgCl2. Кальций
сілтілік металдар сияқты
тұздарының балқымаларын
электролиздеп алады.
20. Алынуы
• Кальцийдің алынуы Кальций-белсенділігіжоғары металл болғандықтан, балқыған
хлоридінен электролиз арқылы алады.Ең
алғаш рет неміс химигі Вильгельм Бунзен
осы әдіспен кальцийден басқа марганец,
магний металдарын алған.
CaCl2 = Ca + Cl2
• Магний хлориді ерітіндісінің электролизі:
MgCl2 ↔ Mg2+ +2Cl-
21. Физикалық қасиеттері
• Магний – ақ түсті металл,пластикалығы басым, жеңіл
созылады және иіледі. Ол ауамен
жанасқанда бірден жұқа және
тығыз қорғаныш оксид
қабықшасымен қапталады,
сондықтан да мөлдір емес. Жылу
мен электр тогын жақсы өткізеді.
Тығыздығы 1,739 г/см³
Балқу температурасы, 651°С.
Қайнау температурасы, 1107 °С.
• Кальций – күмістей ақ түсті жеңіл
металл. Оның ауамен әрекеттесуі
нәтижесінде түзілген оксид
қабықшасымен лезде қапталады,
сондықтан оны сілтілік металдар
сияқты керосин қабатының астында
сақтайды.
Тығыздығы, 1,55 г/см³
Балқу температурасы, 840 °С
Қайнау температурасы, 1482 °С
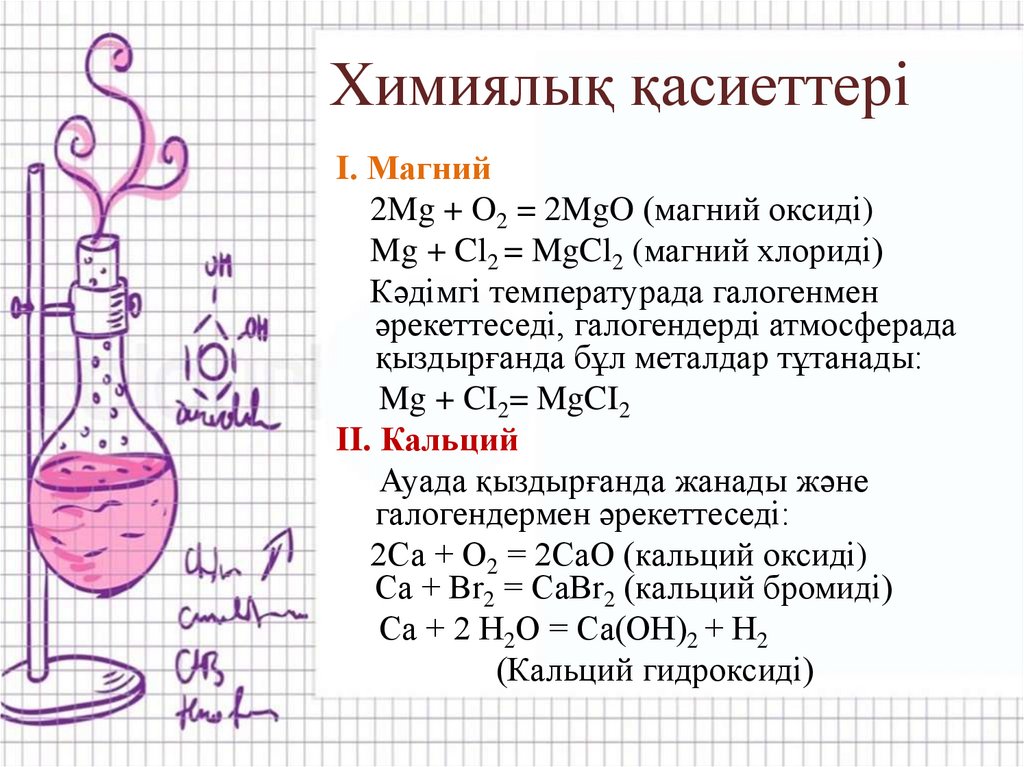
22. Химиялық қасиеттері
I. Магний2Mg + O2 = 2MgO (магний оксиді)
Mg + Cl2 = MgCl2 (магний хлориді)
Кәдімгі температурада галогенмен
әрекеттеседі, галогендерді атмосферада
қыздырғанда бұл металдар тұтанады:
Mg + CI2= MgCI2
II. Кальций
Ауада қыздырғанда жанады және
галогендермен әрекеттеседі:
2Са + О2 = 2СаО (кальций оксиді)
Са + Вr2 = СаВr2 (кальций бромиді)
Са + 2 Н2О = Са(ОН)2 + Н2
(Кальций гидроксиді)
23.
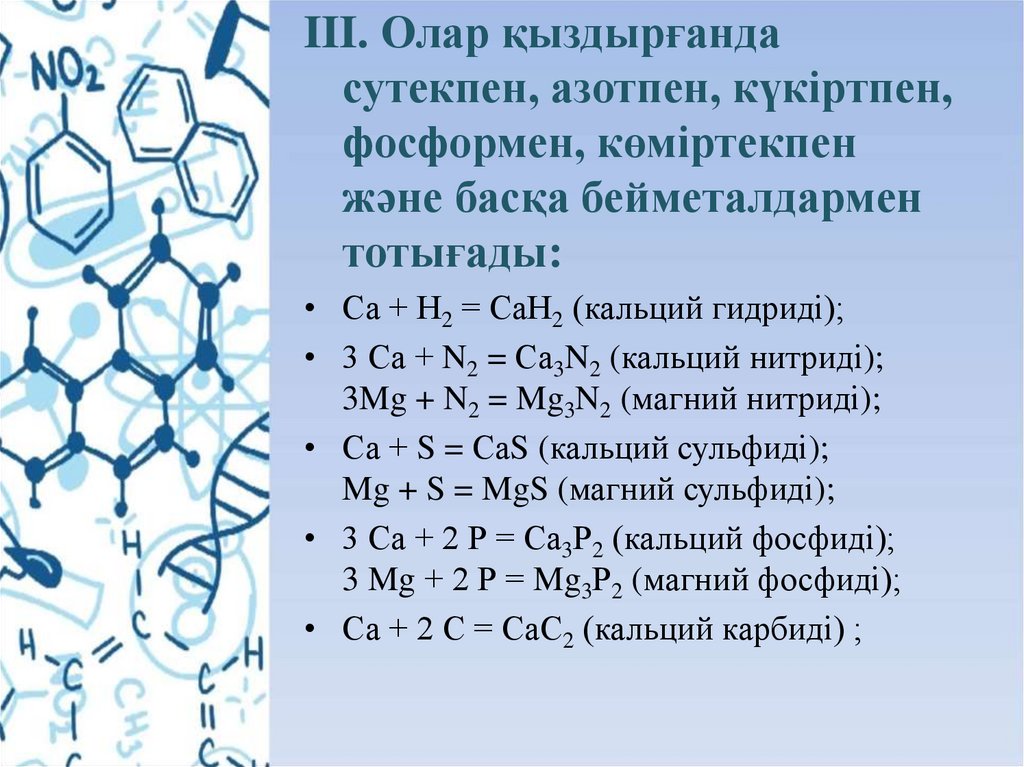
III. Олар қыздырғандасутекпен, азотпен, күкіртпен,
фосформен, көміртекпен
және басқа бейметалдармен
тотығады:
• Са + Н2 = СаН2 (кальций гидриді);
• 3 Са + N2 = Са3N2 (кальций нитриді);
3Mg + N2 = Mg3N2 (магний нитриді);
• Са + S = СаS (кальций сульфиді);
Mg + S = MgS (магний сульфиді);
• 3 Са + 2 Р = Са3Р2 (кальций фосфиді);
3 Mg + 2 Р = Mg3Р2 (магний фосфиді);
• Са + 2 С = СаС2 (кальций карбиді) ;
24. Биологиялық рөлі
Магнийдің ағзадажетіспеушілігі миокард
инфарктына алып келеді.
Оның қанда аз болу
себебі – стресстің немесе
шаршағандықтың белгісі.
Ол үлкен адамға күніне
300-500 мг мөлшерде
қажет.
Кальций адам ағзасында өте
кең таралған макроэлемент,
ол көп мөлшерде қаңқада
және тісте кездеседі. Оның
үлкен адамға қажет мөлшері
800-1000 мг, ал жас балаға
600-900 мг. қажет. Кальцийдің
сіңірілуіне аспирин,
қымыздық қышқыл әсер
етеді. Сондай-ақ ағзаның
кальцийді сіңіруіне магний
қажет екені көрсетілген.
25.
Магний нанда, сүт , етжәне басқа күнделікті
тағамдарда аз болады.
Құрамында көп
мөлшерде кальций бар
тағам ішу адамның өмір
жасын ұзартатындығын
швед ғалымдары
зерттеген. Тістен басқа
ол сүйекте болады.
Олар жемістер мен
көкөністерде көптеп
кездеседі.
26. Қолданылулары
• Магнийдің берік және жеңіл құймаларын авиацияда жәнемашина жасауда кеңінен қолданады. Бұл құймаларға
электрон (Mg, Al, Zn, Mn), магналит және т.б. жатады.
Магнийді шойынға қосқанда шойынның беріктігін және
иілгіштігін едәір жоғарылатады.
• Кальций құймаларын, жоғары сортты болат алу үшін
пайдаланады. Кальций және қорғасын құймаларын
подшипник өндіріснде қолданады.
• Кальций мен магнийдің тотықсыздандырғыштық
қасиеттерін өнеркәсіпте кейбір бағалы және сирек металдар
алу үшін қолданады.
27.
«Шешімін тап»1- тапсырма:
Теңдеуді шығар:CаО + Н2О =…;
Мg + O2 = …;
Na2O + H2O=….
2- тапсырма:
Мынадай айналымдардың реакция теңдеулерін жазыңдар:
Са→СаО→Са(ОН)2→Са(NO3)2
3- тапсырма:
Теңдеуді шығар:
MgO + H2O = ….;
MgO +HCI = …. + ….;
Na2O + H2SO4 = Na2 SO4 + ….


















 chemistry
chemistry








