Similar presentations:
Лекция _МОЛ ФИЗ 11.11.25
1. Основы молекулярной физики и термодинамики
Газовые законыМодель идеального газа
Уравнение Клапейрона-Менделеева
2. Введение
Молекулярная физика и термодинамика – разделы физики, вкоторых изучаются макроскопические процессы в телах, связанные с
огромным числом содержащихся в телах атомов и молекул.
Молекула – наименьшая частица данного
вещества, сохраняющая его свойства
Атом
–
наименьшая
химического
элемента,
свойства
частица
данного
сохраняющая
его
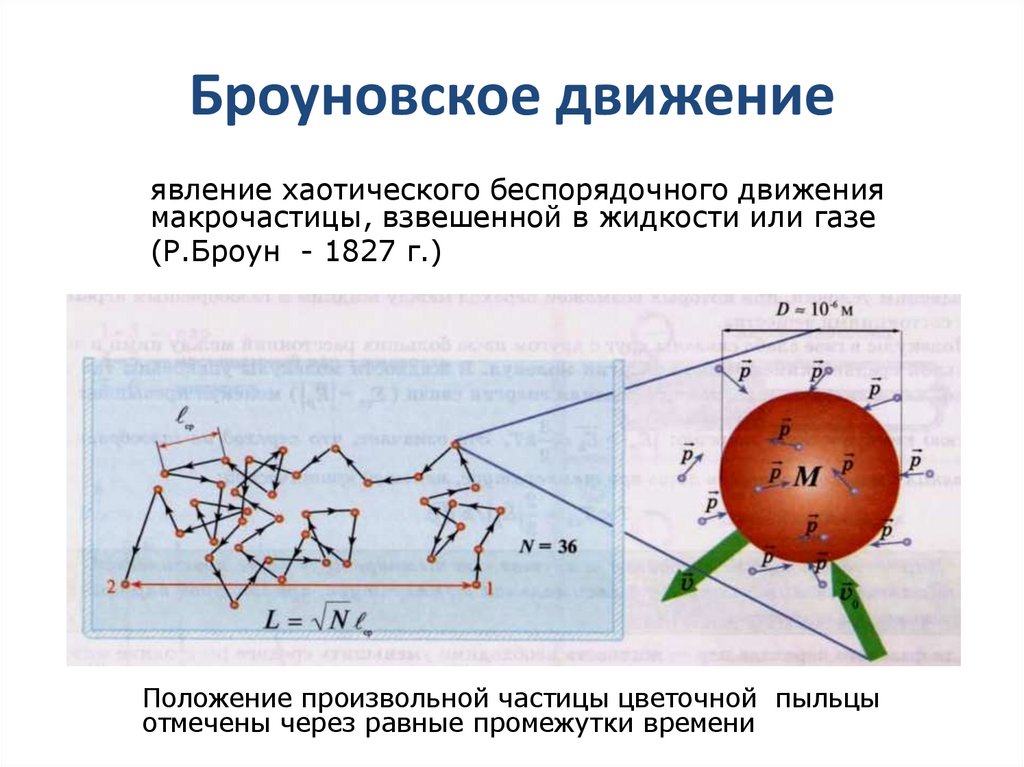
3. Броуновское движение
явление хаотического беспорядочного движениямакрочастицы, взвешенной в жидкости или газе
(Р.Броун - 1827 г.)
Положение произвольной частицы цветочной пыльцы
отмечены через равные промежутки времени
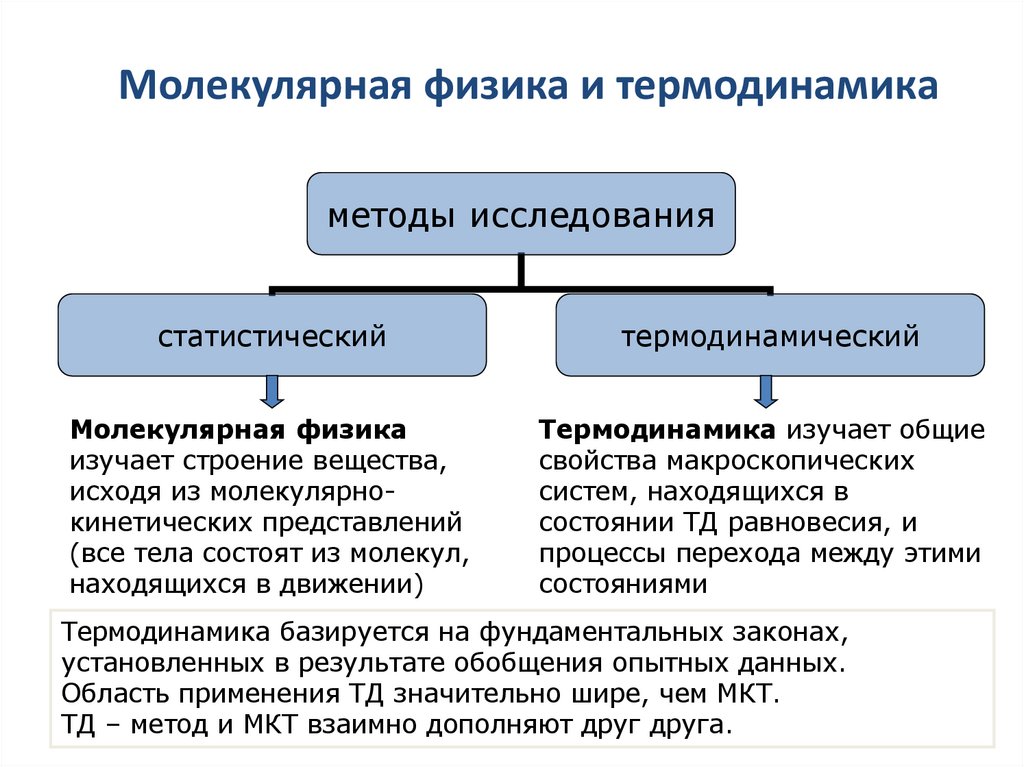
4. Молекулярная физика и термодинамика
методы исследованиястатистический
термодинамический
Молекулярная физика
изучает строение вещества,
исходя из молекулярнокинетических представлений
(все тела состоят из молекул,
находящихся в движении)
Термодинамика изучает общие
свойства макроскопических
систем, находящихся в
состоянии ТД равновесия, и
процессы перехода между этими
состояниями
Термодинамика базируется на фундаментальных законах,
установленных в результате обобщения опытных данных.
Область применения ТД значительно шире, чем МКТ.
ТД – метод и МКТ взаимно дополняют друг друга.
5.
Параметры телаМакроскопическ
ие
Микроскопичес
кие
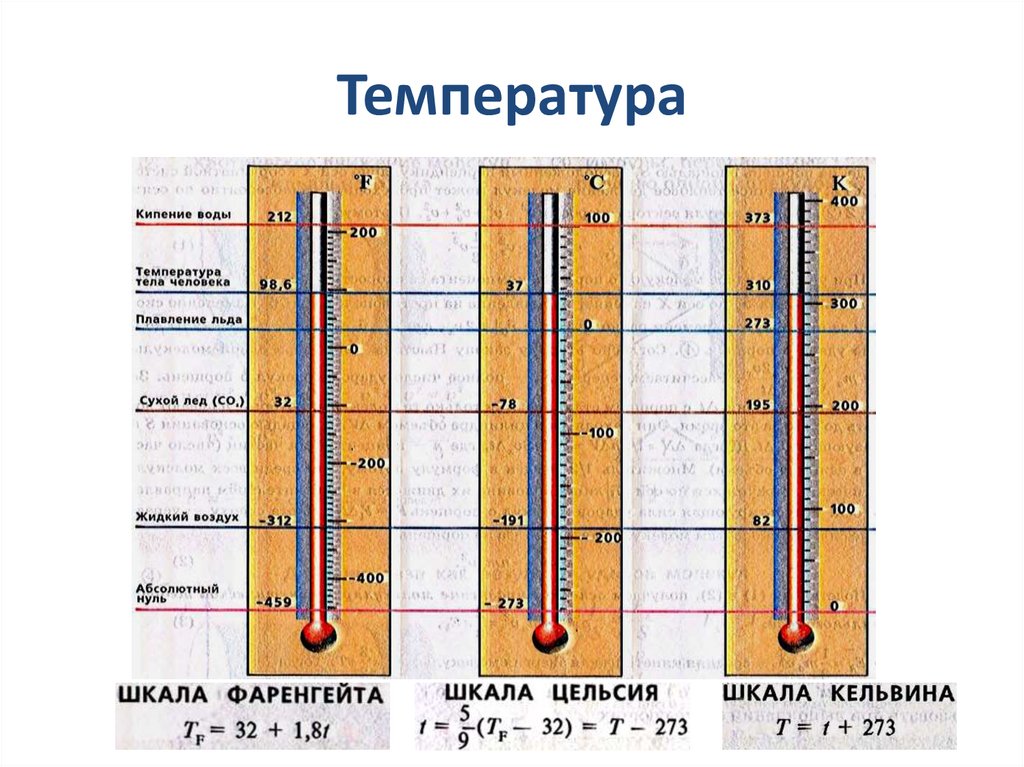
6. Температура
7.
Газы - системы, состоящиеиз очень большого числа
частиц (до 1026м–3),
находящихся в постоянном
беспорядочном движении.
При нормальных условиях
(р = 1,013·105 Па, Т = 273,15
К) все газы содержат в
единицы объёма одинаковое
число молекул.
8. Модель идеального газа
• Собственный объем молекулпренебрежимо мал по сравнению с
объемом сосуда
• Между молекулами отсутствуют силы
взаимодействия
• Столкновения молекул газа между собой и
со стенками сосуда абсолютно упругие
9. Единицы измерения количества вещества
1 моль – количество вещества, в котором находитсястолько же частиц, сколько содержится атомов в 0,012 кг
изотопа углерода C¹².
1 моль любого вещества содержит одинаковое
количество частиц, называемое постоянной Авогадро:
N A 6,022 10 моль
23
1
Молярная масса – масса одного моля вещества
m
M
N
NA
масса одной частицы
- число молей
m
m0
N
M
m0
NA
10.
().
Основное уравнение МКТ
Давление газа
пропорционально
произведению массы молекулы,
концентрации молекул и
среднему квадрату скорости
движения молекул.
где макропараметры
микропараметры
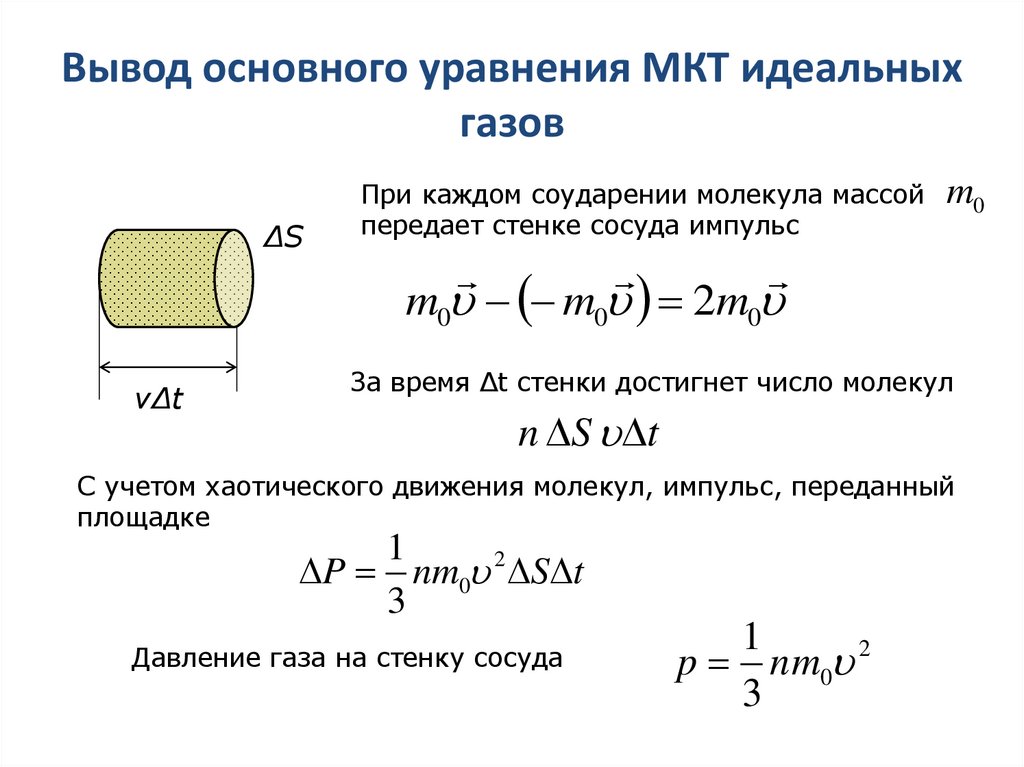
11. Вывод основного уравнения МКТ идеальных газов
ΔSПри каждом соударении молекула массой
передает стенке сосуда импульс
m0
m0 m0 2m0
νΔt
За время Δt стенки достигнет число молекул
n S t
С учетом хаотического движения молекул, импульс, переданный
площадке
1
P nm0 2 S t
3
Давление газа на стенку сосуда
1
p n m0 2
3
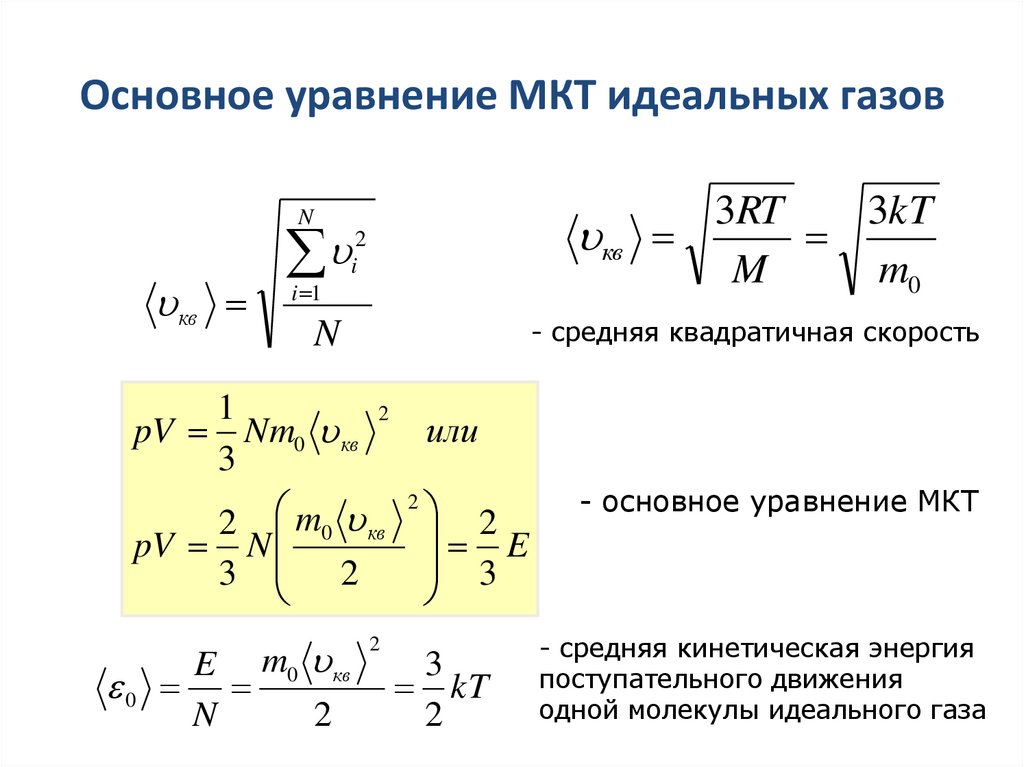
12. Основное уравнение МКТ идеальных газов
2i
3RT
3kT
кв
M
m0
N
- средняя квадратичная скорость
N
кв
i 1
1
2
pV Nm0 кв
или
3
2
2 m0 кв 2
pV N
E
3
3 2
E m0 кв
0
N
2
2
3
kT
2
- основное уравнение МКТ
- средняя кинетическая энергия
поступательного движения
одной молекулы идеального газа
13. Изопроцессы
Изопроцессы – термодинамические процессы,происходящие при одном постоянном
термодинамическом параметре и неизменной
массе газа
Изотермический процесс T=const
Изобарный процесс
p=const
Изохорный процесс
V=const
T1
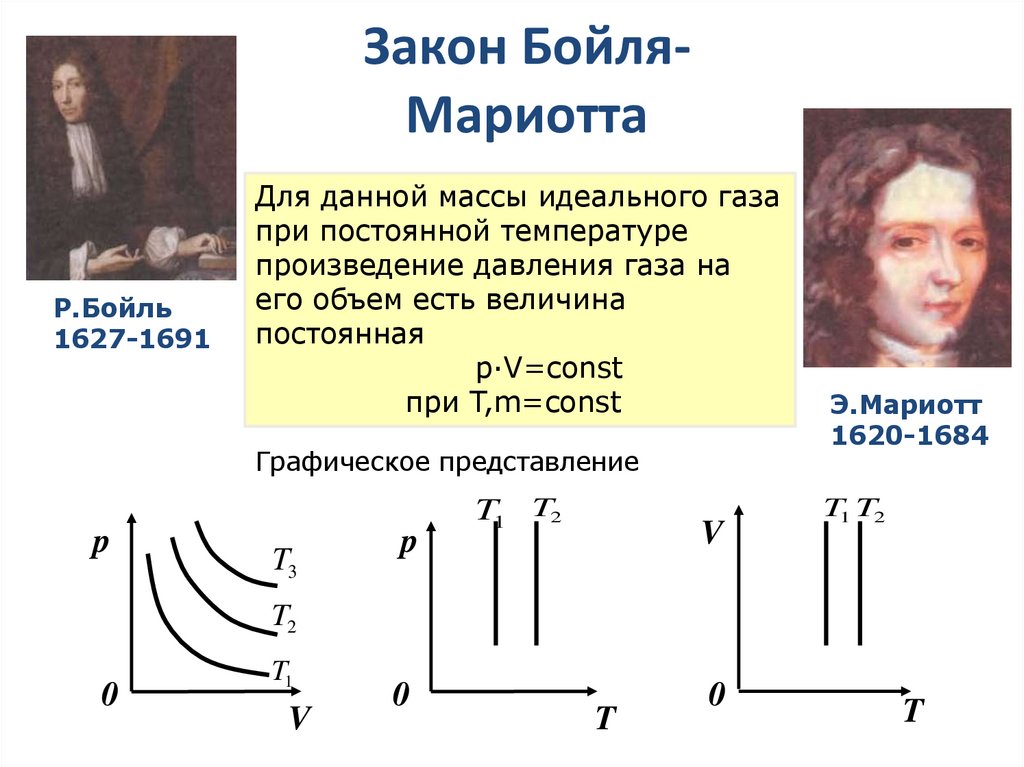
14. Закон Бойля-Мариотта
Закон БойляМариоттаР.Бойль
1627-1691
Для данной массы идеального газа
при постоянной температуре
произведение давления газа на
его объем есть величина
постоянная
p·V=const
при T,m=const
Графическое представление
p
T3
p
T1 T2
V
Э.Мариотт
1620-1684
T1 T2
T2
0
T1
V
0
T
0
T
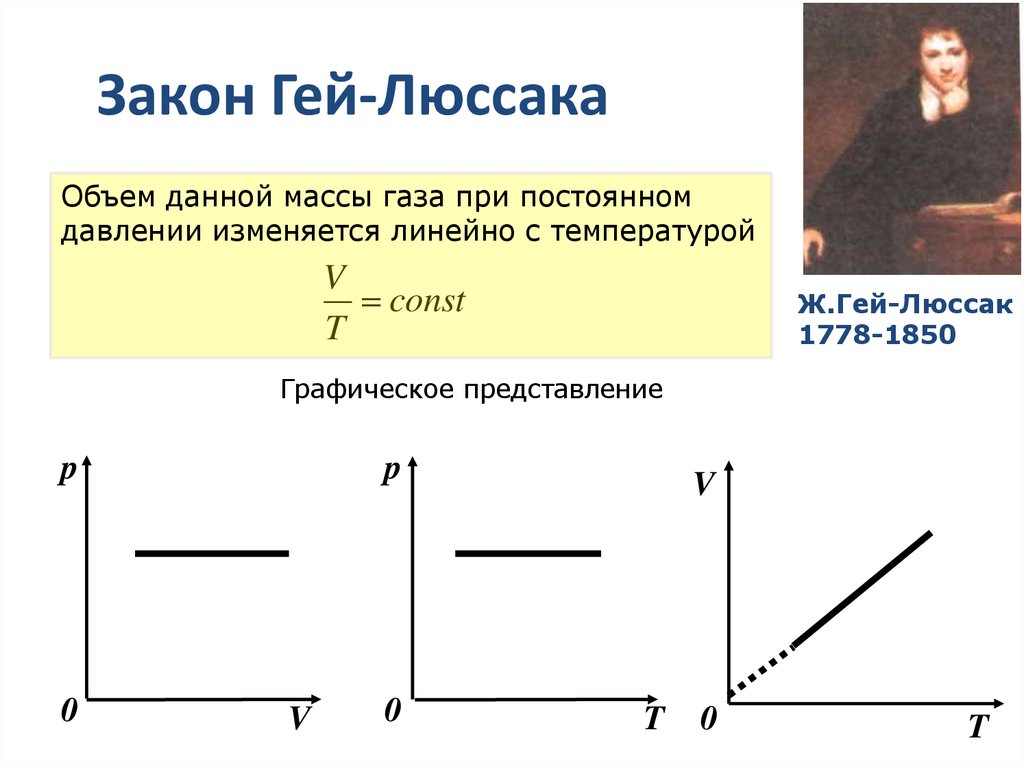
15. Закон Гей-Люссака
Объем данной массы газа при постоянномдавлении изменяется линейно с температурой
V
const
T
Ж.Гей-Люссак
1778-1850
Графическое представление
p
0
p
V
0
V
T
0
T
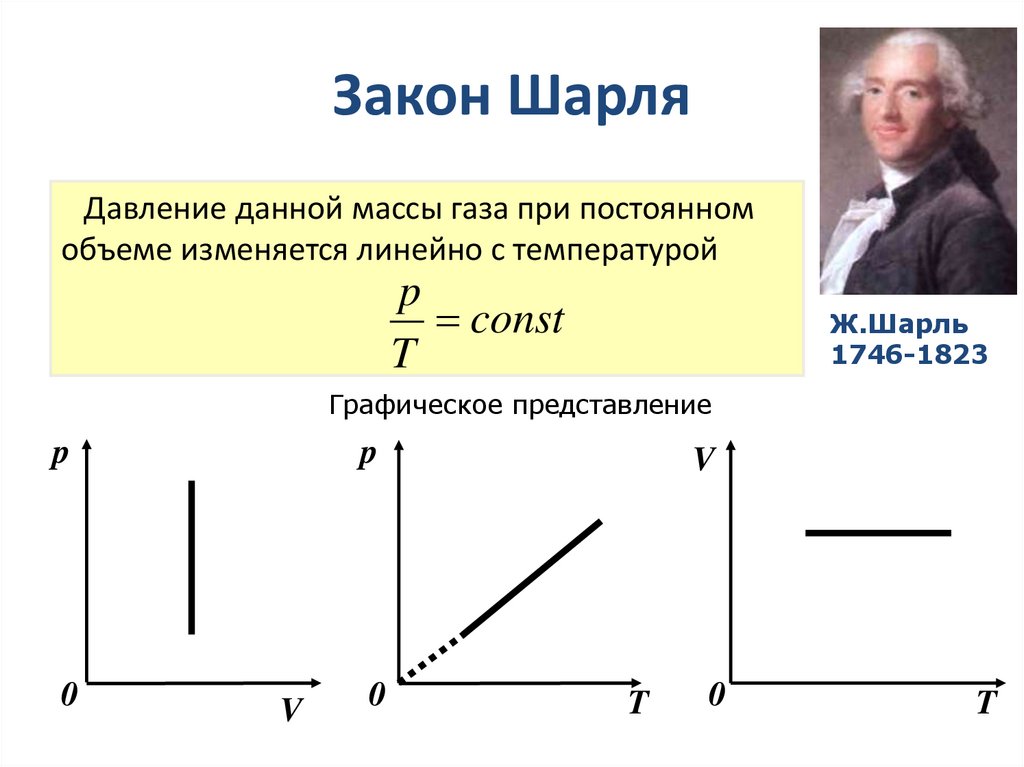
16. Закон Шарля
Давление данной массы газа при постоянномобъеме изменяется линейно с температурой
p
const
T
Ж.Шарль
1746-1823
Графическое представление
p
0
p
V
0
V
T
0
T
17. Уравнение Клапейрона-Менделеева
Уравнение состояния – уравнение, связывающеетермодинамические параметры, однозначно описывающие
состояние термодинамической системы в любой момент времени.
pV
const
T
-уравнение Клапейрона
pV
R
T
уравнение КлапейронаМенделеева
R= 8.31 Дж/К моль
Б.Клапейрон
1799-1864
Д.И.Менделеев
1834-1907
18.
ОБОБЩЕНИЕ ГАЗОВЫХ ЗАКОНОВ19. Закон Дальтона- английский химик в 1809 г.
Закон Дальтона утверждает, что общеедавление всех газов вместе взятых равно
сумме парциальных давлений каждого газа в
отдельности.
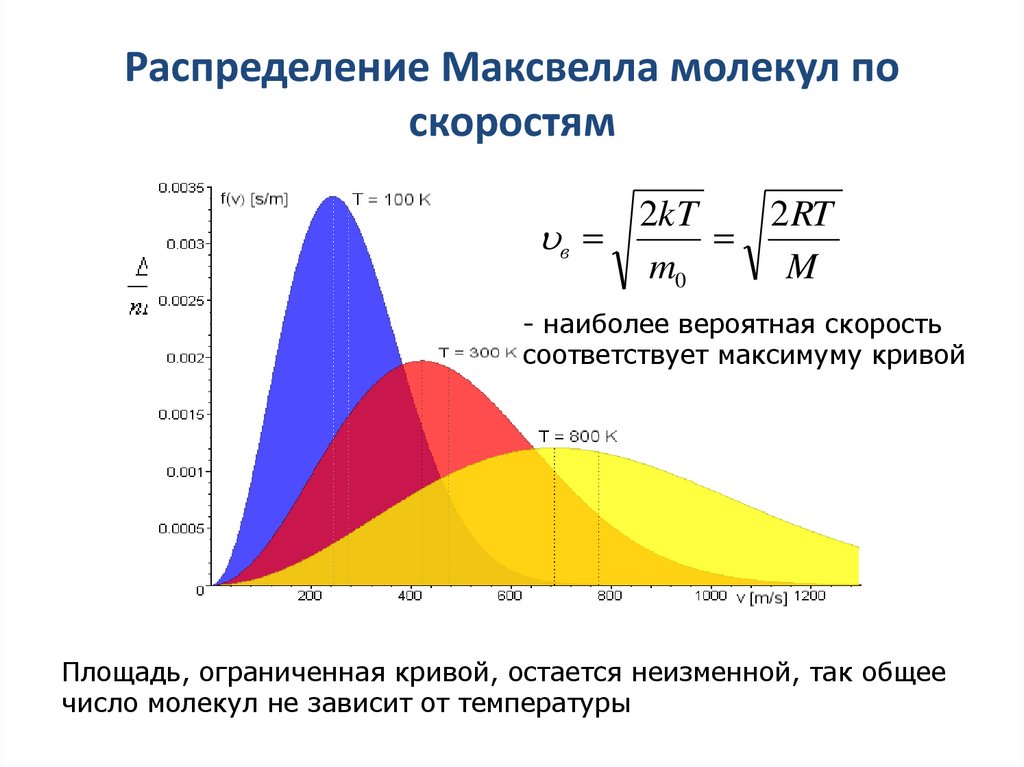
20. Распределение Максвелла молекул по скоростям
2kT2 RT
в
m0
M
- наиболее вероятная скорость
соответствует максимуму кривой
Площадь, ограниченная кривой, остается неизменной, так общее
число молекул не зависит от температуры
21. Задача
1. Каким должен быть наименьший объембаллона, вмещающего массу 6,4 кг кислорода,
если его стенки при температуре 20оС
выдерживают давление 15,7 МПа?
Решение: р=15,7 МПа=15,7 106Па; Т=20оС=293К.
Из уравнения Менделеева-Клапейрона:
m
pV RT
M
m RT
V
M p
6,4кг 8,31 Дж/(моль К)
3 3
V
31
10
м 31 л
6
0,032кг/моль 15,7 10 Па
22. ЗадачаЗЗа
1 (A). Какой из приведенныхграфиков, изображенных на
рисунке, соответствует процессу,
проведенному при постоянной
температуре?
Решение: Б – изобара, В – изотерма, Г – изохора.
p
const.
График А описывается уравнением
V
Правильный ответ: В
23. Испарение, конденсация
Парообразование – процесс переходавещества из жидкого состояния в
газообразное.
Конденсация – процесс перехода вещества
из газообразного состояния в жидкое.
Испарение – образование пара,
происходящее с открытой поверхности
жидкости при любой температуре.
Кипение − образование пара, происходящее
как с открытой поверхности, так и внутри
жидкости при определенной температуре
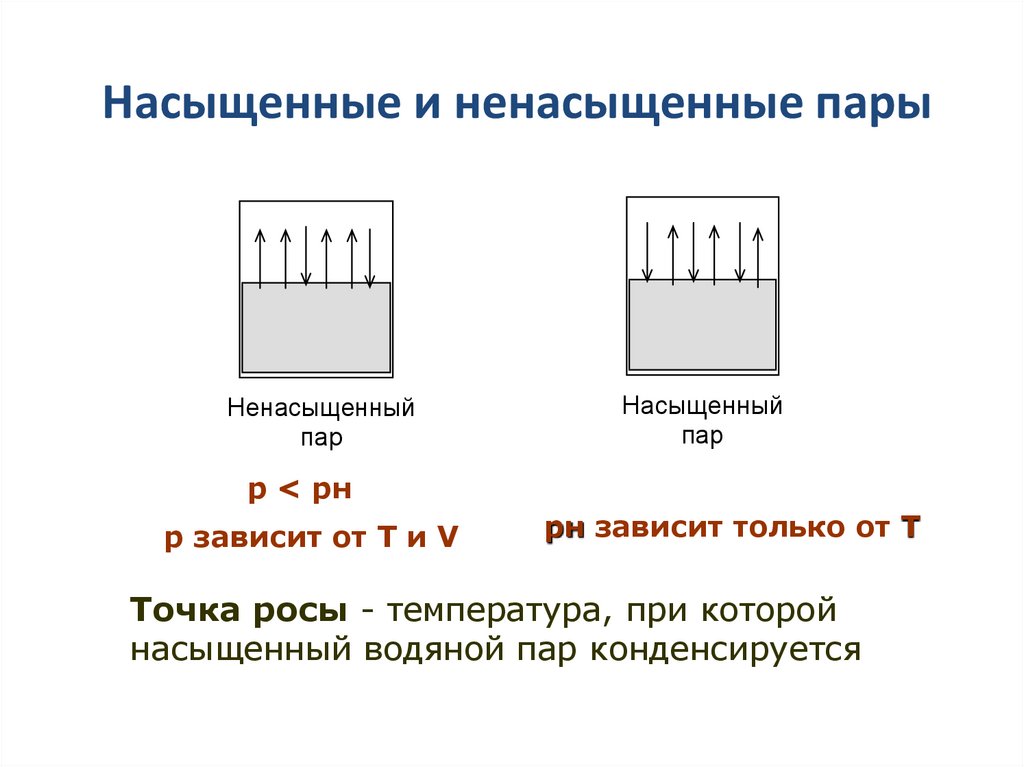
24. Насыщенные и ненасыщенные пары
Ненасыщенныйпар
Насыщенный
пар
р < рн
р зависит от T и V
рн зависит только от Т
Точка росы - температура, при которой
насыщенный водяной пар конденсируется
25. Влажность - содержание паров воды в воздухе
Влажность содержание паров воды в воздухеАбсолютная
влажность:
Относительная
влажность:
m
V
г
[ ] 3
м
100%
н
р
100%
рн
26. Задача
1 (А). Относительная влажность воздуха равна 60%, давлениенасыщенного пара в нем при некоторой температуре равно
2,2 кПа. Чему равно парциальное давление пара при этой
же температуре?
р
100%
Решение: относительная
р0влажность
р рн.п.
р 0,6 рн.п.
р 0,6 2,2 10 Па 1,3 10 Па 1,3 кПа
3
3
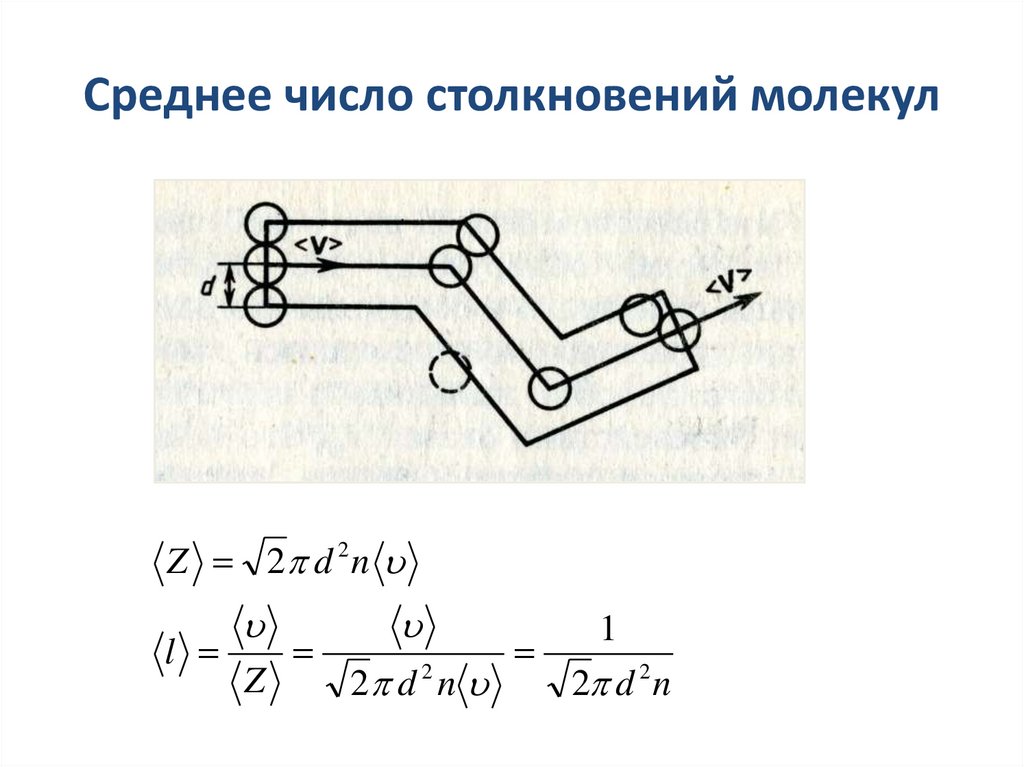
27. Среднее число столкновений и средняя длина свободного пробега молекул
lZ
- средняя длина свободного пробега молекул –
расстояние, которое проходят молекулы между 2-мя
последовательными столкновениями
средняя скорость
Z среднее число столкновений молекул за 1с
Эффективный диаметр молекулы d –
минимальное расстояние, на которое
сближаются при столкновении центры 2-х
молекул
d
28. Среднее число столкновений молекул
Z 2 d 2n1
l
2
Z
2 d n
2 d 2 n
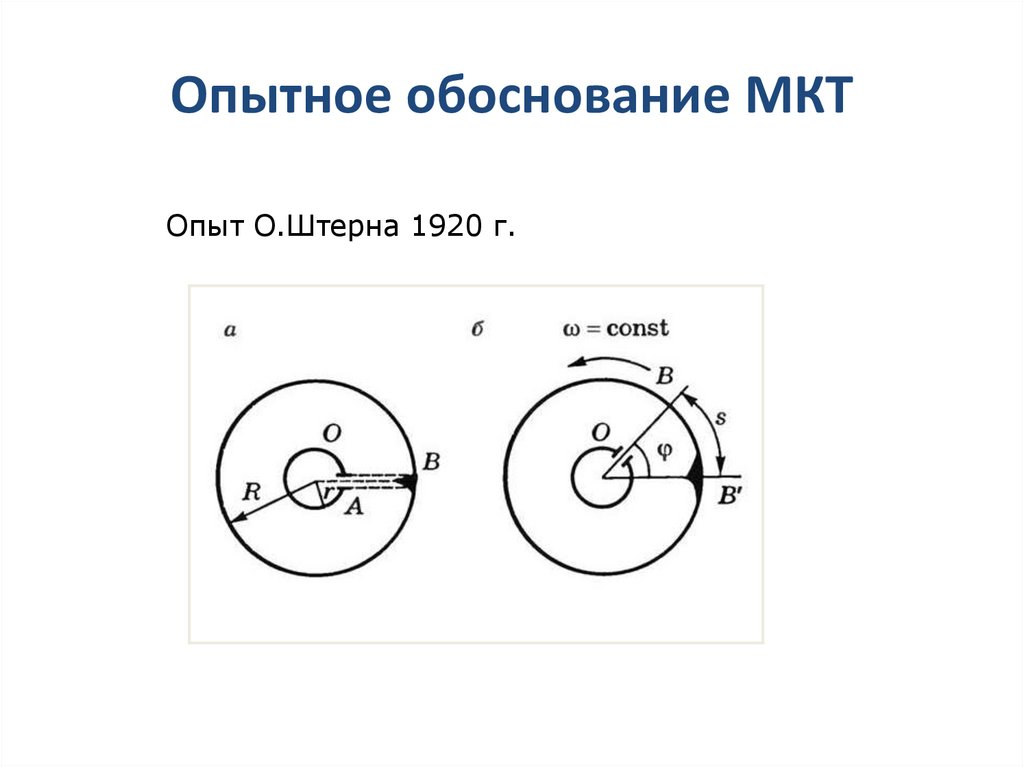
29. Опытное обоснование МКТ
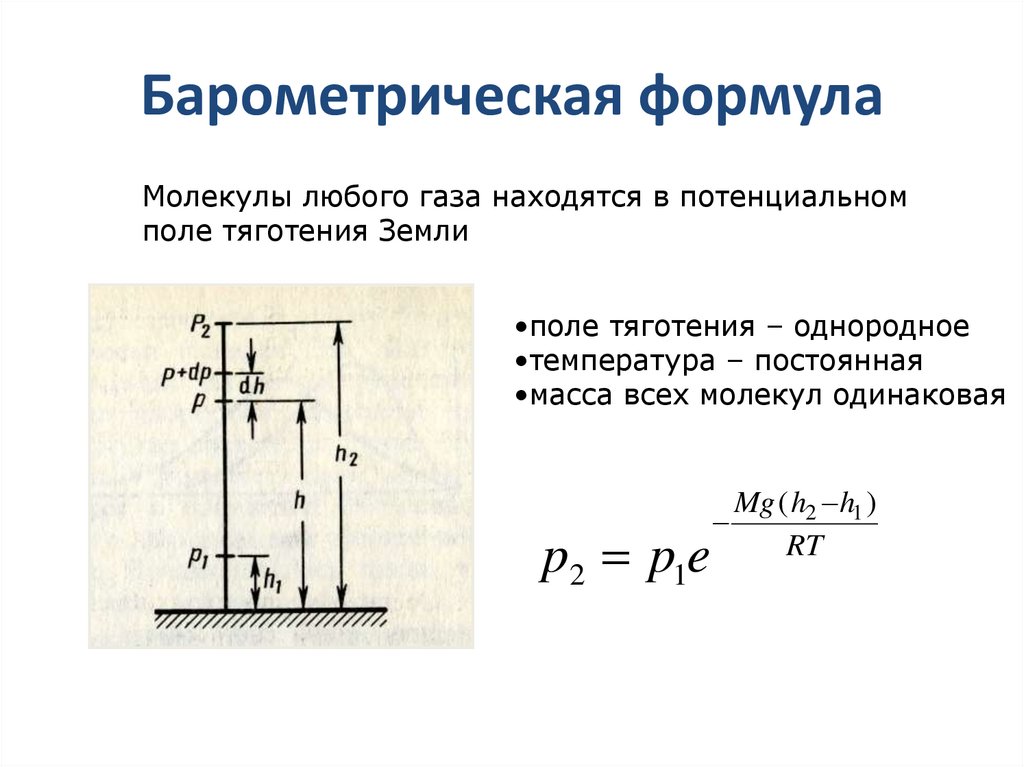
Опыт О.Штерна 1920 г.30. Барометрическая формула
Молекулы любого газа находятся в потенциальномполе тяготения Земли
•поле тяготения – однородное
•температура – постоянная
•масса всех молекул одинаковая
p2 p1e
Mg ( h2 h1 )
RT

















 physics
physics








