Similar presentations:
Органическая химия. Итоговая аттестация
1.
ОРГАНИЧЕСКАЯ ХИМИЯЗубков Фёдор Иванович
fzubkov1973@gmail.com
лаборатории 619, 616
2.
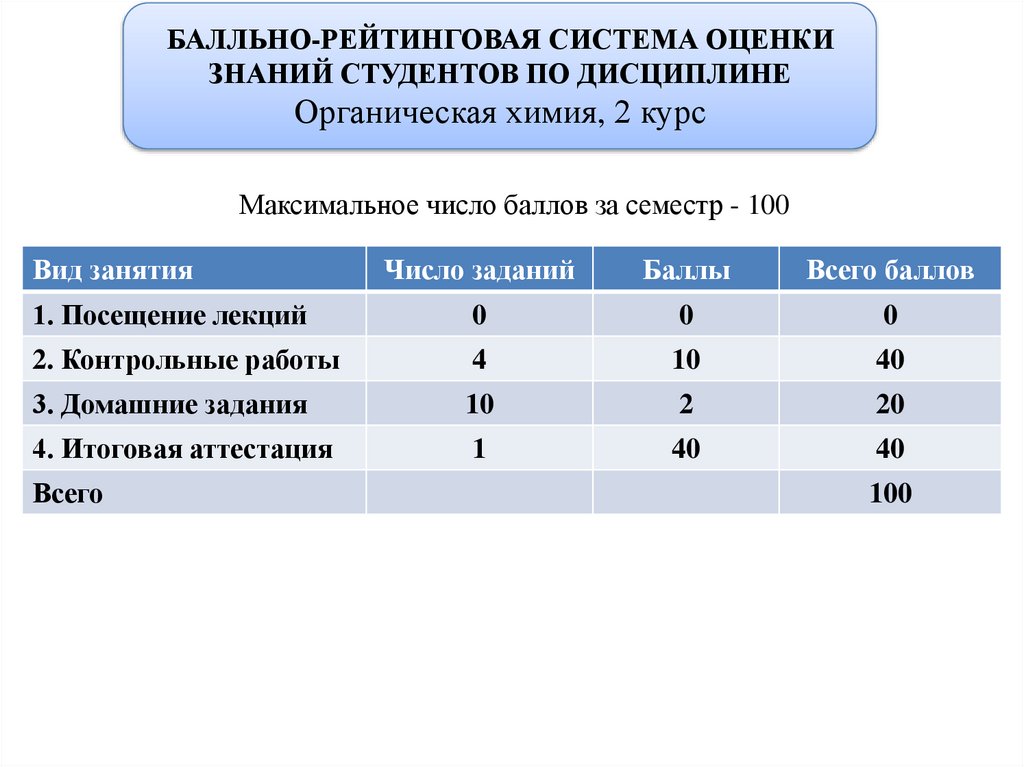
БАЛЛЬНО-РЕЙТИНГОВАЯ СИСТЕМА ОЦЕНКИЗНАНИЙ СТУДЕНТОВ ПО ДИСЦИПЛИНЕ
Органическая химия, 2 курс
Максимальное число баллов за семестр - 100
Вид занятия
Число заданий
Баллы
Всего баллов
1. Посещение лекций
0
0
0
2. Контрольные работы
4
10
40
3. Домашние задания
10
2
20
4. Итоговая аттестация
1
40
40
Всего
100
3.
БАЛЛЬНО-РЕЙТИНГОВАЯ СИСТЕМА ОЦЕНКИ ЗНАНИЙ СТУДЕНТОВ1. Студенты обязаны сдавать домашние задания в сроки, установленные преподавателем. Работы,
сданные не в срок, не оцениваются.
2. Плановые контрольные работы проводятся 4 раза в семестр, в конце каждого месяца.
Студент допускается к контрольной работе после выполнения всех домашних работ по теме.
Контрольные работы рассчитаны на 1 час.
3. Разрешается единожды переписывать контрольную работу, если по ней получено менее 5
баллов, при этом, ранее полученные баллы аннулируются. Переписывать контрольную работу
разрешается после разбора ошибок на консультации и в период времени не более трёх недель
после контрольной.
4. Отсрочка в переписывании контрольных работ и сдачи домашнего задания считается
уважительной в случае болезни студента, что подтверждается медицинской справкой
(предоставляется в деканат). Во время болезни студент может и должен предоставлять домашние
задания для проверки в виде единственного файла в формате pdf по эл. адресу:
fzubkov1973@gmail.com или адресу руководителя семинарских занятий.
Старостам всех групп – прислать сегодня письмо на указанный адрес (указать номер группы,
ФИО, контингент, номера студенческих билетов в виде таблицы эксэль)
4.
БАЛЛЬНО-РЕЙТИНГОВАЯ СИСТЕМА ОЦЕНКИ ЗНАНИЙ СТУДЕНТОВ5. Итоговая контрольная работа является обязательной. Студент допускается к итоговой
контрольной с любым количеством баллов, набранным в семестре. Баллы, выставленные за
итоговую контрольную работу, суммируются с баллами, полученными в семестре.
6. Если в итоге за семестр студент набирает менее 51 балла, то студенту разрешается переписать
итоговую контрольную работу (ИКР) в ходе текущей сессии. При этом все баллы, набранные в
семестре, аннулируются, а ИКР оценивается из 100 баллов. Для получения оценки
удовлетворительно студент должен набрать не менее 51 балла.
Студенты, получившие неудовлетворительную оценку по итогам переписывания ИКР,
переписывают ИКР ещё раз в начале следующего семестра (комиссионная пересдача).
7. ИКР – письменная, содержит вопросы по всем разделам дисциплины, пройденным в семестре.
Основное внимание уделяется механизмам реакций. На подготовку к ответу отводится 2.5 ч.
Варианты ИКР за последние 5 лет выложены в ТУИС, на страничке лектора и руководителей
семинара (https://esystem.rudn.ru/course/view.php?id=6282).
5.
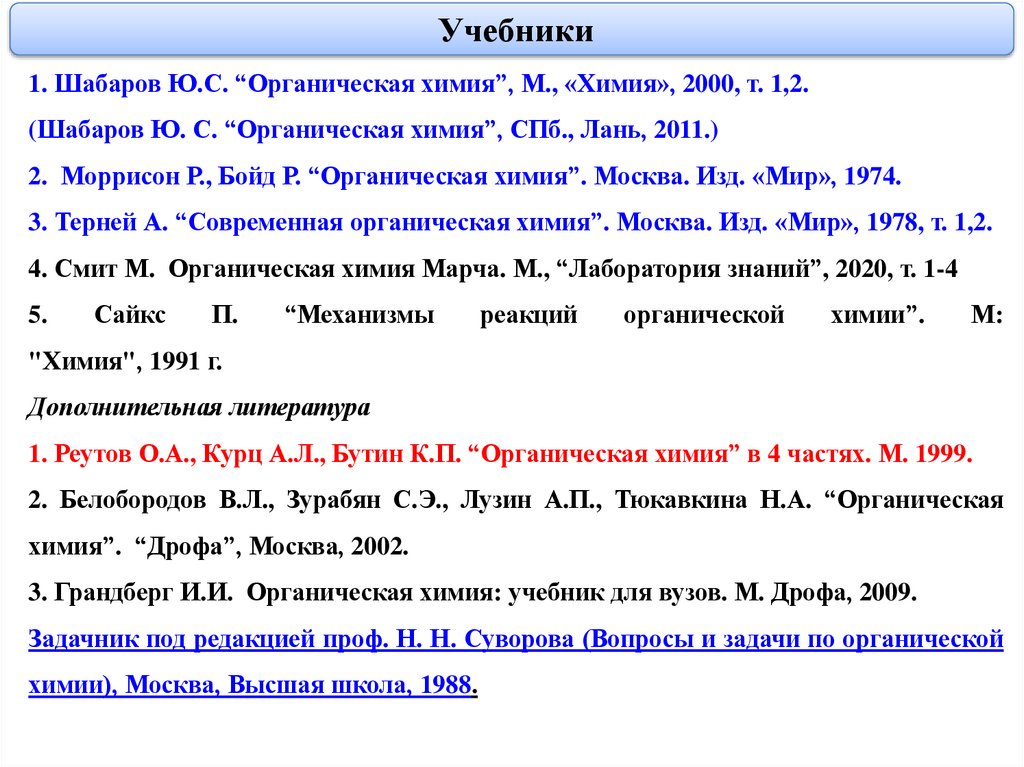
Учебники1. Шабаров Ю.С. “Органическая химия”, М., «Химия», 2000, т. 1,2.
(Шабаров Ю. С. “Органическая химия”, СПб., Лань, 2011.)
2. Моррисон Р., Бойд Р. “Органическая химия”. Москва. Изд. «Мир», 1974.
3. Терней А. “Современная органическая химия”. Москва. Изд. «Мир», 1978, т. 1,2.
4. Смит М. Органическая химия Марча. М., “Лаборатория знаний”, 2020, т. 1-4
5.
Сайкс
П.
“Механизмы
реакций
органической
химии”.
М:
"Химия", 1991 г.
Дополнительная литература
1. Реутов О.А., Курц А.Л., Бутин К.П. “Органическая химия” в 4 частях. М. 1999.
2. Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. “Органическая
химия”. “Дрофа”, Москва, 2002.
3. Грандберг И.И. Органическая химия: учебник для вузов. М. Дрофа, 2009.
Задачник под редакцией проф. Н. Н. Суворова (Вопросы и задачи по органической
химии), Москва, Высшая школа, 1988.
6.
Учебники1. Шабаров Ю.С. “Органическая химия”, М., «Химия», 2000, т. 1,2.
(или Шабаров Ю. С. “Органическая химия”, СПб., Лань, 2011.)
http://elibrary.sgu.ru/uch_lit/564.pdf
2. Моррисон Р., Бойд Р. “Органическая химия”. Москва. Изд. «Мир», 1974.
3. Терней А. “Современная органическая химия”. Москва. Изд. «Мир», 1978, т. 1, 2.
7.
Учебники4. Смит М. Органическая химия Марча. М., “Лаборатория знаний”, 2020, т. 1-4
Реакции, механизмы, строение
(углубленный курс для университетов
и химических вузов)
8.
Учебники5. Реутов О.А., Курц А.Л., Бутин К.П. “Органическая химия” в 4 частях. 1999-2021.
Задачник под редакцией проф. Н. Н. Суворова (Вопросы и задачи по органической
химии), Москва, Высшая школа, 1988 или старше. Есть в библиотеке.
9.
Студенческий научно-исследовательский кружокОрганический синтез
Исследовательские работы проводятся во всех лабораториях кафедры
органической химии. Например, лаборатория 616, 6 этаж, напротив лифта.
Приглашаются студенты, заинтересованные в научной карьере.
Наличие опубликованной статьи: + 5 баллов к бакалаврской и +15 баллов
к магистерской, на защите дипломов.
Каждая статья даёт +5 баллов при поступлении в аспирантуру.
Руководители доценты Зубков Ф. И., Зайцев В. П. и Борисова Т. Н.
ORCID: http://orcid.org/0000-0002-0289-0831
Scopus AutorID: 6603592191
ResearcherID: http://www.researcherid.com/rid/A-6020-2012
10.
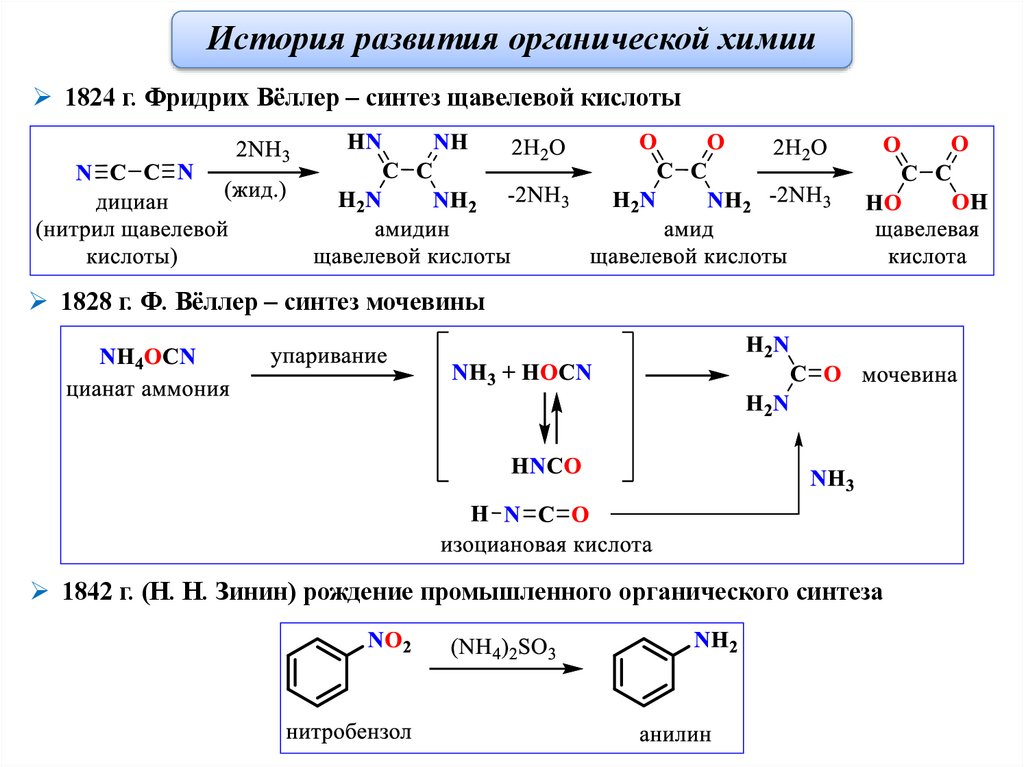
История развития органической химии1824 г. Фридрих Вёллер – синтез щавелевой кислоты
1828 г. Ф. Вёллер – синтез мочевины
1842 г. (Н. Н. Зинин) рождение промышленного органического синтеза
11.
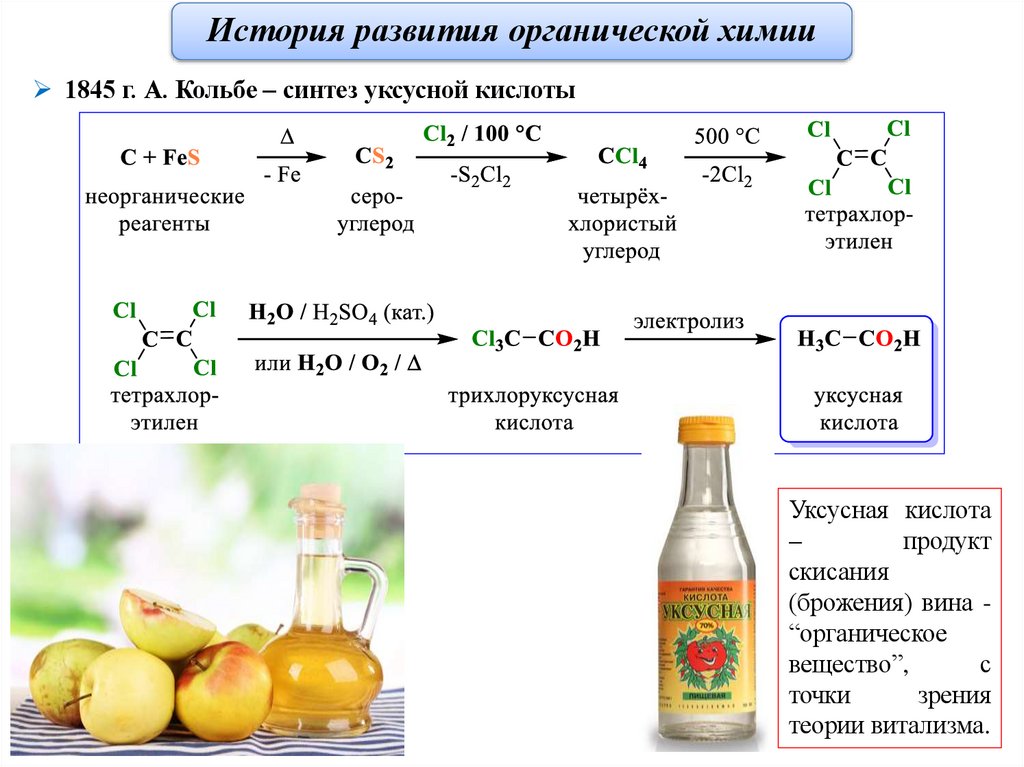
История развития органической химии1845 г. А. Кольбе – синтез уксусной кислоты
Уксусная кислота
–
продукт
скисания
(брожения) вина “органическое
вещество”,
с
точки
зрения
теории витализма.
12.
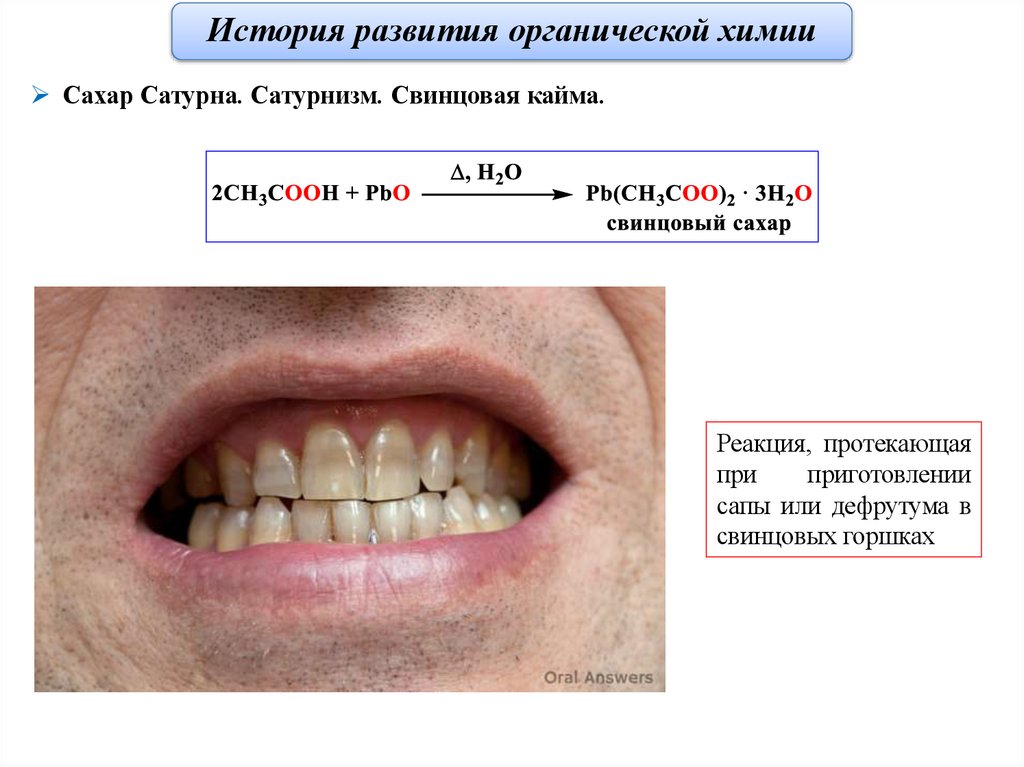
История развития органической химииСахар Сатурна. Сатурнизм. Свинцовая кайма.
Реакция, протекающая
при
приготовлении
сапы или дефрутума в
свинцовых горшках
13.
Теория химического строения А.М. Бутлерова (1861 г.)Основные положения теории
1. Атомы в молекулах соединены друг с другом в
определенной последовательности согласно их
валентностям. Последовательность межатомных
связей в молекуле называется ее химическим
строением и отражается одной структурной
формулой.
2. Свойства соединений зависят не только от того,
какие атомы и в каком количестве входят в состав
молекулы, но и от химического строения.
3. Атомы и группы атомов, входящие в состав
молекул, взаимно влияют друг на друга, что
отражается на свойствах органических соединений.
Александр Михайлович
Бутлеров
14.
Типы химической связи. Ковалентная связьКовалентная – связь, образованная за счет обобществления электронов двух атомов.
Имеется два механизма образования связи:
а) 1ē + 1ē – ковалентный механизм образования (ē - электрон)
Н-Н, С-С, Br-Br – ковалентная неполярная; Н-Cl, H-C, C-F – ковалентная полярная.
Полярность связи (поляризация связи) обозначается в органической химии с
помощью частичных зарядов ( - “дельта”) и определяется разницей в
электроотрицательности элементов. Например, CH3+ Br- , H+ Br- .
Электроотрицательность элементов по Полингу
Li 1.0
Na 0.9
K 0.8
Rb 0.8
Cs 0.7
б)
Be 1.5
Mg 1.2
Ca 1.0
Sr
1.0
Ba 0.9
B 2.0
Al 1.5
H
2.1
C 2.5
Si 1.8
N 3.0
P 2.1
- донорно-акцепторный механизм образования,
(
O 3.5 F 4.0
S 2.5 Cl 3.0
Se 2.5 Br 2.8
I 2.5
- вакантная орбиталь)
15.
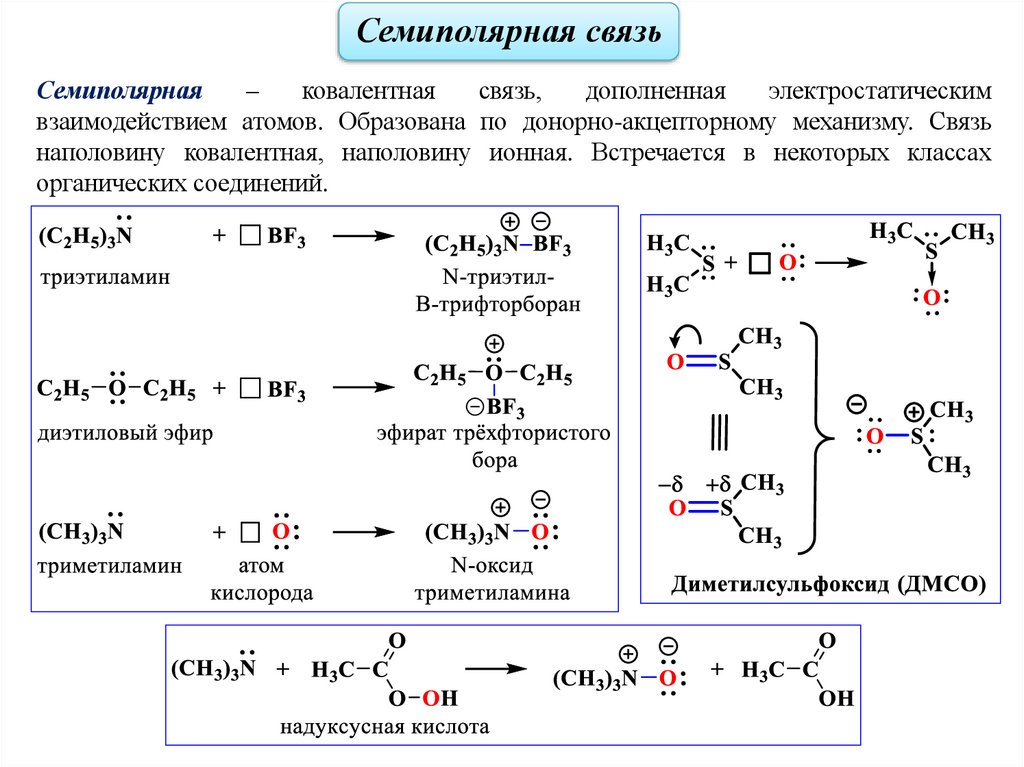
Семиполярная связьСемиполярная
–
ковалентная
связь,
дополненная
электростатическим
взаимодействием атомов. Образована по донорно-акцепторному механизму. Связь
наполовину ковалентная, наполовину ионная. Встречается в некоторых классах
органических соединений.
16.
Ионная связьИонная – прочная химическая связь, образующаяся между атомами с большой
разностью электроотрицательностей (> 1.5 по шкале Полинга), при которой общая
электронная пара переходит к атому с большей электроотрицательностью.
Ионная связь относительно редко встречается в органических молекулах.
Например, связи между атомами углерода (в sp-гибридизации), кислорода, азота, серы
и щелочными и щелочноземельными металлами рассматриваются, как ионные.
Причиной ионизации этих связей является значительная разница в
электроотрицательности образующих их элементов.
Примеры молекул с ионной связью (ЭО K 0.8, Na 0.9, C 2.5, O 3.5):
Связь между атомом углерода и любым щелочным металлом можно считать ионной
17.
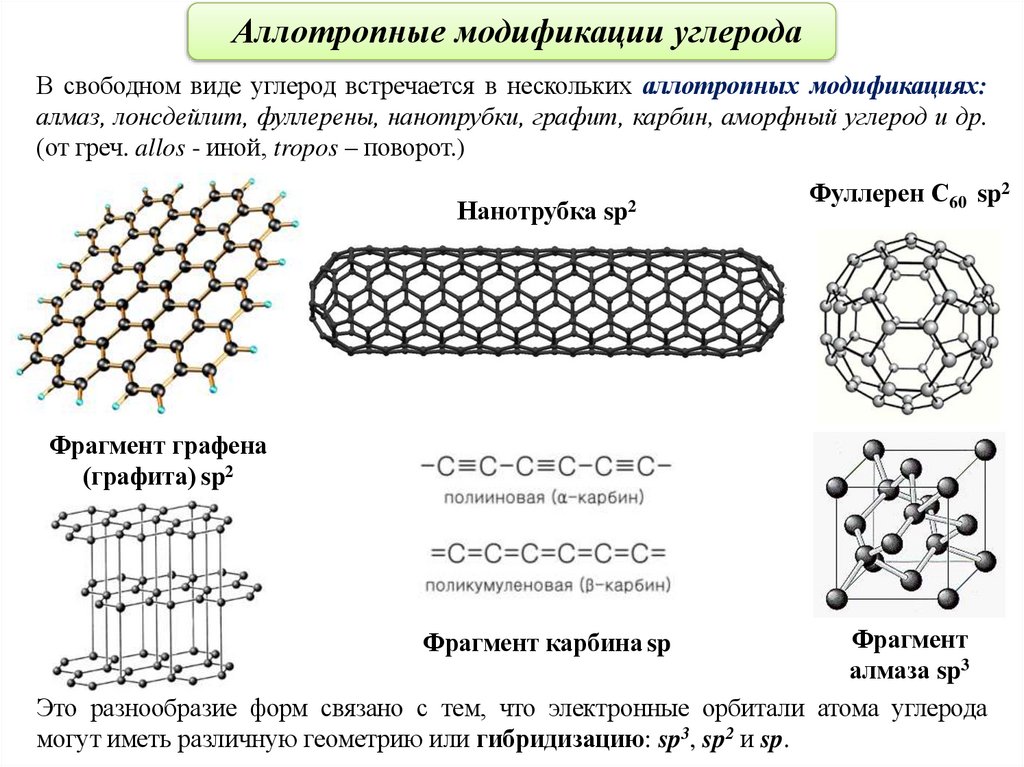
Аллотропные модификации углеродаВ свободном виде углерод встречается в нескольких аллотропных модификациях:
алмаз, лонсдейлит, фуллерены, нанотрубки, графит, карбин, аморфный углерод и др.
(от греч. allos - иной, tropos – поворот.)
Нанотрубка sp2
Фуллерен С60 sp2
Фрагмент графена
(графита) sp2
Фрагмент
алмаза sp3
Это разнообразие форм связано с тем, что электронные орбитали атома углерода
могут иметь различную геометрию или гибридизацию: sp3, sp2 и sp.
Фрагмент карбина sp
18.
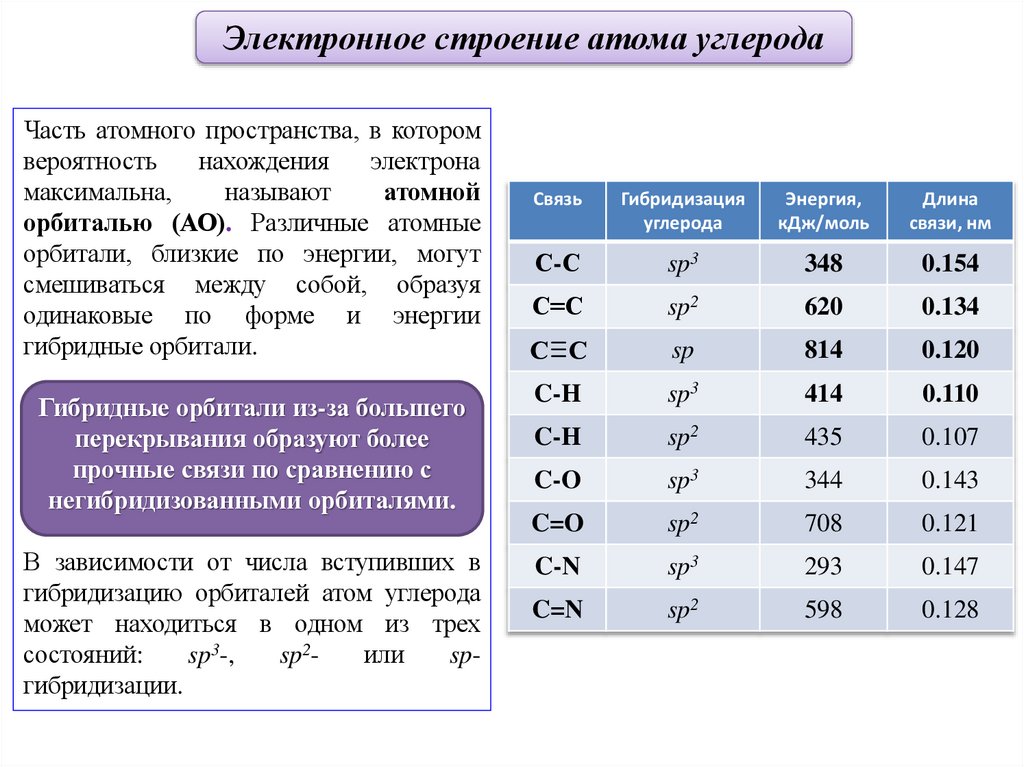
Электронное строение атома углеродаЧасть атомного пространства, в котором
вероятность
нахождения
электрона
максимальна,
называют
атомной
орбиталью (АО). Различные атомные
орбитали, близкие по энергии, могут
смешиваться между собой, образуя
одинаковые по форме и энергии
гибридные орбитали.
Гибридные орбитали из-за большего
перекрывания образуют более
прочные связи по сравнению с
негибридизованными орбиталями.
В зависимости от числа вступивших в
гибридизацию орбиталей атом углерода
может находиться в одном из трех
состояний:
sp3-,
sp2или
spгибридизации.
Связь
Гибридизация
углерода
Энергия,
кДж/моль
Длина
связи, нм
С-С
sp3
348
0.154
С=С
sp2
620
0.134
sp
814
0.120
C-H
sp3
414
0.110
C-H
sp2
435
0.107
C-O
sp3
344
0.143
C=O
sp2
708
0.121
C-N
sp3
293
0.147
C=N
sp2
598
0.128
19.
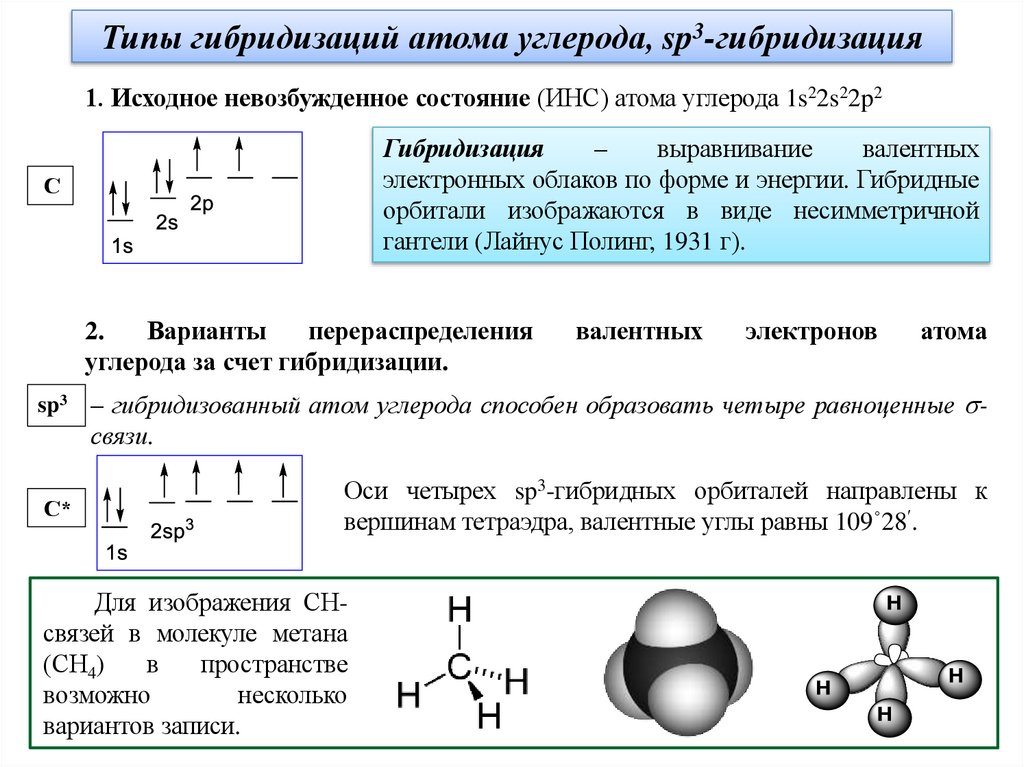
Типы гибридизаций атома углерода, sp3-гибридизация1. Исходное невозбужденное состояние (ИНС) атома углерода 1s22s22p2
Гибридизация
–
выравнивание
валентных
электронных облаков по форме и энергии. Гибридные
орбитали изображаются в виде несимметричной
гантели (Лайнус Полинг, 1931 г).
С
2.
Варианты
перераспределения
углерода за счет гибридизации.
sp3
С*
валентных
электронов
атома
– гибридизованный атом углерода способен образовать четыре равноценные связи.
Оси четырех sp3-гибридных орбиталей направлены к
вершинам тетраэдра, валентные углы равны 109˚28 .
Для изображения СНсвязей в молекуле метана
(СН4)
в
пространстве
возможно
несколько
вариантов записи.
20.
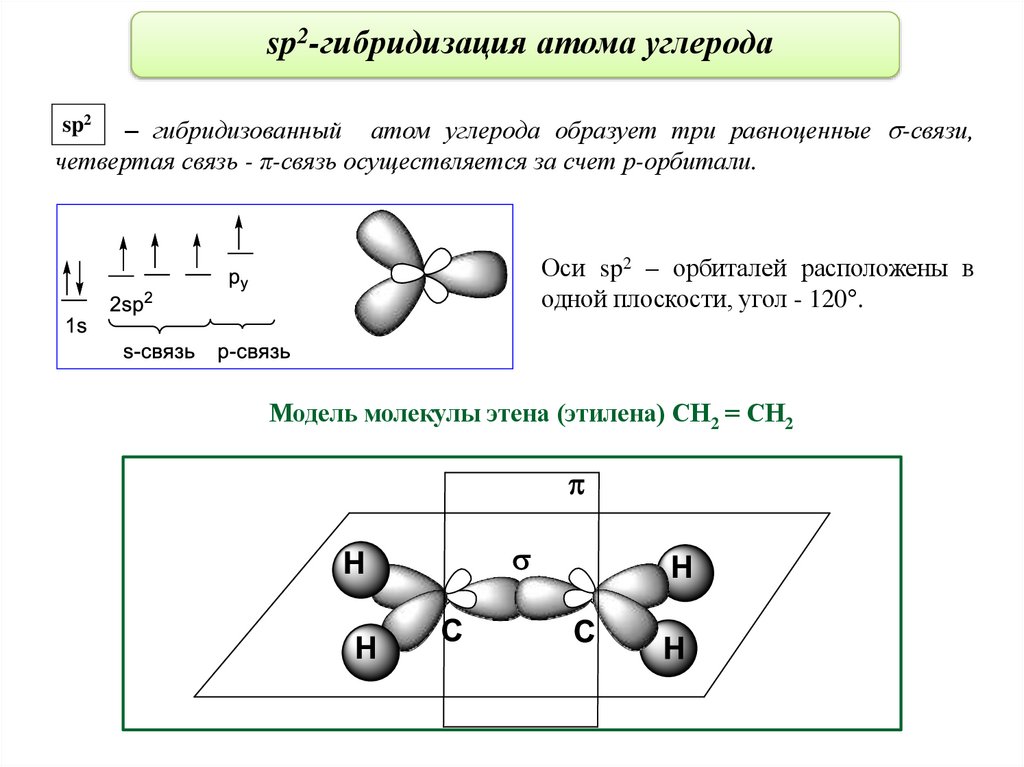
sp2-гибридизация атома углерода– гибридизованный атом углерода образует три равноценные -связи,
четвертая связь - π-связь осуществляется за счет р-орбитали.
sp2
Оси sp2 – орбиталей расположены в
одной плоскости, угол - 120°.
Модель молекулы этена (этилена) СН2 = СН2
21.
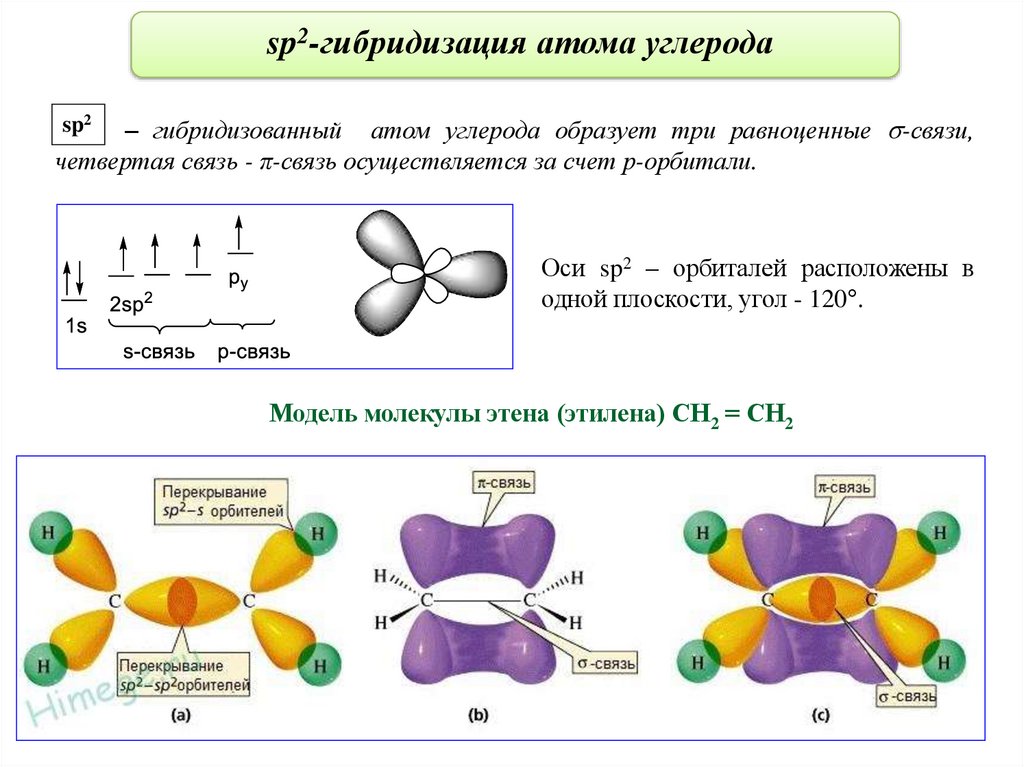
sp2-гибридизация атома углерода– гибридизованный атом углерода образует три равноценные -связи,
четвертая связь - π-связь осуществляется за счет р-орбитали.
sp2
Оси sp2 – орбиталей расположены в
одной плоскости, угол - 120°.
Модель молекулы этена (этилена) СН2 = СН2
22.
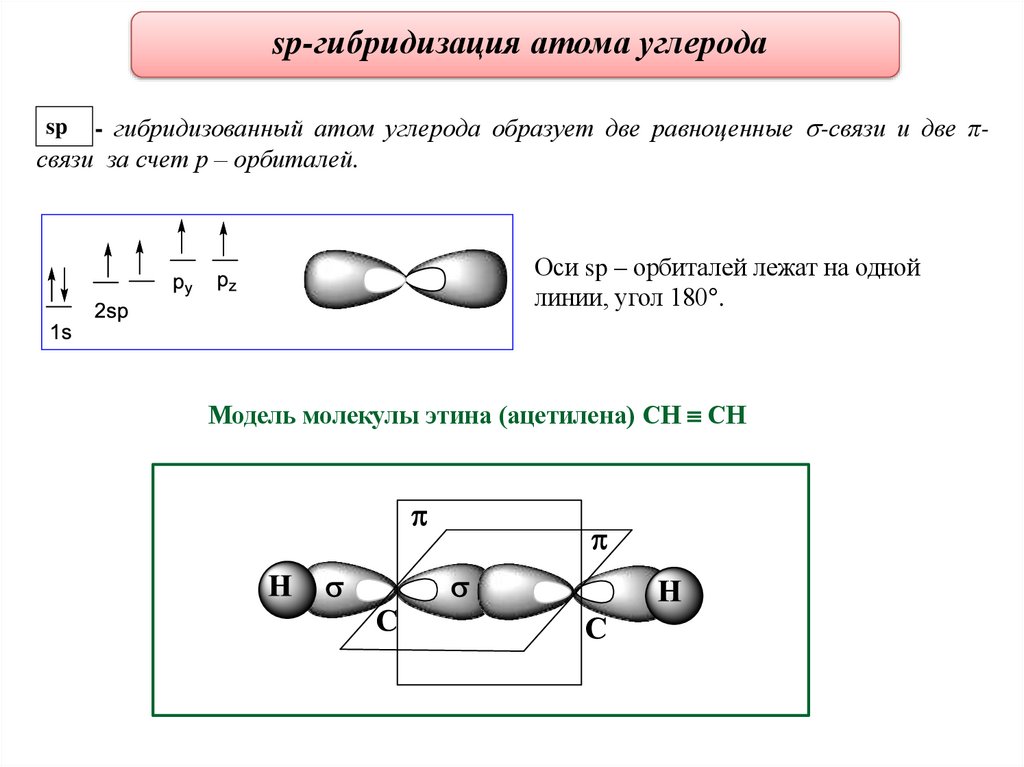
sp-гибридизация атома углерода- гибридизованный атом углерода образует две равноценные -связи и две πсвязи за счет р – орбиталей.
sp
Оси sp – орбиталей лежат на одной
линии, угол 180 .
Модель молекулы этина (ацетилена) СН СН
23.
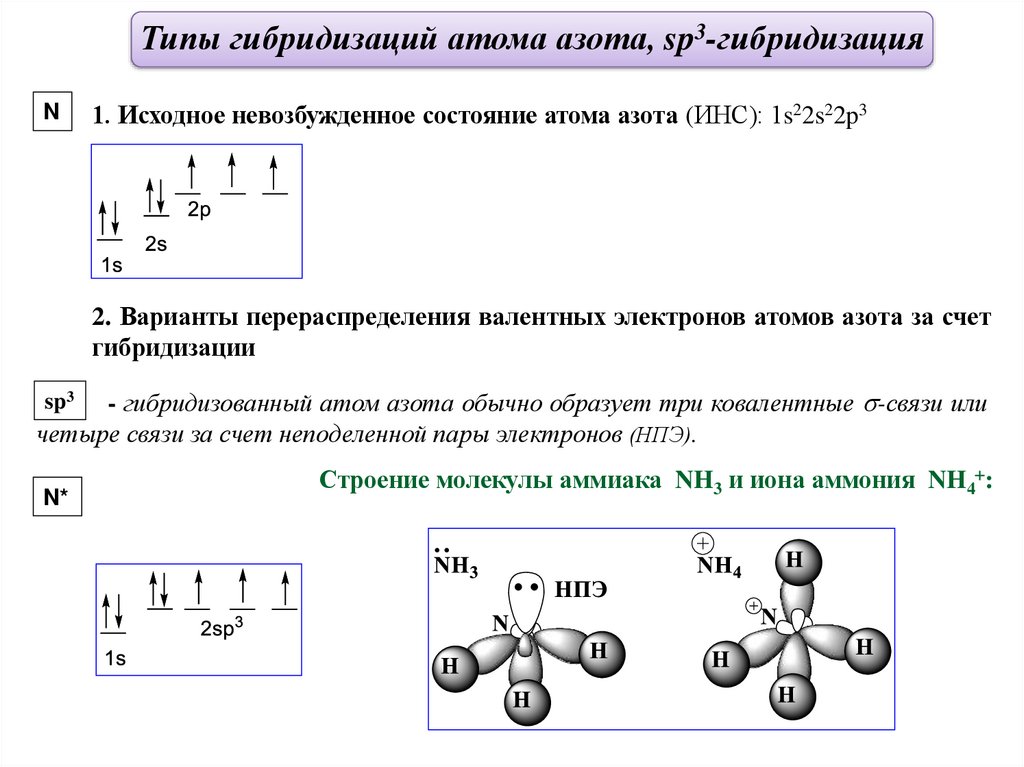
Типы гибридизаций атома азота, sp3-гибридизацияN
1. Исходное невозбужденное состояние атома азота (ИНС): 1s22s22p3
2. Варианты перераспределения валентных электронов атомов азота за счет
гибридизации
- гибридизованный атом азота обычно образует три ковалентные -связи или
четыре связи за счет неподеленной пары электронов (НПЭ).
sp3
N*
Строение молекулы аммиака NH3 и иона аммония NH4 :
24.
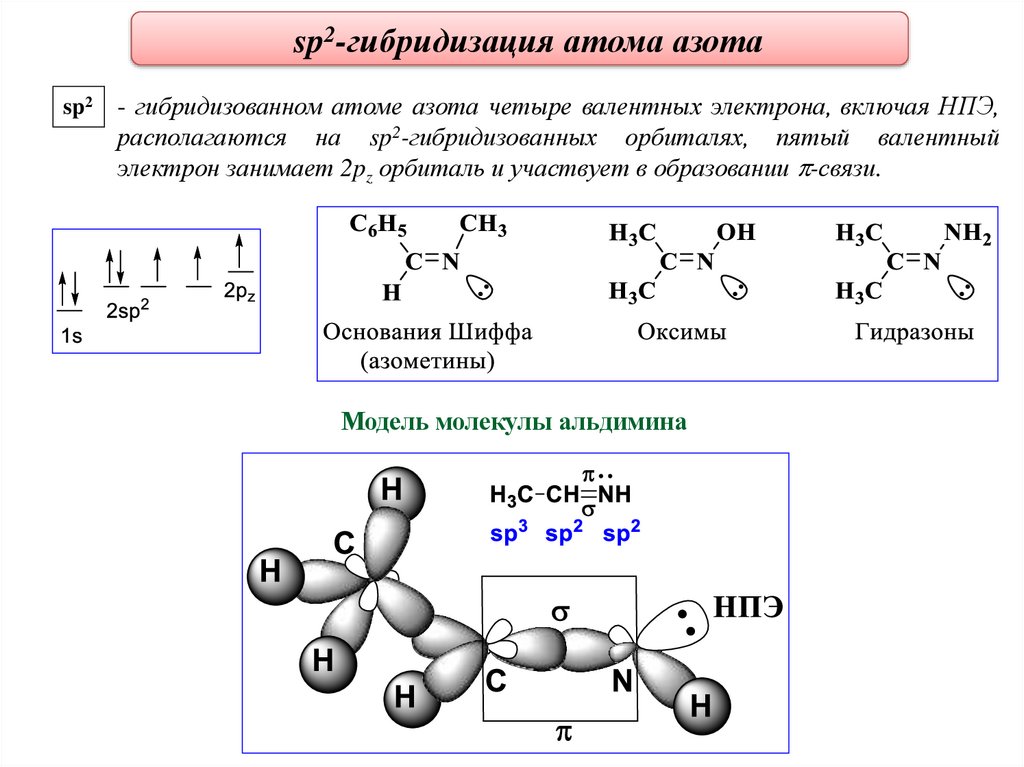
sp2-гибридизация атома азотаsp2
- гибридизованном атоме азота четыре валентных электрона, включая НПЭ,
располагаются на sp2-гибридизованных орбиталях, пятый валентный
электрон занимает 2pz орбиталь и участвует в образовании -связи.
Модель молекулы альдимина
25.
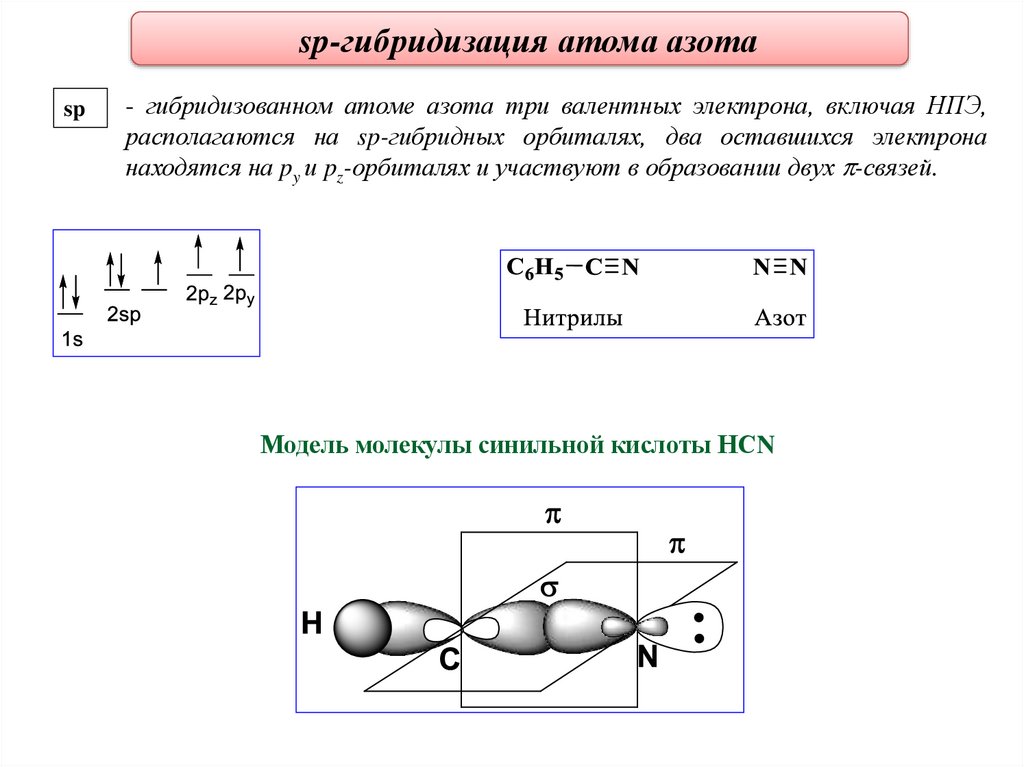
sp-гибридизация атома азотаsp
- гибридизованном атоме азота три валентных электрона, включая НПЭ,
располагаются на sp-гибридных орбиталях, два оставшихся электрона
находятся на py и pz-орбиталях и участвуют в образовании двух -связей.
Модель молекулы синильной кислоты НСN
26.
Алканы (парафины)Углеводороды состава CnH2n+2, содержащие в молекуле только ординарные или σ–
связи, называются алканами, парафинами или предельными углеводородами.
В гомологическом ряду алканов температуры плавления и кипения увеличиваются с
ростом молекулярной массы веществ. Метан, этан, пропан – газы без цвета и запаха.
Алканы с числом атомов углерода от 5 до 15 при обычных условиях бесцветные
жидкости, начиная с С16Н34 – твёрдые, белые, воскоподобные вещества.
27.
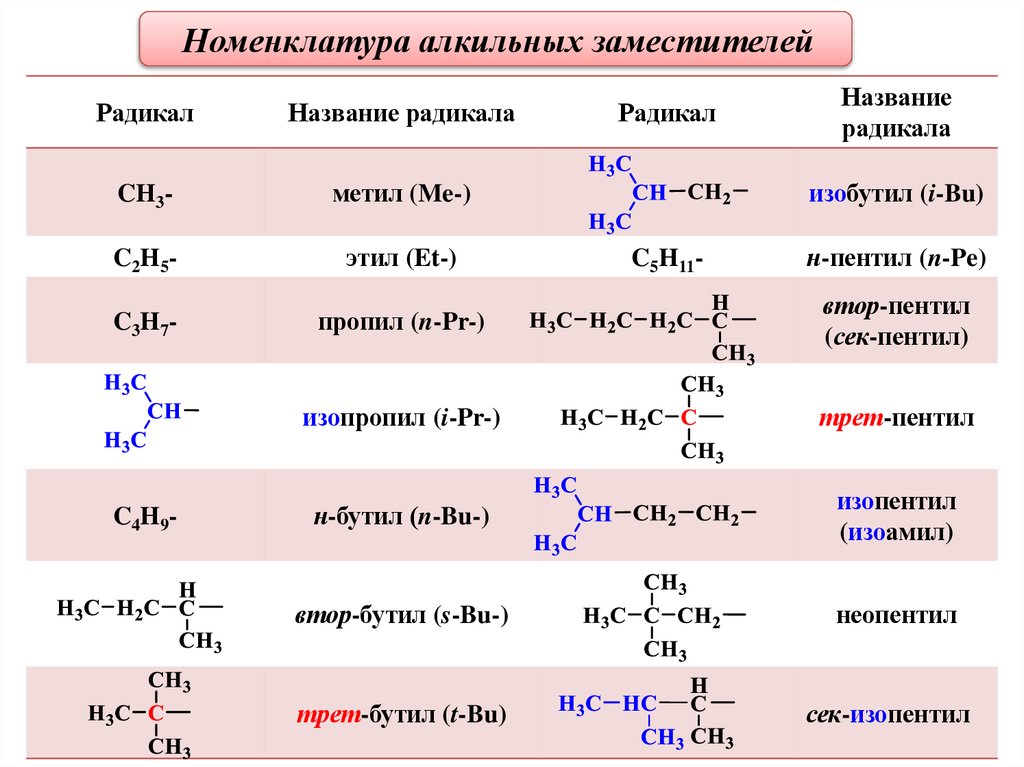
Номенклатура алкильных заместителейНазвание радикала
CH3-
метил (Me-)
C2H5-
этил (Et-)
C3H7-
пропил (n-Pr-)
втор-пентил
(сек-пентил)
изопропил (i-Pr-)
трет-пентил
н-бутил (n-Bu-)
изопентил
(изоамил)
втор-бутил (s-Bu-)
неопентил
трет-бутил (t-Bu)
сек-изопентил
C4H9-
Радикал
Название
радикала
Радикал
изобутил (i-Bu)
C5H11-
н-пентил (n-Pe)
28.
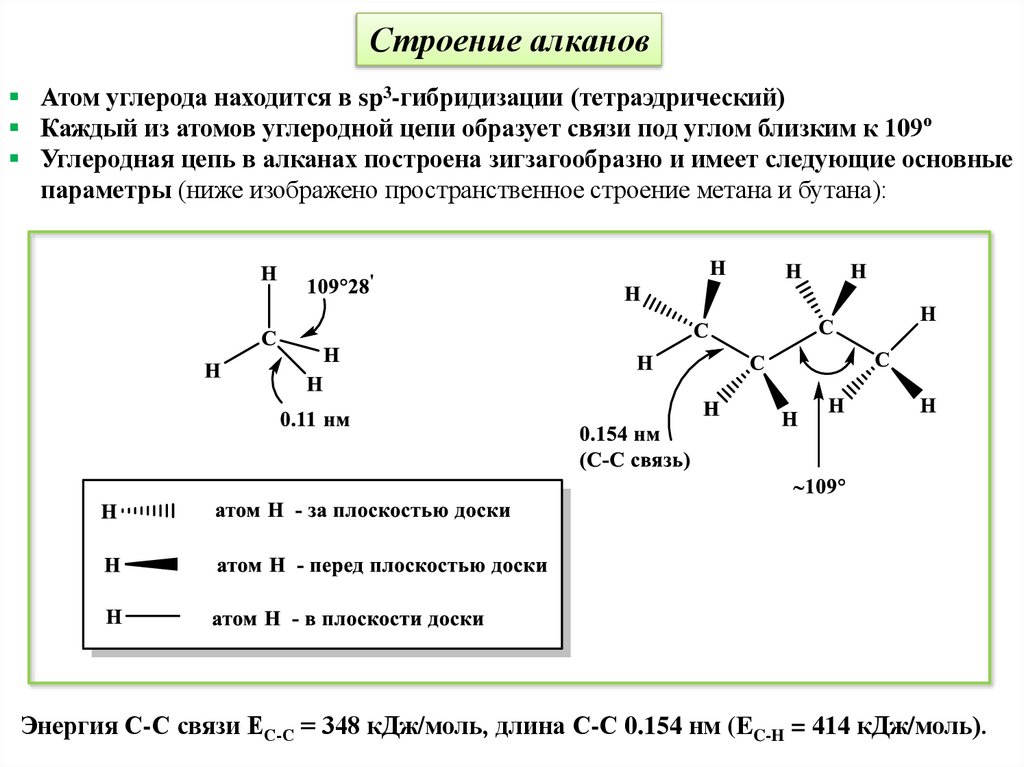
Строение алкановАтом углерода находится в sp3-гибридизации (тетраэдрический)
Каждый из атомов углеродной цепи образует связи под углом близким к 109о
Углеродная цепь в алканах построена зигзагообразно и имеет следующие основные
параметры (ниже изображено пространственное строение метана и бутана):
Энергия С-С связи ЕС-С = 348 кДж/моль, длина С-С 0.154 нм (EC-H = 414 кДж/моль).
29.
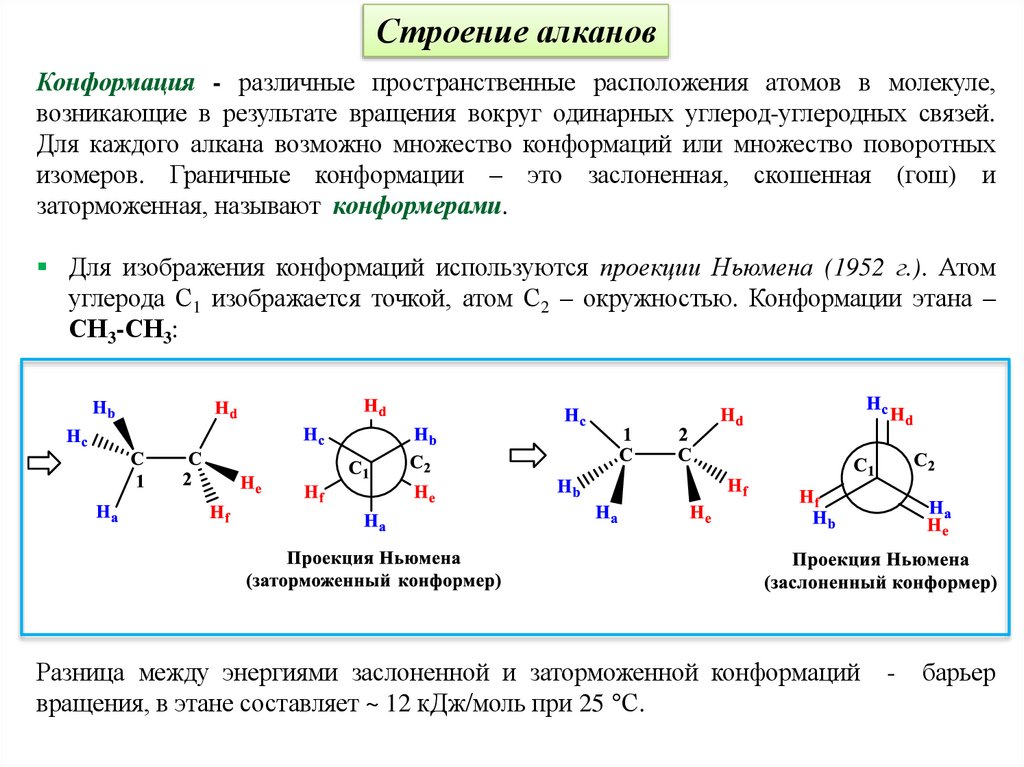
Строение алкановКонформация - различные пространственные расположения атомов в молекуле,
возникающие в результате вращения вокруг одинарных углерод-углеродных связей.
Для каждого алкана возможно множество конформаций или множество поворотных
изомеров. Граничные конформации – это заслоненная, скошенная (гош) и
заторможенная, называют конформерами.
Для изображения конформаций используются проекции Ньюмена (1952 г.). Атом
углерода С1 изображается точкой, атом С2 – окружностью. Конформации этана –
СН3-СН3:
Разница между энергиями заслоненной и заторможенной конформаций
вращения, в этане составляет ~ 12 кДж/моль при 25 °С.
-
барьер
30.
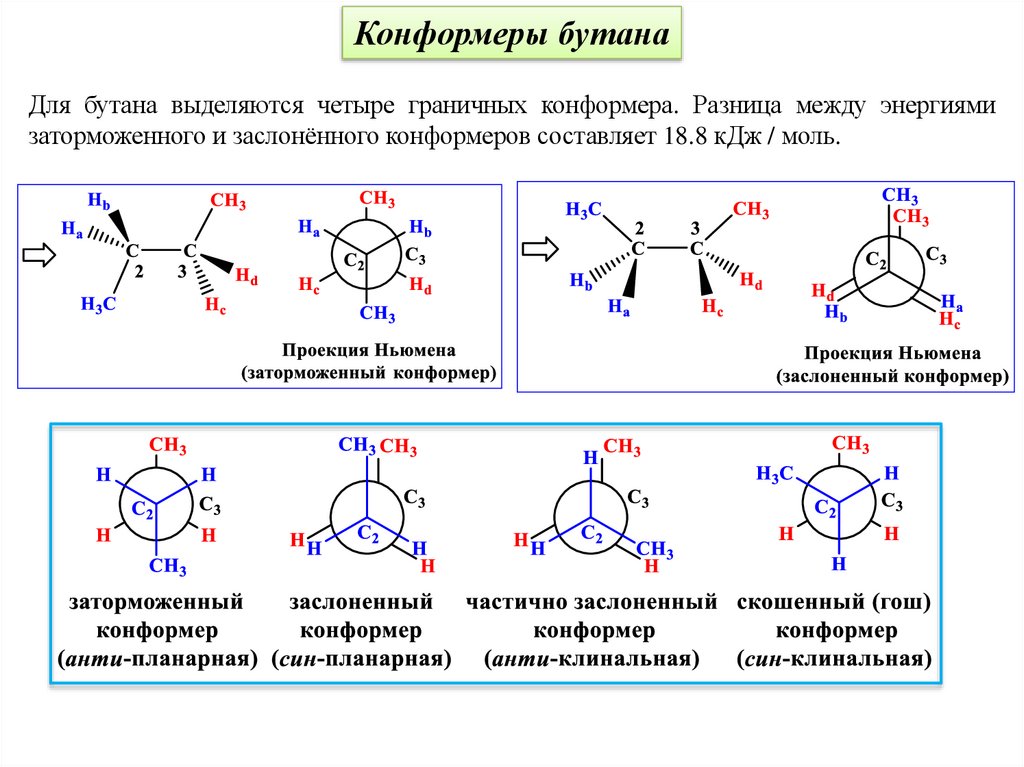
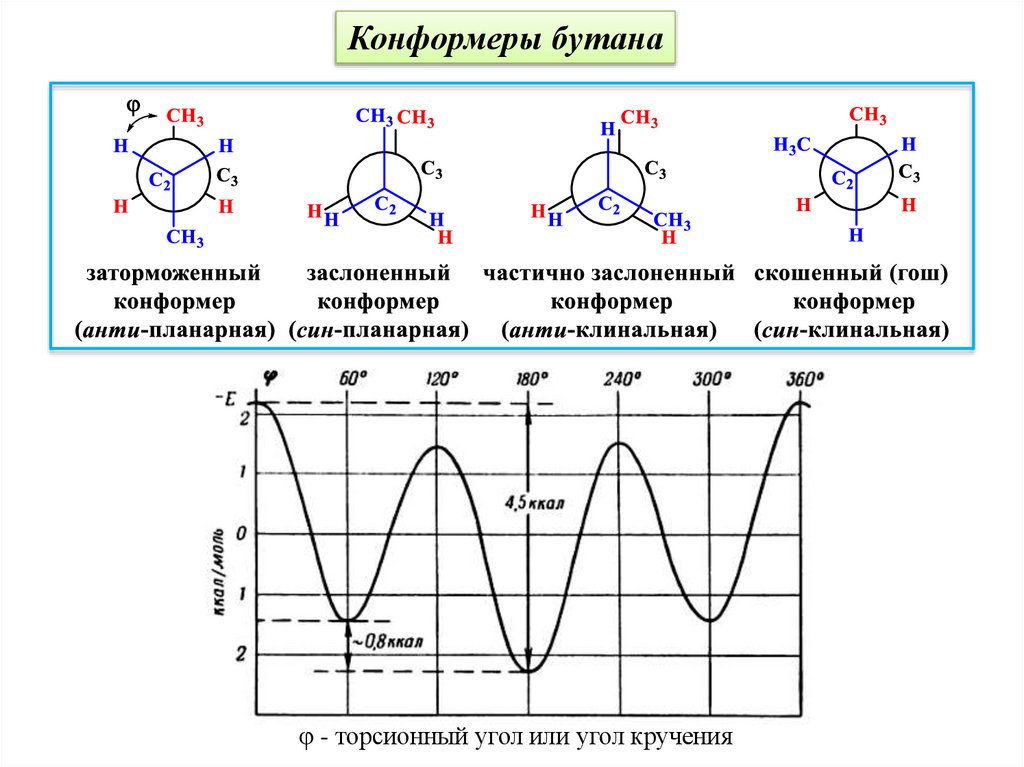
Конформеры бутанаДля бутана выделяются четыре граничных конформера. Разница между энергиями
заторможенного и заслонённого конформеров составляет 18.8 кДж / моль.
31.
Конформеры бутанаφ - торсионный угол или угол кручения
32.
Метан – простейший представитель алкановБесцветный газ без запаха, малорастворимый в воде, легче воздуха. При
использовании в быту, промышленности в метан обычно добавляют одоранты (обычно
этилмеркаптан - C2H5SН) со специфическим «запахом газа». Метан нетоксичен и
неопасен для здоровья. CH4 – важное промышленное сырье для получения
углеводородов.
При избытке паров воды идет дальнейшее окисление
СО до СО2 :
33.
Реакции радикального замещения атома водорода (SR)Атомы углерода в алканах различаются по реакционной способности.
Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Реакционная способность связей С-Н:
СТ -Н СВ -Н СП –Н
Наиболее легко разрываются связи СТ-Н. Для объяснения этого факта
сравнивают величины энергий диссоциации связей С-Н или устойчивости
образующихся при этом свободных радикалов.
Свободный радикал – элекрононейтральная промежуточная частица, имеющая
один неспаренный электрон.
метильный
первичный
вторичный третичный
34.
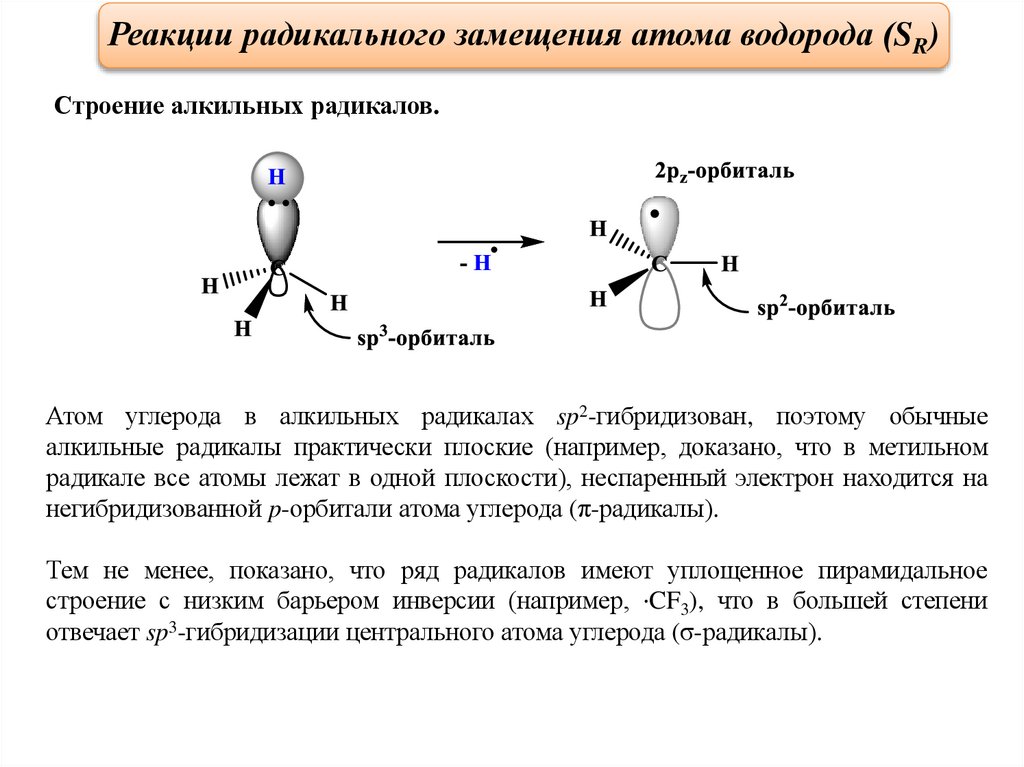
Реакции радикального замещения атома водорода (SR)Строение алкильных радикалов.
Атом углерода в алкильных радикалах sp2-гибридизован, поэтому обычные
алкильные радикалы практически плоские (например, доказано, что в метильном
радикале все атомы лежат в одной плоскости), неспаренный электрон находится на
негибридизованной p-орбитали атома углерода (π-радикалы).
Тем не менее, показано, что ряд радикалов имеют уплощенное пирамидальное
строение с низким барьером инверсии (например, ·CF3), что в большей степени
отвечает sp3-гибридизации центрального атома углерода (σ-радикалы).
35.
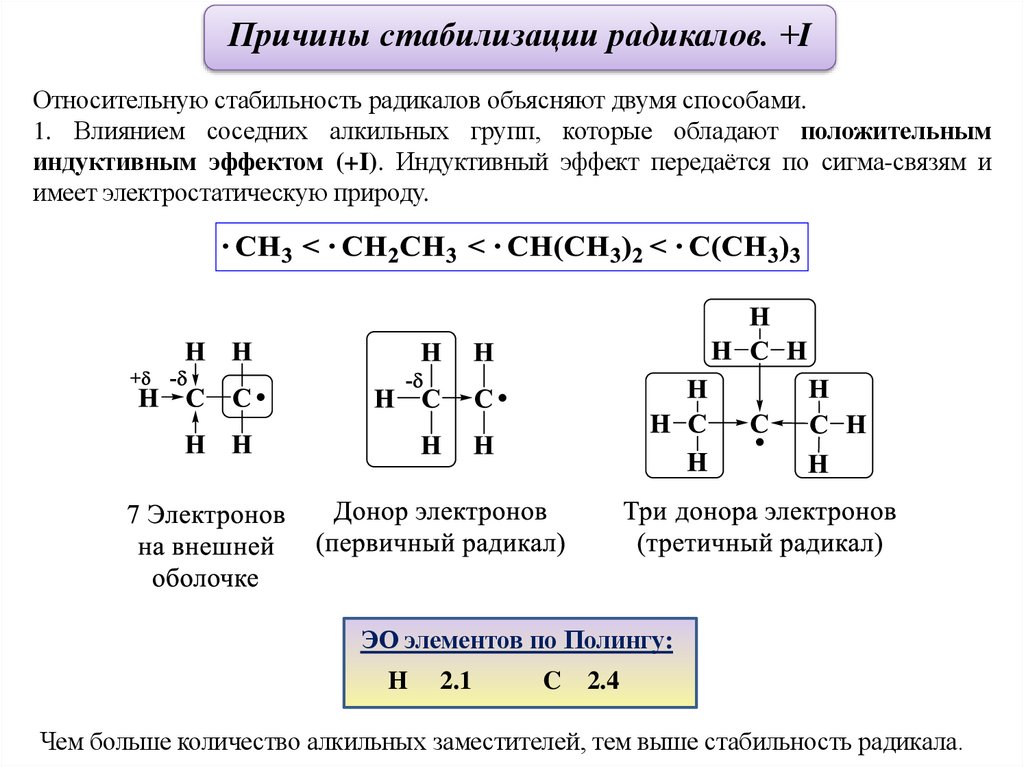
Причины стабилизации радикалов. +IОтносительную стабильность радикалов объясняют двумя способами.
1. Влиянием соседних алкильных групп, которые обладают положительным
индуктивным эффектом (+I). Индуктивный эффект передаётся по сигма-связям и
имеет электростатическую природу.
ЭО элементов по Полингу:
H
2.1
C
2.4
Чем больше количество алкильных заместителей, тем выше стабильность радикала.
36.
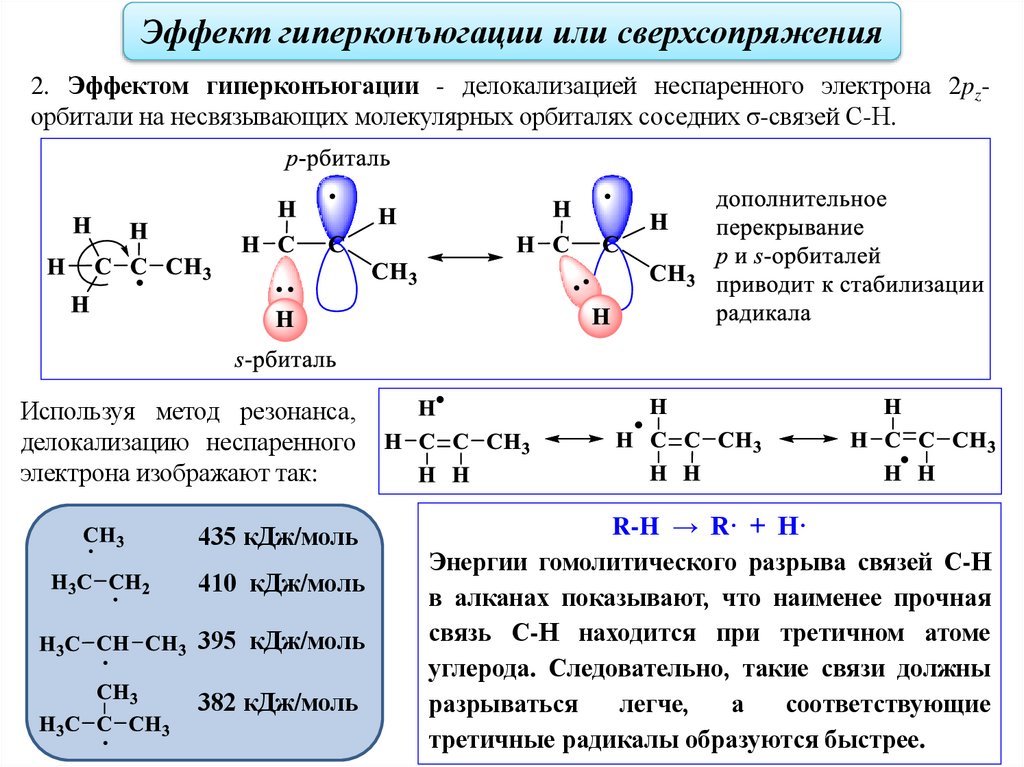
Эффект гиперконъюгации или сверхсопряжения2. Эффектом гиперконъюгации - делокализацией неспаренного электрона 2pzорбитали на несвязывающих молекулярных орбиталях соседних σ-связей С-Н.
Используя метод резонанса,
делокализацию неспаренного
электрона изображают так:
435 кДж/моль
410 кДж/моль
395 кДж/моль
382 кДж/моль
R-H → R· + H·
Энергии гомолитического разрыва связей С-Н
в алканах показывают, что наименее прочная
связь С-Н находится при третичном атоме
углерода. Следовательно, такие связи должны
разрываться
легче,
а
соответствующие
третичные радикалы образуются быстрее.
37.
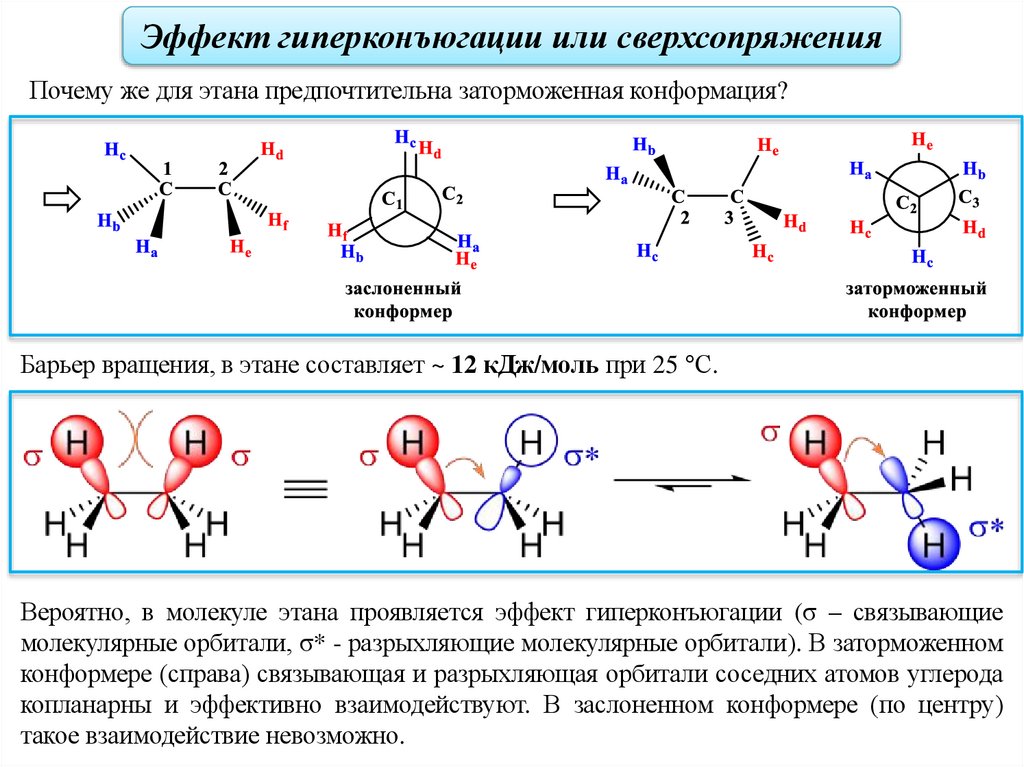
Эффект гиперконъюгации или сверхсопряженияПочему же для этана предпочтительна заторможенная конформация?
Барьер вращения, в этане составляет ~ 12 кДж/моль при 25 °С.
Вероятно, в молекуле этана проявляется эффект гиперконъюгации (σ – связывающие
молекулярные орбитали, σ* - разрыхляющие молекулярные орбитали). В заторможенном
конформере (справа) связывающая и разрыхляющая орбитали соседних атомов углерода
копланарны и эффективно взаимодействуют. В заслоненном конформере (по центру)
такое взаимодействие невозможно.
38.
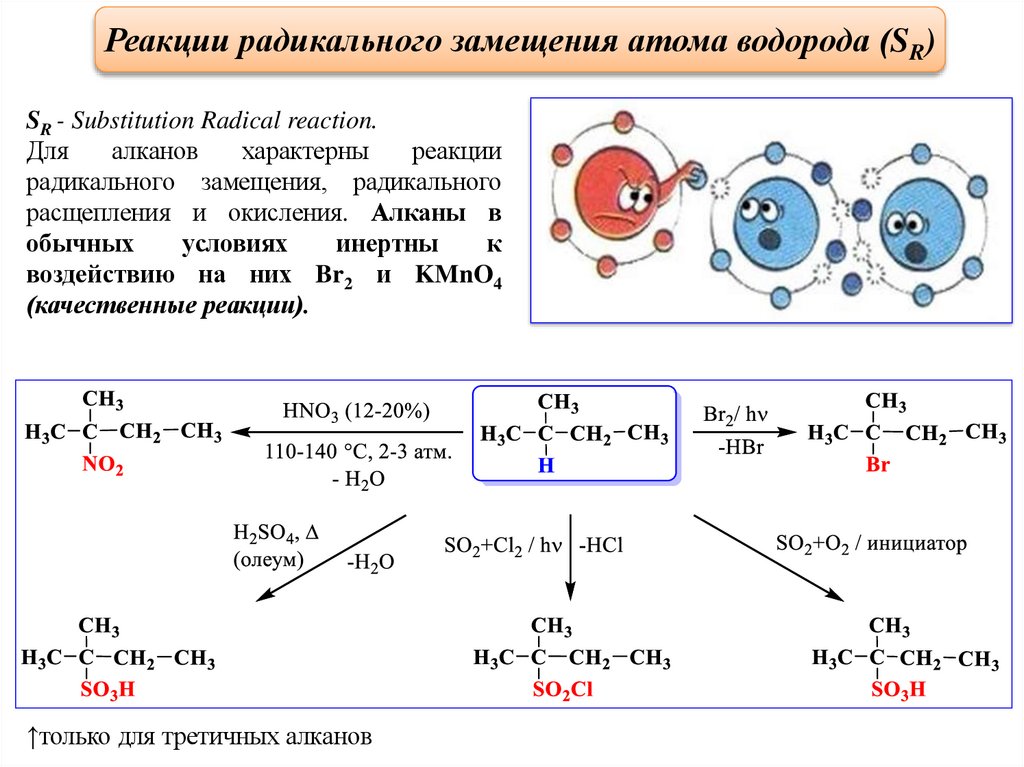
Реакции радикального замещения атома водорода (SR)SR - Substitution Radical reaction.
Для
алканов
характерны
реакции
радикального замещения, радикального
расщепления и окисления. Алканы в
обычных
условиях
инертны
к
воздействию на них Br2 и KMnO4
(качественные реакции).
↑только для третичных алканов
39.
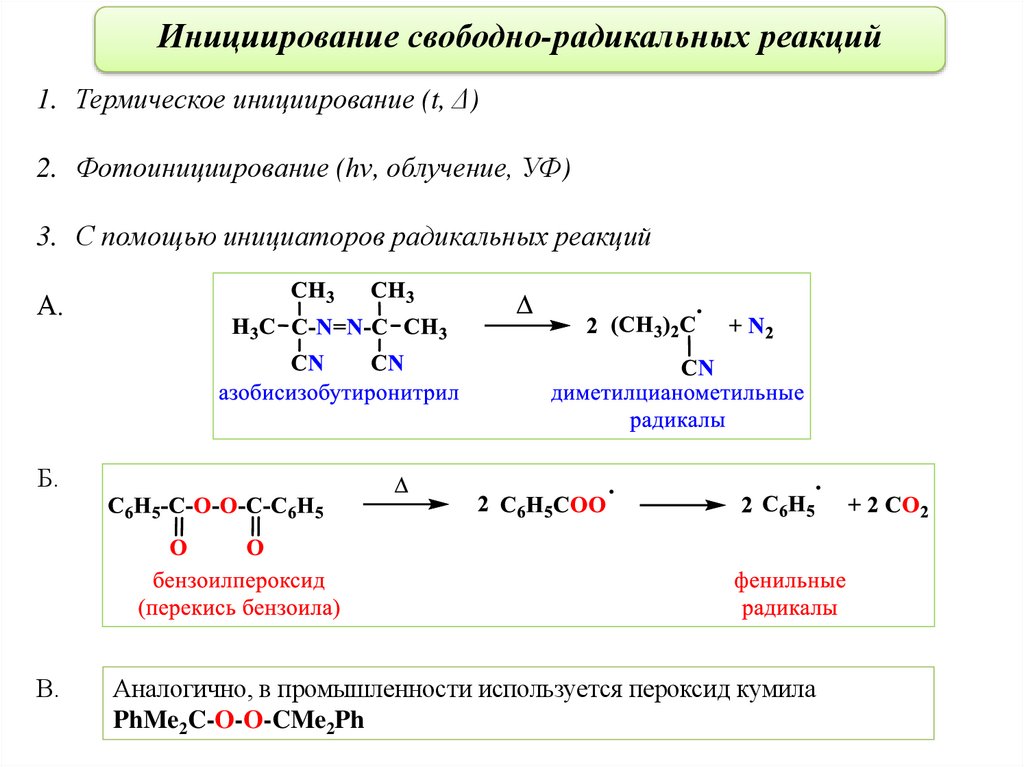
Инициирование свободно-радикальных реакций1. Термическое инициирование (t, Δ)
2. Фотоинициирование (hν, облучение, УФ)
3. С помощью инициаторов радикальных реакций
А.
Б.
В.
Аналогично, в промышленности используется пероксид кумила
PhMe2C-O-O-CMe2Ph
40.
Реакции радикального галоидированияГалоидирование – замещение атомов водорода в алканах на галоген.
Условия реакций: Cl2 / h (свет); Br2 / 100 °C
CH4 + Cl2 → CH3-Cl + HCl (+ СН2Cl2 + CHCl3 + CCl4)
побочные
F2 ˃ Cl2 ˃ Br2 ˃ I2
ряд реакционной
способности галогенов
41.
Региоселективность реакций хлорирования и бромированияСелективность хлорирования низка. Относительные скорости замещения
третичного, вторичного и первичного атомов водорода при хлорировании алканов
составляют при комнатной температуре 5 : 3.8 : 1
Селективность бромирования значительно выше. Относительные скорости
замещения третичного, вторичного и первичного атомов водорода при
бромировании алканов составляют при 25 °С 1600 : 82 : 1
42.
Реакции радикального фторирования и иодированияПроцесс фторирования трудно контролировать: большой суммарный тепловой эффект
(104 кДж/моль) и большая отрицательная энтальпия каждой стадии приводят не только
к образованию перфторалканов, но и к разрыву С-С связей (тепловой взрыв).
Радикальное фторирование удаётся провести разбавляя исходные реагенты инертными
газами (N2, Ar) или (в промышленных масштабах) при использовании фторидов
металлов в высшей степени окисления.
Иодирование алканов происходит медленно даже при температуре 300 °С, что связано
с высокой энергией активации первой стадии развития цепи. При более высоких
температурах иодирование обратимо, поэтому требуется вводить окислитель для
удаления HI из реакционной смеси. Оба эти ограничения приводят к
экспериментальным осложнениям.
Прямое радикальное хлорирование и бромирование алканов имеют практическое
значение, фторирование и иодирование – нет.
43.
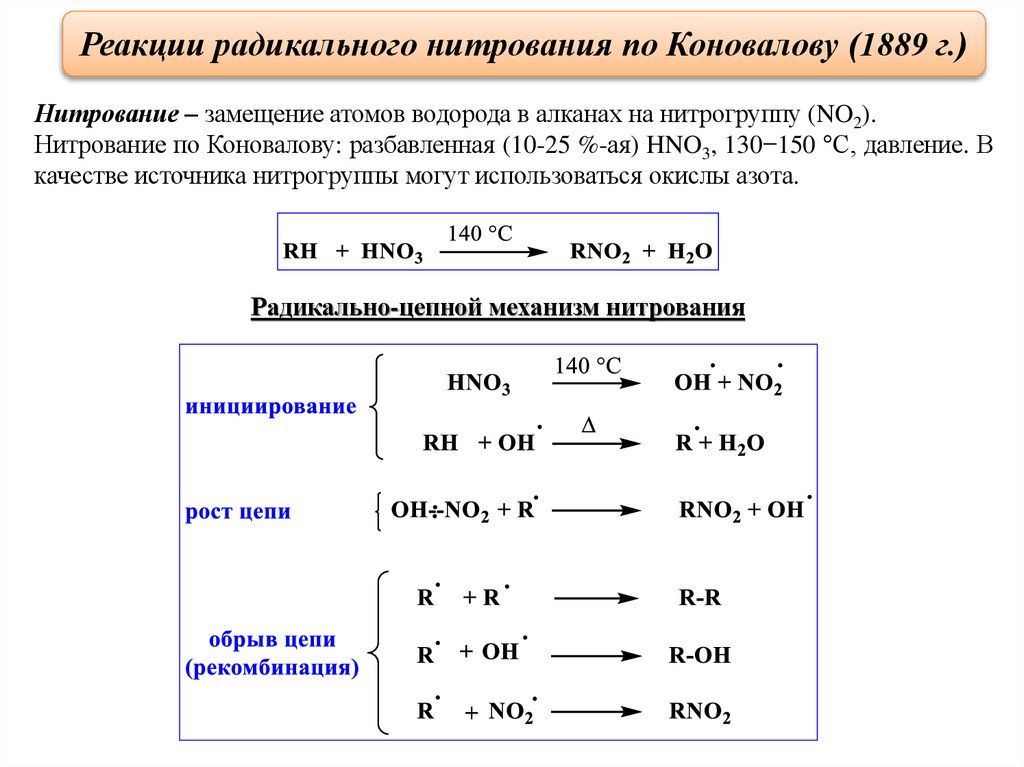
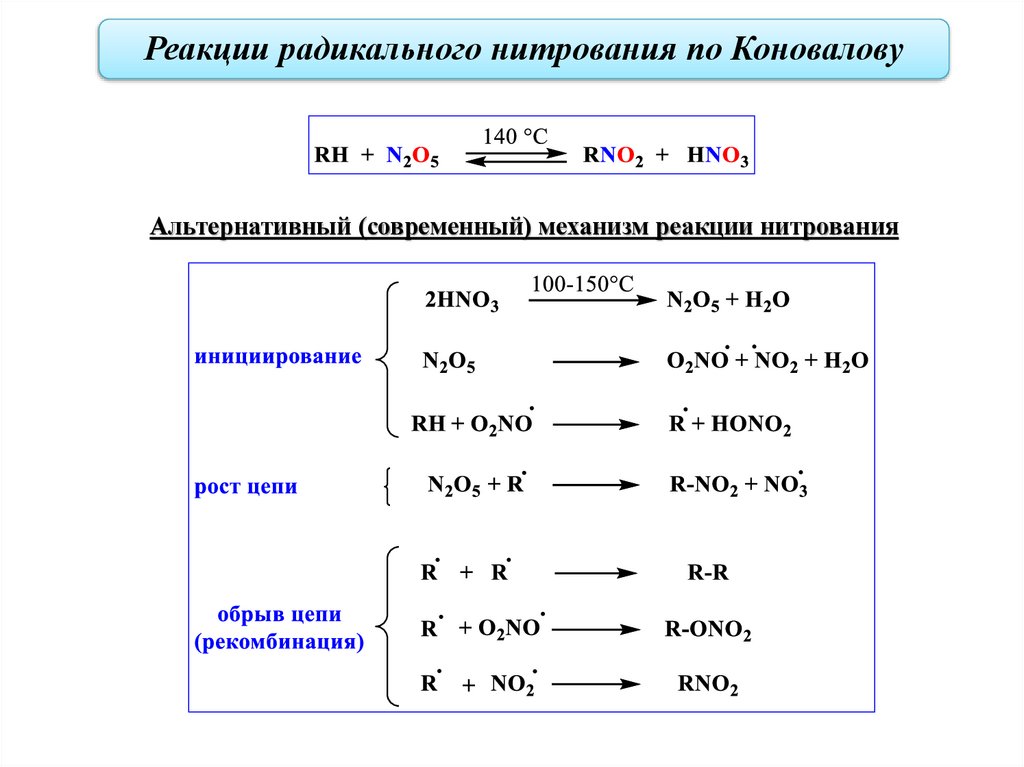
Реакции радикального нитрования по Коновалову (1889 г.)Нитрование – замещение атомов водорода в алканах на нитрогруппу (NO2).
Нитрование по Коновалову: разбавленная (10-25 %-ая) HNO3, 130−150 °С, давление. В
качестве источника нитрогруппы могут использоваться окислы азота.
Радикально-цепной механизм нитрования
44.
Реакции радикального нитрования по КоноваловуАльтернативный (современный) механизм реакции нитрования
45.
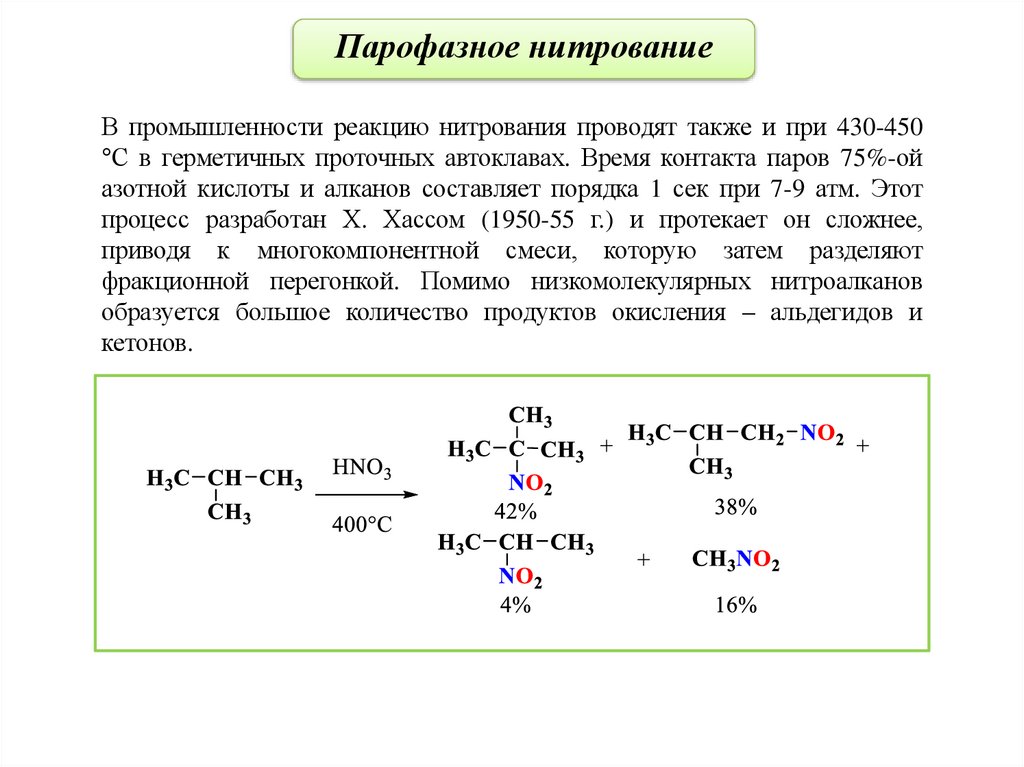
Парофазное нитрованиеВ промышленности реакцию нитрования проводят также и при 430-450
°С в герметичных проточных автоклавах. Время контакта паров 75%-ой
азотной кислоты и алканов составляет порядка 1 сек при 7-9 атм. Этот
процесс разработан Х. Хассом (1950-55 г.) и протекает он сложнее,
приводя к многокомпонентной смеси, которую затем разделяют
фракционной перегонкой. Помимо низкомолекулярных нитроалканов
образуется большое количество продуктов окисления – альдегидов и
кетонов.
46.
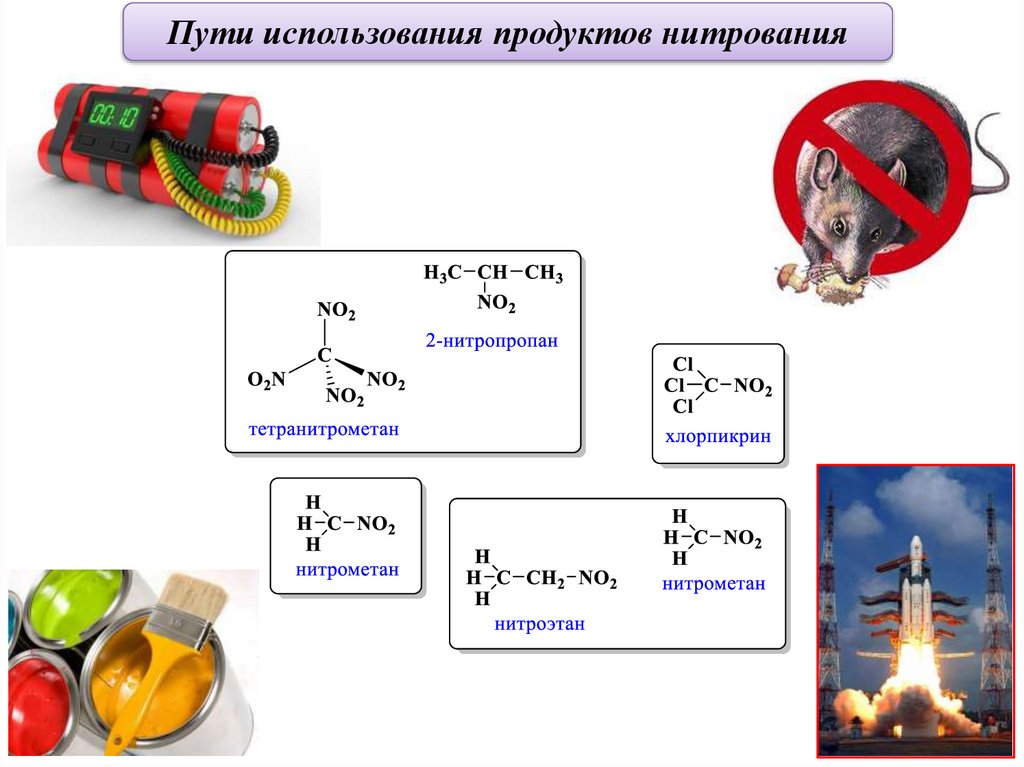
Пути использования продуктов нитрования47.
Реакции радикального сульфохлорированияСульфохлорирование (реакция Рида, 1936 г.) – замещение атомов
водорода в алканах на сульфохлоридную группу
Радикально-цепной механизм реакции
Для подавления побочно протекающей реакции хлорирования используют избыток SO2.
48.
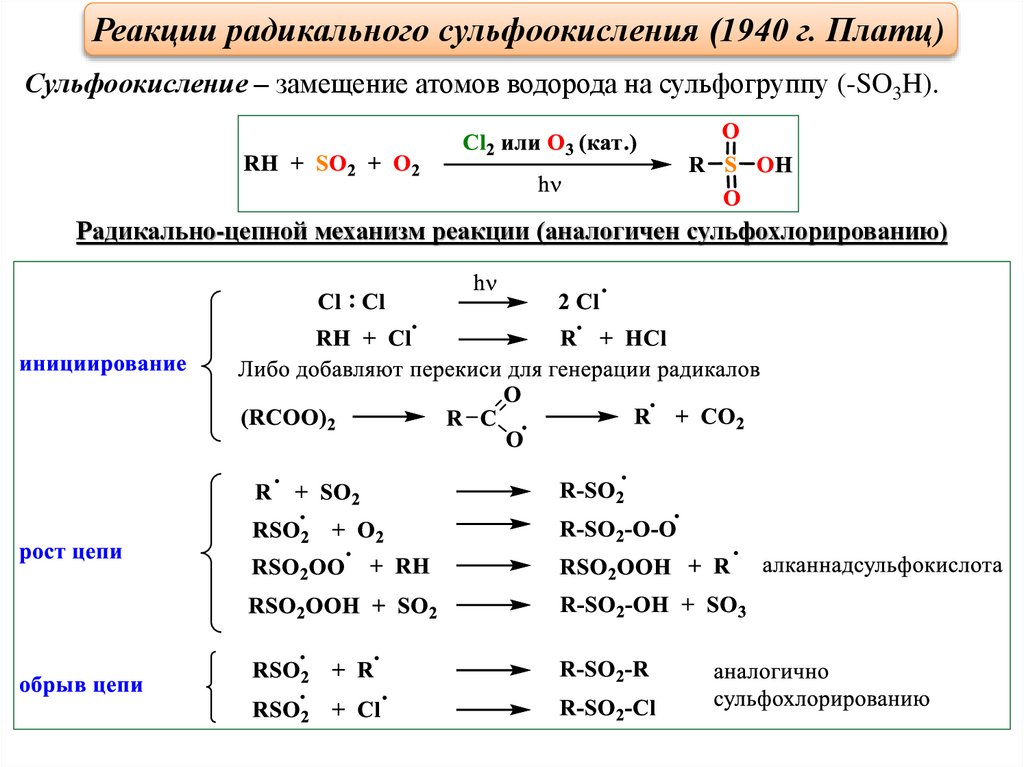
Реакции радикального сульфоокисления (1940 г. Платц)Сульфоокисление – замещение атомов водорода на сульфогруппу (-SO3H).
Радикально-цепной механизм реакции (аналогичен сульфохлорированию)
49.
Примеры реакций сульфоокисления и сульфохлорированияСелективность реакций сульфоокисления и сульфохлорирования низка.
50.
Детергенты (моющие вещества)С помощью реакций сульфохлорирования и сульфоокисления синтезируют
хлорангидриды алкансульфокислот и сами сульфокислоты, которые далее используют
для получения детергентов (синтетических моющих средств). Способны пениться
даже в жёсткой воде.
Синтетические детергенты имеют общую
особенность
строения
молекул,
присущую обычному мылу: содержат
большой неполярный углеводородный
остаток, растворимый в масле, и
полярный заместитель, растворимый в
воде. В этом случае неполярным концом
является алкильная цепь, а полярным –
SO3-Na+ (ионный детергент).
51.
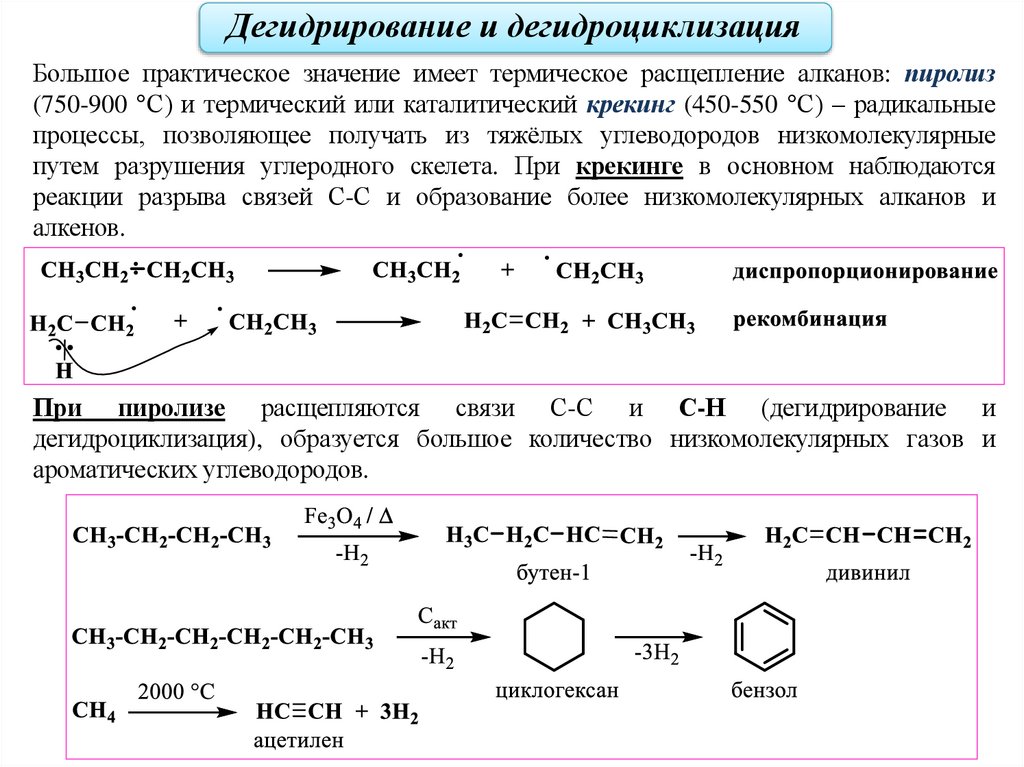
Дегидрирование и дегидроциклизацияБольшое практическое значение имеет термическое расщепление алканов: пиролиз
(750-900 °С) и термический или каталитический крекинг (450-550 °С) – радикальные
процессы, позволяющее получать из тяжёлых углеводородов низкомолекулярные
путем разрушения углеродного скелета. При крекинге в основном наблюдаются
реакции разрыва связей С-С и образование более низкомолекулярных алканов и
алкенов.
При пиролизе расщепляются связи С-С и С-Н (дегидрирование и
дегидроциклизация), образуется большое количество низкомолекулярных газов и
ароматических углеводородов.
52.
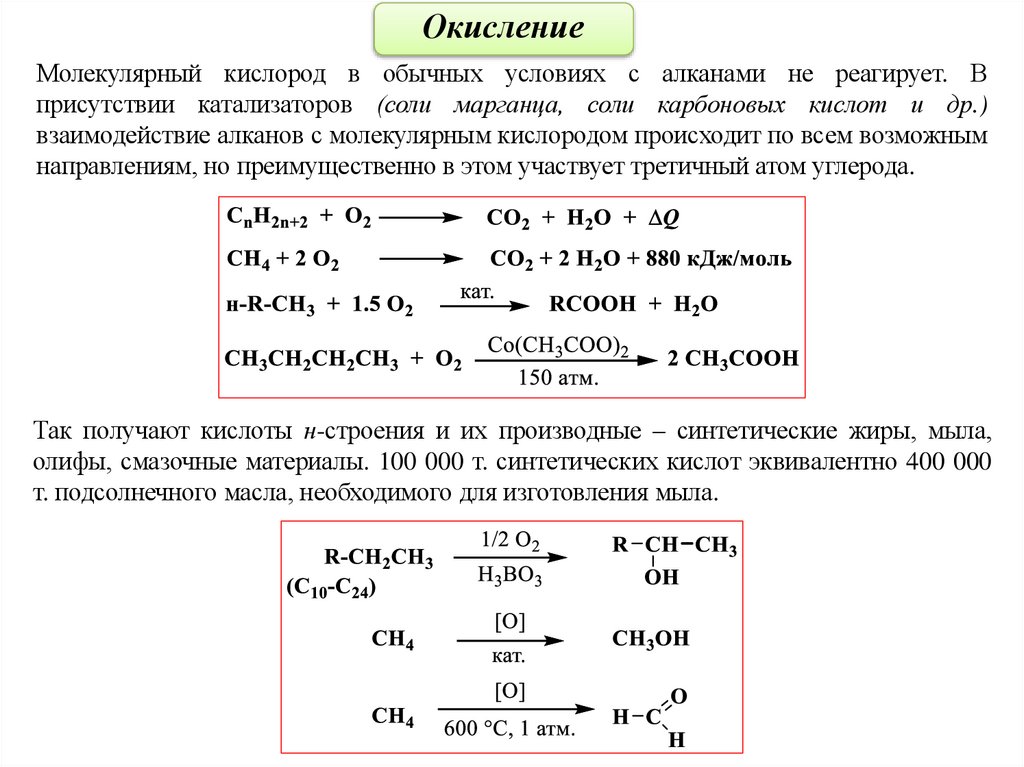
ОкислениеМолекулярный кислород в обычных условиях с алканами не реагирует. В
присутствии катализаторов (соли марганца, соли карбоновых кислот и др.)
взаимодействие алканов с молекулярным кислородом происходит по всем возможным
направлениям, но преимущественно в этом участвует третичный атом углерода.
Так получают кислоты н-строения и их производные – синтетические жиры, мыла,
олифы, смазочные материалы. 100 000 т. синтетических кислот эквивалентно 400 000
т. подсолнечного масла, необходимого для изготовления мыла.
53.
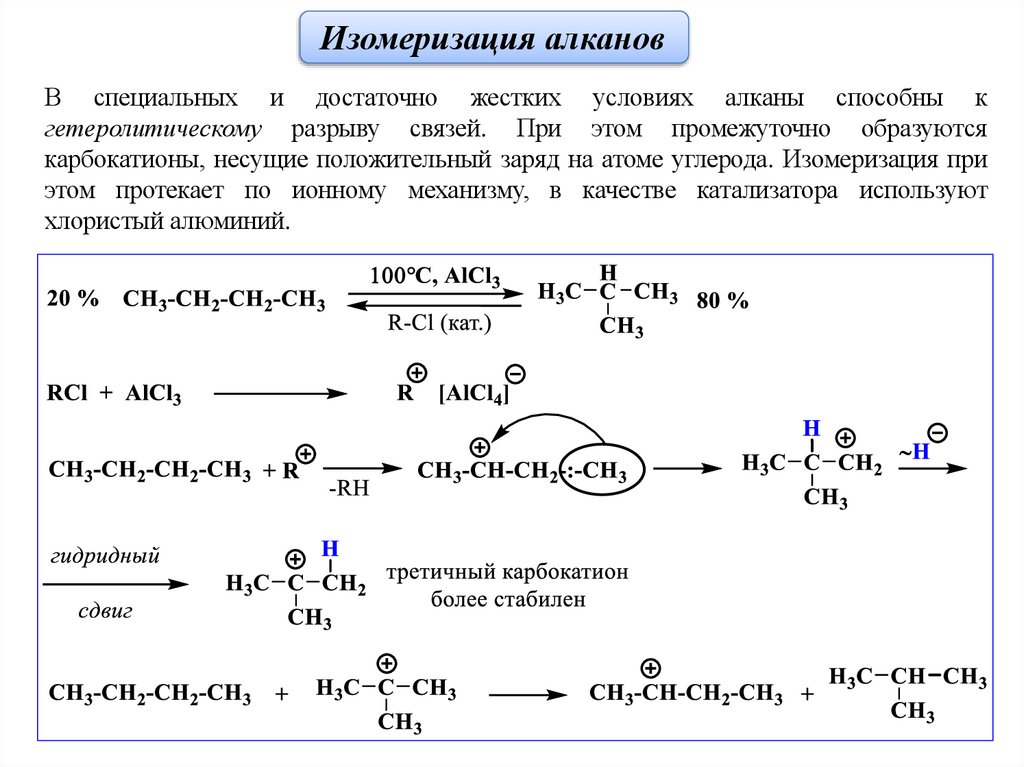
Изомеризация алкановВ специальных и достаточно жестких условиях алканы способны к
гетеролитическому разрыву связей. При этом промежуточно образуются
карбокатионы, несущие положительный заряд на атоме углерода. Изомеризация при
этом протекает по ионному механизму, в качестве катализатора используют
хлористый алюминий.
54.
Методы получения алкановГлавный источник получения алканов – нефть
Газ
80-98% - CH4 + 2-3 % (C2H6, C3H8, C4H10, C5H12)
остальное – примеси (Н2S, CO2, N2, Ar)
Нефть
бензин легкий
С5 – С11
бензин тяжелый (лигроин)
С8 – С14
керосин
С9 – С15
дизельное топливо (солярка)
С12 - С20
газойль
С12 – С35
масляные дистилляты (мазуты) С20 – С70
20-150 °С
150-200 °С
150-250 °С
180-340 °С
200-450 °С
> 350 °С
Энергетический баланс РФ 2023 год (%): 35 газ, 12 нефть, 12 каменный
уголь, 20 гидроэнергия, 20 АЭС, меньше 1 % другие ВИЭ.
Лишь 6-8 % свсей добываемой нефти идет на нужды химии
Помимо нефти важным источником алканов может служить каменный уголь
55.
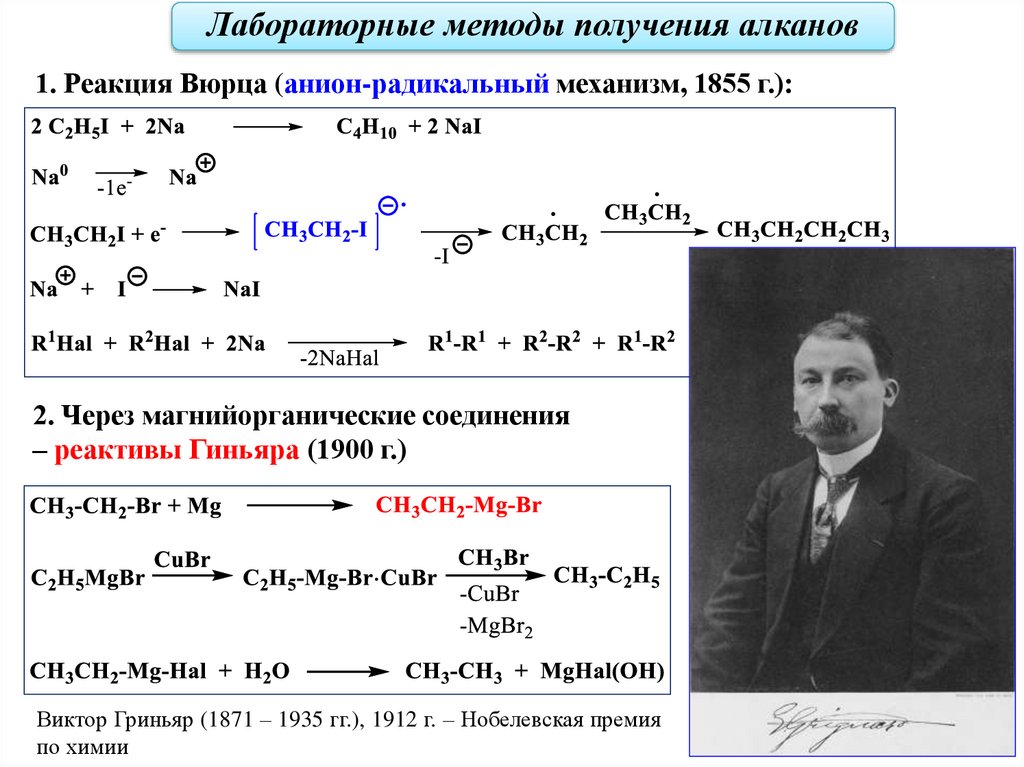
Лабораторные методы получения алканов1. Реакция Вюрца (анион-радикальный механизм, 1855 г.):
2. Через магнийорганические соединения
– реактивы Гиньяра (1900 г.)
Виктор Гриньяр (1871 – 1935 гг.), 1912 г. – Нобелевская премия
по химии
56.
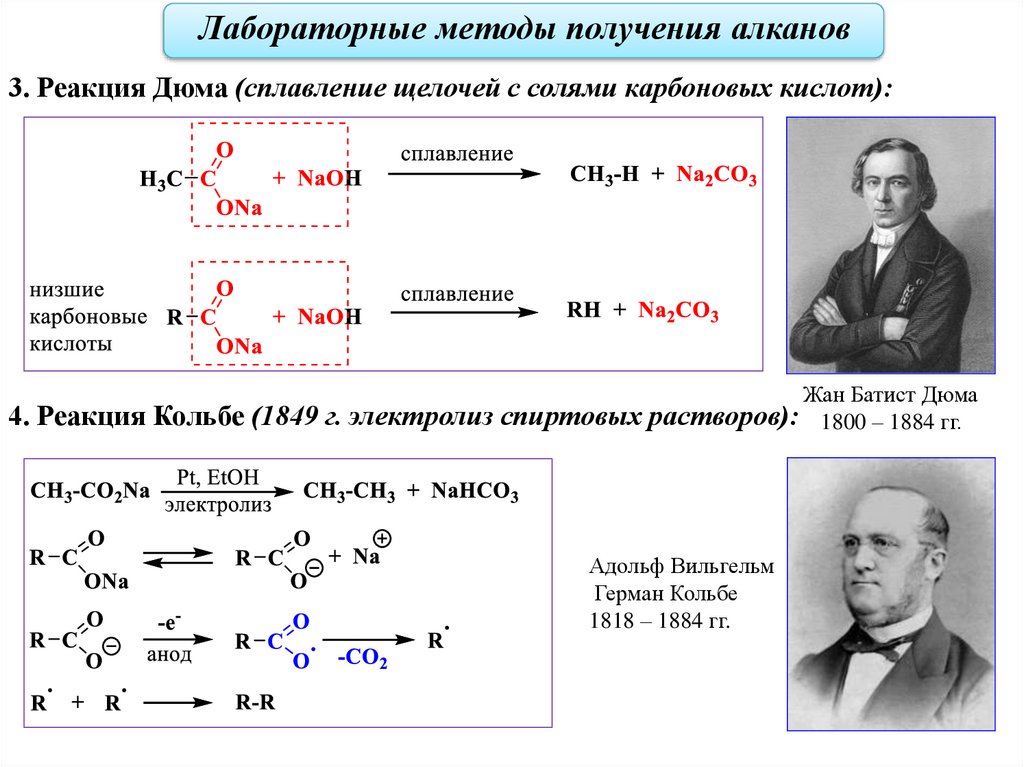
Лабораторные методы получения алканов3. Реакция Дюма (сплавление щелочей с солями карбоновых кислот):
Жан Батист Дюма
4. Реакция Кольбе (1849 г. электролиз спиртовых растворов): 1800 – 1884 гг.
Адольф Вильгельм
Герман Кольбе
1818 – 1884 гг.
57.
Лабораторные методы получения алканов5. Метод Фишера-Тропша (из синтез-газа) (1926 г.)
Процесс использовался во времена 3-его Рейха для производства синтетического
моторного топлива.
В настоящее время экономически нецелесообразен. Продолжают работать лишь
несколько крупных заводов в ЮАР (5౼6 млн т/год), Катаре и Малайзии (0.5 млн т/год).
Китай планирует покрывать до 5 %-ов потребностей в топливе за счёт ожижения угля.




















 chemistry
chemistry








