Similar presentations:
Начальные представления об органической химии
1.
Начальные представления оборганической химии (ОХ)
Подготовила: учитель химии Окунева В.Е.
2.
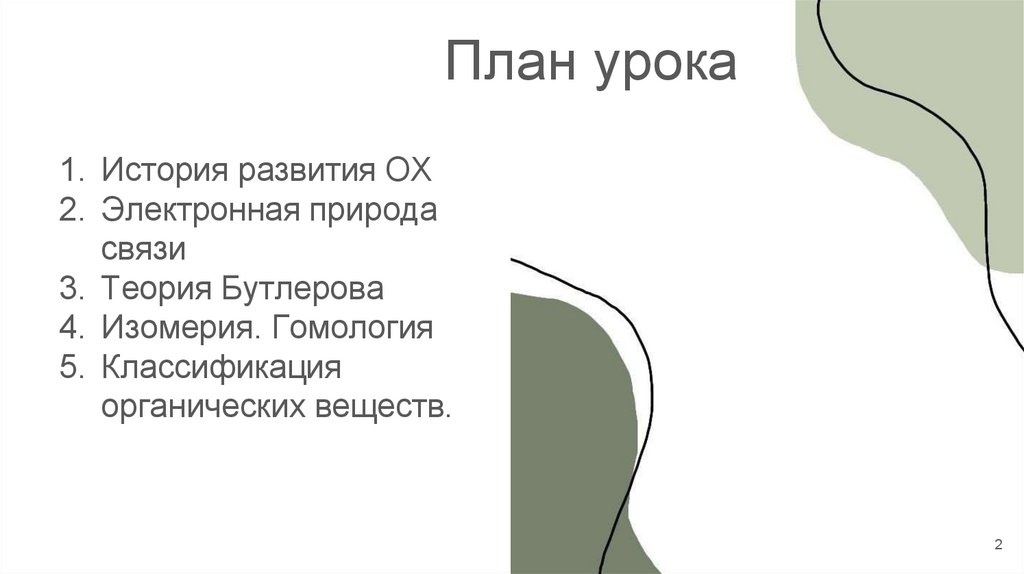
План урока1. История развития ОХ
2. Электронная природа
связи
3. Теория Бутлерова
4. Изомерия. Гомология
5. Классификация
органических веществ.
2
3.
История развития ОХ● сахара, крахмал, спирт, смолы, масла, индиго известны с
древнейших времен.
● 1675 – Лемери, «Cours de Chimie»: разделение на
минеральные, растительные и животные вещества.
● 1784 году – Лавуазье: во всех соединениях, получаемых
из растительных и животных источников всегда
содержится углерод и водород (часто азот и
фосфор).
● Берцелиус (1815): органические вещества
производятся под воздействием жизненной силы, они
не могут быть получены искусственно (теория
3
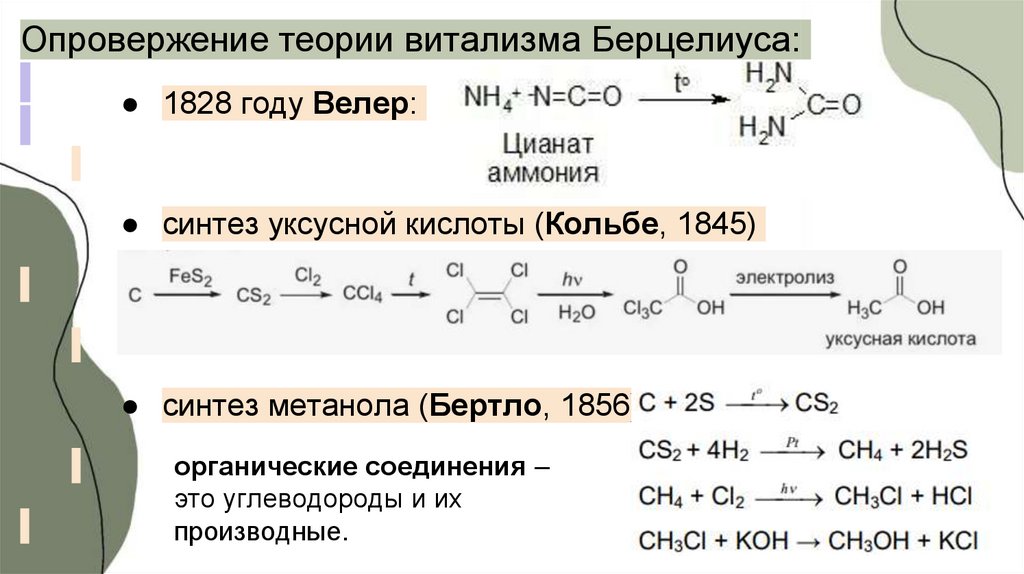
4.
Опровержение теории витализма Берцелиуса:● 1828 году Велер:
● синтез уксусной кислоты (Кольбе, 1845)
● синтез метанола (Бертло, 1856)
органические соединения –
это углеводороды и их
производные.
4
5.
Электронная природа ХС1. Все органические вещества содержат углерод. Он переходит
в возбуждённое состояние:
1. Органике свойственны ковалентные связи. КС
характеризуется:
● энергией
● длиной
● насыщаемостью
● пространственной направленностью.
5
6.
Энергия связиа) КС образуется за счёт перекрывания электронных облаков,
при этом образуется энергия
Типы перекрываний в порядке возрастания их прочности
и энергии выделяемой при образовании:
σ(s – s) < σ(s – p) < σ (p – p)
6
7.
Длина, насыщаемость и направленностьДлина связи (l) определяется расстоянием между центрами ядер
связывающихся атомов
С повышением кратности связи длина становится
меньше, а энергия выше:
(С – С) < (C = C) < (C ≡ C)
Насыщаемость показывает способность образовывать
строго определённое количество ковалентных связей.
Направленность к – взаимное расположение
электронных облаков, участвующих в образовании
химической связи.
7
8.
Атом C содержит на внешнем уровне четыревалентных электрона
2
2
1s 2s sp2
Можно предположить, что в молекуле
метана CH4 C не может образовать 4
одинаковых связи с четырьмя H.
1931 г. Л. Полинг: в молекуле метана
в момент образования молекулы
электронные облака смешиваются и
образуют гибридные электронные
облака, происходит процесс
гибридизации.
8
9.
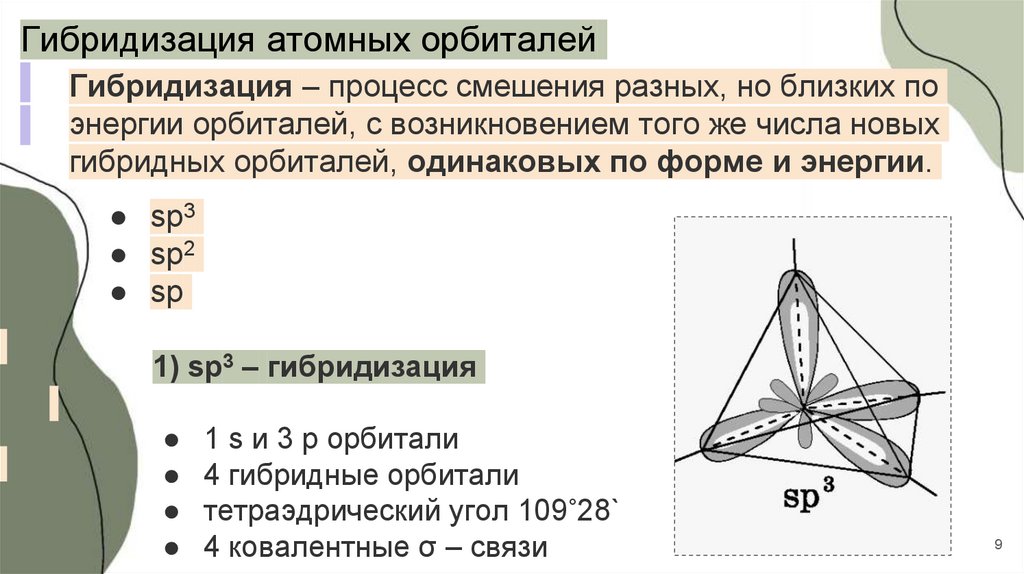
Гибридизация атомных орбиталейГибридизация – процесс смешения разных, но близких по
энергии орбиталей, с возникновением того же числа новых
гибридных орбиталей, одинаковых по форме и энергии.
● sp3
● sp2
● sp
1) sp3 – гибридизация
1 s и 3 p орбитали
4 гибридные орбитали
тетраэдрический угол 109˚28`
4 ковалентные σ – связи
9
10.
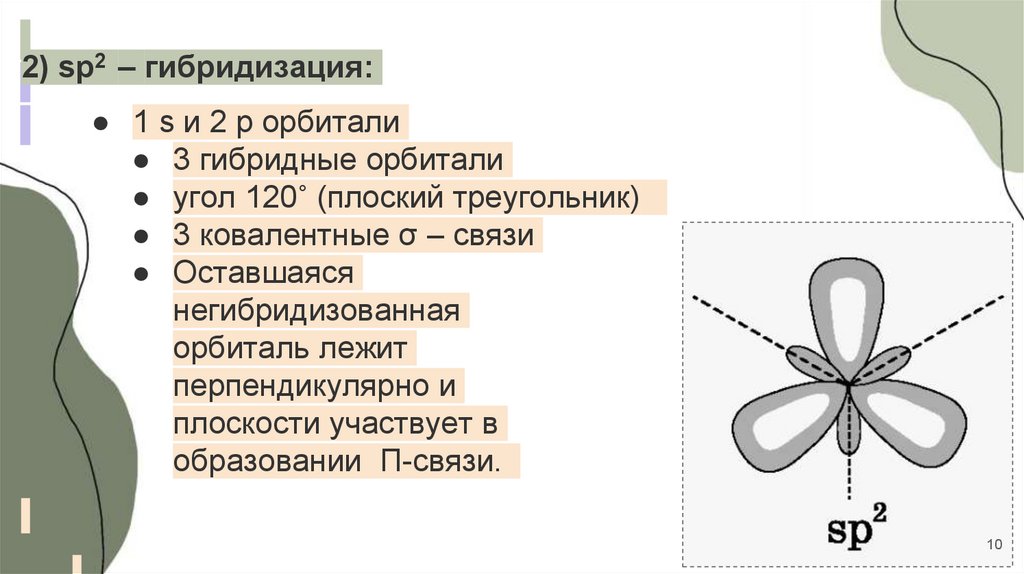
2) sp2 – гибридизация:● 1 s и 2 p орбитали
● 3 гибридные орбитали
● угол 120˚ (плоский треугольник)
● 3 ковалентные σ – связи
● Оставшаяся
негибридизованная
орбиталь лежит
перпендикулярно и
плоскости участвует в
образовании П-связи.
10
11.
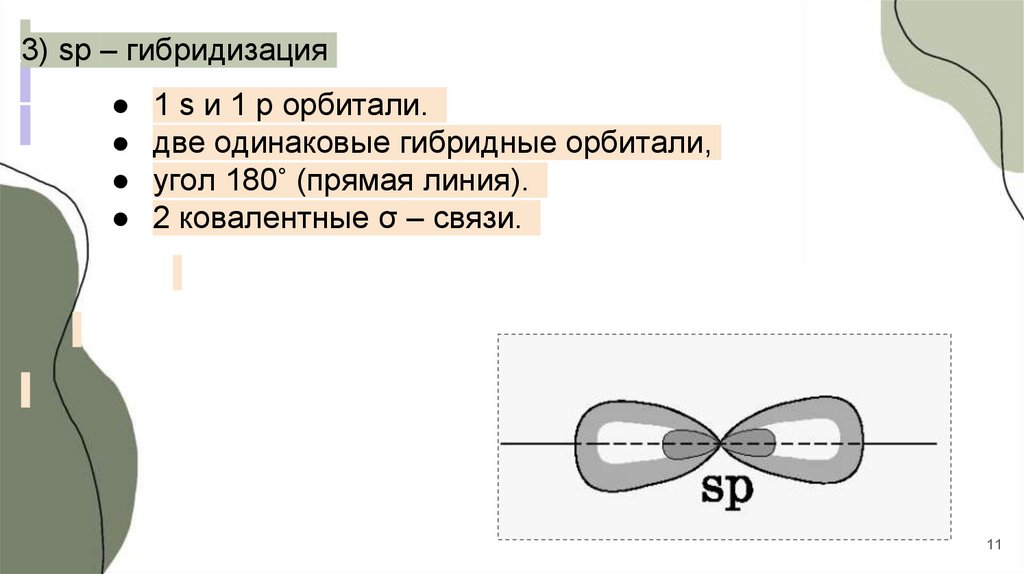
3) sp – гибридизация1 s и 1 p орбитали.
две одинаковые гибридные орбитали,
угол 180˚ (прямая линия).
2 ковалентные σ – связи.
11
12.
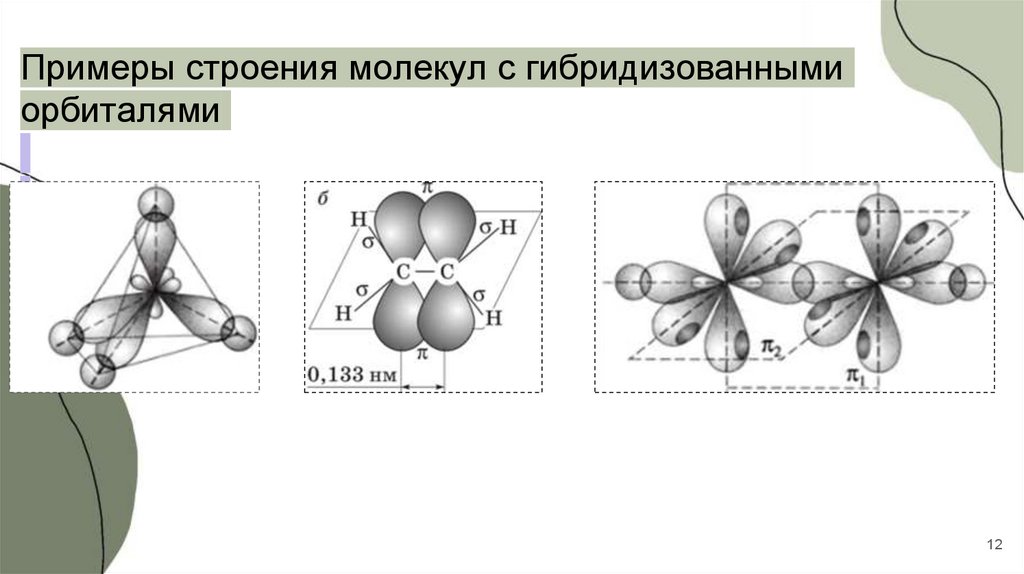
Примеры строения молекул с гибридизованнымиорбиталями
12
13.
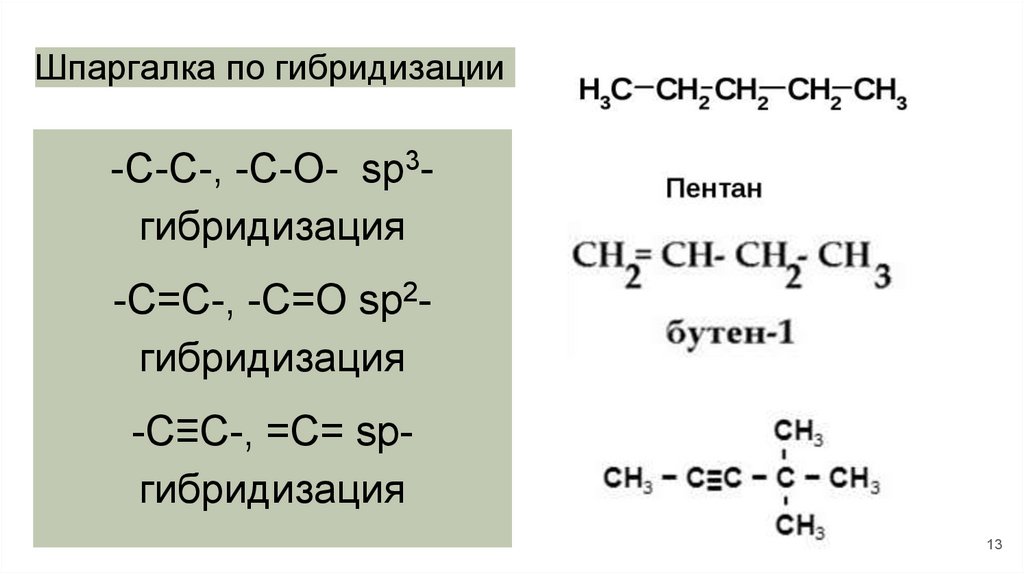
Шпаргалка по гибридизации-C-C-, -C-O- sp3гибридизация
-C=C-, -C=O sp2гибридизация
-C≡C-, =C= spгибридизация
13
14.
1. Органическая химия – изучает соединения углерода (кромепростейших - СО, СО2, угольной кислоты и её солей).
2. Органогены – химические элементы, входящие в состав
органических соединений – С, H,N, O, P, S.
3. Органическая химия как наука зародилась к началу XIX
века.
4. 1861 год А. М. Бутлеров создал теорию химического
строения органических соединений.
14
15.
Органические вещества имеют ряд особенностей:1. В состав всех органических веществ входят углерод и водород, поэтому
при горении они чаще всего образуют углекислый газ и воду.
2. Почти все горючи.
3. большинство органических соединений не диссоциирует на ионы, что
обусловлено природой ковалентной связи в органических веществах.
4. Ионный тип связи реализуется только в солях органических кислот,
например, CH3COONa.
5. Органические вещества построены сложно и могут иметь огромную
молекулярную массу (белки, жиры, углеводы).
6. Органические вещества можно расположить в ряды сходных по составу,
строению и свойствам гомологов.
7. Для органических веществ характерной является изомерия.
15
16.
Основные положения теории химического строенияорганических веществ (теория А.М. Бутлерова)
1. Атомы в молекулах соединены друг с другом в
определённом порядке, согласно валентностям.
2. Порядок соединения атомов – химическое
строение.
3. Свойства веществ зависят не только от их
состава, но и от химического строения.
4.Явление существования веществ с
одинаковым качественным и
количественным составом, но разным
химическим строением, называется
16
17.
Виды формул в ОХ1. Молекулярная (количество и природу атомов).
H2SO4
C4H10
2. Структурная (+ строение)
а) развёрнутая
б) сокращённая
в) скелетная
17
18.
Типы углеродных атомов в составе органических молекулПервичные
Вторичные
Третичные
Четвертичные
Атомы углерода,
Атомы углерода,
Атомы углерода,
Атомы углерода,
которые в углеродной которые в углеродной которые в углеродной которые в углеродной
цепи соединены с
цепи соединены с
цепи соединены с
цепи соединены с
одним атомом
двумя атомами
тремя атомами
четырьмя атомами
углерода
углерода
углерода
углерода
18
19.
Гомологический ряд – это бесконечный ряд органических соединений,имеющих сходное строение и, следовательно, сходные химические
свойства и отличающихся друг от друга на любое число метиленовых
СН2– групп (гомологическая разность).
19
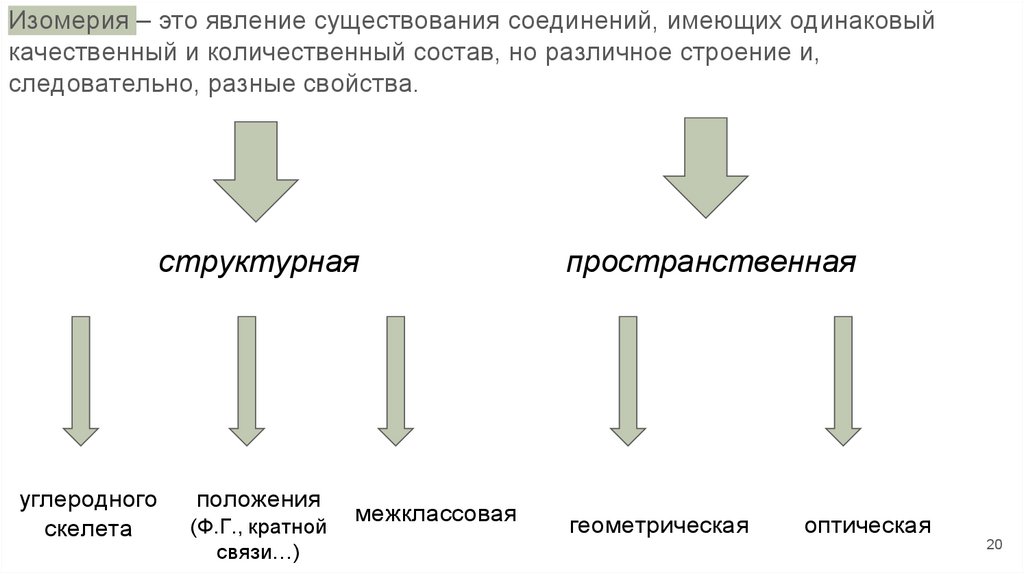
20.
Изомерия – это явление существования соединений, имеющих одинаковыйкачественный и количественный состав, но различное строение и,
следовательно, разные свойства.
структурная
углеродного
скелета
положения
(Ф.Г., кратной
связи…)
межклассовая
пространственная
геометрическая
оптическая
20
21.
Структурная изомерияСтруктурные изомеры – соединения с одинаковым составом, но различным
порядком связывания атомов, т.е. с различным химическим строением.
Молекулярная формула у структурных изомеров одинаковая, а
структурная различается.
Изомерия углеродного скелета: вещества различаются строением
углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
21
22.
Изомерия положенияИзомерия положения обусловлена различным положением
кратной связи, функциональной группы или заместителя при
одинаковом углеродном скелете молекул.
Например, бутен-1 и бутен-2:
Или пропанол-1 и пропанол-2:
22
23.
Межклассовая изомерияМежклассовая изомерия – ещё один вид структурной изомерии, когда
вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой
эфир (диметиловый эфир):
Или:
23
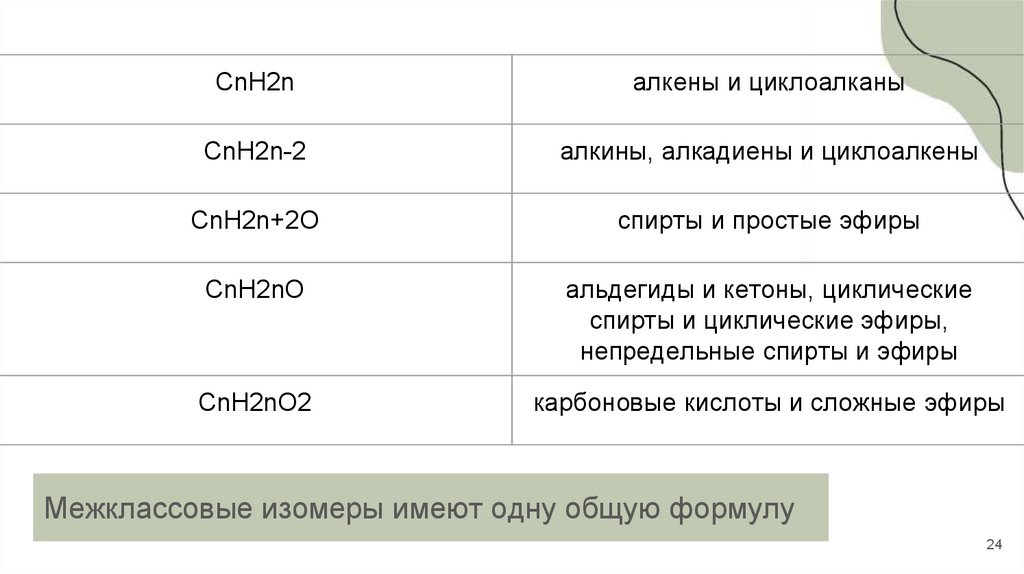
24.
CnH2nалкены и циклоалканы
CnH2n-2
алкины, алкадиены и циклоалкены
CnH2n+2O
спирты и простые эфиры
CnH2nO
альдегиды и кетоны, циклические
спирты и циклические эфиры,
непредельные спирты и эфиры
CnH2nO2
карбоновые кислоты и сложные эфиры
Межклассовые изомеры имеют одну общую формулу
24
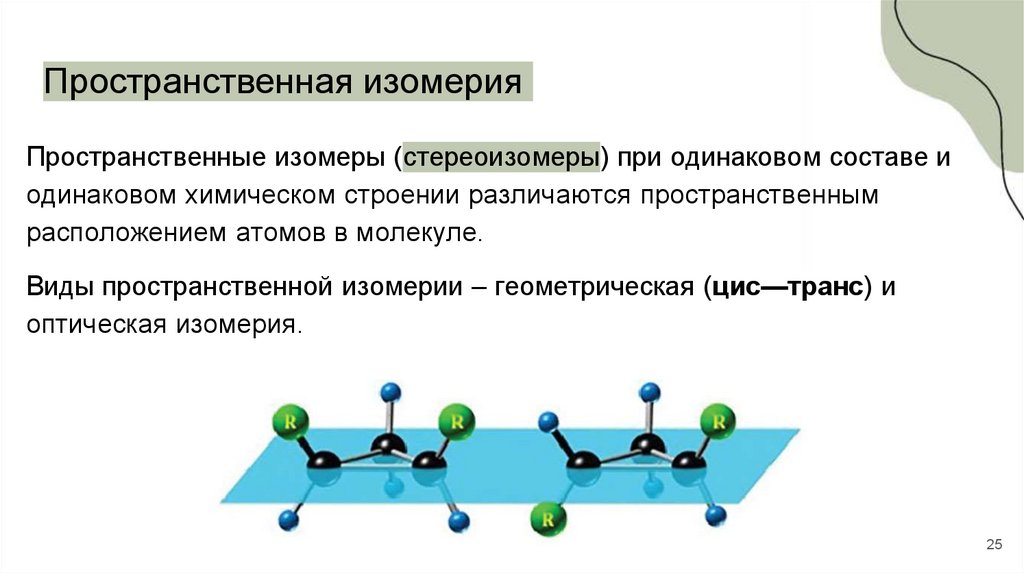
25.
Пространственная изомерияПространственные изомеры (стереоизомеры) при одинаковом составе и
одинаковом химическом строении различаются пространственным
расположением атомов в молекуле.
Виды пространственной изомерии – геометрическая (цис—транс) и
оптическая изомерия.
25
26.
Цис-транс-изомерия● заключается в возможности расположения заместителей по одну или по
разные стороны плоскости двойной связи или неароматического цикла.
В цис-изомерах заместители находятся по одну сторону от плоскости кольца или
двойной связи, в транс-изомерах – по разные.
Геометрическая изомерия характерна для соединений, в которых различается
положение заместителей относительно плоскости двойной связи или цикла.
Например, для алкенов и циклоалканов. Например, бутен-2 существует в
виде цис— и транс-изомеров
26
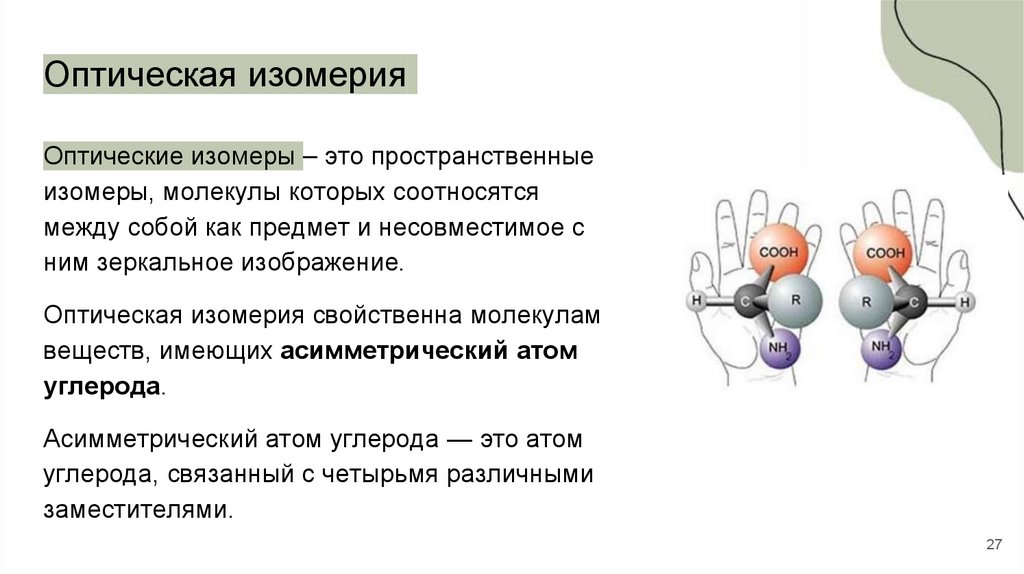
27.
Оптическая изомерияОптические изомеры – это пространственные
изомеры, молекулы которых соотносятся
между собой как предмет и несовместимое с
ним зеркальное изображение.
Оптическая изомерия свойственна молекулам
веществ, имеющих асимметрический атом
углерода.
Асимметрический атом углерода — это атом
углерода, связанный с четырьмя различными
заместителями.
27
28.
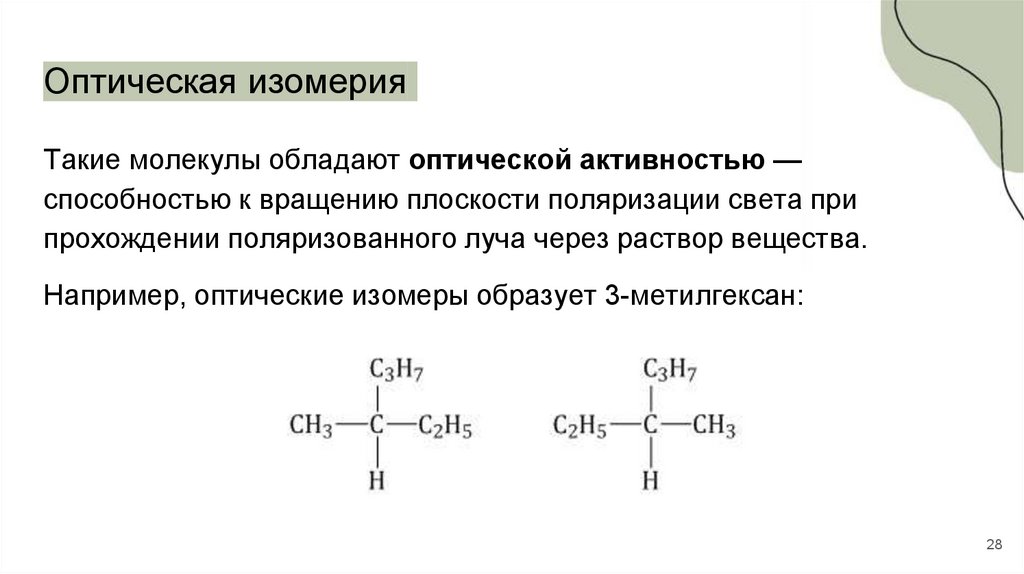
Оптическая изомерияТакие молекулы обладают оптической активностью —
способностью к вращению плоскости поляризации света при
прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
28
29.
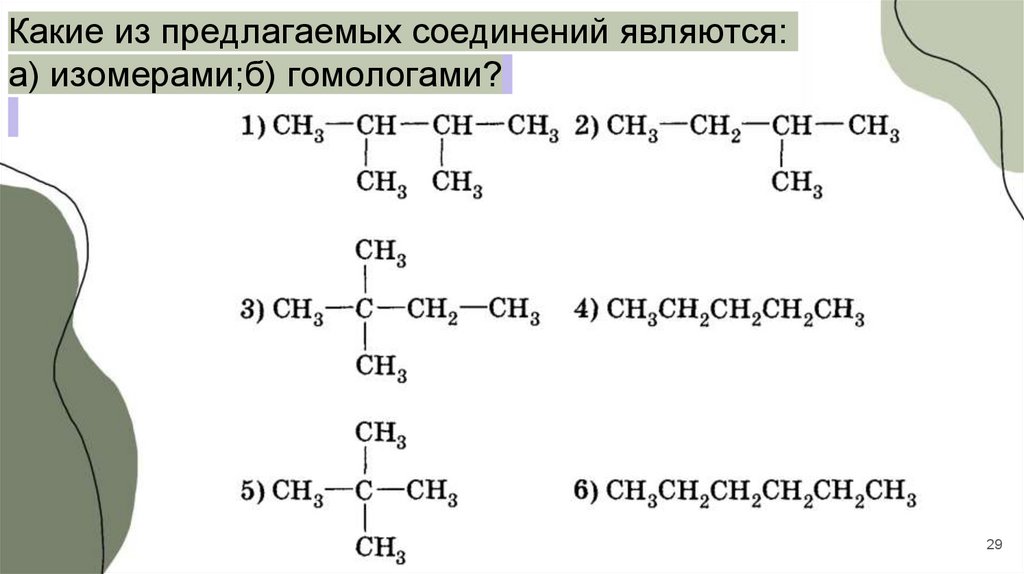
Какие из предлагаемых соединений являются:а) изомерами;б) гомологами?
29
30.
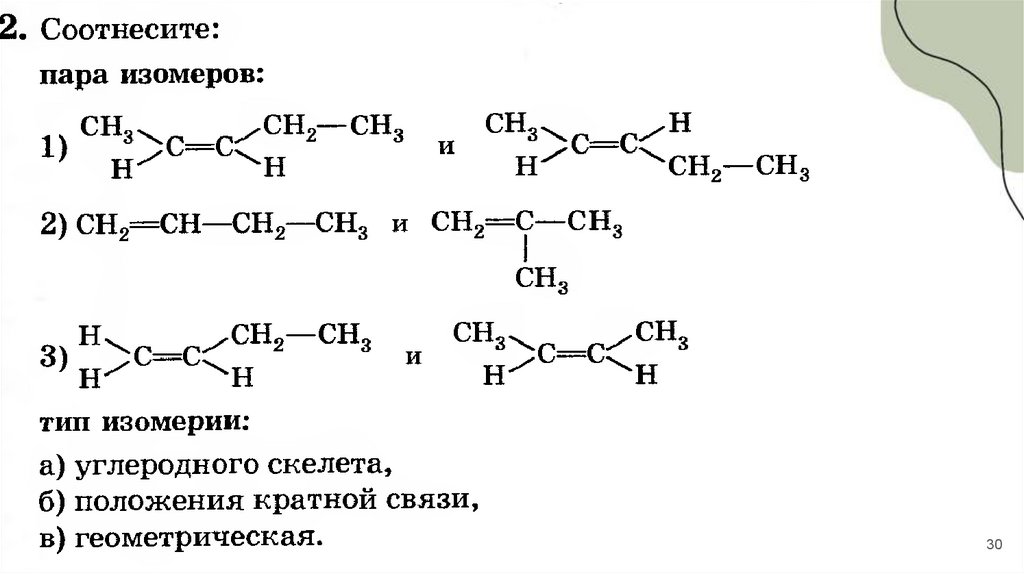
3031.
https://orgchem.ru/test/test1_1.htm31
32.
Классификация и номенклатураорганических соединений
32
33.
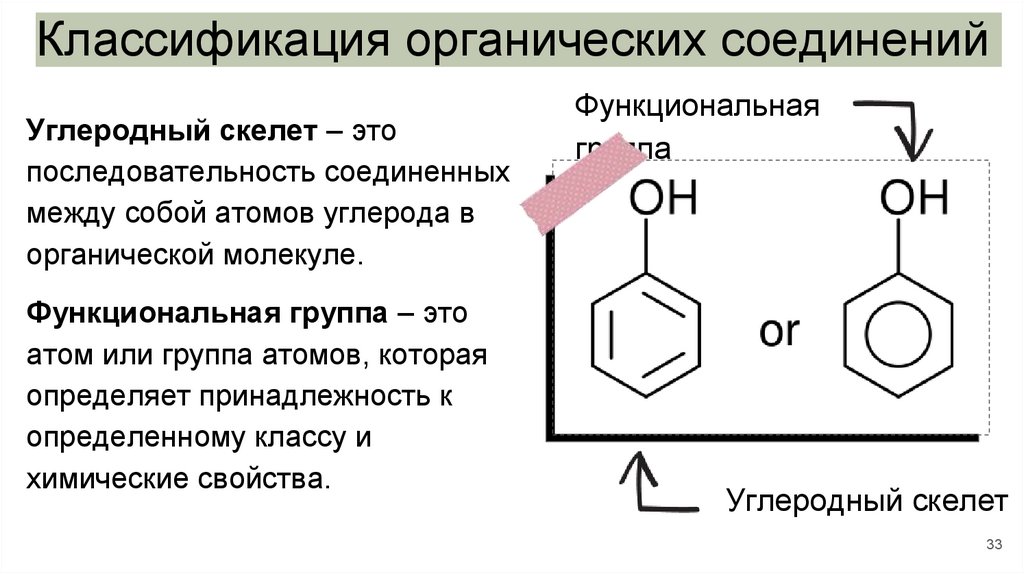
Классификация органических соединенийУглеродный скелет – это
последовательность соединенных
между собой атомов углерода в
органической молекуле.
Функциональная группа – это
атом или группа атомов, которая
определяет принадлежность к
определенному классу и
химические свойства.
Функциональная
группа
Углеродный скелет
33
34.
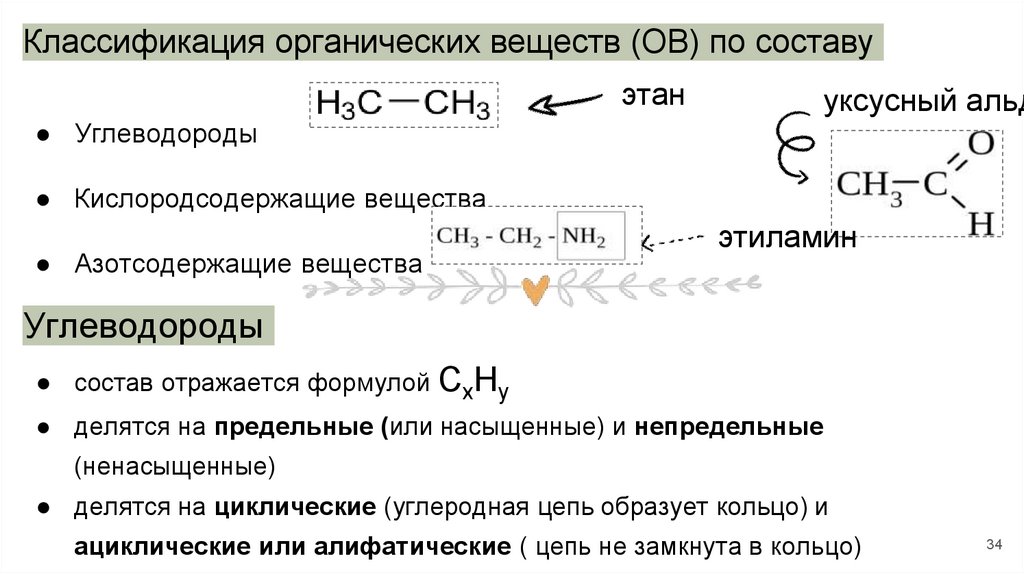
Классификация органических веществ (ОВ) по составуэтан
уксусный альд
● Углеводороды
● Кислородсодержащие вещества
● Азотсодержащие вещества
этиламин
Углеводороды
● состав отражается формулой СхНу
● делятся на предельные (или насыщенные) и непредельные
(ненасыщенные)
● делятся на циклические (углеродная цепь образует кольцо) и
ациклические или алифатические ( цепь не замкнута в кольцо)
34
35.
Кислородсодержащие ОВОсновные функциональные группы,
содержащие кислород:
● группа –О-Н (гидроксильная)
● группа >С=О (карбонильная)
● группа –СОО(карбоксильная)
Азотсодержащие ОВ
● амины – содержат группы –NН2,
–NH–, либо -N< ,
Некоторые органические вещества
содержат и азот, и кислород. К ним
относятся:
● нитросоединения –NO2
● амиды –CONH2,
● аминокислоты –
полифункциональные
соединения, которые содержат
и карбоксильную группу –
COOH, и аминогруппу –NH2
● нитрилы (группа –С≡N),
● азотистые гетероциклы.
35
36.
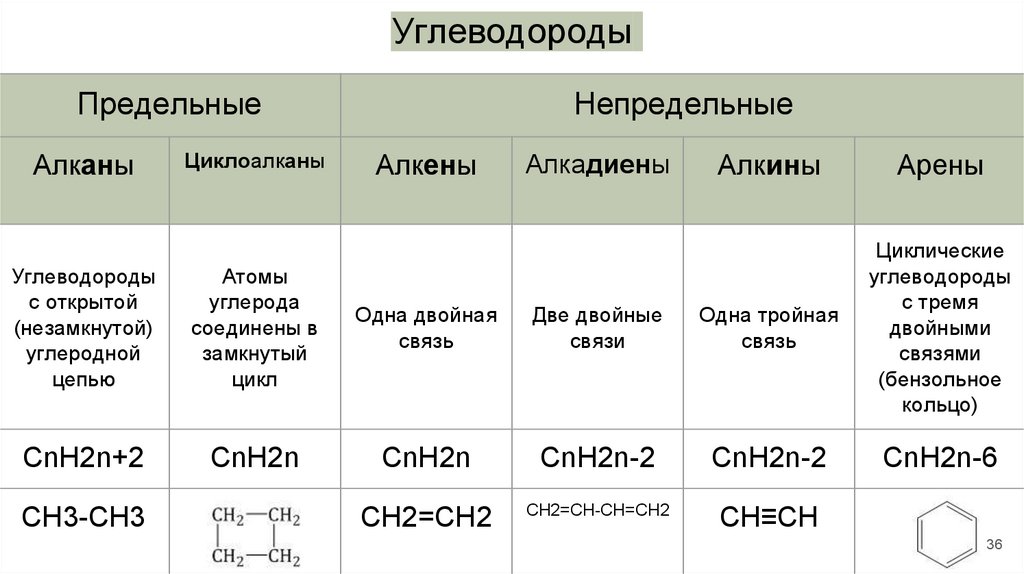
УглеводородыПредельные
Алканы
Циклоалканы
Непредельные
Алкены
Алкадиены
Алкины
Арены
Углеводороды
с открытой
(незамкнутой)
углеродной
цепью
Атомы
углерода
соединены в
замкнутый
цикл
Одна двойная
связь
Две двойные
связи
Одна тройная
связь
Циклические
углеводороды
с тремя
двойными
связями
(бензольное
кольцо)
CnH2n+2
CnH2n
CnH2n
CnH2n-2
CnH2n-2
CnH2n-6
CH2=CH2
CH2=CН-СН=СH2
СН≡СН
CH3-CH3
36
37.
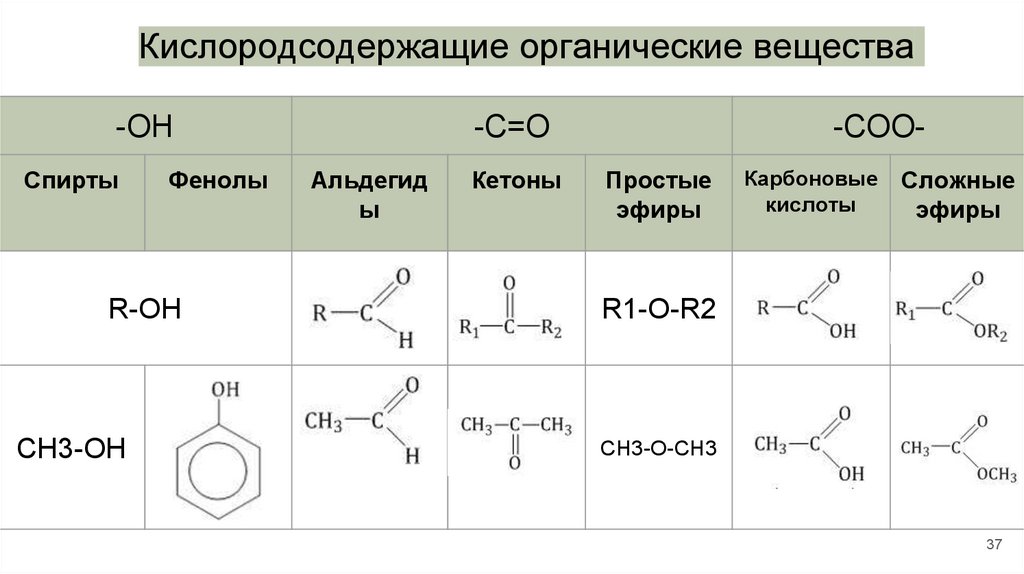
Кислородсодержащие органические вещества-OH
Спирты
Фенолы
R-OH
CH3-OH
-С=О
Альдегид
ы
Кетоны
-СООПростые
эфиры
Карбоновые
кислоты
Сложные
эфиры
R1-O-R2
CH3-O-CH3
37
38.
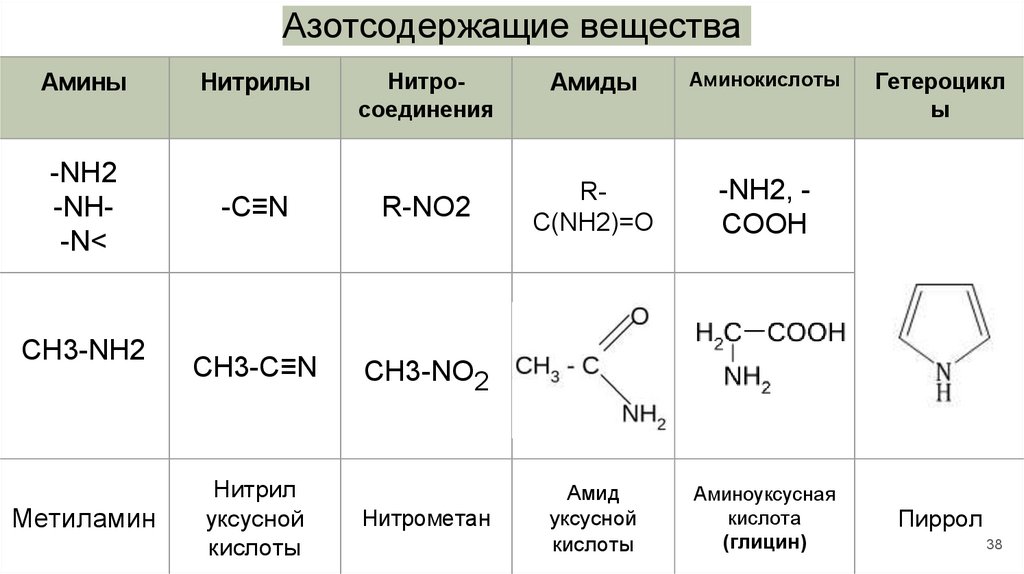
Азотсодержащие веществаАмины
Нитрилы
Нитросоединения
-NH2
-NH-N<
-C≡N
R-NO2
CH3-C≡N
CH3-NO2
CH3-NH2
Метиламин
Нитрил
уксусной
кислоты
Нитрометан
Амиды
Аминокислоты
RC(NH2)=O
-NH2, COOH
Амид
уксусной
кислоты
Аминоуксусная
кислота
(глицин)
Гетероцикл
ы
Пиррол
38
39.
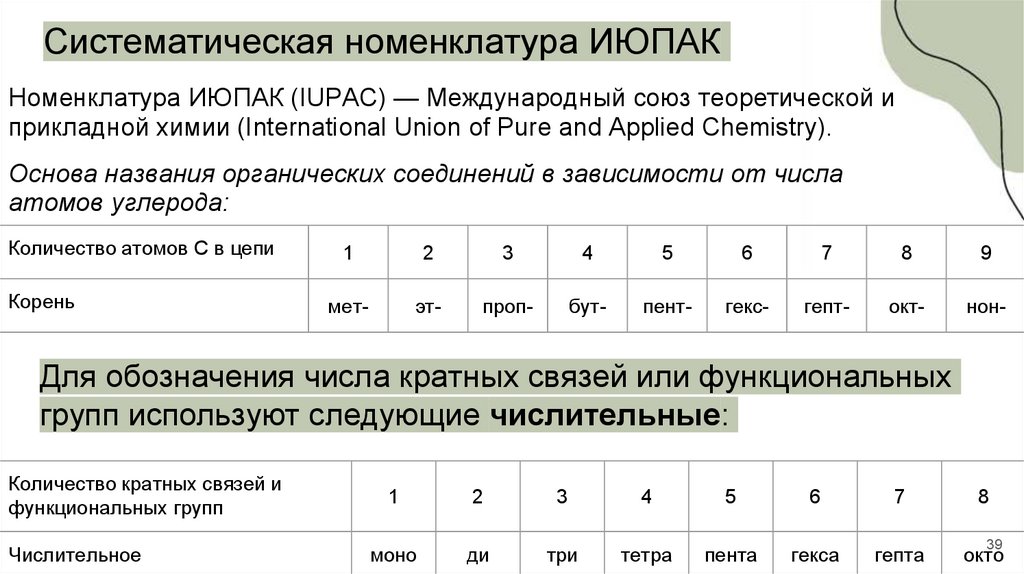
Систематическая номенклатура ИЮПАКНоменклатура ИЮПАК (IUPAC) — Международный союз теоретической и
прикладной химии (International Union of Pure and Applied Chemistry).
Основа названия органических соединений в зависимости от числа
атомов углерода:
Количество атомов С в цепи
Корень
1
2
3
4
5
6
7
8
9
мет-
эт-
проп-
бут-
пент-
гекс-
гепт-
окт-
нон-
Для обозначения числа кратных связей или функциональных
групп используют следующие числительные:
Количество кратных связей и
функциональных групп
Числительное
1
2
3
4
5
6
7
8
моно
ди
три
тетра
пента
гекса
гепта
окто
39
40.
Наличие двойных или тройных связей в молекулах органическихсоединений обозначают, добавляя в конце слова суффикс -ен или -ин:
Тип связей
Одинарная связь (С–С)
Суффикс
-ан
Двойная связь (С=С)
Тройная связь (С≡С)
-ен
-ин
● CH4 метан
● CH2=CH-CH3 пропен
1
2
3
4
● CH≡CH-CH2-CH3 бутин-1
4
3
2
1
2
3
4
● CH3-C≡C-CH3 бутин-2
1
● CH≡CH-CH2-CH3
40
41.
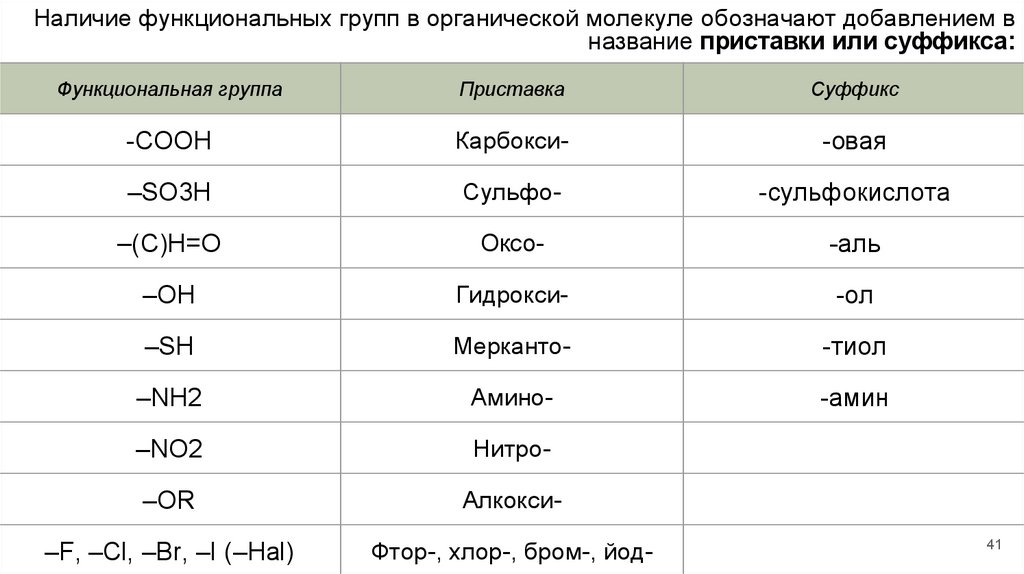
Наличие функциональных групп в органической молекуле обозначают добавлением вназвание приставки или суффикса:
Функциональная группа
Приставка
Суффикс
-COOH
Карбокси-
-овая
–SO3H
Сульфо-
-сульфокислота
–(С)Н=O
Оксо-
-аль
–ОН
Гидрокси-
-ол
–SН
Мерканто-
-тиол
–NH2
Амино-
-амин
–NО2
Нитро-
–OR
Алкокси-
–F, –Cl, –Br, –I (–Hal)
Фтор-, хлор-, бром-, йод-
41
42.
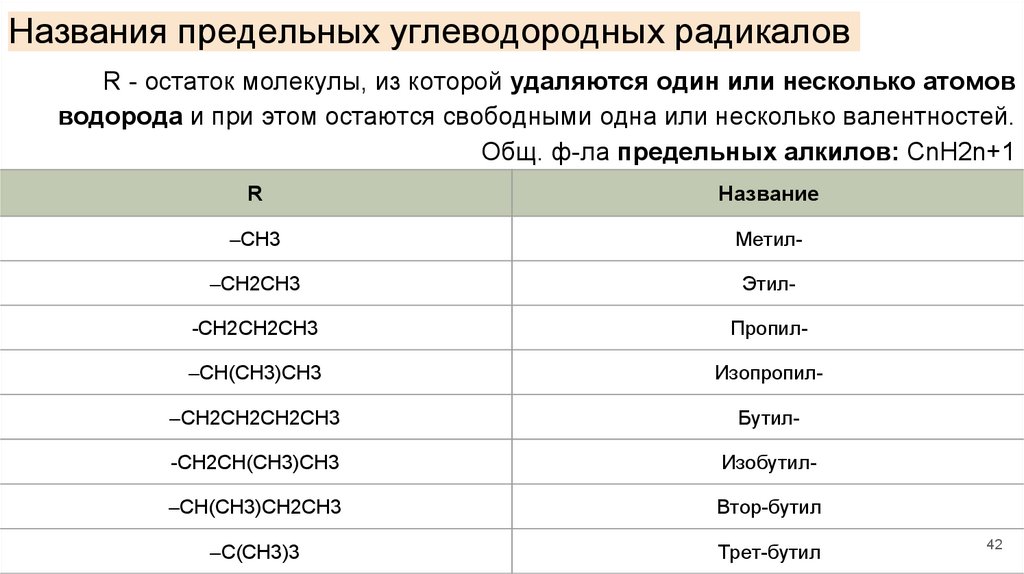
Названия предельных углеводородных радикаловR - остаток молекулы, из которой удаляются один или несколько атомов
водорода и при этом остаются свободными одна или несколько валентностей.
Общ. ф-ла предельных алкилов: CnH2n+1
R
Название
–CH3
Метил-
–CH2CH3
Этил-
-CH2CH2CH3
Пропил-
–CH(CH3)CH3
Изопропил-
–CH2CH2CH2CH3
Бутил-
-CH2CH(CH3)CH3
Изобутил-
–CH(CH3)CH2CH3
Втор-бутил
–C(CH3)3
Трет-бутил
42
43.
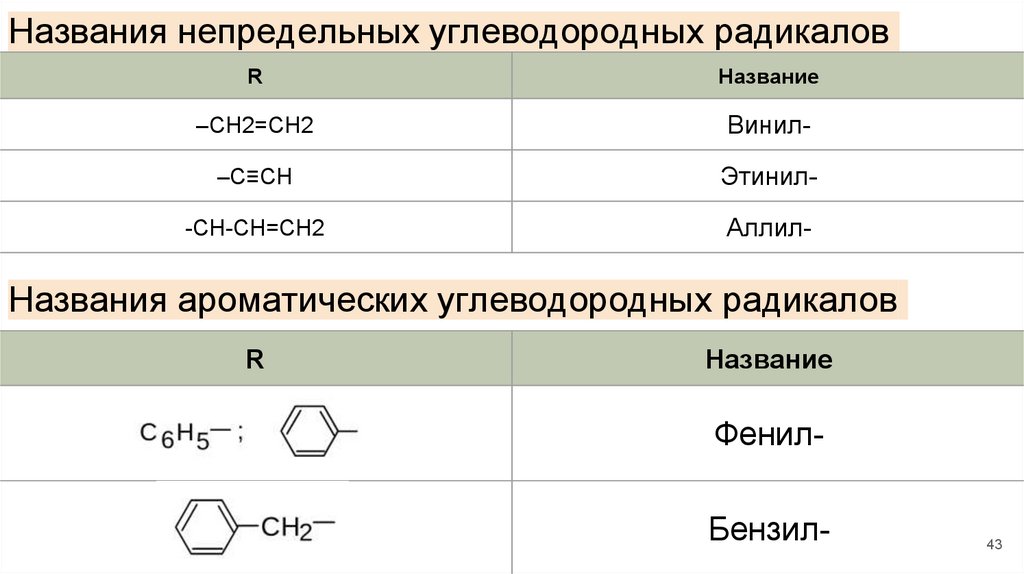
Названия непредельных углеводородных радикаловR
Название
–CH2=CH2
Винил-
–C≡CH
Этинил-
-CH-CH=CH2
Аллил-
Названия ароматических углеводородных радикалов
R
Название
Фенил-
Бензил-
43
44.
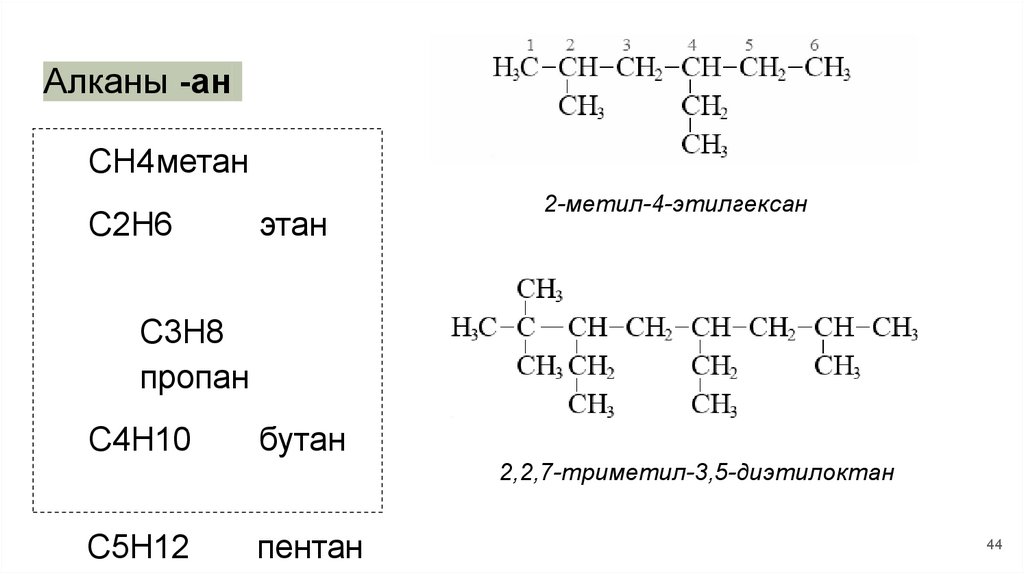
Алканы -анCH4метан
C2H6
этан
2-метил-4-этилгексан
C3H8
пропан
C4H10
бутан
2,2,7-триметил-3,5-диэтилоктан
C5H12
пентан
44
45.
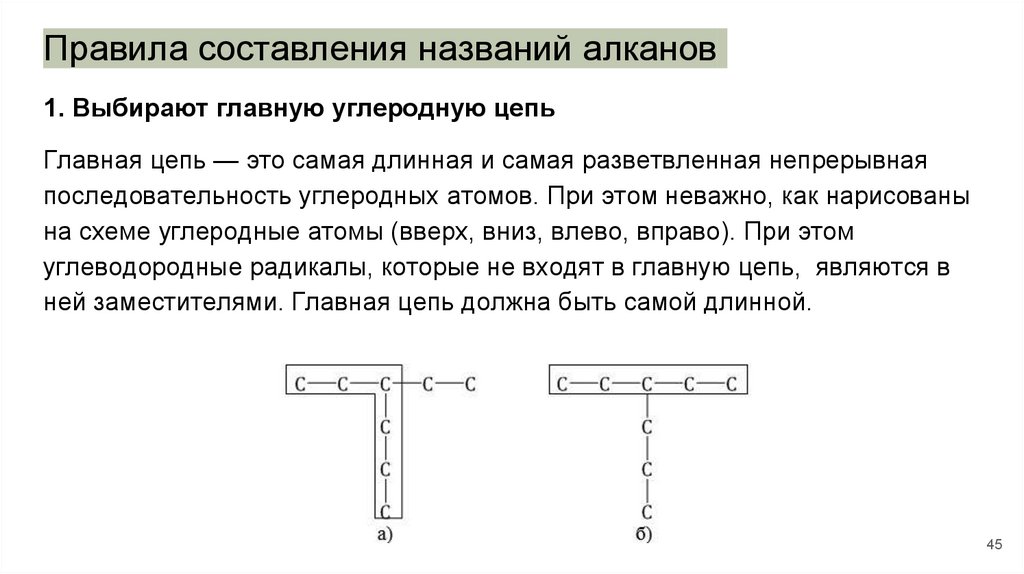
Правила составления названий алканов1. Выбирают главную углеродную цепь
Главная цепь — это самая длинная и самая разветвленная непрерывная
последовательность углеродных атомов. При этом неважно, как нарисованы
на схеме углеродные атомы (вверх, вниз, влево, вправо). При этом
углеводородные радикалы, которые не входят в главную цепь, являются в
ней заместителями. Главная цепь должна быть самой длинной.
45
46.
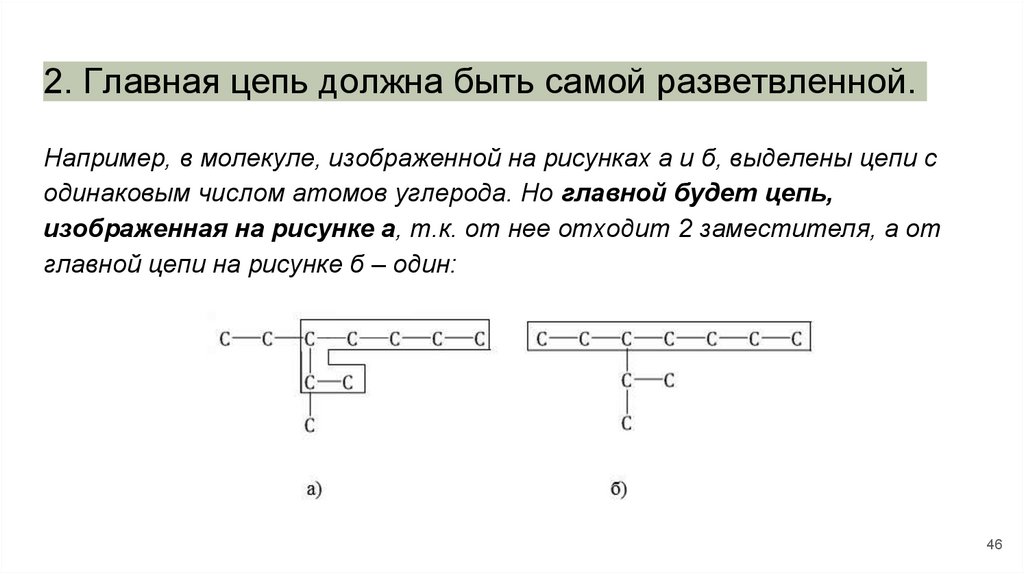
2. Главная цепь должна быть самой разветвленной.Например, в молекуле, изображенной на рисунках а и б, выделены цепи с
одинаковым числом атомов углерода. Но главной будет цепь,
изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от
главной цепи на рисунке б – один:
46
47.
3. Нумеруют атомы углерода в главной цепи.Нумерацию следует начинать с более близкого к старшей группе конца цепи.
При наличии двух и более заместителей цепь стараются пронумеровать так,
чтобы заместителям принадлежали минимальные номера.
47
48.
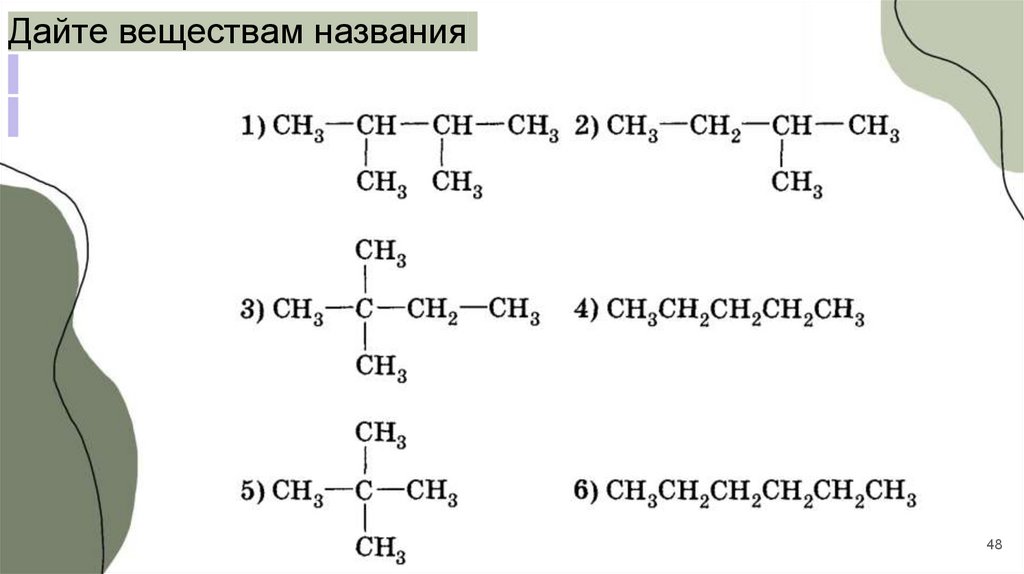
Дайте веществам названия48
49.
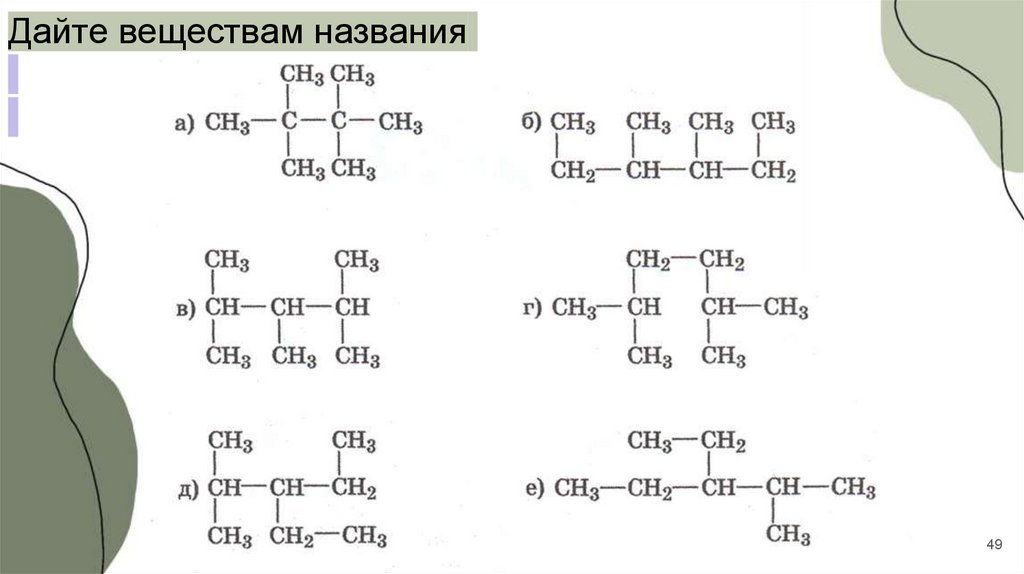
Дайте веществам названия49




















 chemistry
chemistry








