Similar presentations:
АЛКАДИЕНЫ
1. АЛКАДИЕНЫ
2.
Ненасыщенные углеводороды, содержащие две двойные связи,называются алкадиенами (диенами). Общая формула СnH2n-2.
Диены являются структурными изомерами алкинов.
3.
КлассификацияПо взаимному расположению двойных связей различают следующие диены.
- Диены с кумулированными двойными связями. Они содержат примыкающие
друг к другу двойные связи, например аллен:
СН2
С СН2
аллен
проп-1,2-диен
4.
Соединения, содержащие кумулированные двойные связи, интересны своимиструктурными особенностями. Например, в аллене обе двойные связи заметно
короче (0,131 нм), нежели стандартная двойная связь в алкене (0,134 нм в
этилене). Этот факт объясняется тем, что в отличии от первого и третьего
углеродных атомов, находящихся в состоянии sp2-гибридизации, центральный
атом углерода в молекуле аллена имеет sp-гибридизацию.
Другим следствием sp-гибридизации центрального атома углерода является то,
что две двойные связи аллена ориентированы в двух перпендикулярных
плоскостях.
Соединения этого типа неустойчивы.
5.
- Диены с изолированными двойными связями. Двойные связи в таких диенахразделены более чем одной простой связью:
СН2
СН
(СН2)n
СН СН2
n≥1
Эти соединения обладают теми же свойствами, что и алкены, содержащие
одну двойную связь. Изолированные двойные связи проявляют себя, таким
образом, независимо одна от другой.
6.
- Диены с сопряженными двойными связями. Двойные связи в этих диенахразделены одной простой связью, например бут-1,3-диен (дивинил):
СН2 СН СН СН2
бут-1,3-диен
дивинил
7.
НоменклатураСистематическая номенклатура ИЮПАК.
- Выбирают самую длинную цепь атомов углерода, не обязательно
содержащую две кратные связи. Если таких цепей в молекуле несколько, то
главной считается самая разветвленная.
- Атомы углерода главной цепи нумеруют арабскими цифрами. Нумерацию
ведут с того края цепи, где ближе кратная связь, если кратная связь не входит в
основную цепь.
- Перед названием главной углеродной цепи по алфавиту называют
заместители. Перед названием заместителей ставятся цифры, указывающие их
положение в цепи. Цифры отделяются от названий заместителей знаком
«дефис». Если в молекуле имеются несколько одинаковых заместителей, то
для каждого из них ставится номер, указывающий его положение в цепи, а
греческими числителями (ди-, три-, тетра- и т.д.) указывают число одинаковых
заместителей. В алфавитном порядке не учитывают: греческие числительные
и приставки втор. и трет., учитывают приставки изо- и нео-.
8.
- После названия всех заместителей пишут название главной цепи, котороестроится из соответствующего алкана с тем же числом атомов углерода,
окончание «ан» заменяют на «диен». Перед окончанием «диен» цифрами
указывают положение кратных связей.
CH2 CH CH2 CH CH CH2
CH3
3-метилгекс-1,5-диен
CH2 CH CH2 CH CH CH2
CH2
4-этенилгепт-1-ен СН2
СН2
9.
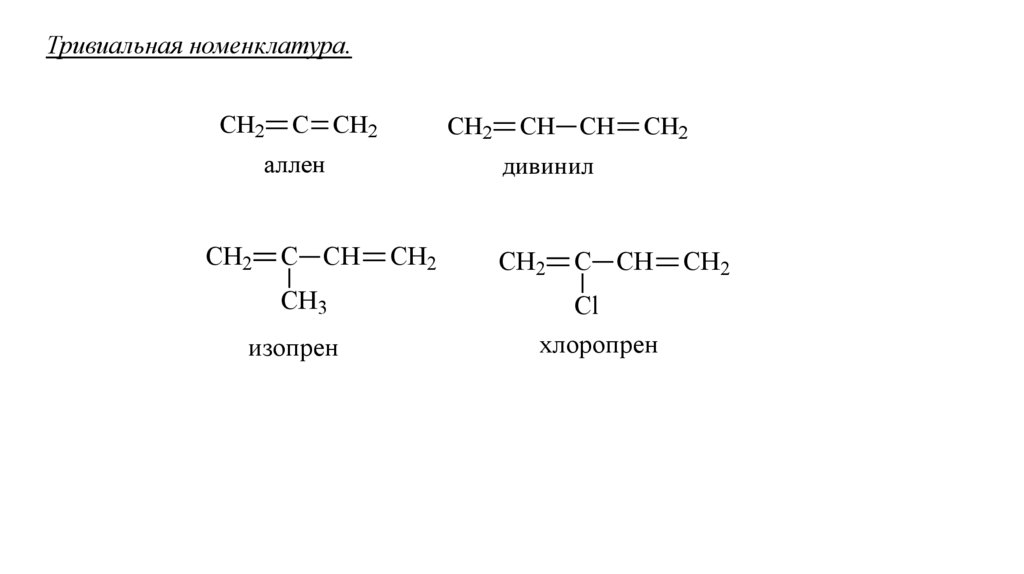
Тривиальная номенклатура.СН2
С СН2
СН2
аллен
СН2
С СН
СН3
изопрен
СН СН
СН2
дивинил
СН2
СН2
С СН
Cl
хлоропрен
СН2
10.
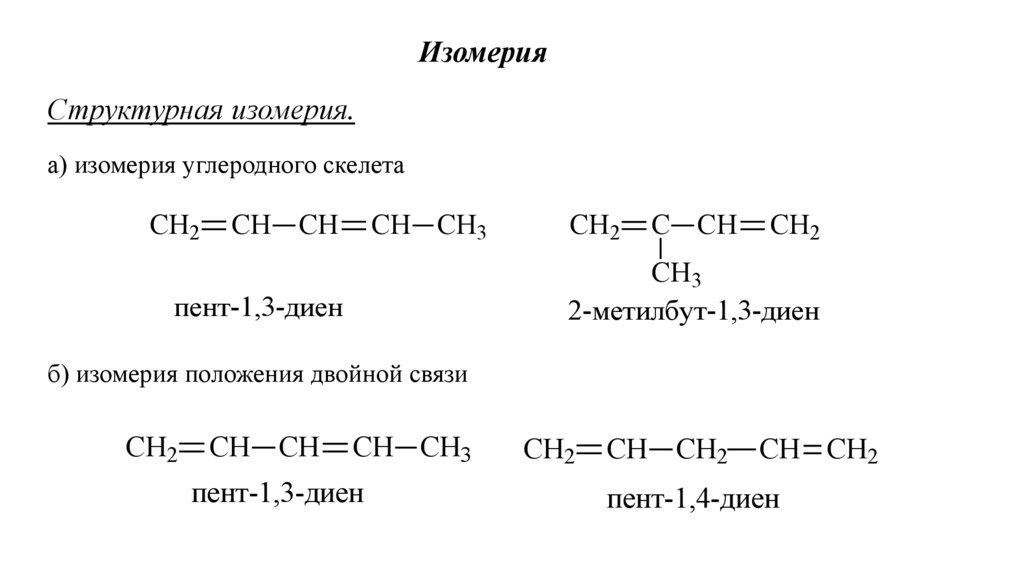
ИзомерияСтруктурная изомерия.
а) изомерия углеродного скелета
СН2
СН СН
СН СН3
СН2
С СН
СН2
СН3
2-метилбут-1,3-диен
пент-1,3-диен
б) изомерия положения двойной связи
СН2
СН СН
СН СН3
пент-1,3-диен
СН2
СН СН2
СН СН2
пент-1,4-диен
11.
Пространственная изомерия:Конформационная изомерия
H3C
HH
CH С СН2
HH
CH3
H
H
H
H
CH
CH3 CH2 CH2 CH С СН2
С СН2
12.
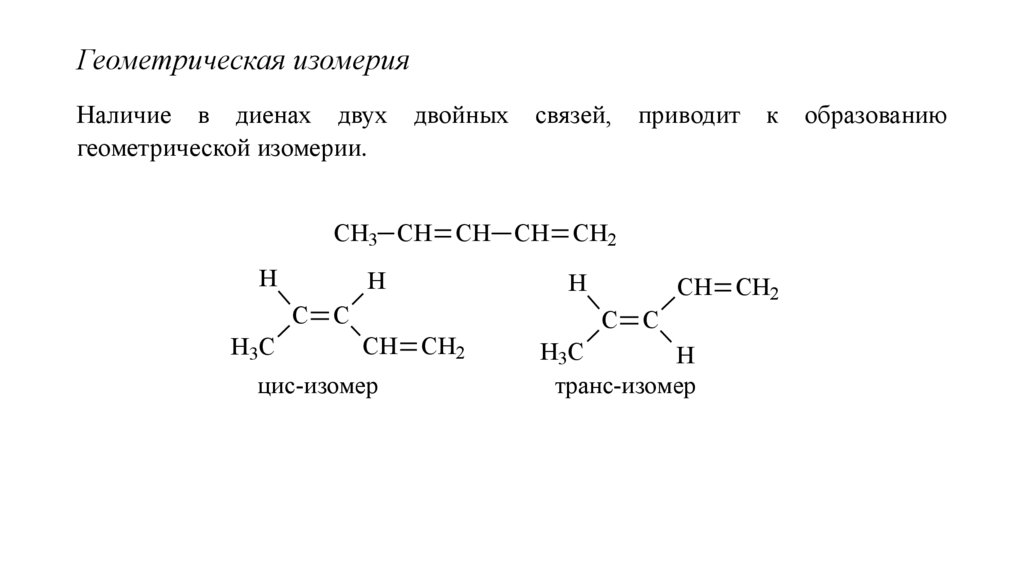
Геометрическая изомерияНаличие в диенах двух
геометрической изомерии.
двойных
связей,
приводит
к
СН3 СН СН СН СН2
Н
Н
С С
Н3С
СН СН2
цис-изомер
Н
СН СН2
С С
Н3С
Н
транс-изомер
образованию
13.
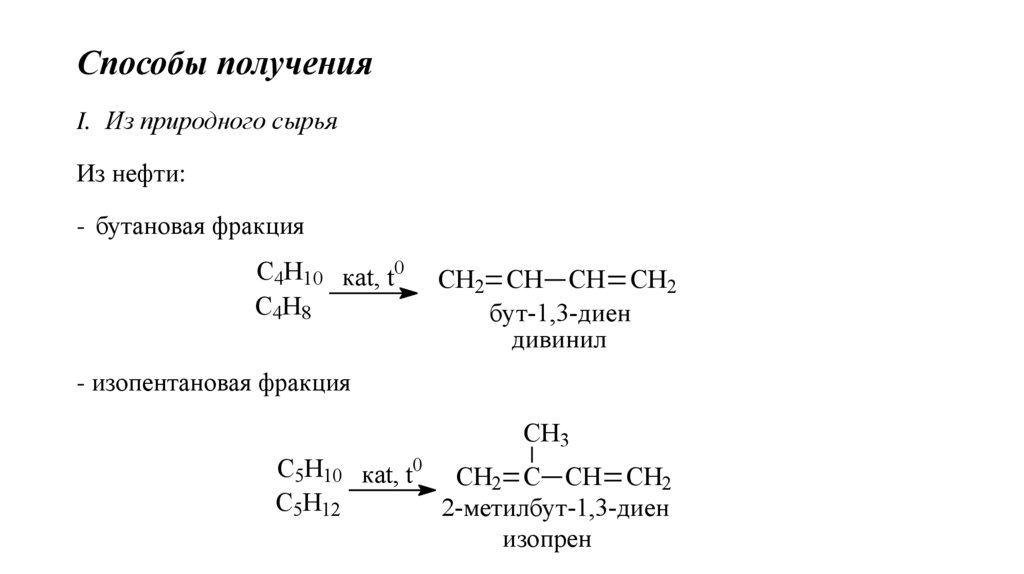
Способы полученияI. Из природного сырья
Из нефти:
- бутановая фракция
С4Н10 каt, t0
С4Н8
СН2 СН СН СН2
бут-1,3-диен
дивинил
- изопентановая фракция
CH3
С5Н10 каt, t0 СН2 С СН СН2
С5Н12
2-метилбут-1,3-диен
изопрен
14.
II. Синтетические методы полученияМногие диены могут быть получены теми же методами, что и алкены.
1. Дегалогенирование дигалогенидов действием металлов
СН2
С CH2Br + Zn
Br
CH2
C
CH2 + ZnBr2
15.
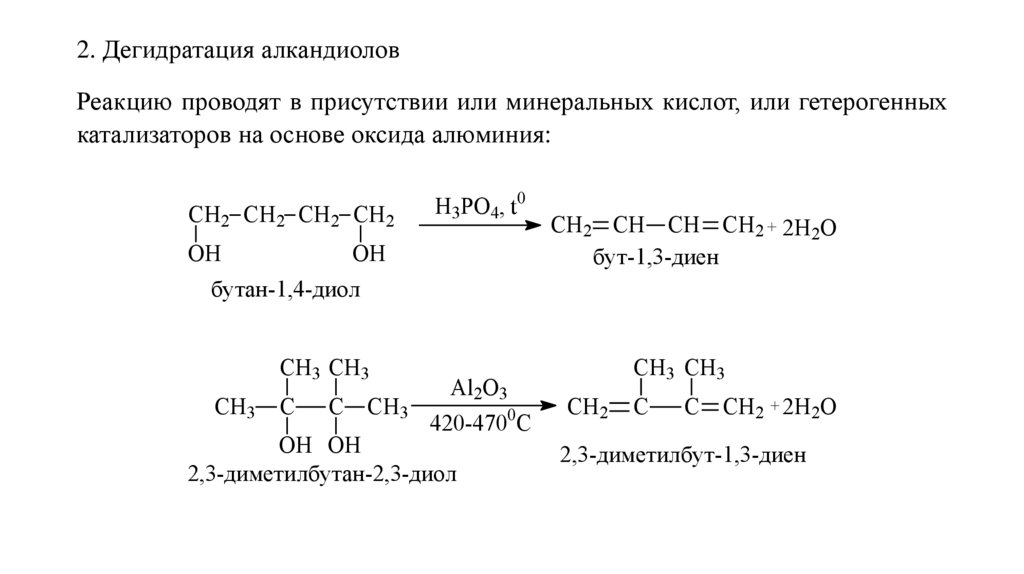
2. Дегидратация алкандиоловРеакцию проводят в присутствии или минеральных кислот, или гетерогенных
катализаторов на основе оксида алюминия:
СН2 СН2 СН2 СН2
ОН
Н3РО4, t0
ОН
СН2 СН СН СН2 + 2Н2О
бут-1,3-диен
бутан-1,4-диол
СН3 СН3
СН3
С
С СН3
Al2O3
0
420-470 C
ОН ОН
2,3-диметилбутан-2,3-диол
CH3 CH3
CH2
C
C CH2 + 2Н2О
2,3-диметилбут-1,3-диен
16.
3. Дегидрогалогенирование дигалогеналкановРеакции элиминирования дигалогеноалканов, сопровождающиеся, как и при
дегидратации диолов, образованием сопряженных диенов, отличаются
высокой региоселективностью.
СН2 СН2 СН2 СН2
Сl
Cl
1,4-дихлорбутан
2КОН, t0 CH2 CH CH CH2
_
бут-1,3-диен
2H2O
_ 2KCl
17.
Среди продуктов реакций элиминирования всегда преобладает болеестабильный, т.е. сопряженный диен.
CH3
СН2
СН СН2
С CH2 CH3
КОН, t0
Br
4-бром-4-метилгекс-1-ен
CH3
+
CH2 CH CH2 C CH CH3
4-метилгекс-1,4-диен (следы)
CH2
CH CH C CH2 CH3 +
CH3
4-метилгекс-1,3-диен (78%)
18.
4. Синтез бут-1,3-диена из этанола по Лебедеву2 С2Н5ОН
ZnO + MgO
0
400 C
СН2
СН СН СН2 + 2Н2О + Н2
бут-1,3-диен
19.
Физические свойстваФизические свойства диенов подобны свойствам других алифатических
углеводородов. Низшие диены С3-С4 – газы, не имеющие ни цвета, ни запаха.
Средние диены представляют собой бесцветные жидкости, не
смешивающиеся с водой.
20.
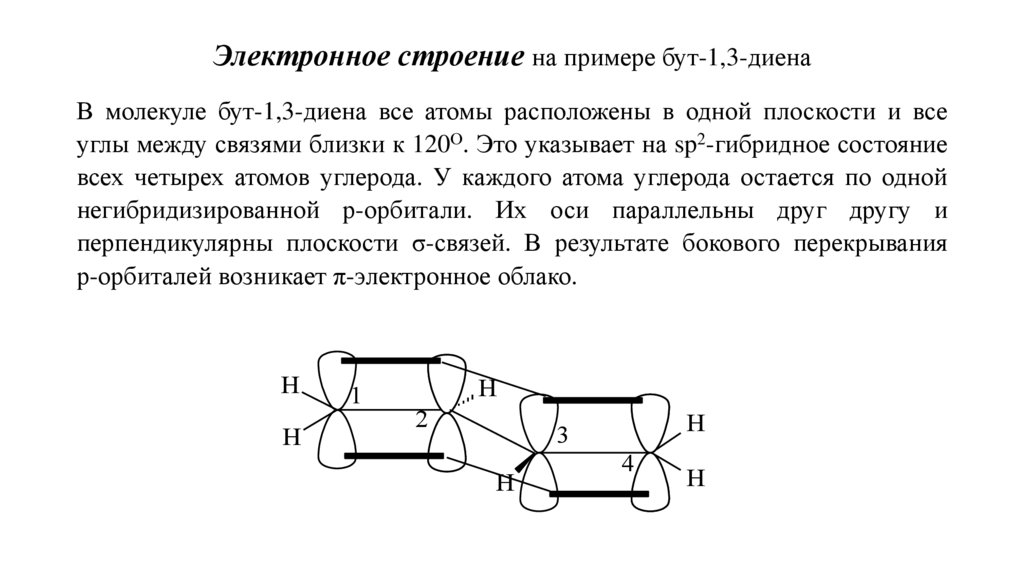
Электронное строение на примере бут-1,3-диенаВ молекуле бут-1,3-диена все атомы расположены в одной плоскости и все
углы между связями близки к 120О. Это указывает на sp2-гибридное состояние
всех четырех атомов углерода. У каждого атома углерода остается по одной
негибридизированной р-орбитали. Их оси параллельны друг другу и
перпендикулярны плоскости σ-связей. В результате бокового перекрывания
р-орбиталей возникает π-электронное облако.
Н
Н
1
Н
2
Н
3
Н
4
Н
21.
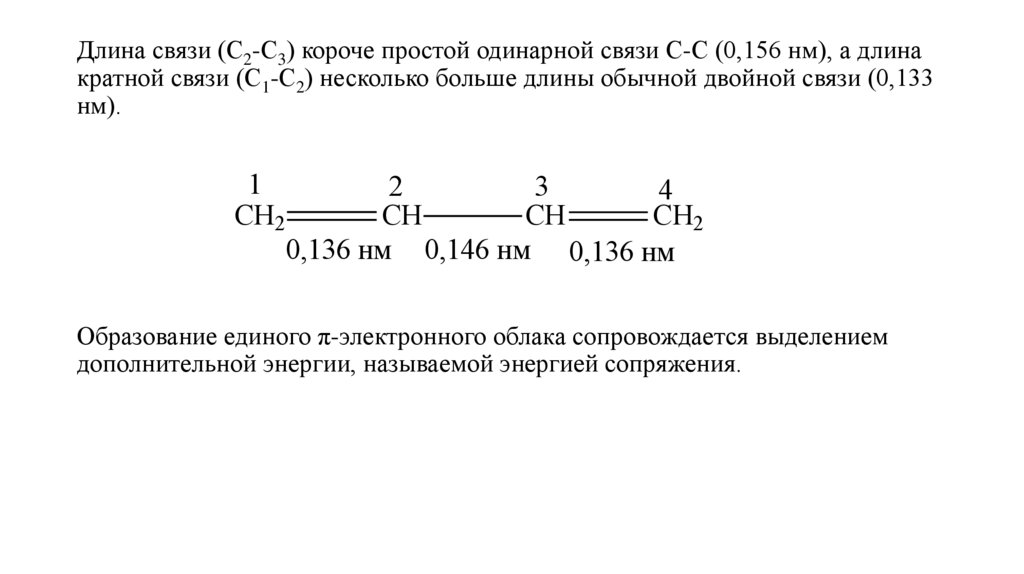
Длина связи (С2-С3) короче простой одинарной связи С-С (0,156 нм), а длинакратной связи (С1-С2) несколько больше длины обычной двойной связи (0,133
нм).
1
СН2
2
3
4
СН
СН
СН2
0,136 нм 0,146 нм 0,136 нм
Образование единого π-электронного облака сопровождается выделением
дополнительной энергии, называемой энергией сопряжения.
22.
Химические свойстваДве π-связи, связанные через σ-связь, связывают своими боковыми облаками и
образуют сопряженную систему. Сопряжение приводит к понижению энергии
молекул по сравнению с системой, когда эти связи были бы не связаны.
Понижение энергии составляет 14,6 кДж/моль, молекула становится прочнее.
В дивиниле возникает неполяризованная сопряженная система.
Под влиянием действия реагентов, π-электронная плотность подвергается
поляризации. Реакционная способность, как в алкенах АЕ и АR. У
сопряженных диеновых углеводородов возникает два направления реакции 1,2
и 1,4.
23.
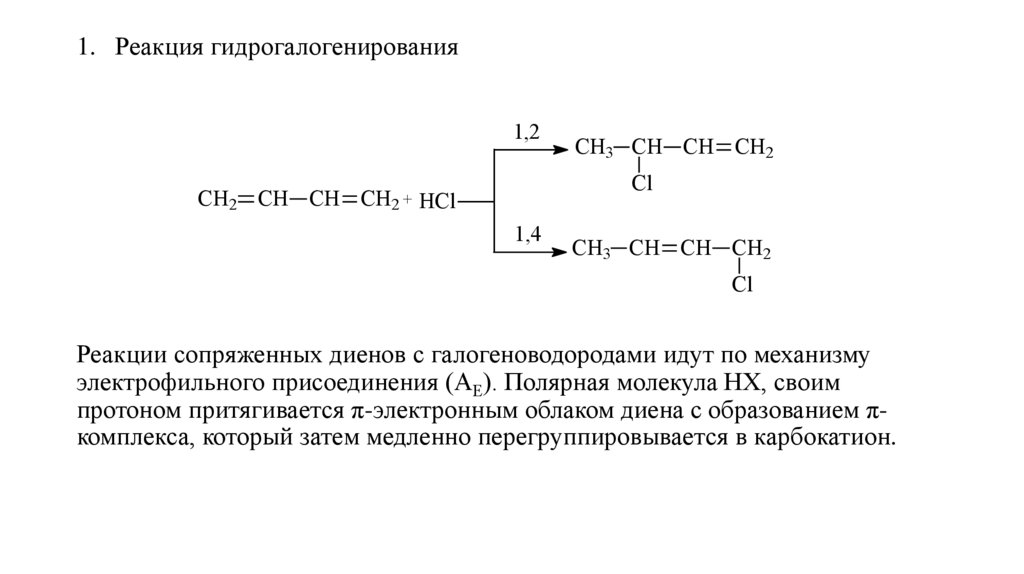
1. Реакция гидрогалогенирования1,2
CH3 CH CH CH2
Cl
СН2 СН СН СН2 + HCl
1,4
CH3 CH CH CH2
Cl
Реакции сопряженных диенов с галогеноводородами идут по механизму
электрофильного присоединения (АЕ). Полярная молекула НХ, своим
протоном притягивается π-электронным облаком диена с образованием πкомплекса, который затем медленно перегруппировывается в карбокатион.
24.
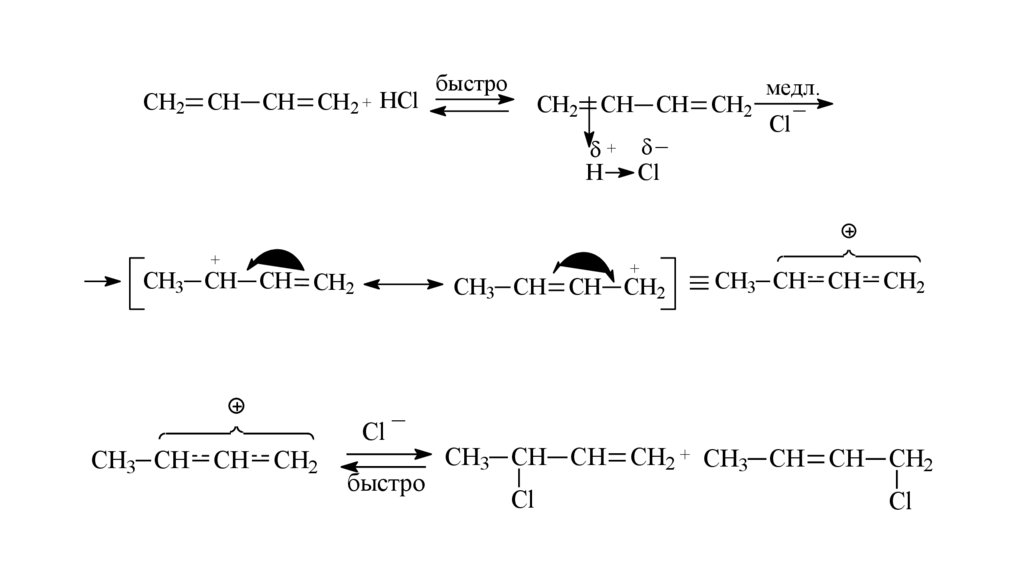
СН2 СН СНСН2 + HCl
быстро
медл.
_
СН2 СН СН СН2
Cl
_
+
H Cl
+
+
CH3 CH CH CH2
CH3 CH CH CH2
Cl
CH3 CH CH CH2
CH3 CH CH CH2
_
быстро
CH3 CH CH CH2 + CH3 CH CH CH2
Cl
Cl
25.
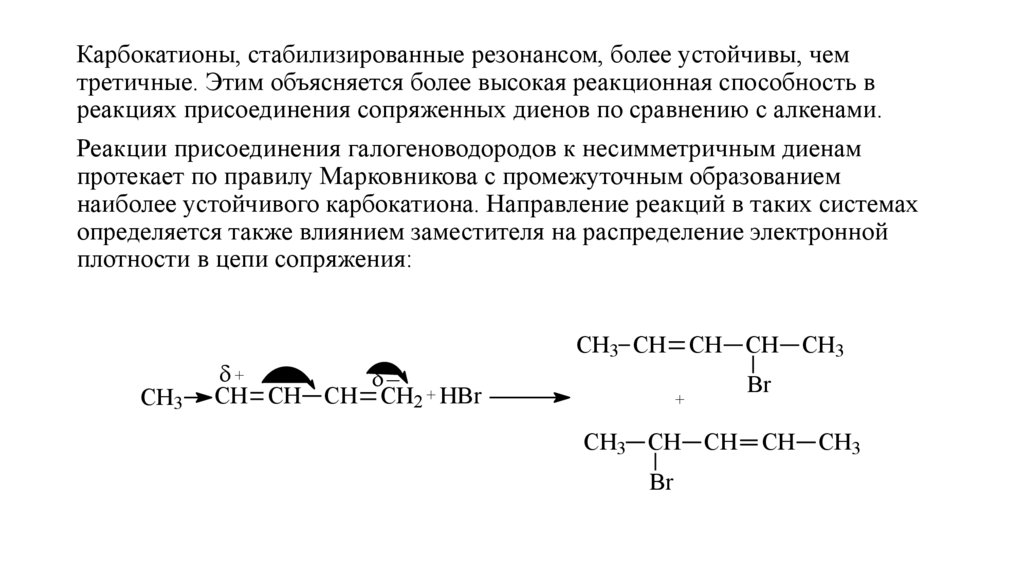
Карбокатионы, стабилизированные резонансом, более устойчивы, чемтретичные. Этим объясняется более высокая реакционная способность в
реакциях присоединения сопряженных диенов по сравнению с алкенами.
Реакции присоединения галогеноводородов к несимметричным диенам
протекает по правилу Марковникова с промежуточным образованием
наиболее устойчивого карбокатиона. Направление реакций в таких системах
определяется также влиянием заместителя на распределение электронной
плотности в цепи сопряжения:
СН3
+
_
СН СН СН СН2 + HBr
CH3 CH CH CH CH3
+
СH3 CH CH
Br
Br
CH CH3
26.
2. Реакция галогенированияРеакции присоединения хлора и брома протекают аналогично реакциям с
галогеноводородами. Соотношение продуктов 1,2 и 1,4-присоединения также
зависит от природы реагентов и условий проведения реакции:
СН2 СН СН СН2 + Cl2
CCl4
СН2 СН СН СН2 + СН2 СН СН СН2
Cl
Cl
Cl
Cl
27.
В присутствии избытка реагента к оставшейся двойной связи в продуктах 1,2 –и 1,4-присоединения может присоединиться еще одна молекула реагента:
СН2 СН СН СН2 + СН2 СН СН СН2+ Cl2
Cl
Cl
Cl
Cl
CCl4
СН2 СН СН СН2
Сl
Cl
Cl
Cl
28.
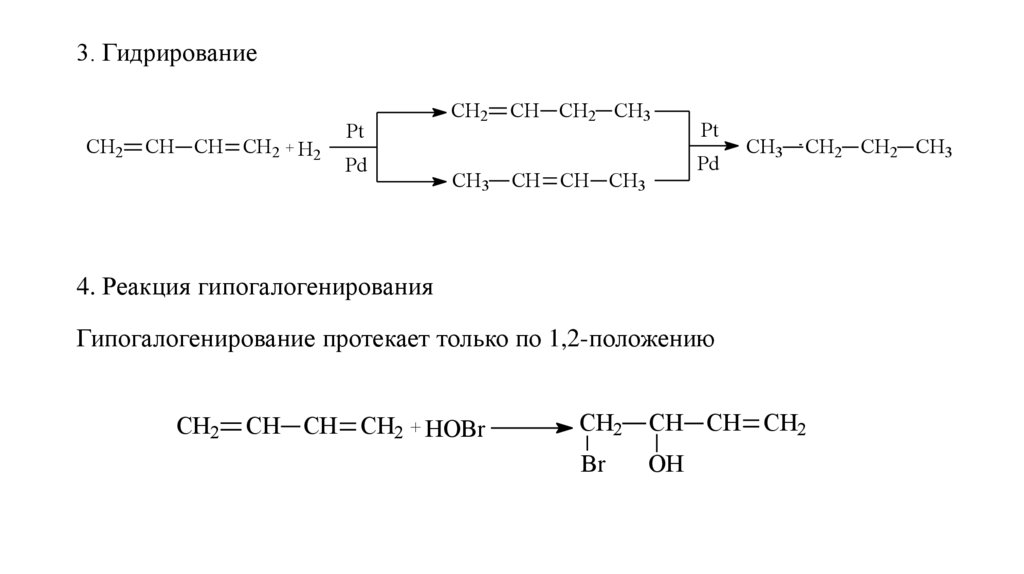
3. ГидрированиеСН2
СН СН СН2 + Н2
Pt
Pd
СН2
СН3
СН СН2 СН3
Pt
Pd
СН СН СН3
СН3
СН2 СН2 СН3
4. Реакция гипогалогенирования
Гипогалогенирование протекает только по 1,2-положению
СН2
СН СН СН2 + HOBr
СН2
СН СН СН2
Br
OH
29.
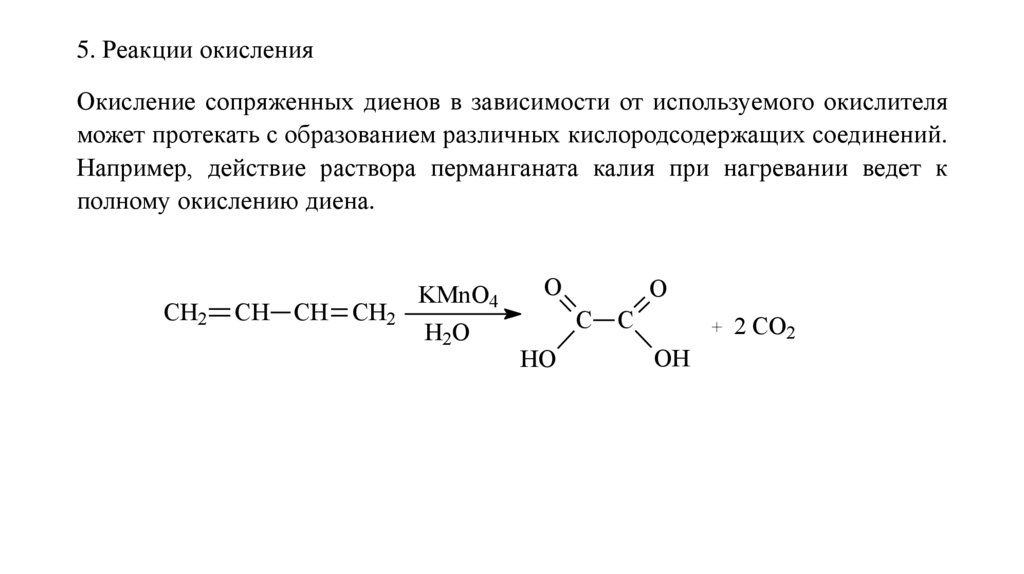
5. Реакции окисленияОкисление сопряженных диенов в зависимости от используемого окислителя
может протекать с образованием различных кислородсодержащих соединений.
Например, действие раствора перманганата калия при нагревании ведет к
полному окислению диена.
СН2
СН СН СН2
KMnO4
H2O
O
O
C C
HO
+ 2 CO2
OH
30.
Окисление диенов с изолированными двойными связями при действииперманганата на холоду ведет к получению соответствующих тетраолов.
CH2
CH CH 2 CH2 CH CH2
р-рKMnO4
CH2
CH CH 2 CH2 CH CH2
ОН
ОН
ОН ОН
гексан-1,2,5,6-тетраол
Озонолиз 1,3-диенов протекает по обычной для алкенов схеме:
СН2
С СН СН2
CH3
O3
O
O
CH3 C C
O
+
H
2 HC
H
31.
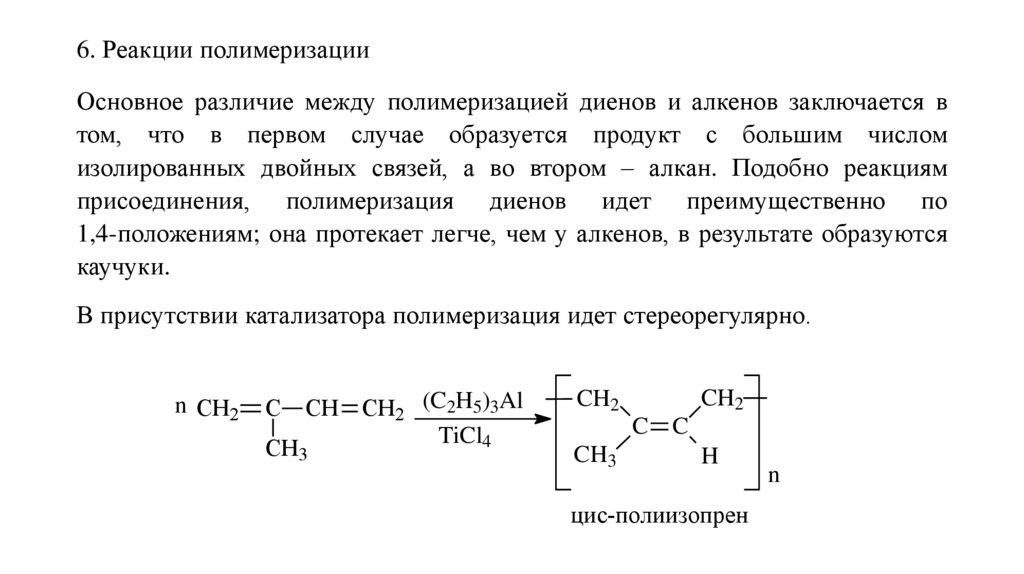
6. Реакции полимеризацииОсновное различие между полимеризацией диенов и алкенов заключается в
том, что в первом случае образуется продукт с большим числом
изолированных двойных связей, а во втором – алкан. Подобно реакциям
присоединения, полимеризация диенов идет преимущественно по
1,4-положениям; она протекает легче, чем у алкенов, в результате образуются
каучуки.
В присутствии катализатора полимеризация идет стереорегулярно.
n СН2
С СН СН2 (C2H5)3Al
TiCl4
СН3
CH2
CH2
C C
CH3
H
цис-полиизопрен
n
32.
Натуральный каучук также имеет строение цис-полиизопрена и представляетсобой липкую эластичную массу. Если эту массу нагреть с серой (около 3%),
то она превращается в прочный эластичный продукт, получивший название
вулканизированного каучука и широко применяемый для изготовления
разнообразных резинотехнических изделий. При вулканизации каучука
происходит поперечная сшивка полимерных цепей.
Синтетический каучук получают полимеризацией дивинила, протекающей в
присутствии металлического натрия:
n СН2 СН СН СН2
Na
CH2 CH CH CH2
n
33.
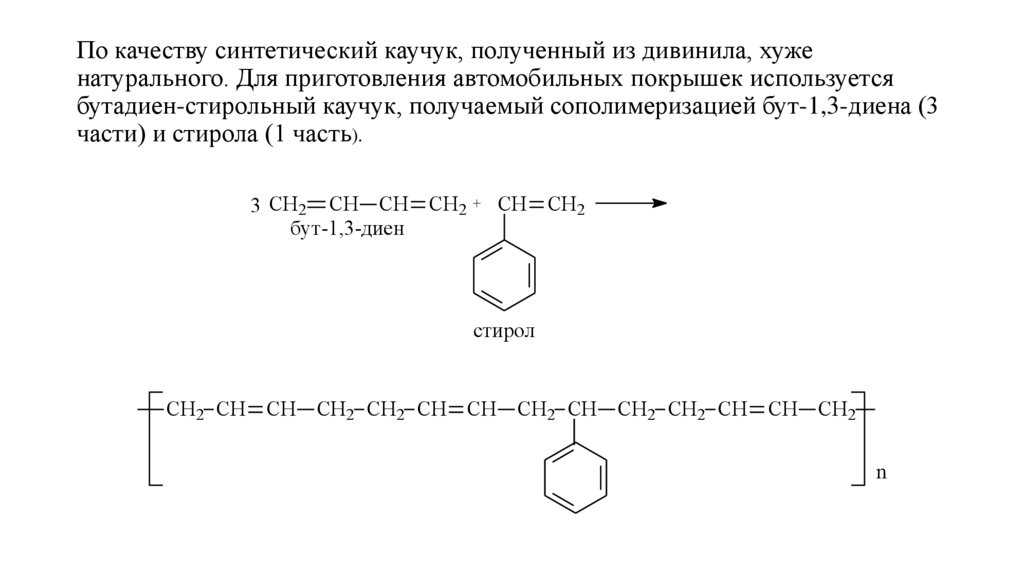
По качеству синтетический каучук, полученный из дивинила, хуженатурального. Для приготовления автомобильных покрышек используется
бутадиен-стирольный каучук, получаемый сополимеризацией бут-1,3-диена (3
части) и стирола (1 часть).
3 CH2 CH CH CH2 + СН СН2
бут-1,3-диен
стирол
СН2 СН СН СН2 СН2 СН СН СН2 СН СН2 СН2 СН СН СН2
n
34.
Биологическая активностьКаучуки находят широкое применение в промышленности: покрышки, камеры
для колес самолетов и автомашин, электроизоляция, медицинские приборы и
т.д.




















 chemistry
chemistry








