Similar presentations:
Природа химической связи Ковалентная химическая связь. Метод молекулярных орбиталей
1.
Общая и неорганическая химияРаздел: Строение вещества
Тема: Природа химической связи
Ковалентная химическая связь.
Метод молекулярных орбиталей
2.
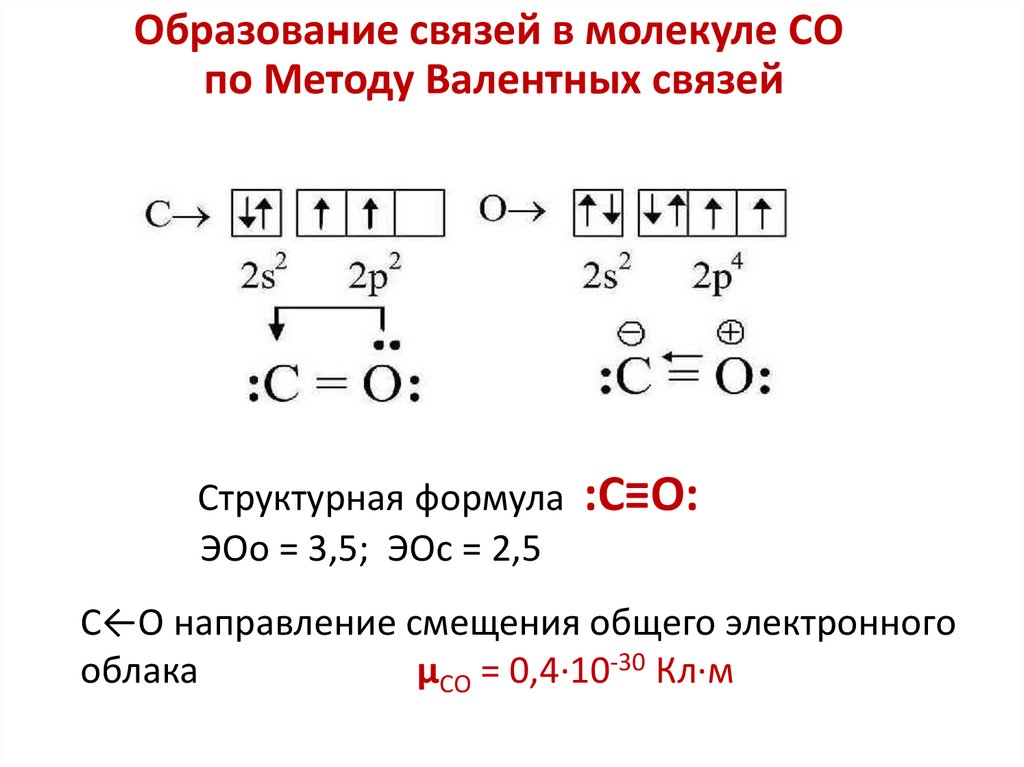
3. Ковалентная химическая связь
Методы описания природы ковалентной связи1.Теория Льюиса – Косселя (построение структурных,
электроно-графических формул молекул и ионов, определение
геометрии по методу ОВЭП )
2.Метод валентных связей (МВС)
(объяснение
насыщаемости ковалентной связи и валентных возможностей
атомов, геометрии молекул, полярности и поляризуемости
молекул)
3.Метод
молекулярных
орбиталей
(ММО)
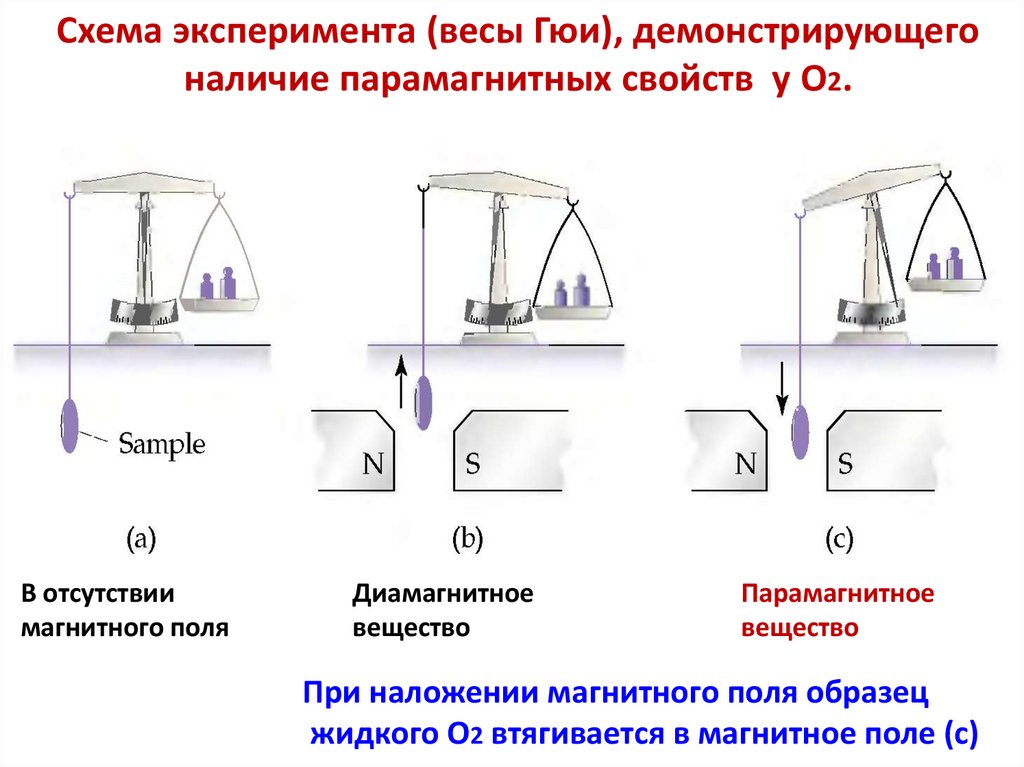
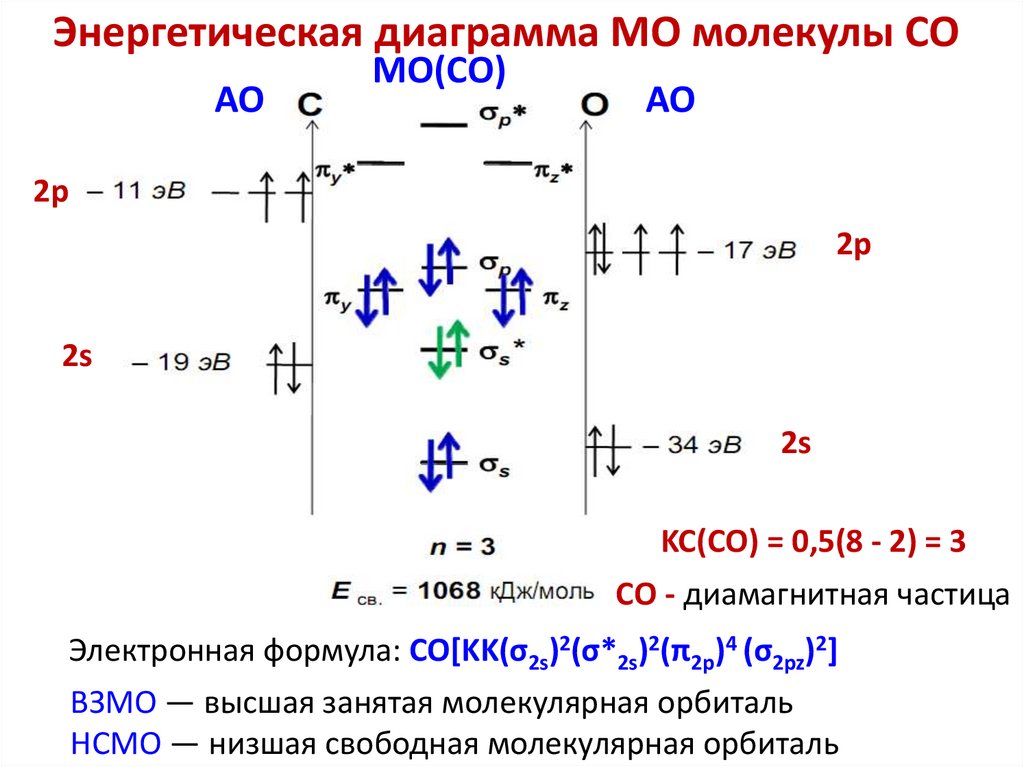
(объяснение устойчивости молекул и ионов, магнитных свойств,
спектральных свойств, окраски молекул и ионов, энергии
ионизации)
МВС и ММО основаны на квантово-механических расчетах и
дополняют друг друга
4. Недостатки метода валентных связей
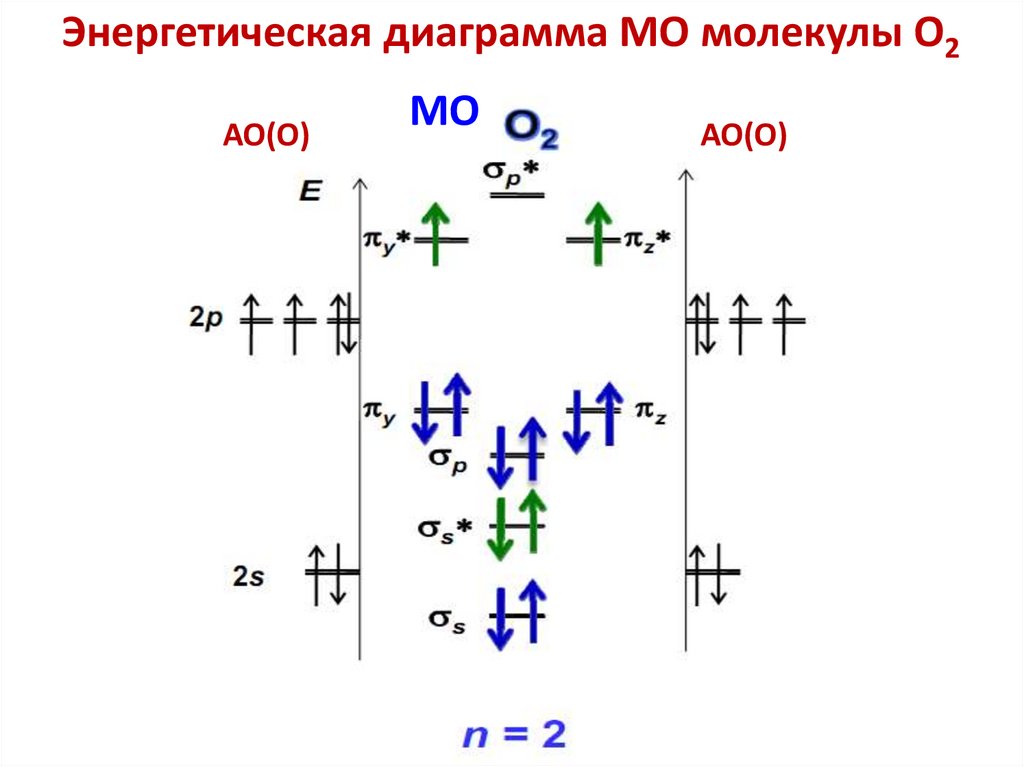
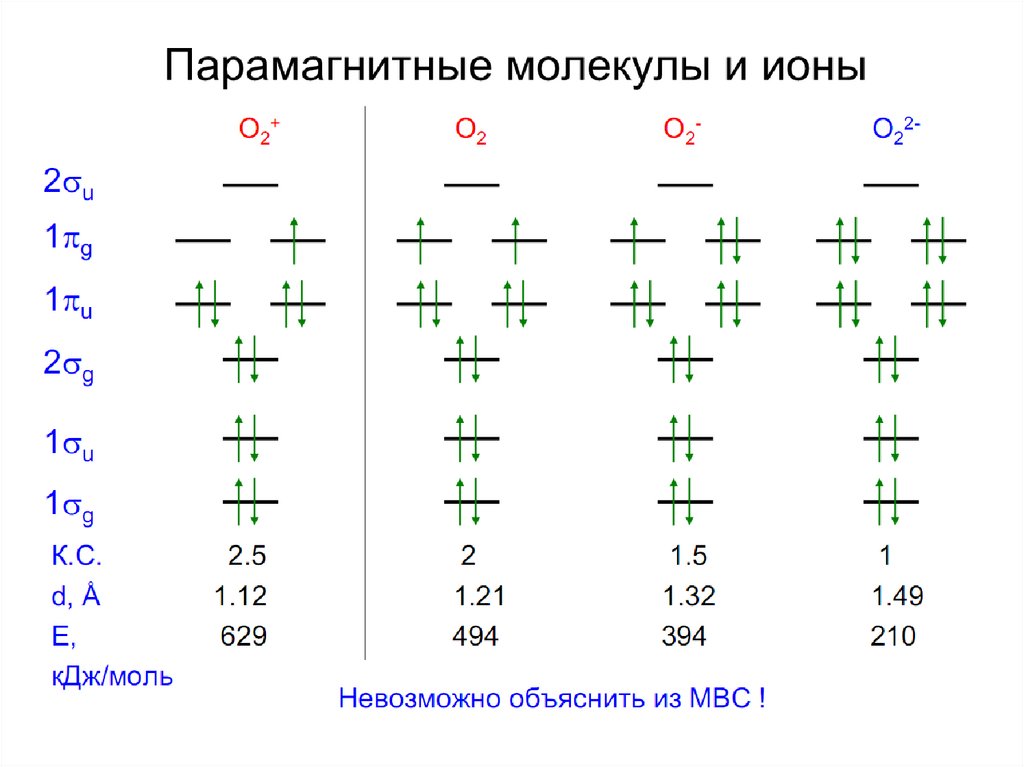
• 1. Не объясняет магнитные свойства молекул,например O2
• 2. Не рассматривается связь, образованная другим
числом электронов (меньше 2)
• 3. Нельзя предсказать и объяснить спектральные
свойства молекул
• 4. Не объясняет образование электронодефицитных и
электроноизбыточных молекул
• 5. Не объясняет, увеличение прочности связи при
отрыве электрона от нейтральной молекулы,
например, O2,, NO.
5.
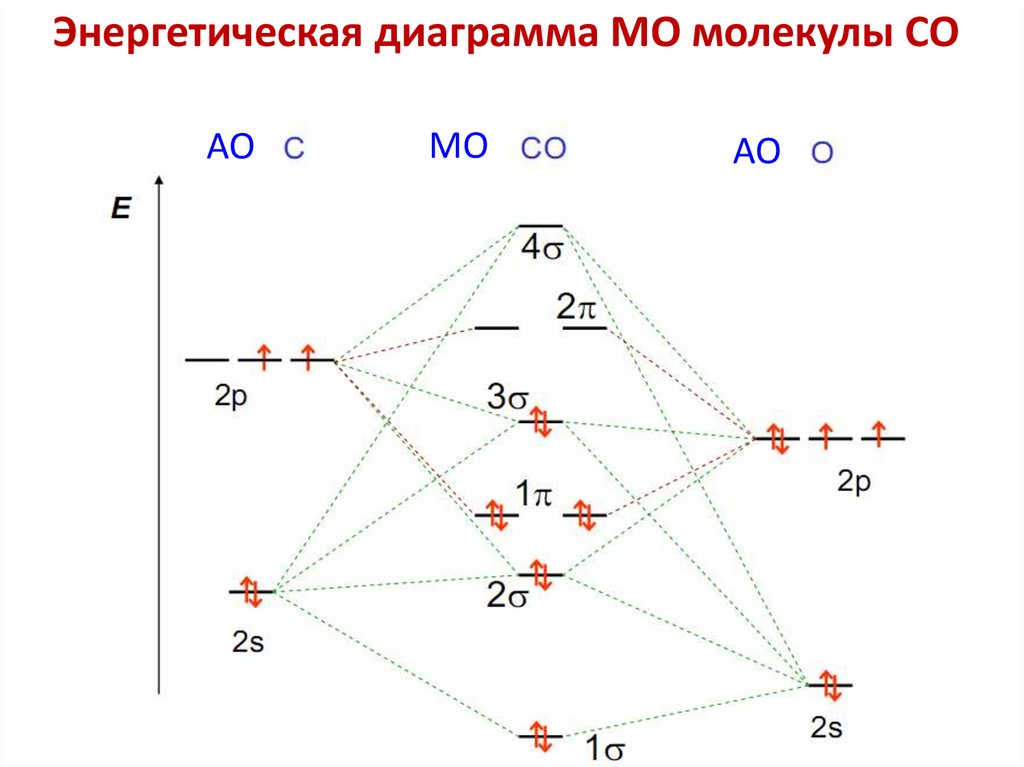
Основные положенияМетода Молекулярных Орбиталей (ММО)
1. Молекула — единая система ядер и электронов,
электроны находятся в общем пользовании всех ядер атомов
молекулы. ММО рассматривает химическую связь как
многоцентровую и многоэлектронную.
2. К молекуле применимы законы квантовой
механики: постулат де Бройля, принцип неопределенности
Гейзенберга, уравнение Шредингера.
3. Уравнение Шредингера имеет точное решение
только для простейшей системы H2+. Для сложных
молекулярных частиц получены только приближенные решения
уравнения Шредингера. Решениями уравнений Шредингера
являются:
ΨМО — волновые функции и Е — энергии электронов.
6.
Основные положенияМетода Молекулярных Орбиталей (ММО)
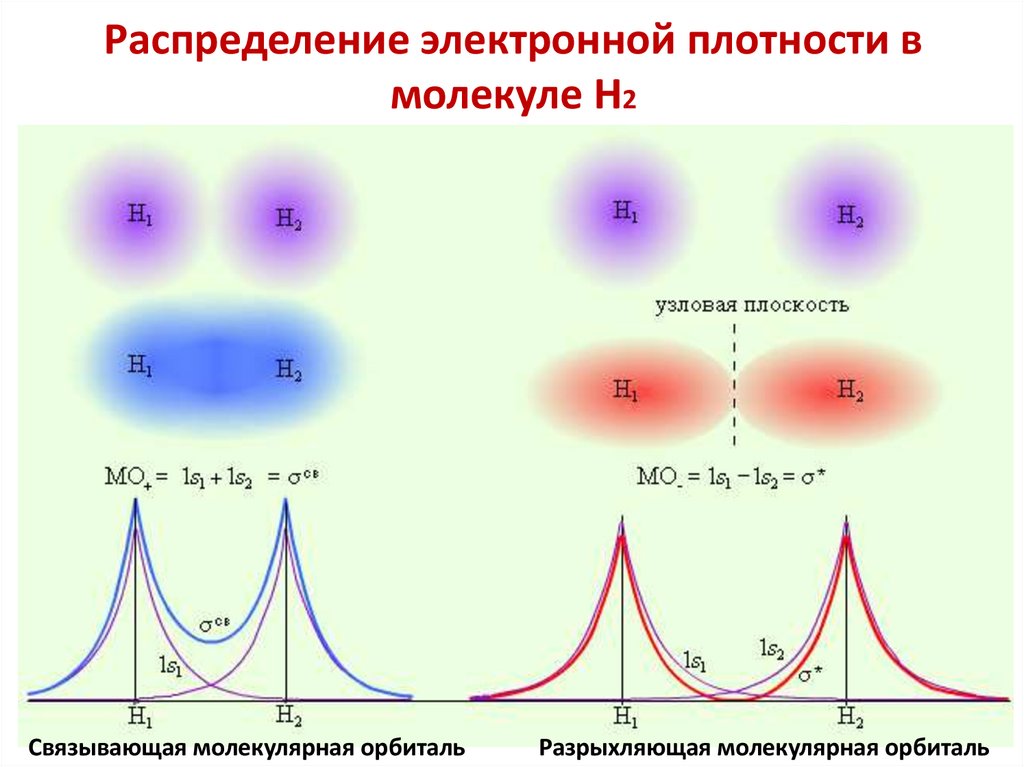
4. ΨМО2 — плотность вероятности нахождения
электрона в точке с координатами (x, y, z).
ΨМО2·dV — вероятность нахождения электрона в
объеме dV.
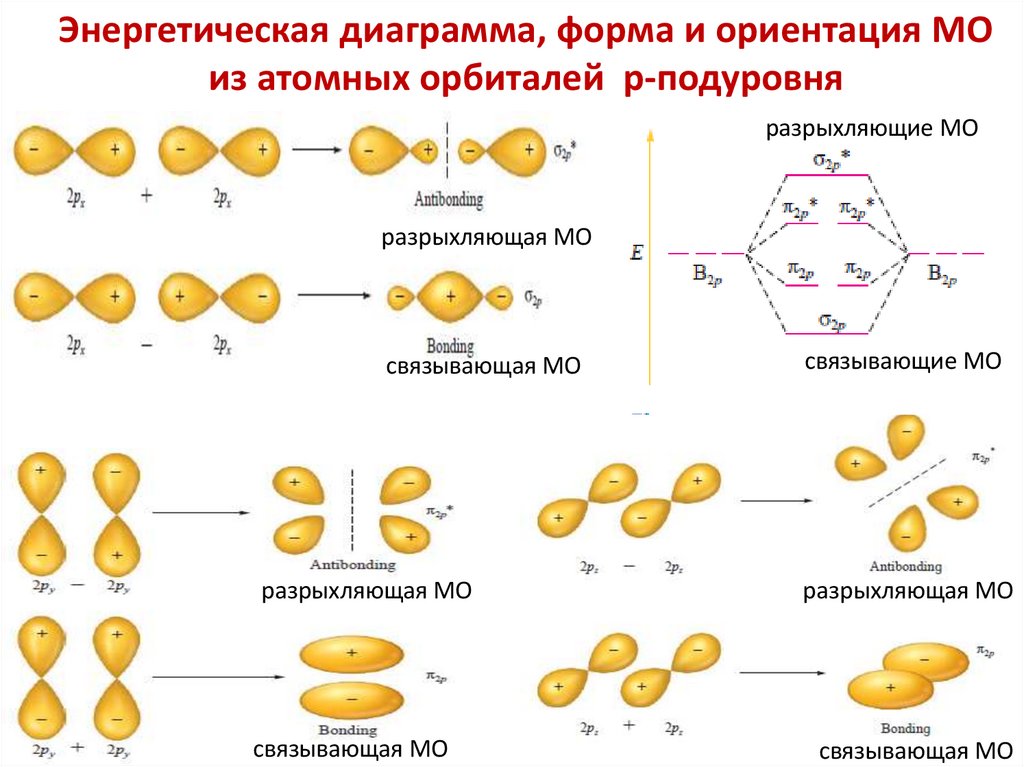
5. Молекулярная орбиталь (МО) — область
пространства вокруг ядер атомов молекулы в которой
вероятность нахождения электрона в данном
энергетическом состоянии составляет не менее 90%.
Молекулярная орбиталь задается волновой функцией ΨМО.
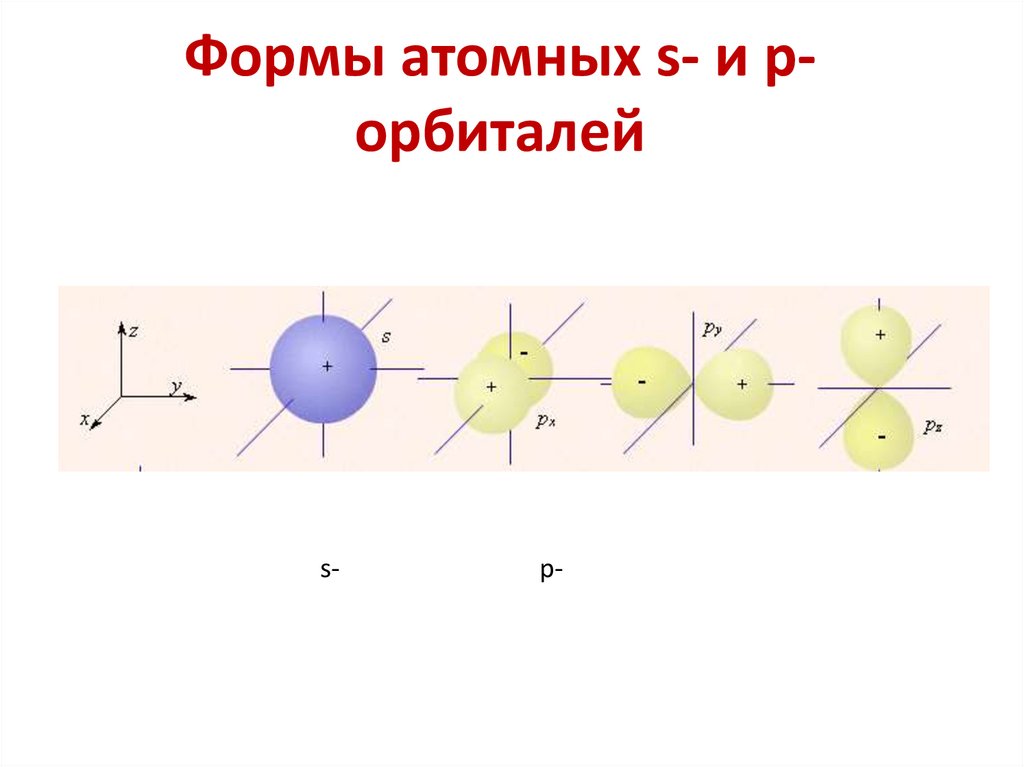
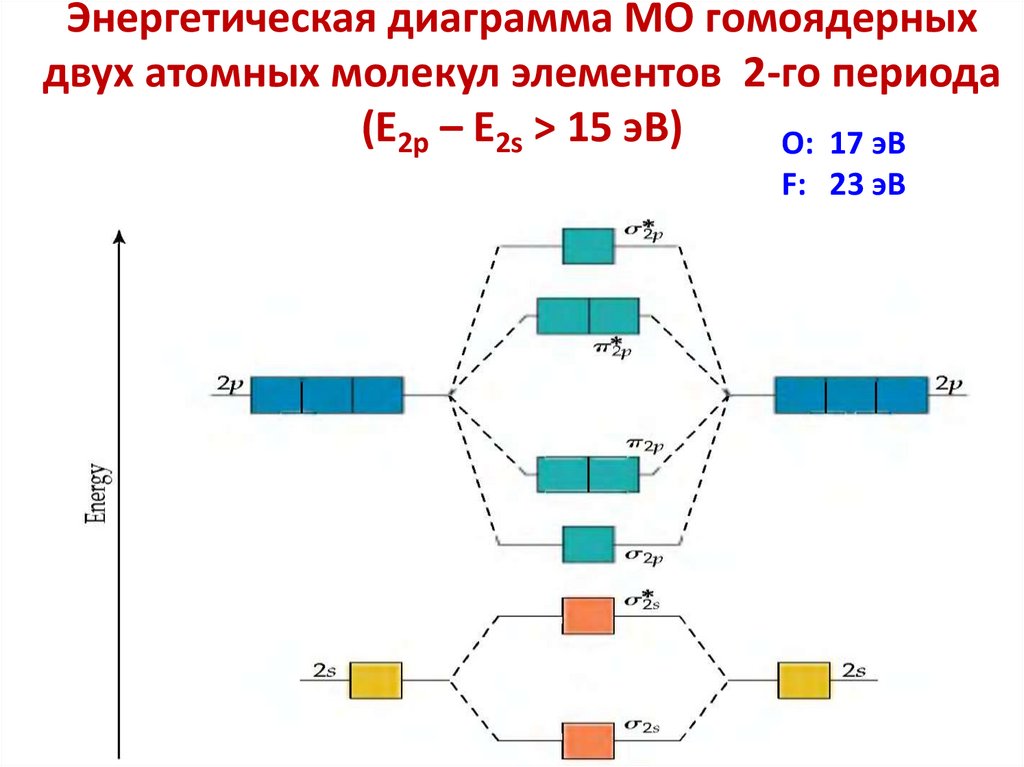
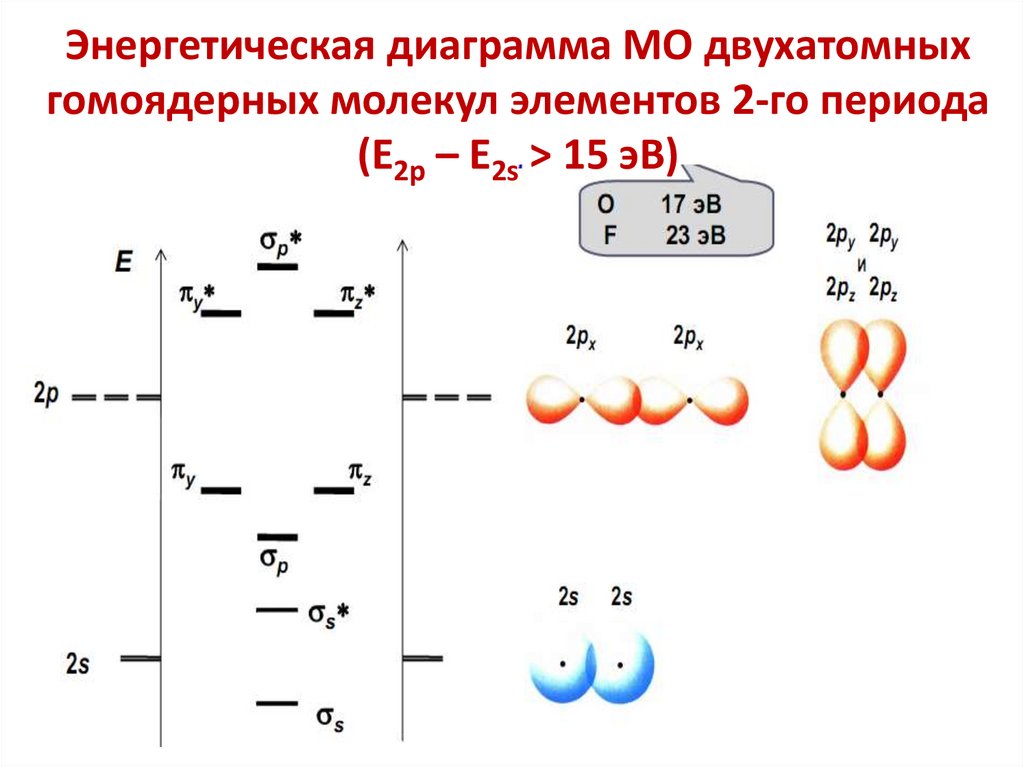
6. Молекулярные орбитали характеризуются
определенной энергией, формой, размерами,
ориентацией в пространстве.
7.
Основные положенияМетода Молекулярных Орбиталей (ММО)
Волновая функция N–электронной системы есть
продукт N одноэлектронных волновых функций
Ядра образуют молекулярный остов.
Электрон движется в поле всех ядер и остальных
электронов.
Молекулярная волновая функция строится из
функций, описывающих поведение отдельных
электронов в поле, создаваемом остальными
электронами и всеми атомными ядрами.
Молекулярные орбитали являются многоцентровыми
орбиталями.
8.
Основные положенияМетода Молекулярных Орбиталей (ММО)
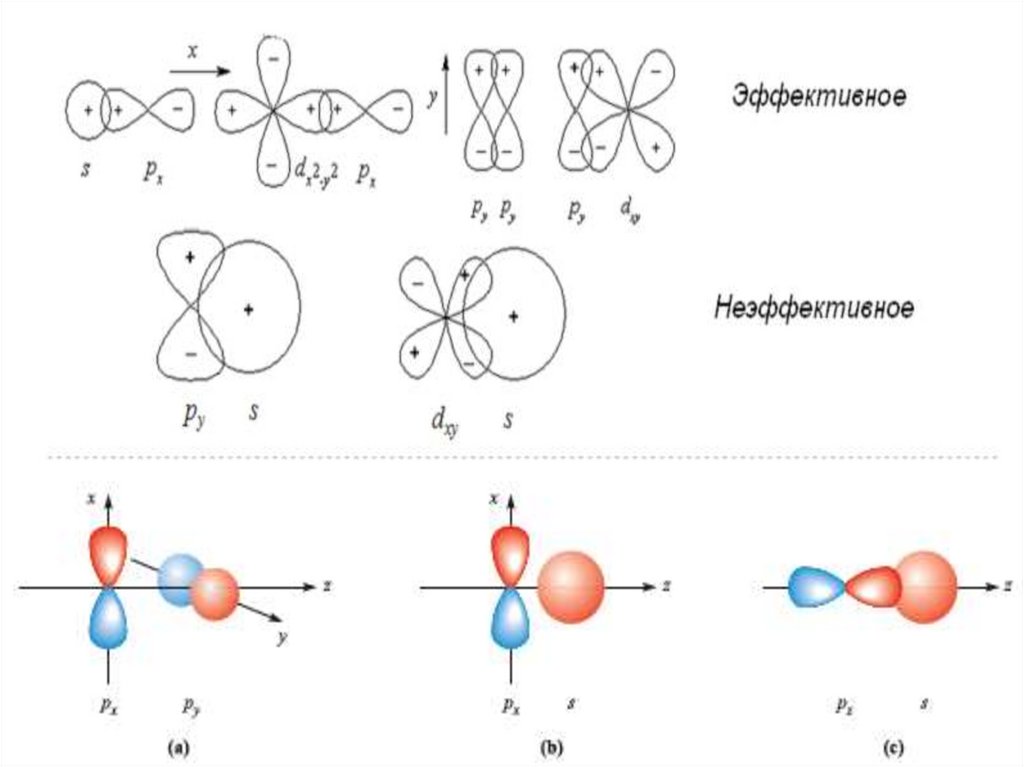
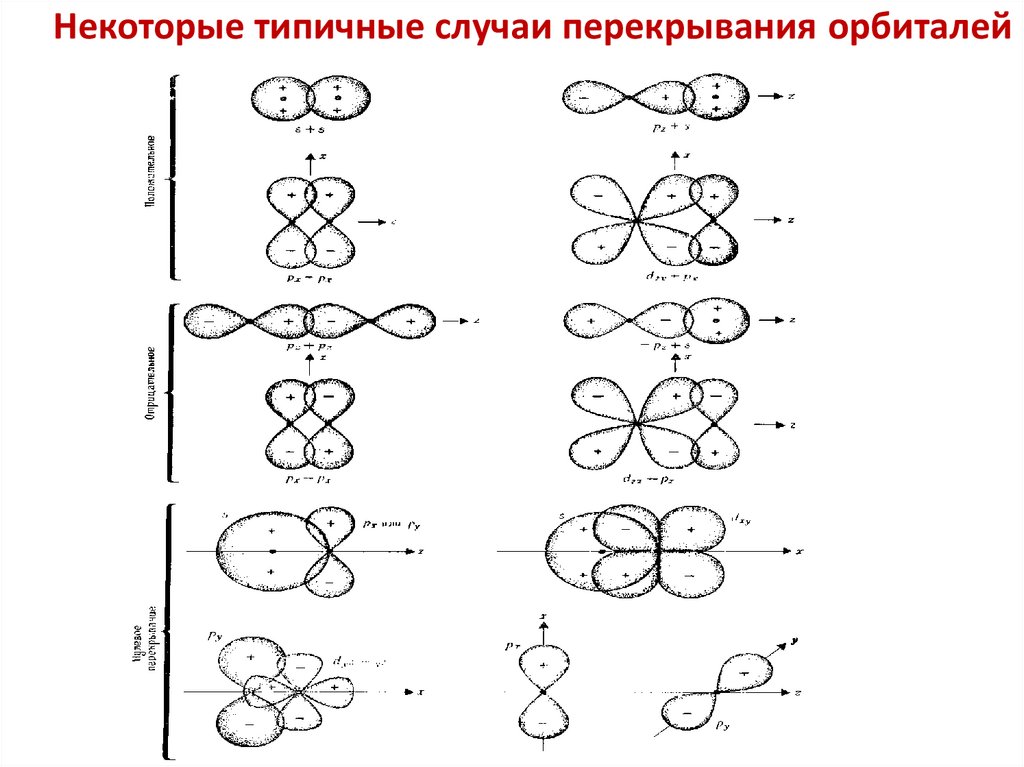
7. Точный расчет волновой функции ΨМО невозможен.
Используют приближенный метод
Линейной Комбинации Атомных Орбиталей: ЛКАО.
Волновую функцию молекулярной орбитали
составляют как линейную комбинацию волновых
функций атомных орбиталей взаимодействующих
атомов:
ΨМО = σ











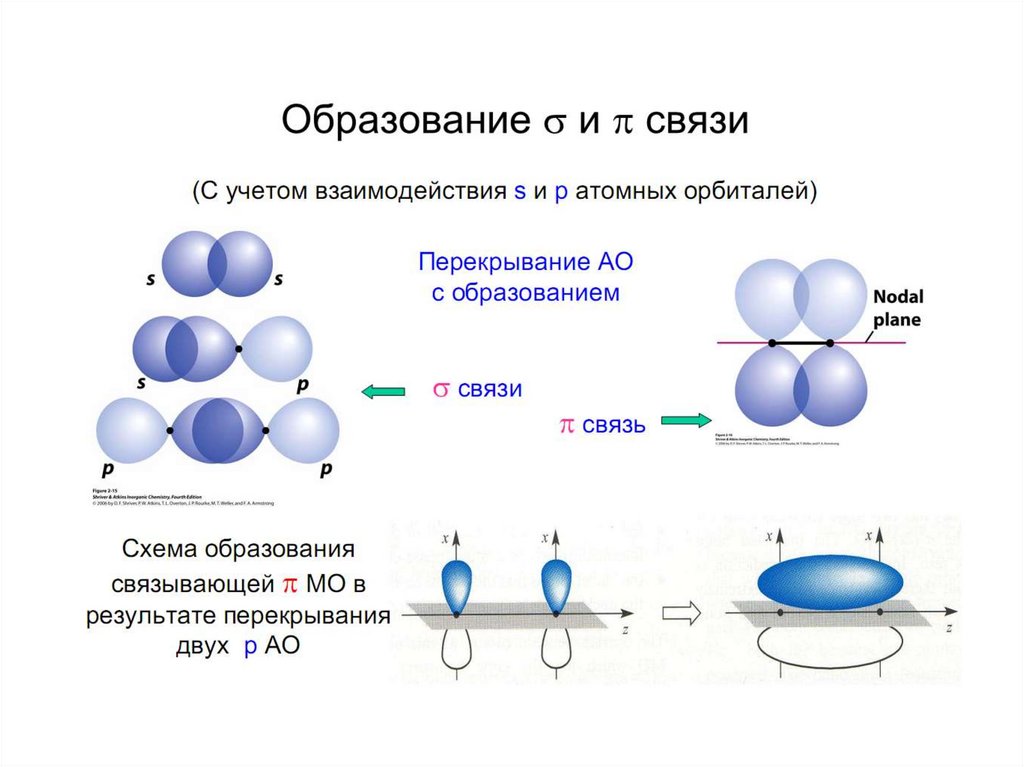
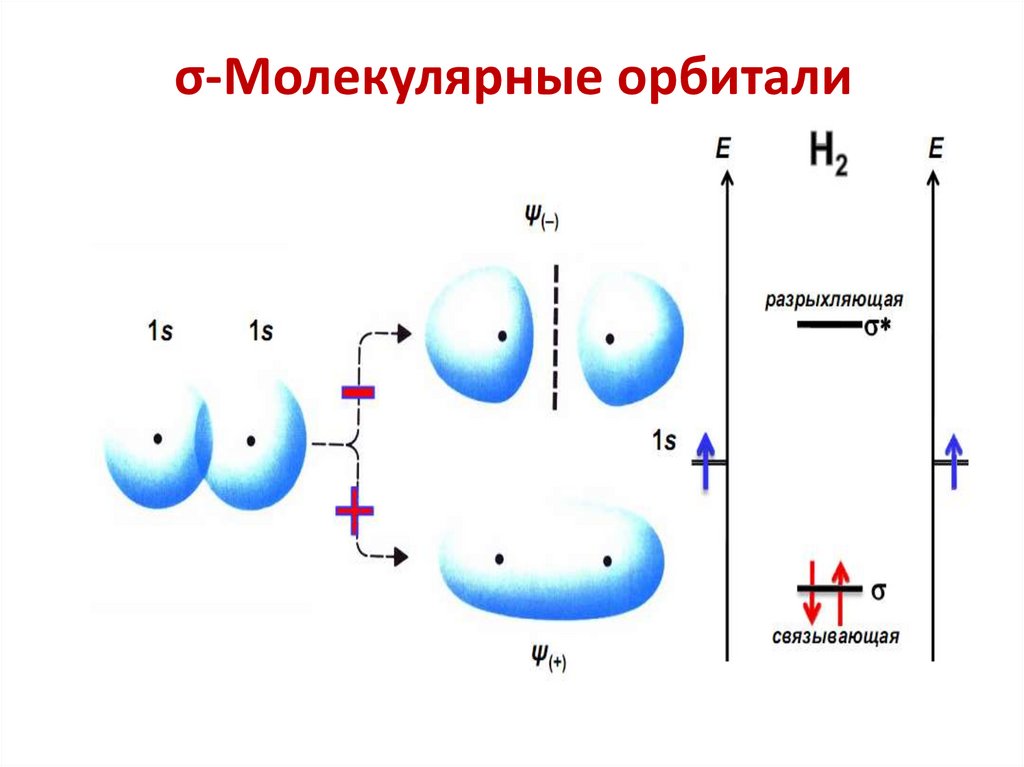
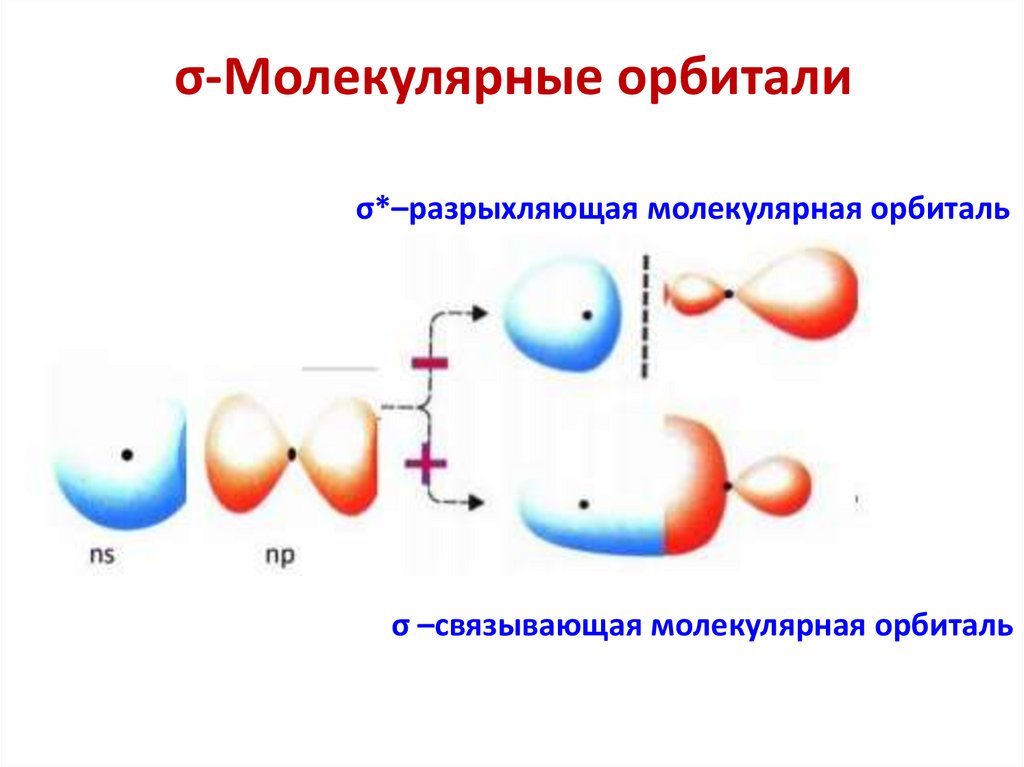
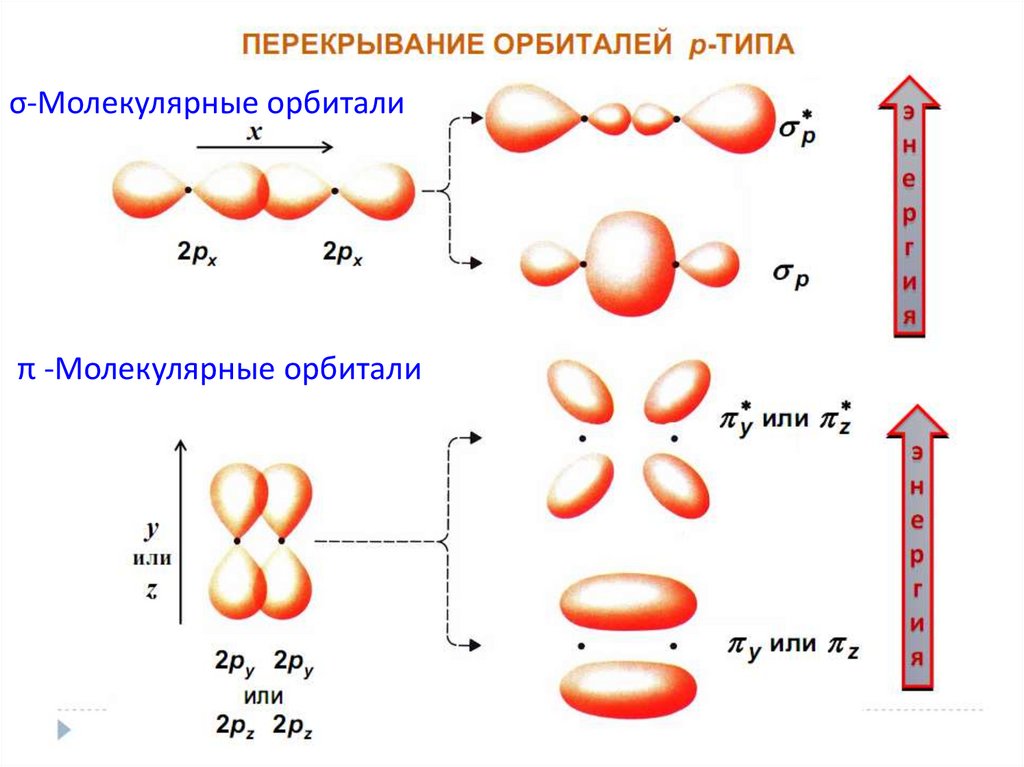







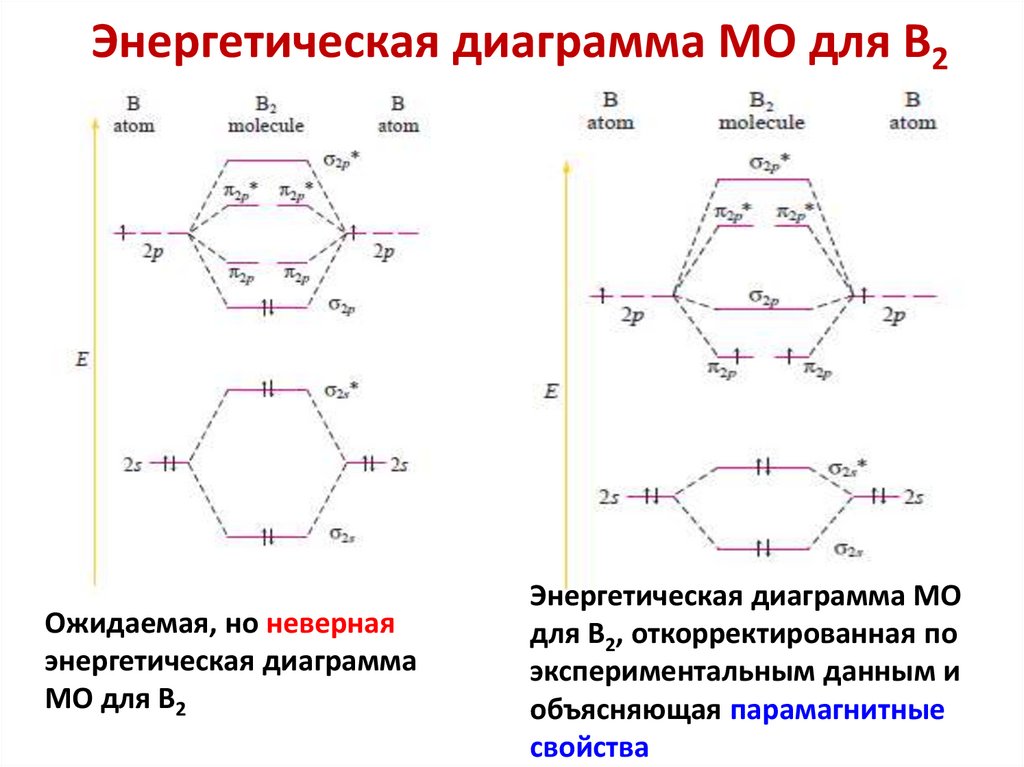
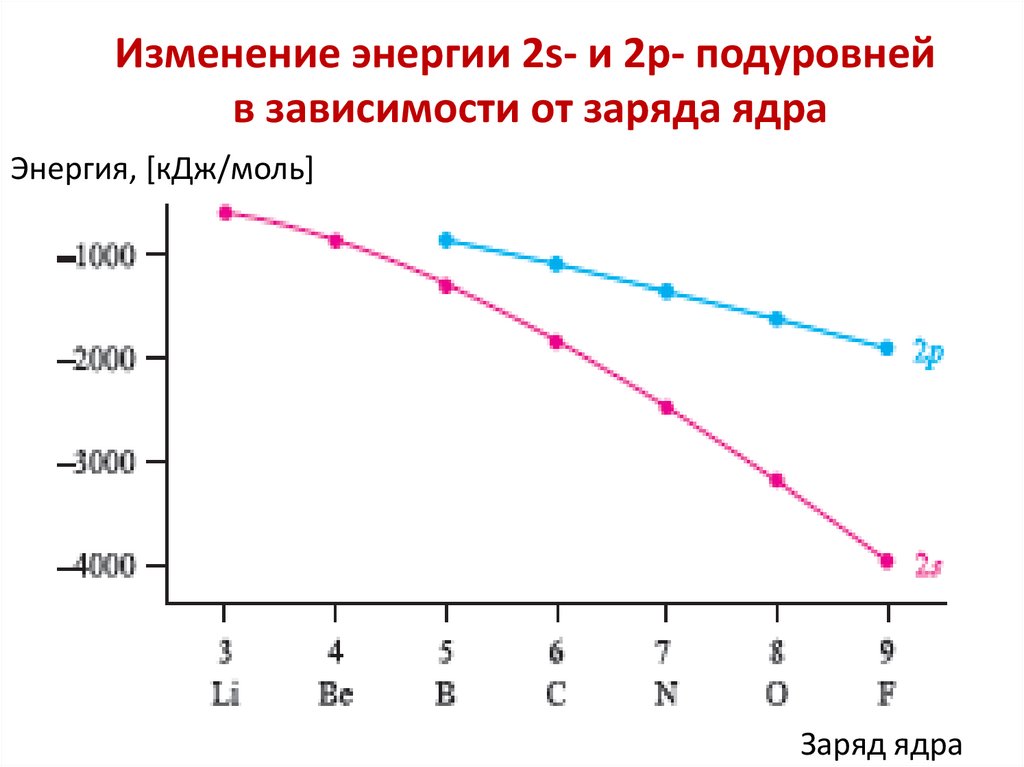
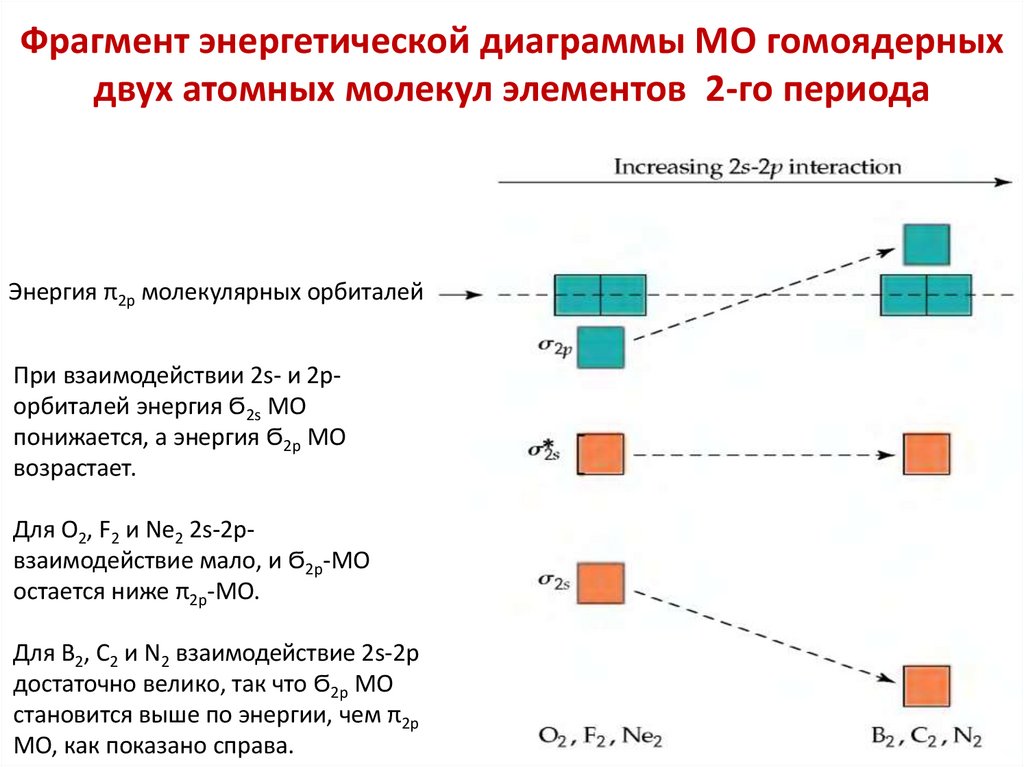
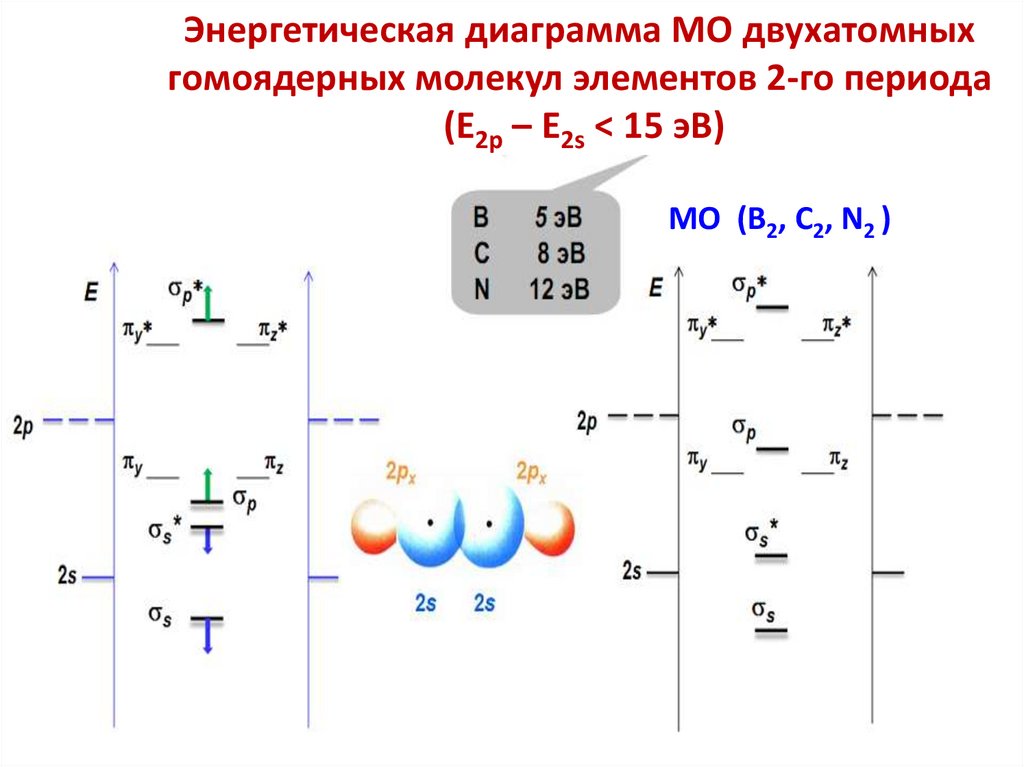

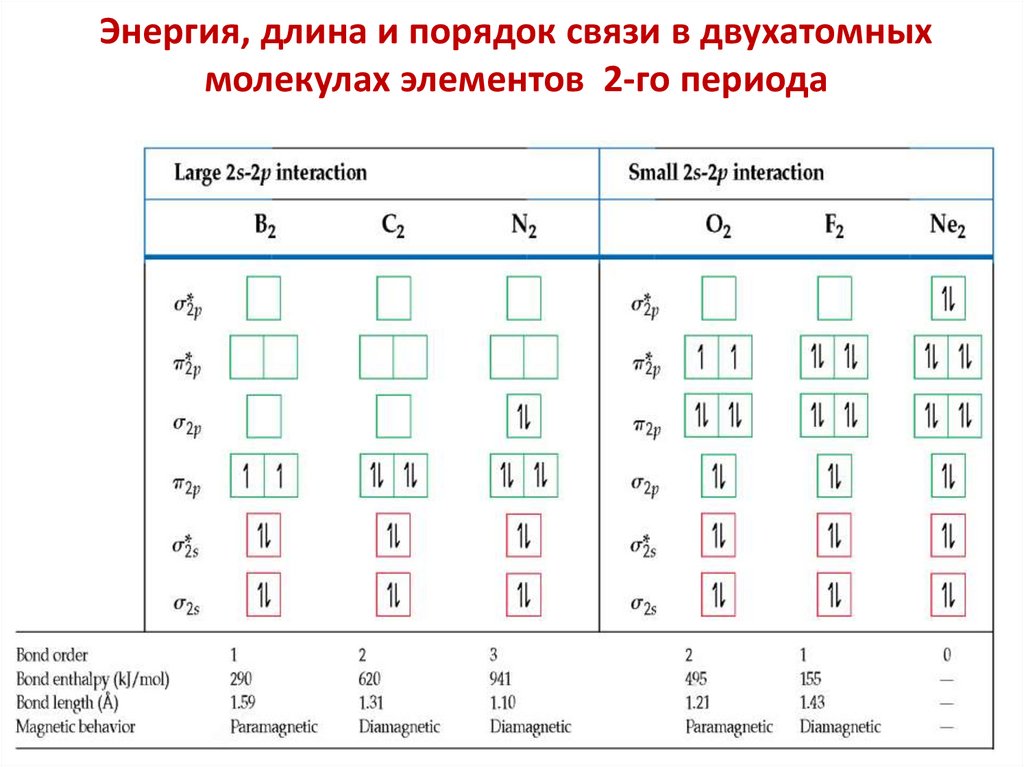
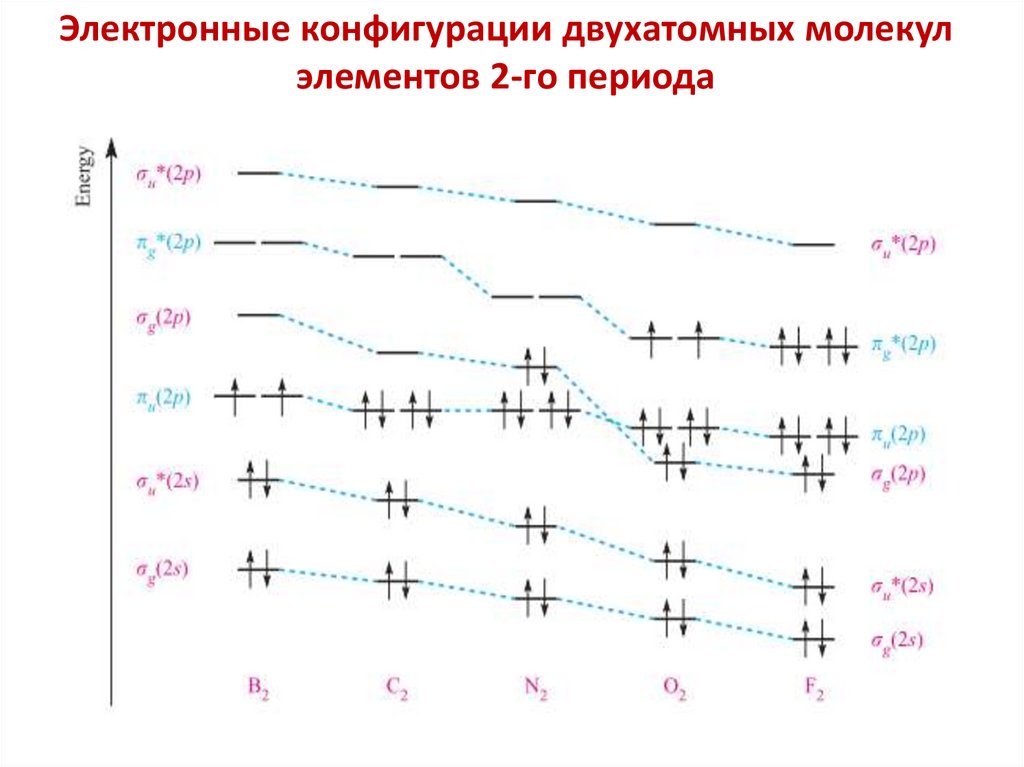
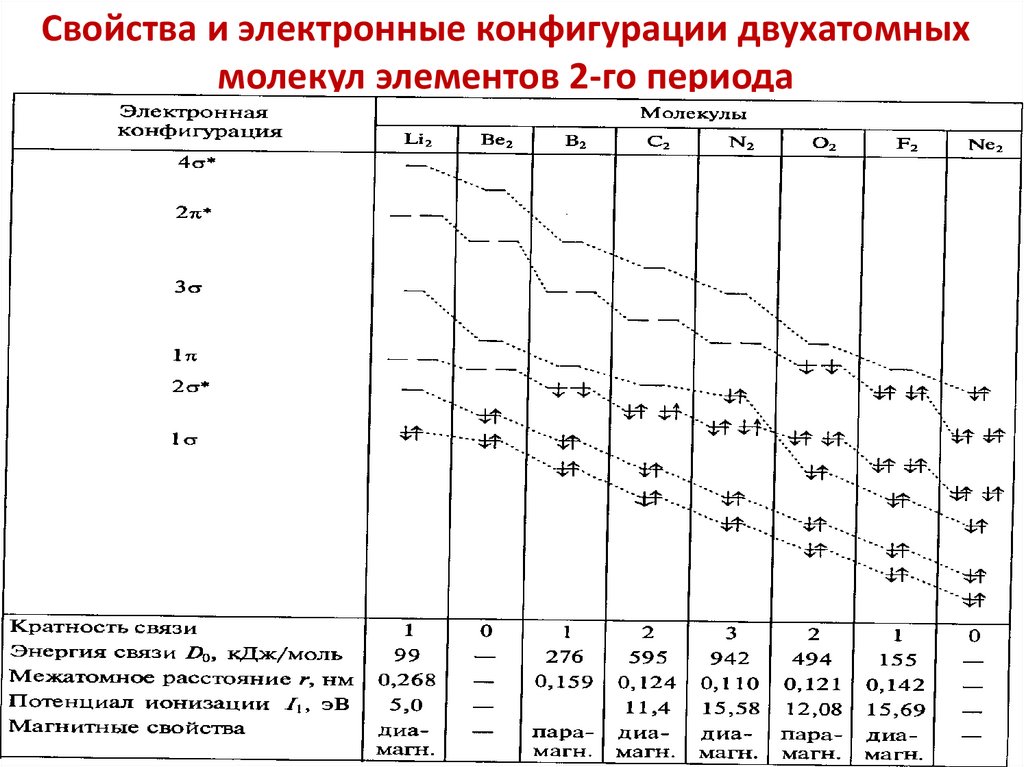
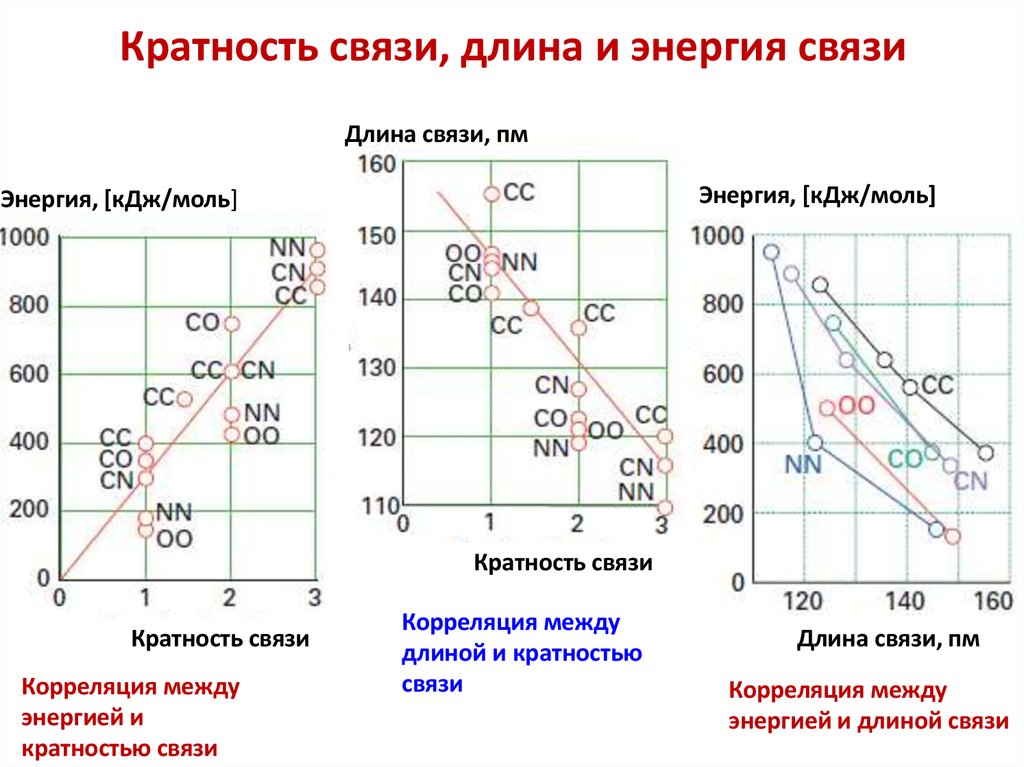
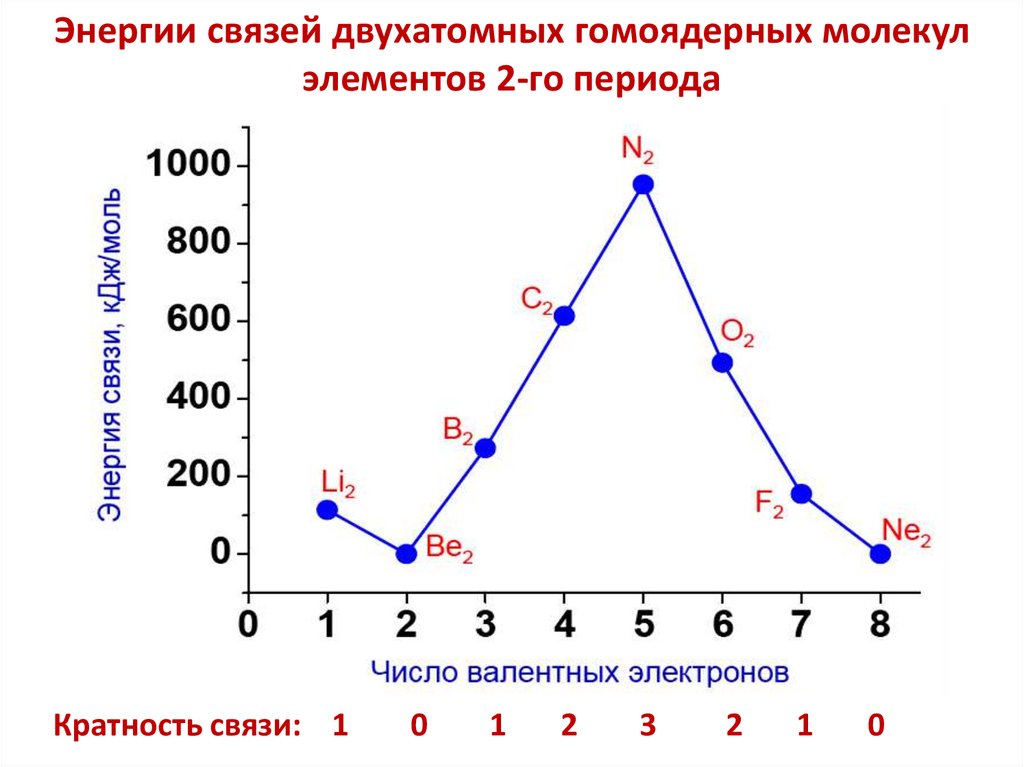

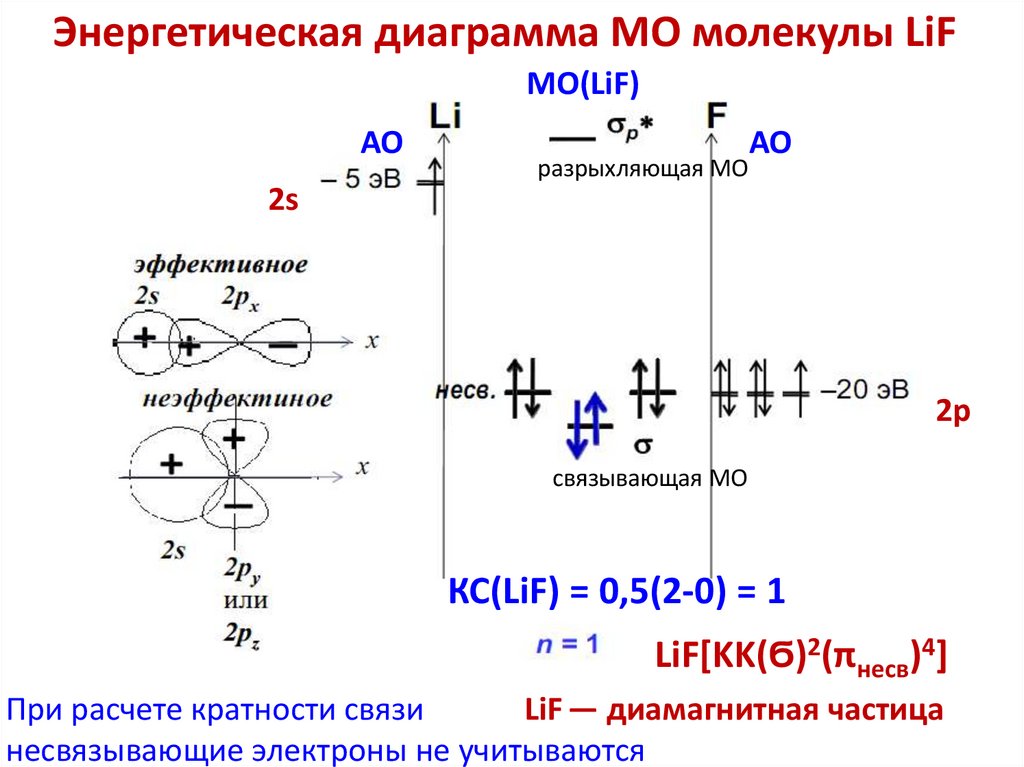
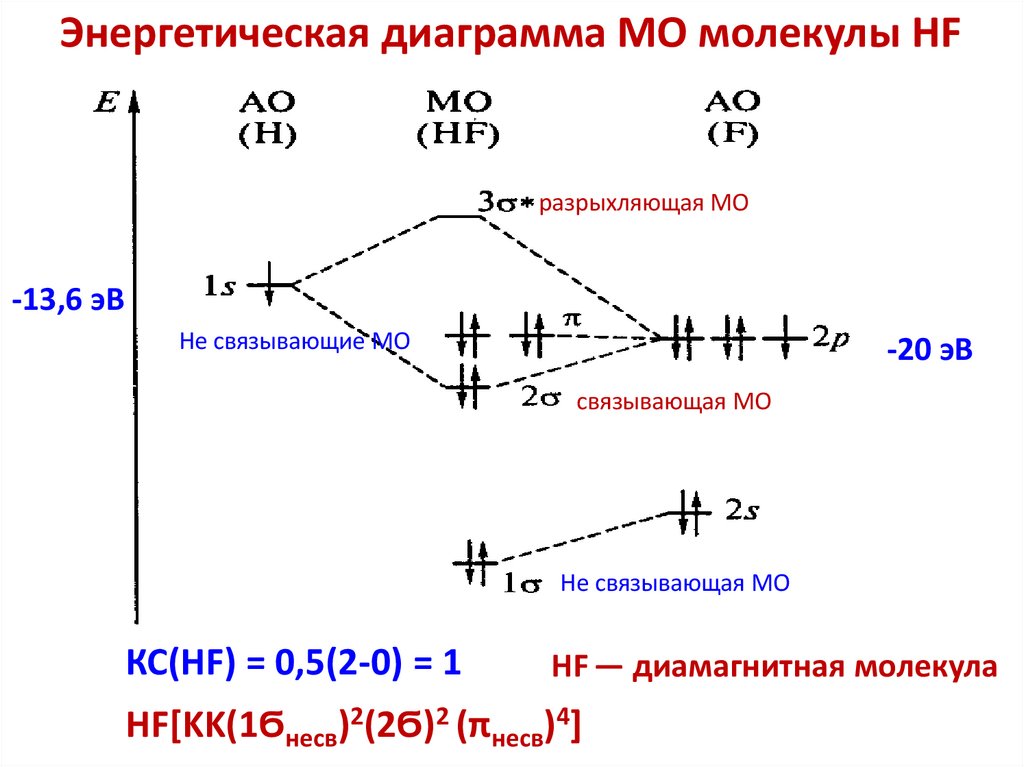
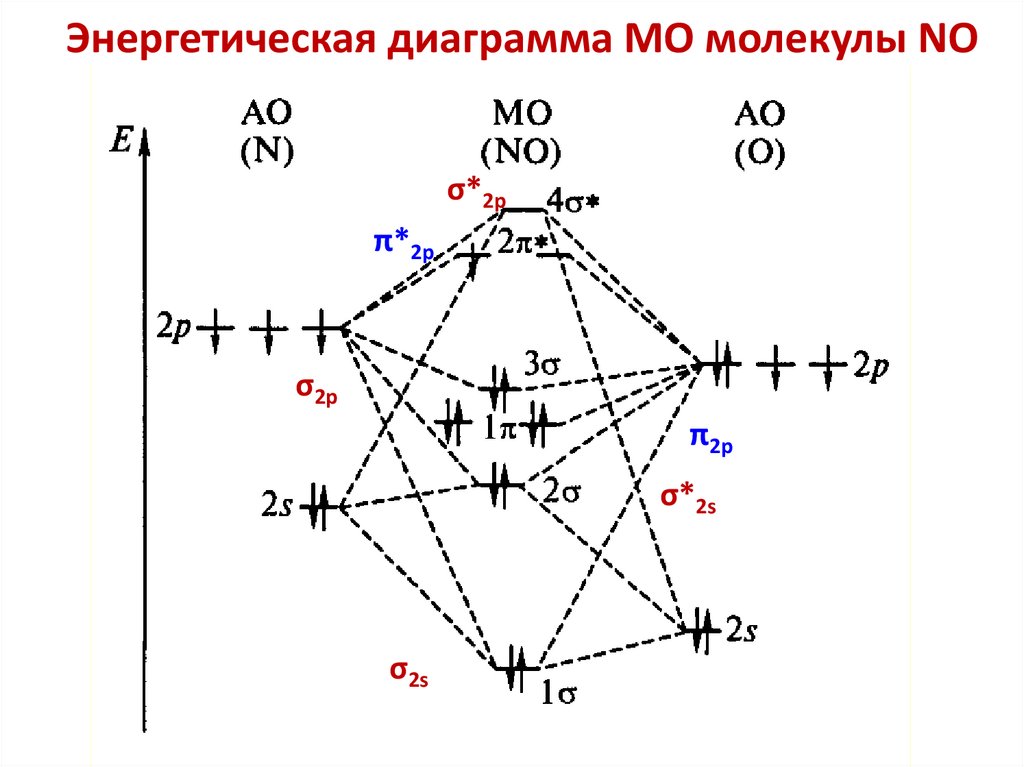


 chemistry
chemistry








