Similar presentations:
Общая характеристика металлов
1. Общая характеристика металлов
I. Положение в ПСХЭ и строениеатомов
Если в периодической таблице провести
воображаемую линию через Бор и Астат, то
слева внизу элементы - все металлы, а справа
вверху - металлы только в длинных строчках.
..\..\..\Инфоурок\Химия 9 класс\Видео\008. Положение металлов в
Периодической системе Д. И. Менделеева и строение их атомов.mp4
2.
Атомы металлов на внешнихэнергетических уровнях содержат в
основном по 1 – 2 электрона, за
исключением:
- по три электрона у алюминия, галлия,
индия, таллия;
- по четыре электрона у германия, олова,
свинца;
- по пять электронов у сурьмы и висмута;
-шесть электронов у полония.
..\..\..\Инфоурок\Химия 8 класс\Видео\013. Металлическая химическая
связь.mp4
о
+
Ме – е → Ме
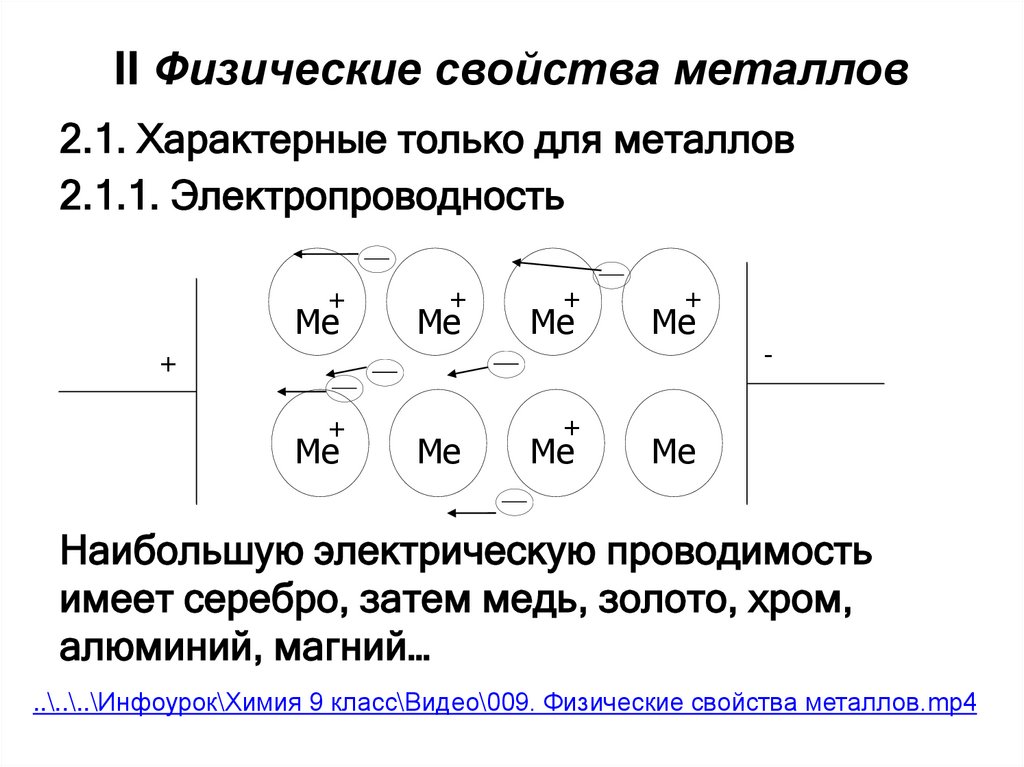
3. II Физические свойства металлов
2.1. Характерные только для металлов2.1.1. Электропроводность
+
Ме
+
Ме
+
Ме
+
Ме
+
+
Ме
Ме
+
Ме
-
Ме
Наибольшую электрическую проводимость
имеет серебро, затем медь, золото, хром,
алюминий, магний…
..\..\..\Инфоурок\Химия 9 класс\Видео\009. Физические свойства металлов.mp4
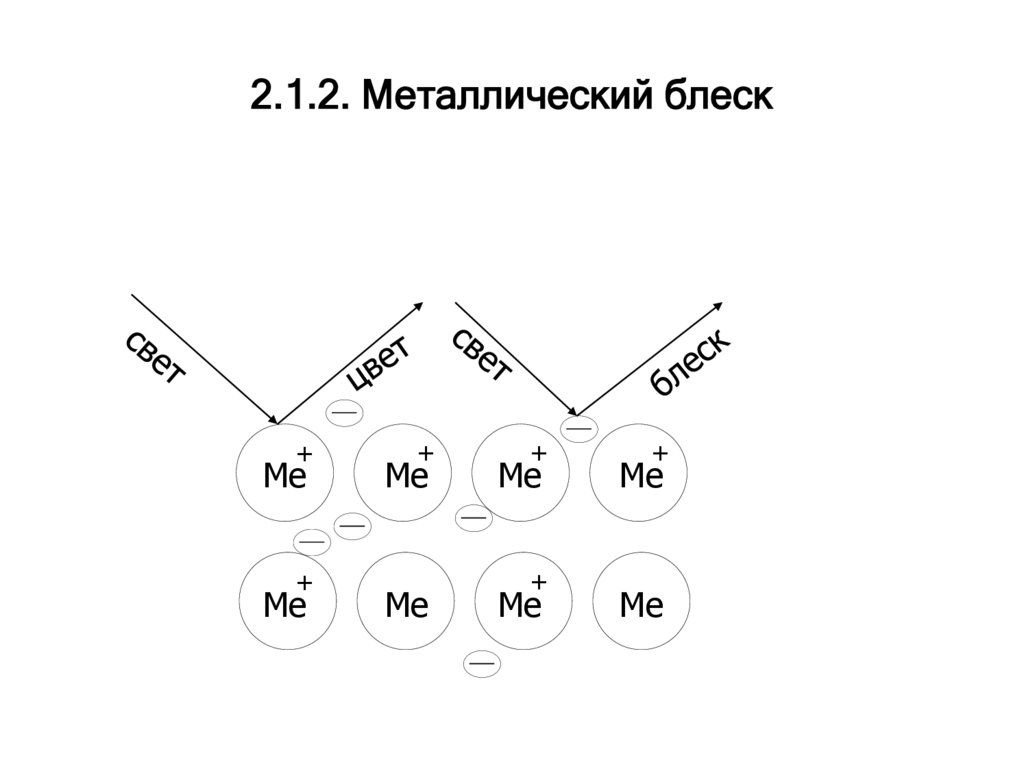
4. 2.1.2. Металлический блеск
+Ме
+
Ме
+
Ме
Ме
+
Ме
+
Ме
+
Ме
Ме
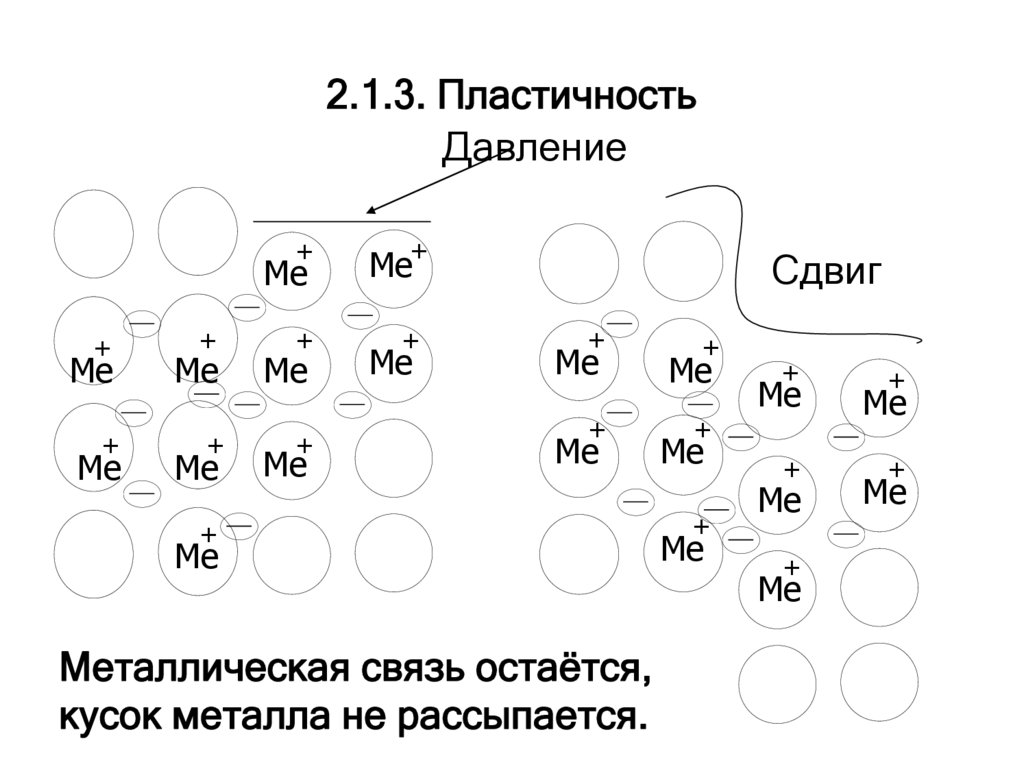
5. 2.1.3. Пластичность
Давление+
+
Ме
Ме
+
+
Ме
Ме
Ме
+
+
+
Ме
Ме
+
+
Ме
Ме
Сдвиг
+
+
Ме
Ме
+
+
Ме
+
Ме
Металлическая связь остаётся,
кусок металла не рассыпается.
Ме
+
Ме
+
+
Ме
Ме
+
+
Ме
+
Ме
Ме
6.
Наибольшей пластичностью, ковкостью итягучестью обладает золото: из него можно
изготовить пластинки толщиной 0,003 мм и
вытягивать в проволоку, невидимую
невооруженным глазом.
В наименьшей степени этими качествами
обладают висмут и марганец
7. 2.2. Характерные для всех веществ
2.2.1. ПлотностьГраница разделения на легкие и тяжелые
металлы – 5 г/см3
Самый легкий металл литий (плотность 0,53 г/см3),
Cамый тяжелый осмий (плотность 22,5г/см3)
8. 2.2.2. Температуры плавления
Граница разделения на легкоплавкие итугоплавкие металлы 3500С.
Самый легкоплавкий из твердых при н.у.
цезий tпл(Cs) = 28°С,
самый тугоплавкий – вольфрам
tпл(W)= 3380°С,
единственный жидкий металл при н.у.
ртуть tпл(Hg) = -390C.
9. 2.2.3. Цвет
В технике металлы делят на группы:черные (железо, хром, марганец и их
сплавы),
цветные - все остальные
..\..\..\Инфоурок\Химия 9 класс\Видео\007. Металлы. Век медный,
бронзовый, железный.mp4
10. III Химические свойства металлов
г) с серой:Fe + S = FeS
2Аl + 3S = Al2S3
д) с углеродом:
4Аl + ЗС = Аl4С3
Са + 2С = СаС2
е) с фосфором:
3Li + P = Li3P
3Zn + 2Р = Zn3P2
ж) с водородом:
2Li + Н2 = 2LiH
Са + Н2 = СаН2
з) с кремнием:
2Mg + Si = Mg2Si
..\..\..\Инфоурок\Химия 9 класс\Видео\011.. Химические свойства металлов.mp4
3.1. Отношение к
неметаллам
а) с кислородом:
4Li + O2 = 2Li2O
2Mg + O2 = 2MgO
б) с галогенами:
2Na + Br2 = 2NaBr
2Fe + 3Cl2 = 2FeCl3
в) с азотом:
ЗВа + N2 = Ba3N2
6Na + N2 = 2Na3N
11.
3.2. Отношение к сложным веществама) в ряду напряжений металлов каждый
предыдущий вытесняет из растворов
солей все последующие:
Fe + CuSO4 = FeSO4 + Cu↓
б) металлы в ряду до водорода вытесняют
его из разбавленных кислот (кроме
азотной):
2НСl + Ва = ВаСl2 + Н2↑
H2SO4 (разб.) + Zn = ZnSO4 + H2↑
12.
Кислоты-окислители(концентрированная серная H2SО4,
и азотная HNО3 любой концентрации)
при взаимодействии с металлами водород
не вытесняют:
Сu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
8Na + 5H2SO4(конц.) = 4Na2SO4 + H2S + 4Н2O
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
ЗCu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
4Zn + 10HNO3(очень разб.) = 4Zn(NO3)2 + NH4NO3+
+ 3H2O
13.
в) щелочные и щелочноземельные металлывытесняют водород из воды:
2Na + 2Н2O = 2NaOH + Н2↑
другие металлы вытесняют его при высокой
температуре:
3Fe + 4Н2O = Fe3O4 + 4Н2↑
г) со щелочами:
2Аl + 2NaOH + 2Н2O = 2NaAlO2 + ЗН2↑
алюминат натрия
Zn + 2NaOH = Na2ZnO2 + H2↑
цинкат натрия










 chemistry
chemistry








