Similar presentations:
Общая характеристика металлов
1. Общая характеристика металлов
2.
3.
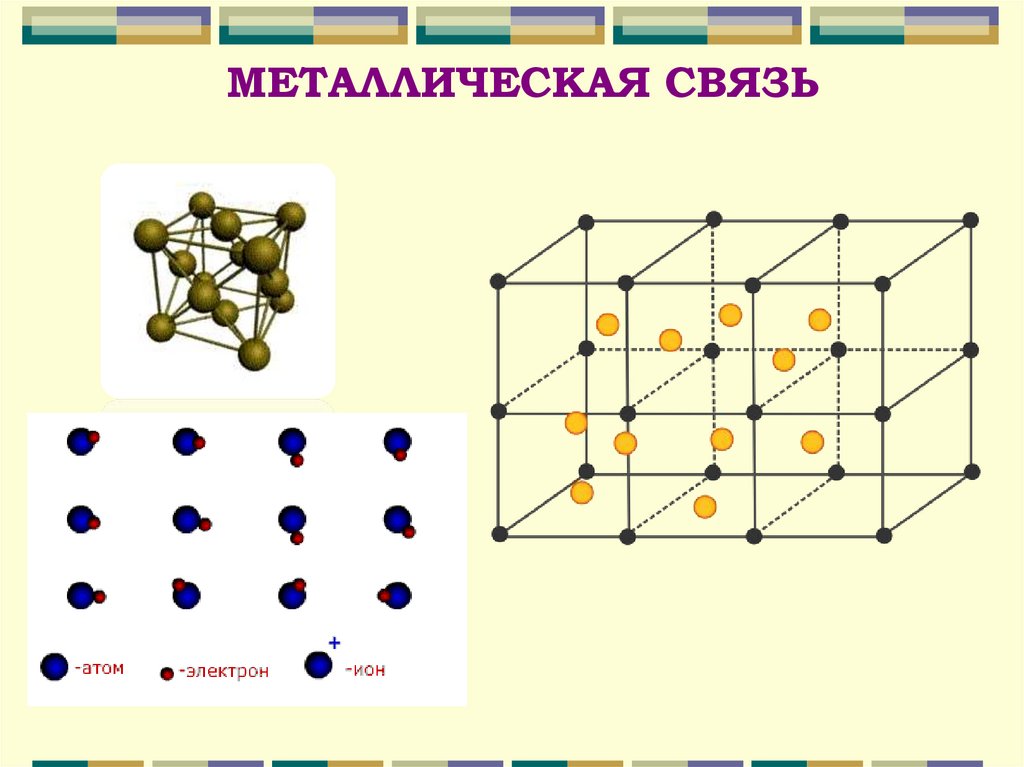
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ4.
Металлическая связь — химическаясвязь между атомами в
металлическом кристалле,
возникающая за счёт перекрытия
(обобществления) их валентных
электронов.
5.
ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВАгрегатное
состояние
Все металлы ТВЁРДЫЕ.
Искл. ртуть – жидкая
Цвет
Большинство серебристо-белые или серые.
Медь – красная, золото – жёлтое
Металлический
блеск
Большинство обладает ярким металлическим
блеском в компактном состоянии.
Самый яркий блеск у серебра и золота.
Твёрдость
Самый твёрдый – хром (режет стекло).
Хрупкий – сурьма.
Пластичность
Ковкость
Самый пластичный – золото.
Железо, сплавы
Тепло- и электропроводность
Все металлы обладают способностью проводить ток
и тепло. Наибольшая - у серебра, меди, алюминия.
Магнитные
свойства
Только три металла обладают этим свойством –
железо, никель и кобальт.
Плотность
Легкие / тяжелые
5 г/см3
Температура
плавления
Легкоплавкие / тугоплавкие
1000оС
Растворимость
В воде – нет. Происходит химическая реакция.
Друг в друге – сплавы.
Литий – 0.53 г/см3
Осмий -22.6 г/см3
6.
HgCu
Au
Ag
Cr
Ni
Co
7.
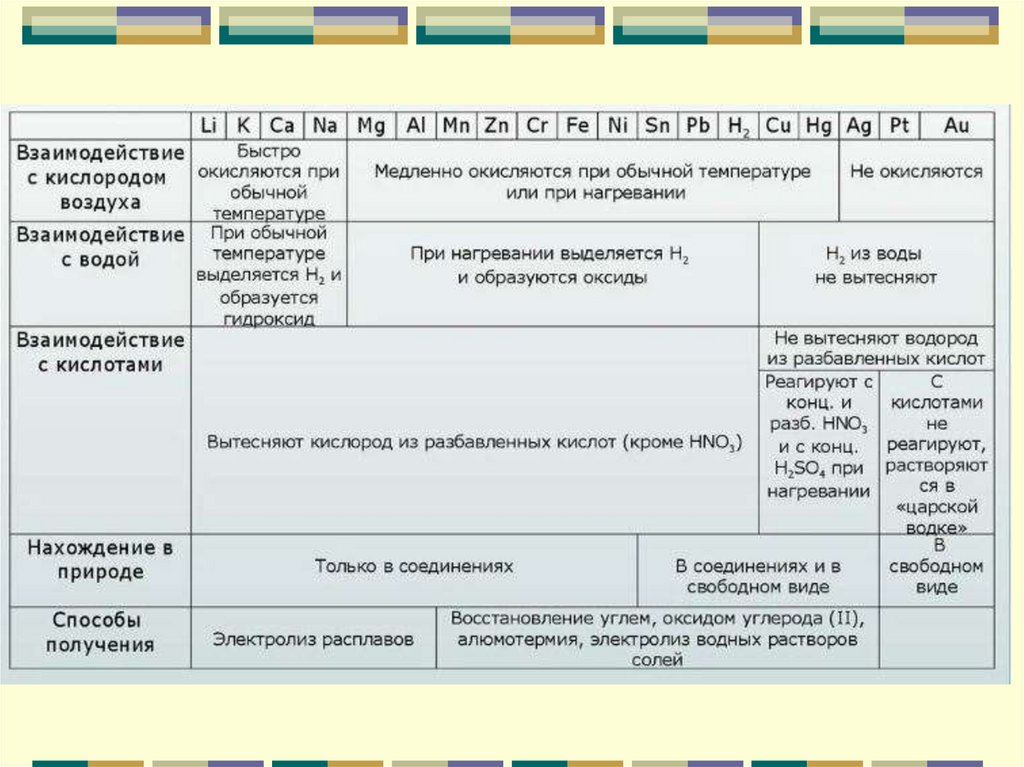
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВВзаимодействие
с неметаллами
(O2, Сl2, Н2, S и
другие)
Met + O2 → MetO
Met + Cl2 → MetCl
Met + H2 → MetH
Met + S → MetS
Большинство
Почти все
Только активные
Большинство
Взаимодействие
с водой (H2O)
Met + H2О → MetОH + H2↑Только активные
Met + H2О → MetО + H2↑ Металлы средней
активности
Met + HCl → MetCl + H2↑
Взаимодействие
Металлы средней активности, стоящие в
с кислотами (HCl)
ряду активности до Н
Взаимодействие
со щелочами
Взаимодействие
с солями.
Met + NaOH + H2О → Na[Met(ОH)4] + H2↑
где Met - Al, Zn, Cr
Met + Met*KO → MetKO + Met*↓
где Met - более активный металл





 chemistry
chemistry








