Similar presentations:
Общая характеристика металлов
1.
Общая характеристикаметаллов
2.
В ы ч и с л и т е о бъе м о кс и д а с е р ы ( I V) , кото р ы й н а д ов з я т ь д л я р е а к ц ии с к и сло р од ом , ч то б ы п олу ч и т ь
о кс и д с е ры ( V I ) м ас с о й 2 0 г. М ас с о вая д ол я в ыход а
п р од у кт а р а в н а 8 0 % . О бъ ем р а ссч ит а й т е п р и н . У.
3.
Характеристика элемента – металла поположению в ПСХЭ Д.И.Менделеева
Li B
Fr
At
1. Металлы находятся в I-III группе главной
подгруппе (искл. H -1e, Hе-2e, B-3e),
а также в I-VIII группах побочной подгруппе.
2. На внешнем энергетическом уровне у
металлов от 1 до 3-х электронов.
3. Ме0 - п е = Ме+п (окисление)
восстановитель
4. Степень окисления металла:
0, +1, +2, +3 (низшая)
+4, +5, +6, +7, +8 (высшая)
4.
Изменение металлических свойств в ПСХЭВ группах:
металлические свойства усиливаются
причина: 1.увеличивается заряд ядра,
2.число электронов на внешнем э.у.
не изменяется
3.радиус атома увеличивается
В периодах:
металлические свойства уменьшаются
причина: 1. увеличивается заряд ядра
2. число электронов на внешнем э.у.
увеличивается
3. радиус атома уменьшается
5.
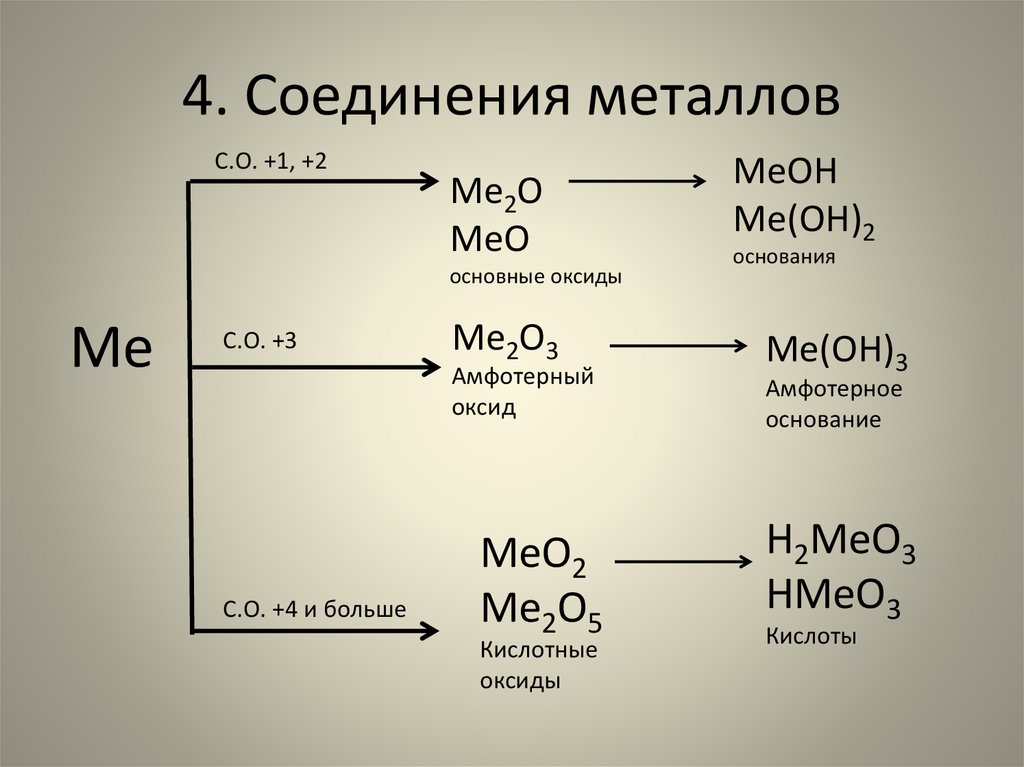
4. Соединения металловС.О. +1, +2
Ме2О
МеО
основные оксиды
Ме
С.О. +3
Ме2О3
Амфотерный
оксид
С.О. +4 и больше
МеО2
Ме2О5
Кислотные
оксиды
МеОН
Ме(ОН)2
основания
Ме(ОН)3
Амфотерное
основание
Н2МеО3
НМеО3
Кислоты
6.
5.Нахождение в природеСамый
распространённый Al,
затем Fe, Ca, Na, K…
Встречаются только в виде соединений, так как активные
7.
Характеристикапростых веществ металлов
1. Состав и строение молекул металлов
Молекулы Ме – одноатомны.
Металлическая связь
Металлическая
кристаллическая решётка
8.
Металлы –простые веществаТипы кристаллических решёток металлов
Кубическая
Объёмно-центрированная
кубическая
Гранецентрированная
кубическая
Гексагональная
плотноупакованная
9.
Химическая связь в металлахВ узлах кристаллической решётки атом-ионы, между
которыми свободно перемещаются свободные электроны
(«электронный газ»)
Металлическая связь – связь
между атом-ионами и относительно
свободными электронами за счёт
сил электростатического притяжения
10.
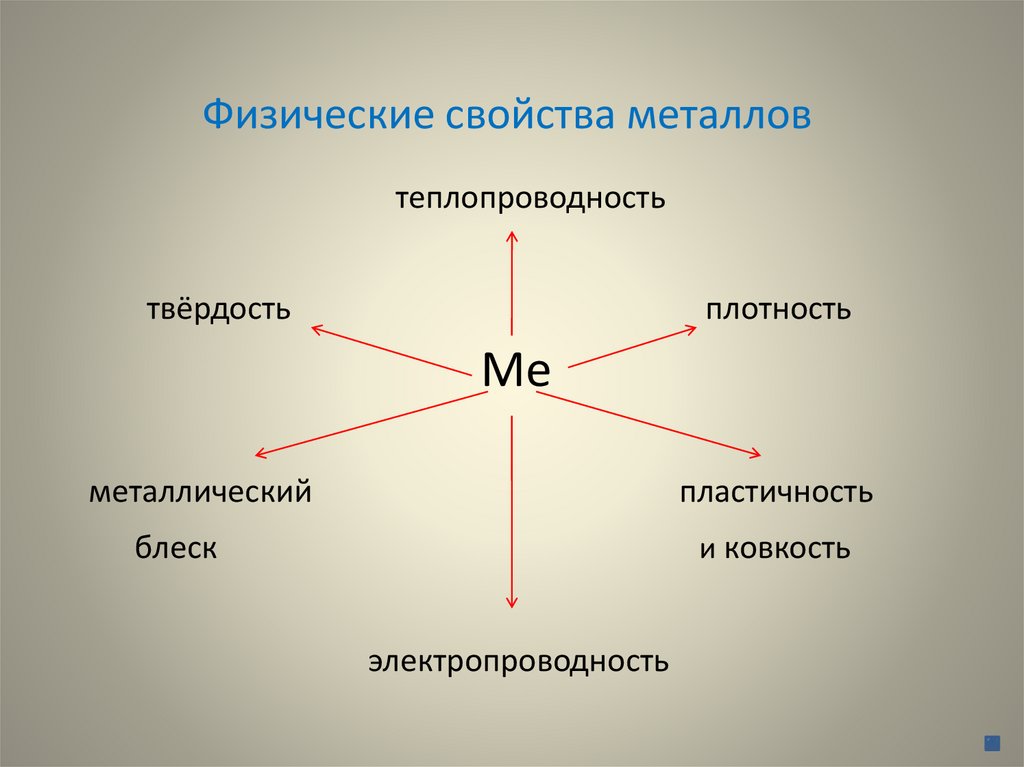
Физические свойства металловтеплопроводность
твёрдость
плотность
Ме
металлический
пластичность
блеск
и ковкость
электропроводность
11.
Физические свойства металлов(продолжение)
Физические свойства металлов:
пластичность, металлический блеск,
теплопроводность и электропроводность обусловлены наличием в
кристаллической решётке металлов
свободных электронов - «электронный газ».
12.
Металлы - «рекордсмены»W - самый тугоплавкий
Ag - самый электропроводный
Li - самый лёгкий
AI - самый распространённый
Cs - самый легкоплавкий
Au - лучший катализатор
Cr - самый твёрдый
Os - самый тяжёлый
13.
Физические свойства металлов14.
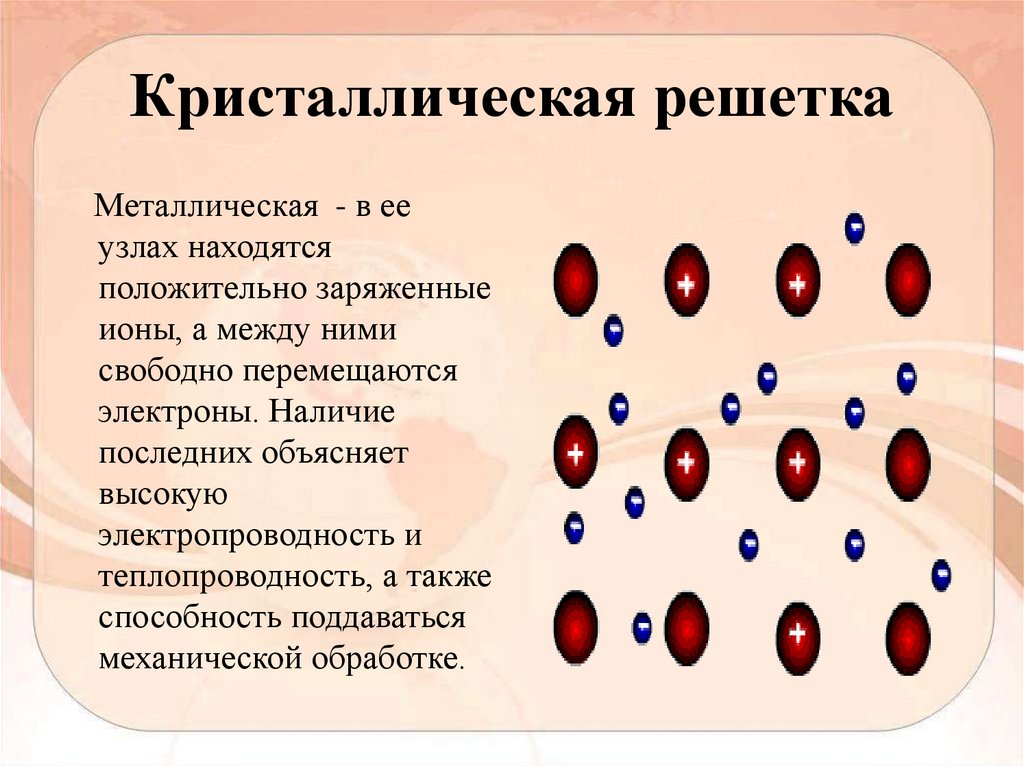
Кристаллическая решеткаМеталлическая - в ее
узлах находятся
положительно заряженные
ионы, а между ними
свободно перемещаются
электроны. Наличие
последних объясняет
высокую
электропроводность и
теплопроводность, а также
способность поддаваться
механической обработке.
15.
Агрегатное состояниеВсе металлы твердые,
исключение ртуть единственный жидкий
металл.
16.
КовкостьИзготовление различных изделий из железа
в кузнице.
17.
Способность намагничиваться - железо,кобальт, никель. Находит применение при
изготовлении магнитов.
18.
ПластичностьСпособность изменять
свою форму при ударе,
прокатываться в
тонкие листы,
вытягиваться в
проволоку: золото,
серебро, медь,
алюминий. Из 1г
золота можно
вытянуть проволоку
длиной 2 км.
19.
ПластичностьВсем известна
алюминиевая фольга.
Алюминиевая фольга это тонкий слой
алюминия, в котором
отлично сохраняются
продукты питания,
кофе, чай, лекарства,
корма для
домашних животных
и многое другое.
20.
Пластичность• Оловянная фольга, которая используется
для заворачивания лучших сортов
шоколада.
21.
Металлический блескСветовые лучи падают
на поверхность
металла и
отталкиваются от неё
свободными
электронами, создавая
эффект
металлического
блеска.
22.
Металлический блескЗеркало состоит из
гладкого стекла, на
которое наносят очень
тонкий слой металла.
Часто зеркала
покрывают серебром,
потому что оно
прекрасно отражает
свет.
23.
Электропроводность• Высокая электропроводность уменьшается
в ряду металлов:
Аg Сu Аu Аl Мg Zn Fе РЬ Hg
• При нагревании уменьшается, т.к.
колебание ионов затрудняет движение
электронов.
24.
ТеплопроводностьХорошая
теплопроводность,
уменьшается в ряду
металлов:
Аg Сu Аu Аl Мg Zn
Fе РЬ Hg
25.
Все металлы делятся на две большиегруппы:
Черные металлы : Имеют темно-серый
цвет, большую плотность, высокую
температуру плавления и относительно
высокую твердость. Типичным
представителем черных металлов является
железо.
26.
Цветные металлы:• Имеют характерную
окраску: красную,
желтую, белую;
обладают большой
пластичностью, малой
твердостью,
относительно низкой
температурой
плавления.
Типичным
представителем цветных
металлов является медь.
27.
Плотность• В зависимости от своей плотности металлы
делятся на:
Легкие (плотность не более 5 г/см3 )К
легким металлам относятся: литий , натрий
, калий , магний , кальций , цезий ,
алюминий , барий.
Самый легкий металл — литий, плотность
0.534 г/см3.
28.
Плотность• Тяжелые (плотность больше 5 г/см3).К
тяжелым металлам относятся: цинк , медь ,
железо , олово , свинец , серебро , золото ,
ртуть и др.
Самый тяжелый металл — осмий ,
плотность 22,5 г/см3.
29.
Твёрдость• Металлы различаются по своей твердости:
— мягкие: режутся даже ножом (натрий ,
калий , индий );
— твердые: металлы сравниваются по
твердости с алмазом, твердость которого
равна 10. Хром — самый твердый металл,
режет стекло.
30.
Температура плавления• В зависимости от температуры плавления
металлы условно делятся на:
Легкоплавкие (температура плавления до
1539°С).
К самым легкоплавким металлам
относятся: ртуть — температура плавления
—38,9°С; галлий — температура плавления
30°С; цезий — температура плавления
28,6°С
31.
Температура плавленияТугоплавкие (температура
плавления выше 1539 С).
К тугоплавким металлам
относятся: хром — температура
плавления 1890°С; молибден —
температура плавления 2620°С;
ванадий — температура
плавления 1900°С; тантал —
температура плавления 3015°С;
и многие другие металлы.
Самый тугоплавкий металл
вольфрам — температура
плавления 3410°С.



























 chemistry
chemistry








