Similar presentations:
Общая характеристика металлов
1.
2.
27.09.2022Общая характеристика металлов
3.
КОЛИЧЕСТВО МЕТАЛЛОВ СРЕДИВСЕХ
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
95 металлов из 118 химических
элементов
металлы
неметаллы
19%
81%
4.
Расположениеэлементов – металлов
в ПСХЭ:
1 группа главная подгруппа – щелочные металлы
2 группа главная подгруппа – щелочно-земельные
металлы
3 группа главная подгруппа – все кроме бора
4 группа главная подгруппа – все кроме углерода и
кремния
5 группа главная подгруппа – сурьма и висмут
6 группа главная подгруппа – только полоний
Во всех побочных подгруппах – только металлы
5.
6.
НАХОЖДЕНИЕ В ПРИРОДЕБольшая часть
металлов существует
в природе в виде
минеральных
образований - руд
Самый распространённый Al
Некоторые неактивные
металлы существуют в
виде самородков:
золото, серебро,
платина, медь
7.
8.
Металлы – это химические элементы,атомы которых отдают электроны
внешнего ( предвнешнего)
электронного слоя, превращаясь в
положительные ионы (катионы).
o
2+
Fe – 2e → Fe
9.
ГЛАВНЫЕ ОСОБЕННОСТИЭЛЕМЕНТОВ МЕТАЛЛОВ.
Число валентных электронов (1-3 ).
Исключительно восстановительные свойства
( отдают свои электроны).
Сравнительно большие радиусы атомов.
Небольшие значения электроотрицательности (от 0,7 до 1,9).
Некоторые химические элементы металлы обладают
двойственными свойствами: Al, Zn, Fe… (амфотерность).
10.
11.
12.
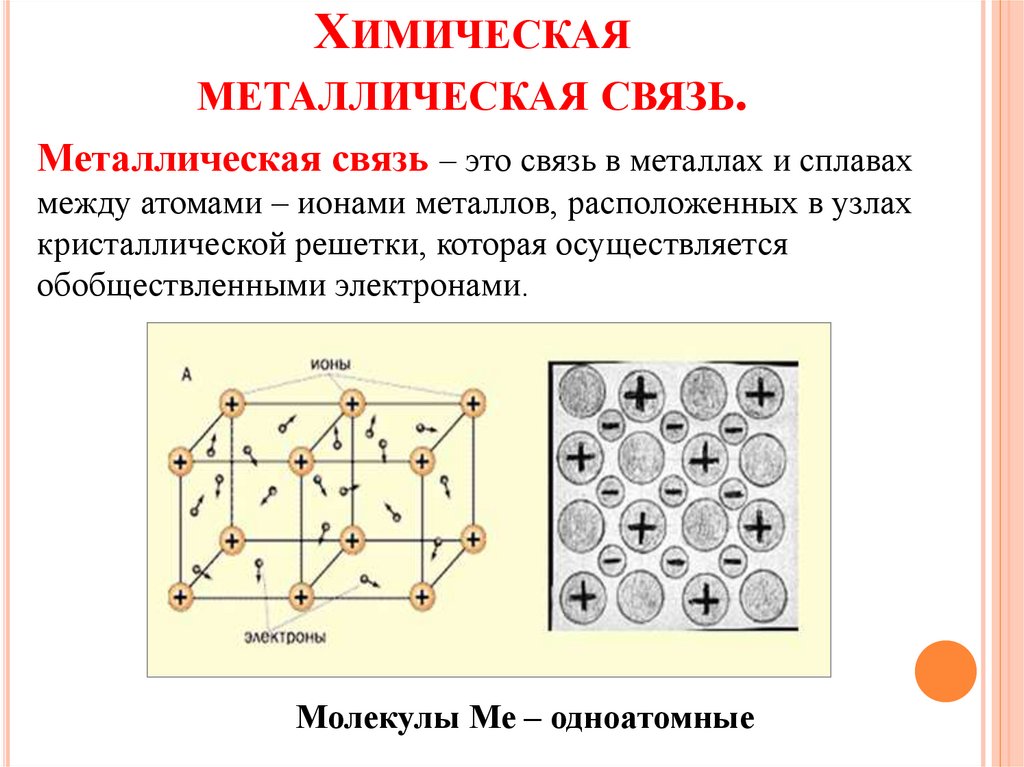
ХИМИЧЕСКАЯМЕТАЛЛИЧЕСКАЯ СВЯЗЬ.
Металлическая связь – это связь в металлах и сплавах
между атомами – ионами металлов, расположенных в узлах
кристаллической решетки, которая осуществляется
обобществленными электронами.
Молекулы Ме – одноатомные
13.
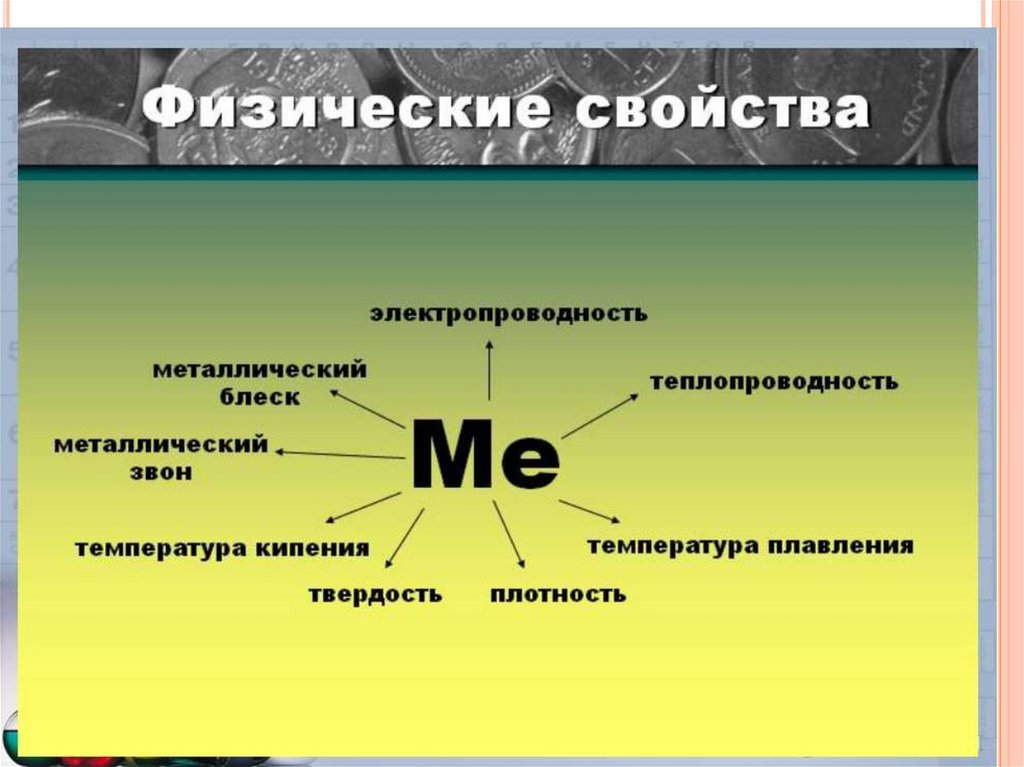
МЕТАЛЛЫ – ПРОСТЫЕВЕЩЕСТВА.
Все металлы обладают общими физическими свойствами:
Пластичность – смещение слоев ионов под внешним
воздействием на кристалл относительно друг друга.
Золото - это самый пластичный металл в мире
Суса́льное золото — тончайшие (около 100 нм)
листы золота, которые обычно используются в
декоративных целях.
14.
МЕТАЛЛЫ – ПРОСТЫЕВЕЩЕСТВА.
Все металлы обладают общими физическими свойствами:
Металлический блеск – наличие свободных электронов.
Самый блестящий металл – серебро.
15.
МЕТАЛЛЫ – ПРОСТЫЕВЕЩЕСТВА.
Все металлы обладают общими физическими свойствами:
Электро- и теплопроводность – обусловлена
нахождением в кристалле хаотически движущихся
электронов.
Самый электро- и теплопроводный металл – серебро.
16.
МЕТАЛЛЫ – ПРОСТЫЕВЕЩЕСТВА.
Все металлы обладают общими физическими свойствами:
Твердость –свойство материала сопротивляться
внедрению более твёрдого тела — индентора.
Самый твердый металл – хром.
17.
МЕТАЛЛЫ – ПРОСТЫЕВЕЩЕСТВА.
Все металлы обладают общими физическими свойствами:
Твердость –свойство материала сопротивляться
внедрению более твёрдого тела — индентора.
Самый твердый металл – хром.
18.
МЕТАЛЛЫ – ПРОСТЫЕВЕЩЕСТВА.
Все металлы обладают общими физическими свойствами:
Плотность –отношение массы к единице объема
металла
19.
МЕТАЛЛЫ – ПРОСТЫЕВЕЩЕСТВА.
Все металлы обладают общими физическими свойствами:
Цвет металла
20.
МЕТАЛЛЫ – ПРОСТЫЕВЕЩЕСТВА.
Все металлы обладают общими физическими свойствами:
Температура плавления
21.
22.
ДОМАШНЕЕ ЗАДАНИЕ1. Выучить записи в тетради
2. Дать характеристику металлов
Al
Пластичность
Твердость
Температура плавления
Блеск
Электро и теплопроводность
Плотность
Цвет
Сплавы
Нахождение в природе/организме
Применение
Cu
Fe
Hg
23.
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВВзаимодействие металлов с галогенами
o
o
+1
-1
2Na + Cl2 → 2NaCl
o
+3
-1
2Sb + 2Cl2 → 2SbCl3
o
o
+3 -1
2Fe + 3Cl2 → 2FeCl3
Взаимодействие
металлов с серой
Взаимодействие
металлов с водой
o
o
o
+2 -2
+1
+1
-1
o
2К + 2H2O = 2КOH + H2
Fe + S → FeS
o
o
o
+3 -2
2Al + 3S → Al2S3
+2
-1
2Са + Н 2О → 2Сa(ОН)
2
(Щелочные и щелочно-земельные металлы)
o
+1
t
o
3Fe + 4H2O → Fe3O4 + 4H2↑
(малоактивные)
24.
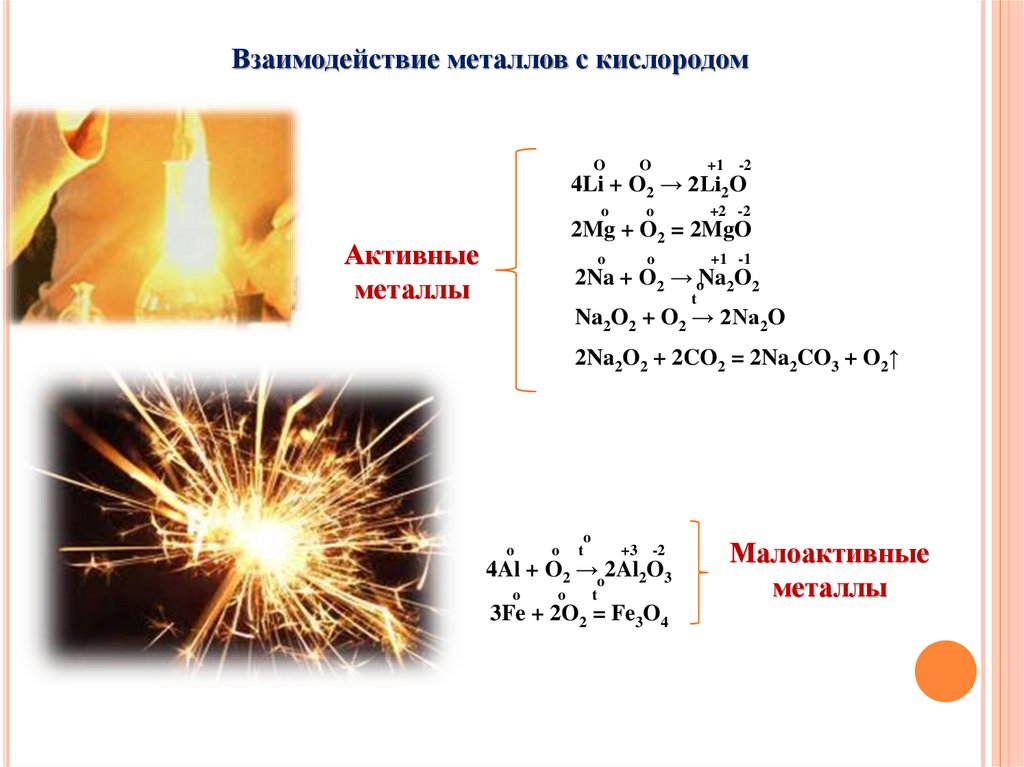
Взаимодействие металлов с кислородомO
O
+1 -2
o
o
+2 -2
4Li + O2 → 2Li2O
2Mg + O2 = 2MgO
Активные
металлы
o
o
+1 -1
2Na + O2 → oNa2O2
t
Na2O2 + O2 → 2Na2O
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
o
o
o
o
t
o
+3 -2
4Al + O2 →o2Al2O3
t
3Fe + 2O2 = Fe3O4
Малоактивные
металлы
25.
Взаимодействие металлов с кислотамиo
+1 -1
+2 -1
o
Zn + 2HCl → ZnCl2 + H2
o
+
+2
o
Zn + 2H → Zn + H2
o
+
2+
2CH3COOH + Zn → (CH3COO)2Zn + H2
o
+
2+
o
o
Zn + 2H → Zn + H2↑
Взаимодействие металлов с солями
Fe + CuSO4 → Cu↓ +FeSO4
o
2+
o
2+
Fe + Cu → Cu + Fe
(окислительно-восстановительная реакция)
o
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
o
+
2+
o
Cu + 2Ag → Cu + Ag↓
26.
Химические свойства металлов1. Все металлы проявляют только восстановительные
свойства
2. Атомы металлов легко отдают электроны внешнего (а
некоторые – и предвнешнего) электронного слоя,
превращаясь в положительные ионы.
3. Металлы имеют большой атомный радиус и малое число
электронов (от 1 до 3) на внешнем слое.
Исключение:
Ge, Sn, Pb ─ 4 электрона;
Sb, Bi ─ 5 электронов;
Po ─ 6 электронов.
27.
ПРИМЕНЕНИЕ МЕТАЛЛОВ28.
Проверь себя:Какие из соединений вступают
в реакцию с металлами:
H2SO4
О2
H 2O
CuSO4
K2O
BaSO4
S
Cr
Fe2O3
29.
Спасибо завнимание!


























 chemistry
chemistry








