Similar presentations:
Неметаллы: общая характеристика
1.
1Оренбургский государственный педагогический университет
Институт естествознания и экономики
Кафедра химии и методики преподавания химии
НЕМЕТАЛЛЫ
Айсувакова Ольга Павловна,
старший преподаватель, к.х.н.
Оренбург, 2016
2.
2Неметаллы
H
He, Ne, Ar, Kr, Xe, Rn
F, Cl, Br, I, At
O, S, Se, Te
N, P, As
C, Si
B
3.
3Положение в периодической
системе элементов
4.
4Важнейшие свойства
элементов
1. Атомный радиус, нм (Å).
2. Потенциал
ионизации,
I,
(кДж/моль).
3. Сродство к электрону, Аē,
(кДж/моль).
4. Электроотрицательность, χ.
5. Степень окисления (СО).
эВ
эВ
5.
5Изменение атомных радиусов
6.
6Изменение других свойств
7.
7Шкала
электроотрицательности
8.
8Распространенность неметаллов
В земной коре
В гидросфере
В атмосфере
Во Вселенной
9.
9Типичные химические свойства
неметаллов
Класс
Пример
Металлы
2Al + 3I2 = 2AlI3
Неметаллы
N2 + 3H2 ↔ 2NH3
Вода
Cl2 + H2O ↔ HCl + HClO
t0
Оксиды
H2 + CuO = Cu + H2O
Конц. кислоты
C + 2H2SO4(конц) = CO2 + 2SO2 + 2H2O
Щелочи
Cl2 + 2KOH = KCl + KClO + H2O
Соли
Cl2 + 2KBr = 2KCl + Br2
10.
10Водород: положение в ПСХЭ
1
H
1s
1
1 группа (IA)
17 группа (VIIA)
Восстановитель
Окислитель
СО = +1
СО = -1
1s1 ns1
Спектр с небольшим числом
линий
Металлический водород
(450 ГПа, Ливерморская национальная
лаборатория (США), 1996)
1s1
ns2np5
Гидриды ~ Галогениды
H2
F2, Cl2, Br2, I2
11.
11Водород: физические свойства и
нахождение в природе
1. Газ, бесцветный, без вкуса, без запаха.
2. Растворимость в воде: 2,1V(H2) в 100V(H2O) при н.у.
3. Диффузия через металлы, стекло, резину.
4. tпл = -259,20С; tкип = -252,80С.
12.
12Водород: изотопный состав
Свойство
H2
D2
T2
Mr
2
4
6
tпл,0С
-259,2
-254,4
-252,5
tкип, 0С
-252,8
-249,5
-248,1
Распространенность
(в % от 100)
99,98%
0,0156%
1 : 1017
13.
Химические свойства:с простыми веществами
13
Реагент
Уравнение
Условия
Hal2
H2 + Hal2 = 2HHal
Hal – F, Cl, Br
F - Tкомн,
Cl - UV,
Br - UV / 2300C (Pt)
O2
2H2 + O2 = 2H2O
400-6000C,
tкомн (Pt)
S
H2 + S = H2S
N2
3H2 + N2 ↔ 2NH3
C
C + 2H2 = CH4
2C + H2 = C2H2
6000C, Pt
1500-20000C
I2
H2 + I2 ↔ 2HI
↑T,
M
Na + H2 = 2NaH
Ca + H2 = CaH2
2000C
4000C, 200 атм, Fe
3000C
500-7000C
14.
14Химические свойства:
со сложными веществами
Реагент
Уравнение
Условия
Оксиды
металлов
H2 + Fe3O4 = 3Fe + 4H2O
H2 + Cu2O = 2Cu + H2O
H2 + Mn3O4 = 3MnO + H2O
Оксиды
неметаллов
4H2 + CO2 = CH4 + 2H2O
2NO+2H2 = N2 + 2H2O
2000C, Cu2O
Соли
H2 + 2FeCl3 = 2FeCl2 + 2HCl
H2 + Ag2SO4 = 2Ag + H2SO4
2H2 + BaSO4 = BaS + 4H2O
↑T
2000C
550-10000C
Бинарные
соединения
H2 + СaC2 = Ca + C2H2
4H2 + CS2 = CH4 + 2H2S
3H2 + 2BCl3 = 2B + 6HCl
20000C
500C, Pt
800-12000C
6000C
250-4000C
↑T
15.
15Химические свойства: атомарный
водород
Cильный восстановитель!!!
2CrCl3 + 2HCl + 2Zn = 2CrCl2 + 2ZnCl2 + H2
KNO3 + 2HCl + Zn = KNO2 + ZnCl2 + H2O
2HCl + Zn = ZnCl2 + 2H0 (in situ)
3KNO3 + 5KOH + 8Al +18H2O = 3NH3 + 8K[Al(OH)4]
2Al+ 2KOH +6H2O = 2K[Al(OH)4] + 6H0 (in situ)
16.
16Получение водорода
Способ
Уравнение
Металл + кислота
Zn + H2SO4 (20%) = ZnSO4 + H2
Металл + щелочь
2Al + 2KOH + 6H2O = 3H2 + 2K[Al(OH)4]
Fe + водяной пар
(10000C)
3Fe+ 4H2O = Fe3O4 + 4H2
Уголь + водяной
пар (10000C)
C + H2O = CO + H2
Конверсия метана
(11000C)
CH4 + H2O = CO + 3H2
Электролиз
растворов солей
2NaCl + 2H2O = 2NaOH + H2 + Cl2
17.
17Гидриды
полимерные
металлические
ионные
NaH + H2O = NaOH + H2
CaH2 + O2 = CaO + H2O (Сa(OH)2)
18.
18Вода: типичные свойства
PHal3 + 3H2O = H3PO3 +
3HHal↑
19.
19Пероксид
водорода
Бесцветная вязкая жидкость
Хорошо растворим в воде
30-40% раствор – «пергидроль»
ρ = 1,443 г/см3 tпл = -0,410С tкип = 150,20С
Неустойчив, самопроизвольно разлагается:
+1 -1
-2
0
2H2O2 = 2H2O+ O2
чаще
H+, Н2О
Ox
+6
-1
-2
Na2SO3 + H2O2 = Na2SO4 +H2O
-1
H2O2
чаще
ОН-
+4
+7
Red
-1
2KMnO4 + 5H2O2 + 3H2SO4 =
5O2 + 2MnSO4 + K2SO4 +8H2O
0
+2
20.
20Пероксид
водорода
+2ē
0
O2
-2ē
-1
H2O2
Кислая среда
+2ē
-2
2H2O
-2
2
Нейтральная
и щелочная среда
чаще
ОНчаще
H+, Н2О
OH
Сl2 + H2O2 + 2NaOH = 2NaCl + 2H2O + O2
2К3[Cr(OH)6]+ 3H2O2 = 2К2CrО4 + 8H2O + 10КOH
PbS + 4H2O2 = PbSO4 + 4H2O
21.
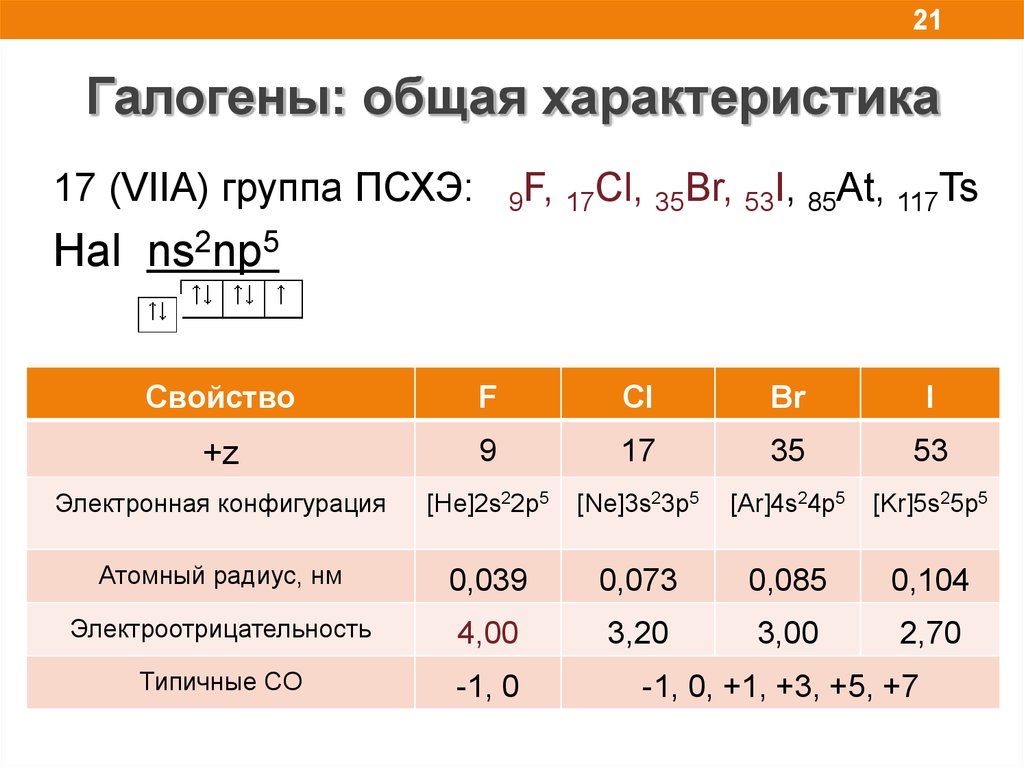
21Галогены: общая характеристика
17 (VIIA) группа ПСХЭ:
9F, 17Cl, 35Br, 53I, 85At, 117Ts
Hal ns2np5
Свойство
F
Cl
Br
I
+z
9
17
35
53
Электронная конфигурация
[He]2s22p5
[Ne]3s23p5
[Ar]4s24p5
[Kr]5s25p5
Атомный радиус, нм
0,039
0,073
0,085
0,104
Электроотрицательность
4,00
3,20
3,00
2,70
Типичные СО
-1, 0
-1, 0, +1, +3, +5, +7
22.
22Галогены: физические свойства и
нахождение в природе
Свойство
F2
Cl2
Br2
I2
Цвет
Оранжевожелтый
Желто-зеленый
Краснокоричневый
Фиолетово
-черный
Mr
38
71
160
254
tпл,0С
-220
-100
-7
114
tкип, 0С
-188
-34
59
185
Содержание в
земной коре
6*10-2
2*10-2
2*10-4
4*10-5
Типичные
природные
соединения
KF
NaCl, KCl,
KCl*NaCl,
KCl*MgCl2*6H2O
NaBr, KBr
NaI, KI
23.
Химические свойства: с простымивеществами
23
Реагент
F2
Cl2
Br2
I2
H2
HF
HCl
HBr
HI
O2
OF2
(разряд)
-
-
-
S
SF6
S2Cl2,
SCl2,
SCl4
S2Br2
-
P
PF3,
PF5
PCl3,
PCl5
PBr3,
PBr5
PI3,
PI5
Металлы
AlF3,
FeF3,
CuF2
AlCl3,
FeCl3,
CuCl2
AlBr3,
FeBr3,
FeBr2,
CuBr2
AlI3,
FeI2,
Cul
24.
24Взаимодействие с водой
25.
25Взаимодействие со сложными веществами
Реагент
Щелочи
Галогениды
Оксиды
Окислители
Восстановители
Уравнение
Хлор, бром:
Hal2 + 2KOH = KHal + KHalO + H2O 00С
3Hal2 + 6KOH = 5KHal + KHalO3 + 3H2O 600С
Йод:
3l2 + 6KOH = 5Kl + KlO3 + 3H2O
Cl2 + 2KBr = 2KCl + Br2
Cl2 + 2KI = 2KCl + I2
Br2 + 2KI = 2KBr + I2
Cl2 + MgO = MgCl2 + O2
SiO2 + 2F2 = SiF4 + O2
3l2 + 10HNO3(конц) = 6HlO3 + 10NO2 + 2H2O
I2 + 5Cl2 +6H2O = 2HIO3 + 10HCl
3Br2 + S +4H2O = 6HBr + H2SO4
3Cl2 + 3H2O2 = 2HCl + 2H2O + O2
26.
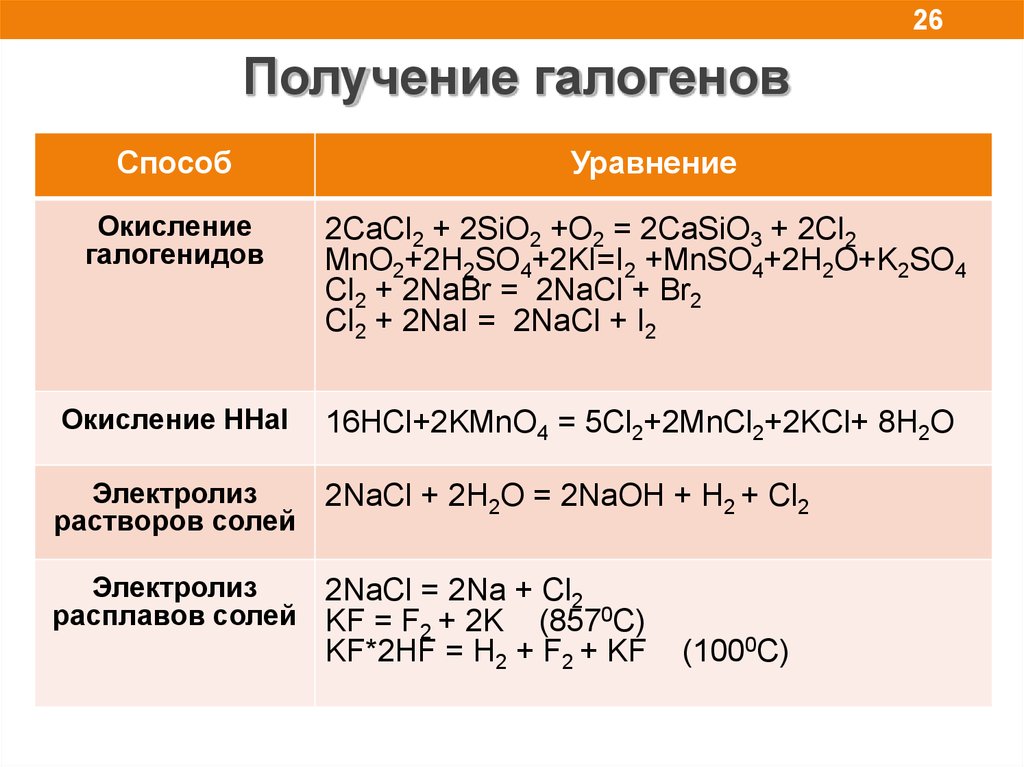
26Получение галогенов
Способ
Уравнение
Окисление
галогенидов
2CaCl2 + 2SiO2 +O2 = 2CaSiO3 + 2Cl2
MnO2+2H2SO4+2KI=I2 +MnSO4+2H2O+K2SO4
Cl2 + 2NaBr = 2NaCl + Br2
Cl2 + 2NaI = 2NaCl + I2
Окисление HHal
16HCl+2KMnO4 = 5Cl2+2MnCl2+2KCl+ 8H2O
Электролиз
растворов солей
2NaCl + 2H2O = 2NaOH + H2 + Cl2
Электролиз
2NaCl = 2Na + Cl2
расплавов солей KF = F2 + 2K (8570C)
KF*2HF = H2 + F2 + KF
(1000C)
27.
27Соединения галогенов
HНal – бесцветные газы, хорошо растворимы в воде
1 V H2O – 507 V HCl или 612V HBr (н.у.)
Водные растворы HНal – сильные кислоты-неокислители
В ряду
HF → HCl → HBr → HI
сила кислот ↑
Получение
Способ
Прямой синтез
Уравнение
H2 + Hal2 = 2HHal
Вытеснение из солей
NaCl+H2SO4 (75-80%)= NaHSO4+HCl↑
NaCl+NaHSO4 = Na2SO4+HCl↑
5300С
Гидролиз галогенидов
неметаллов
PHal3 + 3H2O = H3PO3 + 3HHal↑
28.
28Свойства HHal
Способ
Уравнение
C металлами
(до H)
Zn + 2HCl = ZnCl2 + H2
Fe + 2HCl = FeCl2 + H2
С аммиаком
NH3 + HCl = NH4Cl
С основаниями
С основными оксидами
C окислителями
Электролиз
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
CaO + 2HCl = CaCl2 + H2O
2HBr + 3H2SO4(конц) = Br2 + SO2 + 2H2O
8HI + 3H2SO4(конц) = 4I2 + H2S + 4H2O
4HСl + MnO2 = Cl2 + MnCl2 + 2H2O
2HСl = H2 + Cl2
29.
29Продукты ОВР
±2ē
-2ē
-1
2 Hal-
+2ē
-2ē
0
Hal2
±6ē
-10ē
+1
2HalO
+5
2HalO3-
30.
30Халькогены: общая
характеристика
16(VIA) группа ПСХЭ:
8O, 16S, 34Se, 52Te, 84Po, 116Lv
X ns2np4
Свойство
O
S
Se
Te
+z
8
16
34
52
Электронная конфигурация
[He]2s22p4
[Ne]3s23p4
[Ar]4s24p4
[Kr]5s25p4
Ковалентный радиус, нм
0,074
0,104
0,140
0,160
Электроотрицательность
3,44
2,58
2,55
2,10
Типичные СО
-2,-1, 0,
+2
-2, 0, +2, +4, +6
31.
31Физические свойства
O
S
O2 : ↑, б/ц, б/в, б/з
4,89V(O2) в 100 V(H2O)
tпл = -2190С
tкип = -1830С
параманитен
Ромбическая сера
S8
O3 : ↑, б/ц (голубой), резкий запах
1,8 V(O3) в 100 V(H2O)
tпл = -1930С
tкип = -1120С
диамагнитен
Легкоплавкий
светло-желтый
порошок,
нерастворима в воде, не смачивается водой,
хорошо растворима в жидком аммиаке и
сероуглероде
0
0
tпл = 113 С
tкип = 446 С ρ = 2,07г/см3
t↑↓
Ромбическая S
Пластическая S
Моноклинная сера
S8
Игольчатые
светло-желтые
образуются
из
ромбической
нагревании и охлаждении
ρ = 1,96г/см3
кристаллы,
серы
при
32.
32Нахождение в природе
Кислород – основной элемент биосферы
Сера
Содержание серы в земной коре: 4,8*10-3 %
1. Самородная сера
2. Сульфиды:
халькопирит CuFeS2, сфалерит ZnS
3. Сульфаты:
гипс CaSO4*2H2O, мирабилит Na2SO4*10H2O
4. В виде сернистых соединений: нефть, нефтяные газы, природный газ
33.
33Химические свойства кислорода и серы:
взаимодействие с простыми веществами
Реагент
О2
S
H2
H2O (6000C)
H2S (2000C)
O2
-
Hal2
OF2 (разряд)
SF6
S2Cl2
SCl2
N2
NO (разряд)
-
P
P2O5 (↑t)
P4S10, P4Sn (n=3-7)
C
CO (600-7000C)
CO2 (10000C)
CS2
Mеталлы
Al2O3
Na2O2
KO2
Не реагирует
SO2
(↑t)
Hal2 (-F2), инертные газы, Au, Ag,
платиновые металлы
(-Os)
(280-3600C, примесь SO3)
(1300C)
(200C)
(700-8000C)
Al2S3 (150-2000C)
Na2S
(1300C)
Na2S4, Na2S2 (расплав,1000C)
Инертные газы, N2, Se, Te, Au, I2
34.
34Химические свойства кислорода и серы:
взаимодействие со сложными веществами
Реагент
O2
Гидроксиды
металлов в
промежуточных СО
4Сr(OH)2 + O2 + 2H2O = 4Cr(OH)3↓
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓
( 4Fe(OH)2 + O2 = 4FeO(OH) ↓ + 2H2O )
Соединения серы и
азота в низших или
промежуточных СО
2Na2SO3 + O2 = 2Na2SO4
4FeS2 + 11O2 = 8SO2 + 2Fe2O3
2NO + O2 = 2NO2
Реагент
S
H2O
3S + 3H2O ↔ 2H2S + H2SO3
Щелочи
3S + 6NaOH = 2Na2S + Na2SO3+3H2O (500С)
4S + 8NaOH = 3Na2S + Na2SO4+3H2O (6000С)
Кислоты-окислители
(конц.)
S + 6HNO3 = H2SO4 + 6NO2+2H2O (кип.)
S + 2H2SO4 = 3SO2+2H2O (кип.)
35.
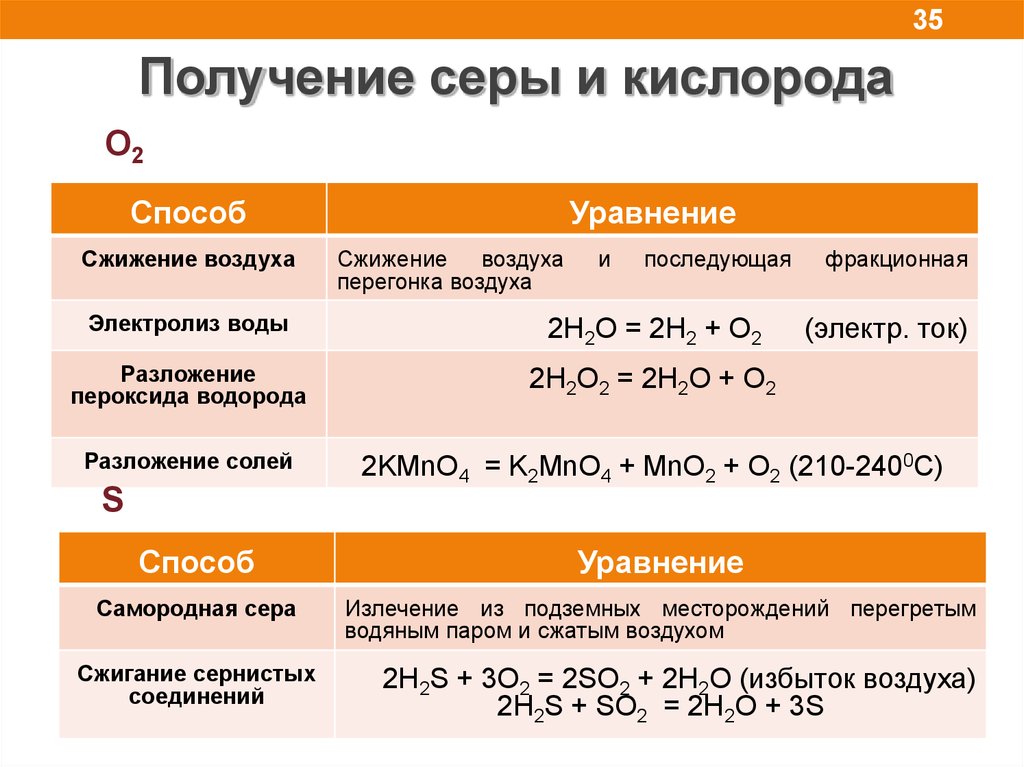
35Получение серы и кислорода
O2
Способ
Сжижение воздуха
Уравнение
Сжижение воздуха
перегонка воздуха
и
последующая
фракционная
Электролиз воды
2H2O = 2H2 + O2
Разложение
пероксида водорода
2H2O2 = 2H2О + O2
Разложение солей
2KMnO4 = K2MnO4 + MnO2 + O2 (210-2400C)
(электр. ток)
S
Способ
Уравнение
Самородная сера
Излечение из подземных месторождений перегретым
водяным паром и сжатым воздухом
Сжигание сернистых
соединений
2H2S + 3O2 = 2SO2 + 2H2O (избыток воздуха)
2H2S + SO2 = 2H2O + 3S
36.
36Соединения серы. Сероводород
H2S – бесцветный газ, характерный неприятный запах
100 г H2O – 2,58V H2S (0,1М насыщенный р-р)
Водный раствор H2S – слабая двухосновная кислота
H2S ↔ HS- + H+ Kа= 1,3*10-7
HS- ↔ S2- + H+ Kа= 7,1*10-15
Получение
Способ
Гидролиз
Вытеснение из солей
Прямой синтез
Уравнение
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
FeS + 2HCl = FeCl2 + H2S↑
H2 + S = H2S (в расплаве серы)
37.
37Свойства H2S
Способ
C
кислородом
Уравнение
2H2S + 3O2 = 2SO2 + 2H2O
2H2S + O2 = 2S + 2H2O
(избыток O2)
(недостаток O2)
С аммиаком и
основаниями
2NH3 + H2S = (NH4)2S
NH3 + H2S = NH4HS
NH3*H2O + H2S = NH4HS + H2O
С солями
H2S + 2AgNO3 = Ag2S↓ + 2HNO3
H2S + PbCl2 = PbS↓ + 2HCl
С оксидами
С металлами
2H2S + SO2 = 2H2O + 3S (жидкость Вакенродера)
2H2S + 4SO2 + 6NaOH = 3Na2S2O3 + 5H2O
H2S + ZnO = ZnS + H2O (800-10000C)
H2S(влаж.) + Zn = ZnS + H2 (700-8000C)
2H2S + 2Na = 2NaHS + H2 (1500C)
38.
38Свойства H2S
Способ
С кислотами
C
окислителями
(S, SO2, H2SO4,
Na2S2O3)
Уравнение
H2S + H2SO4 (конц) = 4SO2↑ + 4H2O (кип.)
H2S + H2SO4 (конц) = S↓ + SO2↑ + 2H2O (комн.)
H2S + 8HNO3 (конц) = H2SO4 + 8NO2 ↑+ 4H2O (кип.)
H2S + 2HNO3 (конц) = S↓ + 2NO2 ↑+ 2H2O (холод.)
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCI
H2S + l2 = S↓ + 2HI (в р-ре)
4H2S + 3PbO2 = 3PbS +SO2↑+ 4H2O
3H2S + 2KMnO4 = 2MnO2 +S↓+ 2H2O + 2KOH
39.
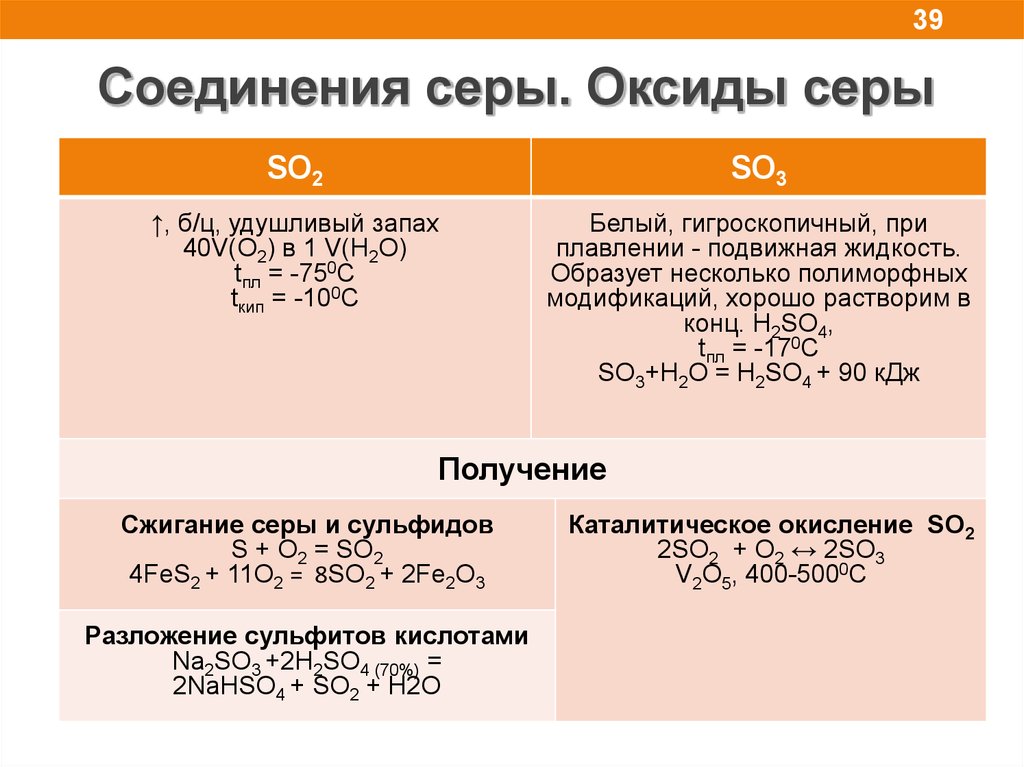
39Соединения серы. Оксиды серы
SO2
SO3
↑, б/ц, удушливый запах
40V(O2) в 1 V(H2O)
tпл = -750С
tкип = -100С
Белый, гигроскопичный, при
плавлении - подвижная жидкость.
Образует несколько полиморфных
модификаций, хорошо растворим в
конц. H2SO4,
tпл = -170С
SO3+H2O = H2SO4 + 90 кДж
Получение
Сжигание серы и сульфидов
S + O2 = SO2
4FeS2 + 11O2 = 8SO2 + 2Fe2O3
Разложение сульфитов кислотами
Na2SO3 +2H2SO4 (70%) =
2NaHSO4 + SO2 + H2O
Каталитическое окисление SO2
2SO2 + O2 ↔ 2SO3
V2O5, 400-5000C
40.
40Свойства SO2 и сернистой кислоты
Способ
С водой
Уравнение
SO2 + nH2O = SO2 *nH2O
(H2SO3)
SO2 *6H2O 00C
SO2 *nH2O ↔ H3O+ + HSO3- + (n-2)H2O
H2SO3 ↔ H+ + HSO3- K1 = 1,3*10-2
HSO3- ↔ H+ + SO32- K2 = 6,2*10-8
C основными
оксидами,
основаниями и
аммиаком
SO2 + NaOH = NaHSO3
SO2 + 2NaOH = Na2SO3 + H2O
CaSO3↓ + SO2 + H2O = Ca(HSO3)2
41.
41Свойства SO2 и сернистой кислоты
Способ
C cолями
С кислородом
Уравнение
CaSO3↓ + SO2 + H2O = Ca(HSO3)2
Na2CO3 + 2SO2 + H2O = NaHSO3 + CO2↑
Na2CO3(конц) + 2SO2 = Na2SO3 + CO2↑
2SO2 + O2 ↔ 2SO3
(V2O5, 400-5000C)
2SO2 + 2H2O + O2 = 2H2SO4
C окислителями SO2 + I2 + 2H2O + O2 = 2HI + H2SO4
5SO2+ 2KMnO4+ 2H2O=2MnSO4 + 2KHSO4 + H2SO4
С
SO2 + С = S + СO2 (400-6000C)
восстановителя SO2 + 2СО = S + 2СO2 (Al2O3, 5000C)
ми
SO2 + 2H2S = 3S + 2H2O
SO2 + 2H2 = S + 2H2O
42.
42Свойства SO3
Способ
С водой
Уравнение
SO3 + H2O = H2SO4 (разб)
SO3 + H2O = H2SO4 (конц)
SO3 + H2SO4 = H2S2O7
- в присутствии
C основаниями и SO + 2NaOH = Na SO + H O
3
2
4
2
основными
Fe2O3 + 3SO3 = Fe2(SO4)3
оксидами
C восстановителями
2SO3 + C = 2SO2 + CO2
2SO3 + 2HBr = SO2↑ + Br2 + H2SO4
SO3 + 8HI = H2S↑ + 4I2 +3H2O
H2SO4
43.
43Свойства серной кислоты
H2SO4 –
бесцветная, вязкая, гигроскопичная
Неограниченно смешивается с водой с выделением
Техническая смесь с SO3 - олеум.
Сильная кислота:
H2SO4 ↔ H+ + HSO4- K1 HSO4- ↔ H+ + SO42- K2 = 1,2*10-2
жидкость.
теплоты.
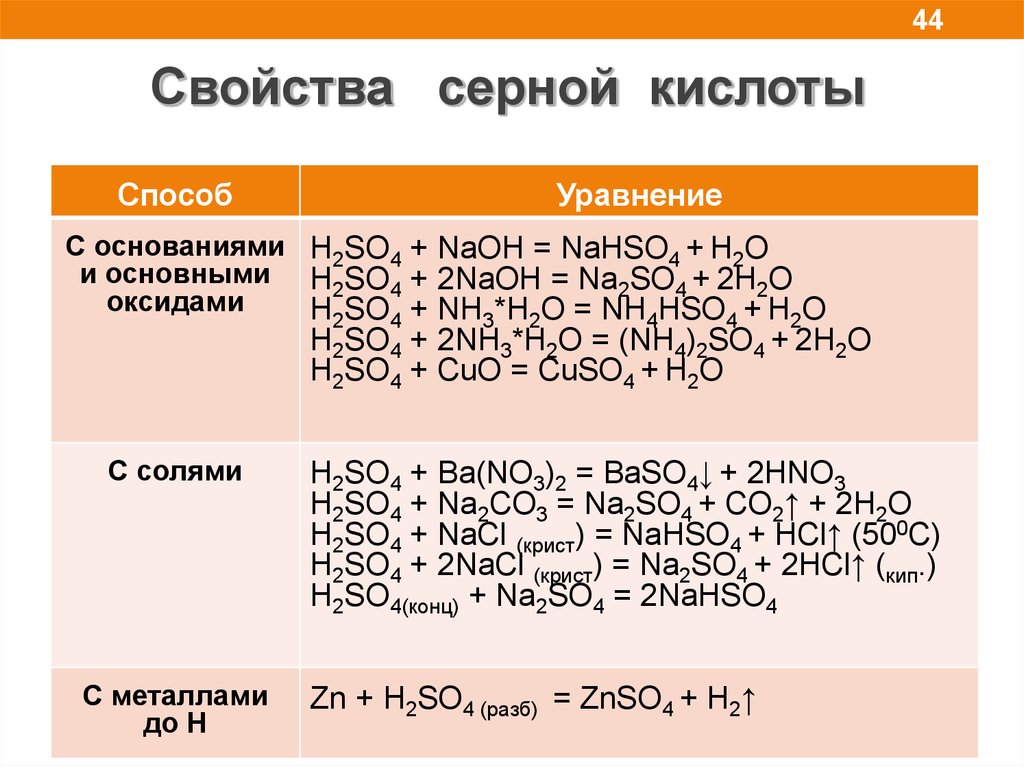
44.
44Свойства серной кислоты
Способ
Уравнение
C основаниями H2SO4 + NaOH = NaHSO4 + H2O
и основными H2SO4 + 2NaOH = Na2SO4 + 2H2O
оксидами
H2SO4 + NH3*H2O = NH4HSO4 + H2O
H2SO4 + 2NH3*H2O = (NH4)2SO4 + 2H2O
H2SO4 + CuO = CuSO4 + H2O
С солями
С металлами
до Н
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
H2SO4 + Na2CO3 = Na2SO4 + CO2↑ + 2H2O
H2SO4 + NaCl (крист) = NaHSO4 + HCl↑ (500C)
H2SO4 + 2NaCl (крист) = Na2SO4 + 2HCl↑ (кип.)
H2SO4(конц) + Na2SO4 = 2NaHSO4
Zn + H2SO4 (разб) = ZnSO4 + H2↑
45.
45Свойства серной кислоты
Взаимодействие концентрированной серной кислоты с металлами
+2ē
+6
H2SO4
Выс. конц.,
малоактивный в-ль
+6ē
Умеренно выс. конц.,
средне активный в-ль
+8ē
Низкая конц.,
активный в-ль
+4
SO2
0
S
-2
H2S
При низких температурах пассивирует железо, хром и алюминий
46.
46Свойства серной кислоты
Способ
Уравнение
C неметаллами 2H2SO4 + S = 3SO2 + H2O
2H2SO4 + C = 2SO2 + CO2 + 2H2O
6H2SO4 + 4P = 4H3PO3 + 6SO2
С
восстановителями
H2SO4 + H2S = S + SO2 + 2H2O
3H2SO4 + 2KBr = SO2 + Br2 + 2H2O + 2KHSO4
5H2SO4 + 8Kl = H2S+ 4l2 + 4H2O +4K2SO4
47.
47Пниктогены: общая характеристика
15(VA) группа ПСХЭ:
7N, 15P, 33As, 51Sb, 83Bi, 115Mc
X ns2np3
Свойство
N
P
As
Sb
Bi
+z
7
15
33
51
83
Электронная
конфигурация
[He]2s22p3
[Ne]3s23p3
[Ar]4s24p3
[Kr]5s25p3
[Xe]5s25p3
Ковалентный радиус, нм
0,7
1,1
1,2
1,4
1,5
Электроотрицательность
3,0
2,1
2,0
1,9
1,9
Типичные СО
-3 до +5
-3, 0, +3,
+5
+3, +5
+3
48.
48Физические свойства азота
N2 : ↑, б/ц, б/в, б/з, 15V(N2) в 100 V(H2O)
tпл = -2100С, tкип = -1960С
В земной коре
Селитры
NaNO3 - чилийская
KNO3 – индийская
Ca(NO3)2 - норвежская
Способы получения
1. Сжижение воздуха
2. Разложение нитрида лития:
2Li3N = 6Li + N2
3. Из нитритов и солей аммония:
NaNO2 + NH4Cl = N2 + 2H2O +NaCl
49.
49Физические свойства фосфора
50.
50Получение фосфора
Содержание в земной коре: 0,04 атомных % (0,1 масс. %)
Минералы:
1) Апатиты:
Гидроксоапатит Ca5(PO4)3OH
Фторапатит Ca5(PO4)3F
2) Фосфорит Ca3(PO4)2
Способы получения
1. Восстановление фосфатов коксом :
2Ca3(PO4)2 + 6SiO2 +10C = P4 + 6CaSiO3 + 10CO↑
2. Восстановление метафосфорной кислоты:
4HPO3 + 12C = P4 + 2H2↑ + 12CO↑
(электропечь, 15000C)
51.
51Химические свойства азота и фосфора:
взаимодействие с простыми веществами
Реагент
N2
P4
H2
NH3
(4000C, 200 атм, Fe)
-
O2
NO (разряд)
Hal2
-
PHal3, PHal5
S
-
P4S10, P4Sn (n=3-7)
Mеталлы
Li3N (комн.)
Mg3N2 (3000C)
Na3P (2000C)
Ca3P2 (3500C)
Р2O5
(P4O10)
52.
52Взаимодействие со сложными
веществами
Реагент
Р4
Вода
2Р(красн.) + 8H2O = 2H3PO4 + 5H2 (7000C, Pt/Cu)
Р4 + 6H2O = 3H3PO2 + РН3 (рН > 7)
Кислоты оксилители
Щелочи
6H2SO4 (конц) + P4 = 4H3PO3 + 6SO2
5HNO3 (конц) + P(красн) = 4H3PO4 + 5NO2 + H2O
(кип.)
Р4 + 3KOH(конц) + 3H2O = 3KH2PO2 + РН3
(кип.)
53.
53Водородные соединения
азота и фосфора
NH3 и РН3 – бесцветные газы с резким запахом
NH3 tпл = -780C
РН3 tпл = -1340C
tкип = -330C
tкип = -880C
1 V H2O – 1200V NH3 (н.у.) 100 V H2O – 26V РH3 (н.у.)
Получение
Вещество
Способ
Аммиак
Прямой синтез
3H2 + N2 = 2NH3 (400-5000C, 10-300 атм, Fe)
Ф. Габер
Фосфин
1. Взаимодействие фосфора со щелочами
Р4 + 3KOH(конц) + 3H2O = 3KH2PO2 + РН3 (кип.)
2. Гидролиз фосфидов
Ca3P2 + 6H2O = 2PH3 + 3Ca(OH)2
54.
54Свойства
аммиака
и
фосфина
Способ
Уравнение
C водой
С кислородом
NH3 + H2O = NH3*H2O
NH3 + H2O = NH4+ + OН- Кд= 1,8*10-5
PH3 + H2O ↔ PH4+ + OН- Кд= 4*10-28
4NH3 + 3O2 = 2N2 + 6H2O (горение в атм. О2)
4NH3 + 5O2 = 4NО + 6H2O (8000С, Pt)
PH3 + 2O2 = HPО3 + H2O
С хлором и бромом Cl2 + 2NH3 = NH2Cl + NH4Cl (комн.)
3Cl2 + 8NH3 = N2 + 6NH4Cl (сгорание)
C металлами
2Li + 2NH3 = 2LiNH2 + H2 (2200C)
3Mg + 2NH3 = 2Mg3N2 + 3H2 (6000C)
C оксидами
металлов
2NH3 + Al2O3 = AlN + 3H2O (10000C)
2NH3 + 3CuO = Cu + N2 + 3H2O (5000C)
C оксидами
неметаллов
NH3 + H2O + СО2 = NH4HCO3
2NH3 + CO2 = C(NH2)2O + H2O (180-5000C, p)
55.
55Свойства аммиака и фосфина
Способ
С кислотами
С растворами солей
C окислителями
Уравнение
NH3 + HCl = NH4Cl (соли аммония)
PH3 + HI = PH4I (соли фосфония)
FeCl2 +2NH3+2H2O = Fe(OH)2 + 2NH4Cl
3NH3+H2O+AgNO3=[Ag(NH3)2]OH+ NH4NO3
NiCl2 + 6NH3 = [Ni(NH3)6 ]Cl2
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
2NH3 + 3H2O2 = N2 + 6H2O
56.
56Оксиды азота и фосфора
57.
57Свойства азотистой кислоты
и нитритов
HNO2
– существует только в растворах.
Получение:
Ba(NO2)2 + H2SO4 = 2HNO2↑+ BaSO4↓
Свойства
1) Легко разлагается:
3HNO2 = HNO3 + 2NO↑ + H2O
2) Окислитель и восстановитель
2NaNO2 + 2KI + 2H2SO4 = I2 + 2NO + K2SO4 + Na2SO4 + 2H2O
5KNO2 + + 2KMnO4 + 3H2SO4 = 2MnSO4+5KNO3 + K2SO4 +
3H2O
58.
58Свойства азотной кислоты
HNO3 – бесцветная, летучая жидкость. При переливании
на воздухе образует туман – «дымящая азотная кислота»
(100%). В лаборатории используют 68% р-р.
Получение:
В промышленности
4NH3 + 5O2 = 4NО + 6H2O (8000С, Pt)
2NO + O2 = NO2
4NO2 + O2 + 2H2O = 4HNO3
В лаборатории:
NaNO3 (тв) + H2SO4 (конц) = HNO3 ↑+ NaHSO4
Сильная кислота:
HNO3 ↔ H+ + NO3-
59.
59Свойства азотной кислоты:
взаимодействие с неметаллами и их
соединениями
P(красн) + 5HNO3 (конц) = 4H3PO4 + 5NO2 + H2O (кип.)
C + 4HNO3 (конц) = CO2↑ + 4NO2 + 2H2O (кип.)
S + 6HNO3 = H2SO4 + 6NO2+2H2O (кип.)
3l2 + 10HNO3(конц) = 6HlO3 + 10NO2 + 2H2O
FeS + 12HNO3 = Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O
6Hl + 2HNO3(конц) = 3l2 + 10NO + 4H2O
60.
60Свойства азотной кислоты: взаимодействие с
металлами
Cu + 4HNO3(60-68%) = Cu(NO3)2 + 2NO2 + 2H2O
(Mg, Zn, Hg)
Cr, Al, Fe - пассивируются (оксидная пленка и низкая
растворимость нитратов в концентрированной азотной
кислоте)
3Cu + 8HNO3(<60%) = 3Cu(NO3)2 + 2NO + 4H2O
Fe + 4HNO3(30%) = Fe(NO3)3 + NO + 2H2O
4Zn + 10HNO3(10%) = 4Zn(NO3)2 + N2O + 5H2O
(Mg)
5Zn + 12HNO3(10%) = 5Zn(NO3)2 + N2 + 6H2O
(Mn, Mg)
5Fe + 12HNO3(5%) = 5Fe(NO3)2 + N2 + 6H2O
4Zn + 10HNO3(3-5%) = Zn(NO3)2 + NH4NO3 + 3H2O
(Al, Sn, Fe)
61.
61Свойства кислот фосфора
СО
Формула
6NO2+2H2O (кип.
+1
H3PO2
Название
Фосфорноватистая (гипофосфиты)
+3
H3PO3
Фосфористая (фосфиты)
+5
HPO3
H3PO4
H4P2O7
Метафосфорная
Ортофосфорная (фосфаты)
Пирофосфорная
H3PO4
Кристаллическое белое вещество, гигроскопичное,
растворимо в воде, разлагается при нагревании.
H3PO4 ↔ H+ + H2PO4-, K1= 7,1*10-3
H2PO4- ↔ H+ + HPO42-, K2= 6,3*10-8
HPO42- ↔ H+ + PO43-, K3 = 4,2*10-13
хорошо
62.
62Химические свойства ортофосфорной
кислоты
6NOРеагент
2+2H2O (кип.
Уравнение
Щелочи
H3PO4
MH2PO4
M2HPO4
M3PO4
Металлы
3Mg + 2H3PO4 = Mg3(PO4)2↓ + H2↑
Оксиды металлов
3ZnO + 2H3PO4 = Zn3(PO4)2↓ + 3H2O
Соли
3AgNO3 + H3PO4 = Ag3PO4↓ + 3HNO3 (NaHCO3)
NaCl + H3PO4(б/в) = NaPO3↓ + HCl + H2O (4000C)
63.
6314 (IVA) группа
14(VIA) группа ПСХЭ: 6С, 14Si, 32Ge, 50Sn, 82Pb, 114Fl
X ns2np2
Свойство
С
Si
Ge
Sn
Pb
+z
6
14
32
50
82
Электронная
конфигурация
[He]2s22p2
[Ne]3s23p2
[Ar]4s24p2
[Kr]5s25p2
[Xe]5s25p2
Атомный радиус, нм
0,077
0,117
0,122
0,140
0,146
Электроотрицательность
2,55
1,90
2,02
1,72
1,55
Типичные СО
-4, -2, 0,
+2,+4
-4, 0,
+2,+4
0, +2, +4
64.
Углерод: нахождение вприроде
По содержанию в земной коре – на 17 месте
64
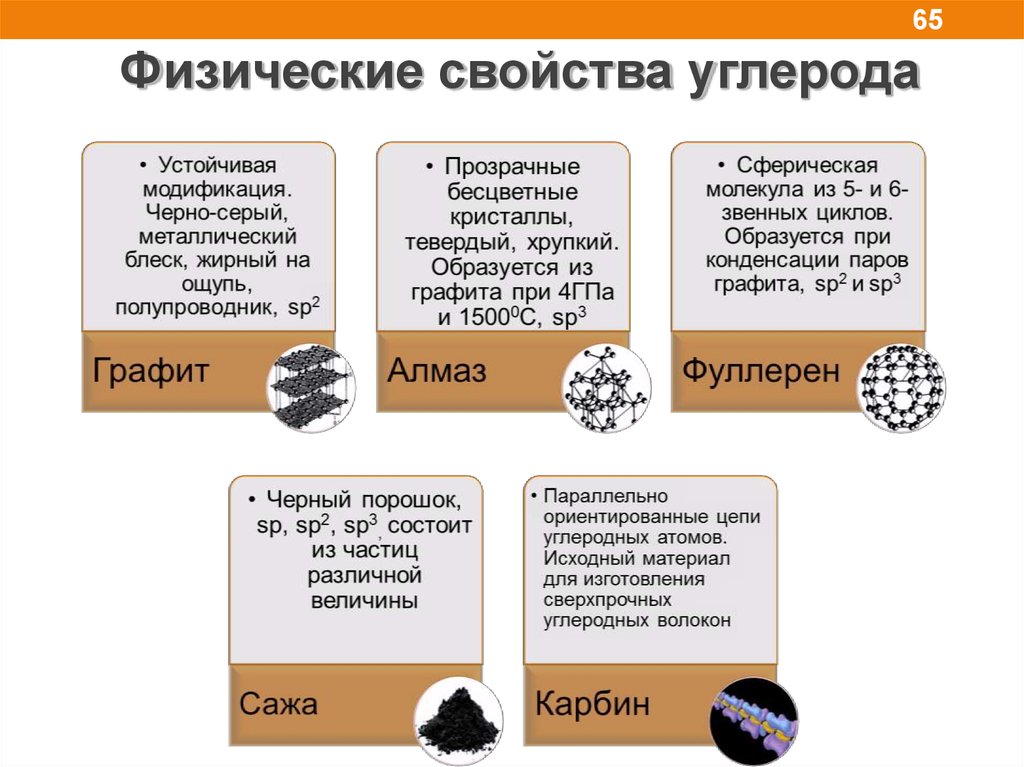
65.
65Физические свойства углерода
66.
66Кремний: нахождение в природе,
физические свойства, получение
По содержанию в земной коре – на 2 месте (27,5%).
(кварц, силикаты и алюмосиликаты)
1. Восставленные из кварца или тетрахлорида кремния
SiO2 + 2C = Si + 2CO
SiCl4 + 2Zn = Si + 2ZnCl2
2. Разложение силана
SiH4 = 2H2 + Si (400-5000C)
67.
67Химические свойства углерода и кремния:
взаимодействие с простыми веществами
Реагент
C
Si
H2
СН4 (6000C), С2Н2 (15000С)
-
O2
CO2 (6000C),
(10000C, недостаток
О2 )
CO
SiO2
(12000C)
F2
СF4 (9000С)
SiF4
SiCl4
SiBr4
(комн. t0C)
(3500C)
(6000C)
N2
C2N2 (дициан, разряд)
Si3N4
(15000C)
SiS2
SiS
(250-6000C)
(600-8000C)
Si/C
SiC (1200-13000C)
S
CS2 (700-8000C)
CO2 (10000C)
Mеталлы
CaC2 (5500C)
Ca2Si
(расплав)
CaC2 + H2O = Ca(OH)2 + C2H2 Be2C + 4H2O = 2Be(OH)2 + CH4↑
68.
68Взаимодействие углерода и кремния
со сложными веществами
Реагент
Щелочи
Вода
Оксиды металлов
Кислоты
Восстановители
Уравнение
Si + 2KOH + H2O = Na2SiO3 + 2H2↑
Si + 4KOH (конц.) = Na4SiO4 + 2H2↑
C + H2O = CO + H2
Si + 2H2O = SiO2 + 2H2
C + ZnO = Zn + CO
C + 2PbO = 2Pb + CO2
3C + CaO = CaC2 + CO
5C + 2CaO = 2CaC2 + CO2
(10000С)
(400-5000С)
(t0С)
(6000С)
(10000С)
(7000С)
С + 4HNO3(конц) = СO2 + 4NO2 + 2H2O
(t0С)
С + 2H2SO4конц) = СO2 + 2SO2 + 2H2O
(t0С)
Si + 4HF = SiF4 + 2H2
(1000С)
Si+ 2H2S = SiS2 + 2H2
(12000C)
69.
69Оксиды углерода
CO – бесцветный ядовитый газ
без запаха
C металлами
5CO + Fe = [Fe(CO)5] (100-2000C)
С неметаллами
СO + Cl2 = COCl2
2СO + O2 = 2CO2
СO + 2H2 = CH3OH (3000C, CuO, Cr2O3)
СO + 3H2 = CH4 + H2O (150-2000C, Ni)
С оксидами и гидроксидами
CO + NaOH = HCOONa (1300C)
5CO + I2O5 = 5CO2 + I2
СO + NiO = СO2 + Ni (3000С)
Получение:
1. Разложение
органических кислот
HCOOН = СО + H2O
H2C2O4 = СО + CO2 + H2O
(t0C, H2SO4 конц.)
2. Восстановление
углекислого газа углем
CO2 + С ↔ 2CO (10000С)
70.
70Оксиды углерода
CO2 – бесцветный газ без запаха, «парниковый
газ» (0,01-0,1 % в атмосфере), тв. – «сухой лед»
97,7%
0,3%
71.
71Оксиды углерода: СО2
C металлами
CO2 + 2Mg = 2MgO + C
2CO2 + 5Сa = 4CaO + CaC2 (5000C)
С неметаллами
СO2 + C = 2CO
СO2 + 4H2 = CH4 + 2H2O (2000C, Cu2O, Cr2O3)
С гидроксидами
CO2 + NaOH(разб) = NaHCO3
CO2 + 2NaOH(конц) = Na2CO3 + H2O
CO2 + 2NH3*H2O= NH4HCO3
CO2 + 2NH3(г) = С(NH2)2O
CO2 + 2Na2O2 = Na2CO3+ O2
CaCO3 + CO2 +H2O ↔ 2Ca(HCO3)
Ca(HCO3) + Сa(OH)2 ↔ 2CaCO3 + H2O
СaCO3 = CaO + CO2 (900-12000C)
72.
72Карбонаты
73.
73Оксиды кремния
SiO2 – тугоплавкое кристаллическое вещество, несколько
полиморфных модификаций
1. C металлами
SiO2 + 2Mg = Si + 2MgO (10000C)
Si + 2Mg = Mg2Si
2. С неметаллами
SiO2 + C = SiC + 2CO↑
SiO2 + 2H2 = Si + 2H2O
3. С оксидами, гидроксидами, солями
SiO2 + CaO = CaSiO3
SiO2 + 2NaOH = Na2SiO3 + H2O
CaCO3 +SiO2 = CaSiO3 + CO2
4. С плавиковой кислотой
SiO2 + 6HF(конц) = H2[SiF6] + 2H2O (350C)
SiO2 + 4HF = SiF4 + 2H2O (250-4000C)
α-кварц
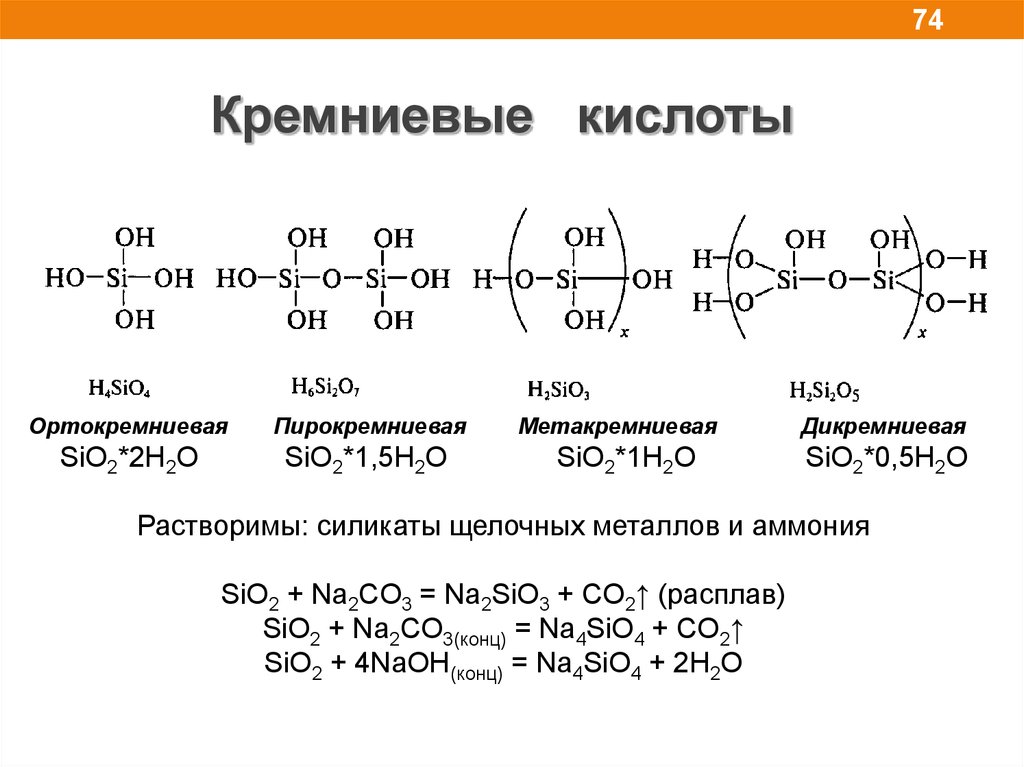
74.
74Кремниевые кислоты
Ортокремниевая
Пирокремниевая
SiO2*2H2O
SiO2*1,5H2O
Метакремниевая
SiO2*1H2O
Дикремниевая
SiO2*0,5H2O
Растворимы: силикаты щелочных металлов и аммония
SiO2 + Na2CO3 = Na2SiO3 + CO2↑ (расплав)
SiO2 + Na2CO3(конц) = Na4SiO4 + CO2↑
SiO2 + 4NaOH(конц) = Na4SiO4 + 2H2O
75.
75СПАСИБО ЗА ВНИМАНИЕ !




































































 chemistry
chemistry








