Similar presentations:
Неметаллы
1.
Тема. НеметаллыХимия – это
просто!
ViTa - курсы по химии и биологии
2.
ViTa - курсы по химии и биологии2
3.
Электронные конфигурации валентных электроновэлементов-неметаллов приведены в таблице:
1s
1
2
1
2
2
2
3
2
4
2
5
2s 2p
ns np
ns np
ns np
ns np
B
C
N
O
F
Si
P
S
Cl
As
Se
Br
Te
I
H
ViTa - курсы по химии и биологии
3
4.
Физические свойствафтор
оранжево-желтый
хлор
зеленовато-желтый
бром
кирпично-красный
йод
фиолетовый
сера
желтая
фосфор
белый, красный и
черный
жидкий кислород
голубой
ViTa - курсы по химии и биологии
4
5.
Закономерности в изменении свойствВ периоде:
-заряд ядра увеличивается,
-радиус атома уменьшается,
-число электронов на внешнем энергетическом
уровне увеличивается,
-электроотрицательность увеличивается,
-окислительные свойства усиливаются,
-неметаллические свойства усиливаются.
В группе:
-заряд ядра увеличивается,
-радиус атома увеличивается,
-число электронов на внешнем энергетическом
уровне не изменяется,
-электроотрицательность уменьшается,
-окислительные свойства ослабевают,
-неметаллические свойства ослабевают.
ViTa - курсы по химии и биологии
5
6.
Водородэлектронная конфигурация 1s1
При обычный условиях водород – это газ, без цвета, вкуса и запаха.
Самый легкий из всех газов. Очень мало растворим в воде.
Он сжижается при очень низкой температуре (- 253 °С).
ViTa - курсы по химии и биологии
6
7.
Химические свойства водорода1. Взаимодействие с Неме:
H2 + F2 = 2HF
(при обычной температуре)
С хлором реагирует только на свету, образуя хлороводород, с бромом реакция протекает
менее энергично, с йодом не идет до конца даже при высоких температурах.
2H2 + O2 = 2H2O
H2 + S = H2S (при 400 °С и выше)
3H2 + N2 = 2NH3
2NO + 2H2 = N2 + 2H2O
Важное значение имеет взаимодействие водорода с оксидом азота (II),
используемое в очистительных системах при производстве азотной кислоты
2. Взаимодействие с оксидами металлов:
CuO + H2 = Cu + H2O
3. Взаимодействие с активными металлами: 2Na + H2 = 2NaH;
(Только с теми, которые стоят после Al)
Ca + H2 = CaH2.
4. С твердыми солями средней и низкой активности:
C неорганическими кислотами не взаимодействует !!!!
ViTa - курсы по химии и биологии
7
8.
Получение водородаВ лаборатории: 1. Взаимодействие металла с разбавленными растворами серной и
соляной кислот, реакция проводится в аппарате Киппа:
Zn + 2HCl = ZnCl2 + H2
2. Взаимодействие алюминия или кремния с водными растворами щелочей:
2Al + 2NaOH + 10H2O = 2Na[Al(H2O)2(OH)4] + 3H2
Si + 2NaOH + H2O = Na2SiO3 + 2H2
В промышленности:
1. Электролиз водных растворов хлоридов натрия и калия или
электролиз воды:
2NaCl + 2H2O = H2 + Cl2 + 2NaOH;
2Н2О = 2Н2 + О2.
2. Конверсионный способ
1. С + Н2О = СО + Н2
2. CO +H2O = CO2 + H2
3. Окисление метана водяным паром: CH4 + H2O = CO + 3H2 (никелевый катализатор, при 800 °С)
4. Термическое разложение метана при 1200 °С:
CH4 = C + 2H2
ViTa - курсы по химии и биологии
8
9.
Применение водородаПрименение водорода основано на его физических и химических свойствах:
как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
кислородно-водородное пламя применяется для получения высоких температур
при сварки металлов;
как восстановитель используется для получения металлов (молибдена,
вольфрама и др.) из их оксидов;
для получения аммиака и искусственного жидкого топлива, для гидрогенизации
жиров.
ViTa - курсы по химии и биологии
9
10.
Галогены - Halns2np5
ViTa - курсы по химии и биологии
10
11.
флюоритCaF2
фторапатит
Ca5(PO4)3F
галит
NaCl
сильвин
KCl
сильвинит
NaCl·KCl
Свойство
F
Cl
Br
I
Агрегатное
состояние
Оранжевожелтый газ
Желто-зеленый
газ
Красно-бурая
жидкость
Чернофиолетовое
твердое вещество
Плотность,
3
кг/м
1696
3214
3123
4930
Температура
плавления,°С
-220
-100
-7
114(12 кПа)
Температура
кипения,°С
-188
-34
59
185
ViTa - курсы по химии и биологии
11
12.
Химические свойства галогенов1. Взаимодействие с ксеноном (только фтор!!!!)
2F2 + Xe = XeF4
2. Взаимодействие с металлами
!!! Фтор при нагревании реагирует со всеми металлами, включая золото и платину, на холоде
взаимодействует с щелочными металлами, свинцом и железом !!!
Хлор, бром и йод
При обычных условия – с щелочными и Щ/М
При нагревании – с медью, железом и оловом
2М + nHal2 = 2MHaln
3. Взаимодействие с водородом
Н2 + Hal2 = 2НHal
4. Взаимодействие с неметаллами
!!! С кислородом и азотом галогены
непосредственно не взаимодействуют !!!
2P + 3Cl2 = 2PCl3; 2P + 3I2 = 2PI3
Si + 2F2 = SiF4.
ViTa - курсы по химии и биологии
12
13.
5. Взаимодействие с водой3F2 + 3H2O = OF2 + 4HF + H2O2
Hal + H2O = HHal + HHalO
6. Взаимодействие со щелочами
Cl2 +2 KOH = KClO + KCl + Н2О (на холоде);
3Cl2 + 6KOH = KClO3 + 5KCl + 3Н2О (при нагревании)
Гипобромид-ион существует только при температуре ниже 0 °С, гипойодит-ион в растворах не существует.
7. Взаимодействие с сероводородом
H2S + Br2 = S + 2HBr.
8. Реакция замещения водорода в углеводородах
9. Взаимное замещение галогенов
CH4 + Cl2 = CH3Cl + HCl
C2H4 + Cl2 = C2H4Cl2
2KI + Br2 = 2KBr+ I2;
2HBr + Cl2 = 2HCl + Br2.
ViTa - курсы по химии и биологии
13
14.
Получение галогеновВ лаборатории:
Получение хлора действием соляной кислоты на окислители: MnO2, KMnO4,
PbO2, K2Cr2O7 :
16HCl + 2KMnO4 = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
Бром и йод получают действием окислителя на бромиды или йодиды в кислой среде:
MnO2 + 2KBr + 2H2SO4 = Br2 + MnSO4 + K2SO4 + 2H2O;
2NaNO2 + 2NaI + 2H2SO4 = I2 + 2NO + 2NaHSO4 + 2H2O
В промышленности:
Важнейший способ получения фтора – электролиз расплавов
фторидов. В качестве основного источника используется
гидрофторид калия KHF2, фтор выделяется на аноде.
Хлор: 2NaCl + 2H2O = 2NaOH + H2 + Cl2
Бром: 2KBr + Cl2 = 2KCl + Br2
2NaI + MnO2 + 3H2SO4 = I2 + 2NaHSO4 + MnSO4 + 2H2O
Основные источники получения йода – морские
водоросли и нефтяные буровые воды
ViTa - курсы по химии и биологии
14
15.
Применение галогенов и их соединенийФтор используется при синтезе полимерных материалов (фторопласты), как окислитель
ракетного топлива, жидкости (фреоны) для холодильных машин.
Хлор применяется для синтеза соляной кислоты, хлорной извести, винилхлорида, каучука;
для отбеливания тканей и бумажной массы; для обеззараживания питьевой воды.
Бром используется для приготовления лекарств, для получения различных органических
веществ, в лакокрасочной промышленности.
Йод применяется для приготовления лекарств, в анализе веществ.
Галогеноводороды используются в химической промышленности для получения
галогеноводородных кислот, из которых наиболее используемой является соляная.
Соляная кислота служит для получения её солей, как реагент в химических лабораториях,
для обработки руд, травления металлов, в пищевой промышленности и медицине.
ViTa - курсы по химии и биологии
15
16.
Кислород– вот без чего ты действительно не можешь жить
2s22p4
При обычных условиях кислород – газ без цвета, вкуса и запаха,
немного тяжелее воздуха, мало растворим в воде.
ViTa - курсы по химии и биологии
16
17.
Химические свойства кислорода1. Взаимодействие c металлами
4Al + 3O2 = 2Al2O3;
3Fe + 2O2 = Fe3O4.
2. Взаимодействие с неметаллами
S + O2 = SO2
(при 250°С)
4Р + 5О2 = 2Р2О5
(при 60°С)
С + О2 = СО2
2Н2 + О2 = 2Н2О
(при 700-800 °С)
(300 °С)
3. Взаимодействие с некоторыми сложными веществами
2CuS + 3O2 = 2CuO + 2SO2;
СН4 + 2О2 = СО2 + 2Н2О.
Горение, гниение, ржавление и дыхание протекают
при участии кислорода.
O2 + F2 = F2O2
2F2 + 2NaOH = OF2 + 2NaF + H2O.
ViTa - курсы по химии и биологии
17
18.
В лабораторииПолучение кислорода
1. В результате разложения некоторых солей:
2KClO3 = 2KCl + 3O2
2KMnO4 = K2MnO4 + MnO2 + O2
(при нагревании до 400 – 500 °С, в присутствии MnO2)
(при 210 – 240 °С)
2. В результате каталитического разложения пероксида водорода (катализатор MnO2)
2Н2О2 = 2Н2О + О2
3. Электролизом водного раствора гидроксида натрия (электроды никелевые)
2H2O = 2H2 + O2
В промышленности
1. Перегонка жидкого воздуха
2. Электролиз воды
12Н2О + 6СО2 = 6О2 + С6Н12О6 + 6Н2О
3. Синтез из неорганических веществ
ViTa - курсы по химии и биологии
18
19.
А кто такая сера? И где она живет?3s23p4
Значительная часть серы встречается в самородном
состоянии.
Также сера встречается в форме сульфидов: пирит,
халькопирит и сульфатов: гипс, целестин и барит.
Много соединений серы содержится в нефти (тиофен
C4H4S, органические сульфиды) и нефтяных газах
(сероводород).
Существует три аллотропные модификации
серы: ромбическая, моноклинная и пластическая.
ViTa - курсы по химии и биологии
19
20.
Химические свойства серы1. Взаимодействие с металлами
Cu + S = CuS
2. Взаимодействие с Неме:
H2 + S = H2S
S + O2 = SO2
при 150–200 °С
при 280 °С
2P + 3S = P2S3 (без доступа кислорода)
2S + C = CS2.
S + 3F2 = SF6
3. Взаимодействие со сложными веществами
3S + 6KOH = K2S+4 O3 + 2K2S-2 + 3H2O
ViTa - курсы по химии и биологии
20
21.
Получение серыИз самородных руд
При нагревании пирита без доступа воздуха
FeS2 = FeS + S
Окислением сероводорода при недостатке кислорода
2H2S + O2 = 2S + 2H2O
Из отходящих газов металлургических и коксовых печей, при
нагревании в присутствии катализатора
H2S + SO2 = 2H2O + 3S
ViTa - курсы по химии и биологии
21
22.
Азот2s22p3
Степень окисления: от -3 до +5
основной компонент земной атмосферы – 78 об. %.
входит в состав белковых тел всех растительных и
животных организмов
При обычных условиях азот – бесцветный газ, без
вкуса и запаха, абсолютно безвреден, немного
легче воздуха, мало растворим в воде.
ViTa - курсы по химии и биологии
22
23.
Химические свойства азотаВзаимодействие с металлами
!!! Гидролизуются с
образованием аммиака!!!
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
Взаимодействие с Неме:
O2 + N2 = 2NO
(высокая температура/электрический разряд)
3H2 + N2 = 2NH3 (T, P, Fe – катализатор)
2B + N2 = 2BN
!!!!! Азот непосредственно не взаимодействует с галогенами (кроме фтора) и серой, но
галогениды и сульфиды могут быть получены косвенным путем !!!!!
!!!!! С водой, кислотами и щелочами азот не взаимодействует !!!!!
ViTa - курсы по химии и биологии
23
24.
Способы получения азотаВ лаборатории
NaNO2 + NH4Cl = N2 + 2H2O + NaCl
NH4NO2тв = N2 + 2H2O
2NH3 + 3CuO = N2 + 3Cu + 3H2O;
4NH3 + 3O2 = 2N2 + 6H2O.
12HNO3 (разб.) + 5Mg = N2 + 5Mg(NO3)2 + 6H2O
2LiN3 = 3N2 + 2Li
В промышленности
Фракционная перегонка воздуха
ViTa - курсы по химии и биологии
24
25.
Фосфор3s23p3
степени окисления -3, +3, +5
апатит Ca5(PO4)3F, фосфорит Ca3(PO4)2 и флюорит CaF2
Черный
Белый
Красный
ViTa - курсы по химии и биологии
25
26.
Химические свойства азота1. Взаимодействие с простыми веществами
2P + 3S = P2S3,
4P + 5O2 = 2P2O5,
2P + 3Cl2 = 2PCl3.
4P + 3O2 = 2P2O3.
2P + 3Ca = Ca3P2
!!! Не взаимодействует с водородом !!!
2. Взаимодействие с водой
4Р + 6Н2О = РН3 + 3Н3РО2 (фосфорноватистая кислота)
3. Взаимодействие со щелочами
4Р + 3KOH + 3Н2О = РН3 + 3KН2РО2
4. Восстановительные свойства
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO;
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O.
6P + 5KClO3 = 5KCl + 3P2O5
ViTa - курсы по химии и биологии
26
27.
Получение фосфораполучают из апатитов или фосфоритов в результате взаимодействия с коксом и
песком при температуре 1500 °С:
2Ca3(PO4)2 + 10C + 6SiO2 = 4P + 10CO + 6CaSiO3
4HPO3 + 12C = 4P + 2H2 + 12CO
ViTa - курсы по химии и биологии
27
28.
Углерод2s22p2
Степени окисления: -4, +2, +4
Алмаз
Графит
ViTa - курсы по химии и биологии
28
29.
Химические свойства углерода1. Взаимодействие с Неме:
С + 2F2 = CF4
2С + О2 = 2СО,
С + О2 = СО2,
С + 2S = CS2
C + 2H2 = CH4
!!!! не взаимодействует с азотом и фосфором !!!
2. Взаимодействие с металлами
3. Взаимодействие с водой
4. Восстановительные свойства
Ca + 2C = CaC2
C + H2O = CO + H2
(Через раскаленный уголь)
2ZnO + C = 2Zn + CO2
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
C + 4HNO3 = CO2 + 4NO2 + 2H2O.
ViTa - курсы по химии и биологии
29
30.
Кремний3s23p2
Кремний образует две аллотропные
модификации – аморфный и кристаллический
кремний
ViTa - курсы по химии и биологии
30
31.
Химические свойства кремния1. Взаимодействие с Неме:
Si + 2F2 = SiF4
Si + 2Cl2 = SiCl4
Si + O2 = SiO2
Si + C = SiC
при нагревании до 400–600 °С
при нагревании до 2000 °С
Si + 3B = B3Si
3Si + 2N2 = Si3N4
при нагревании до 1000 °С
2. Взаимодействие с галогеноводородами
Si + 4HF = SiF4 + 2H2
при обычных условиях
с хлороводородом – при 300 °С, с бромоводородом – при 500 °С
3. Взаимодействие с металлами
2Ca + Si = Ca2Si
4. Взаимодействие с кислотами и щелочами
Кремний устойчив к действию кислот, в кислой среде он покрывается
нерастворимой пленкой оксида и пассивируется
3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O
Si + 2NaOH + H2O = Na2SiO3 + H2
ViTa - курсы по химии и биологии
31
32.
ПолучениеВ лаборатории
SiO2 + 2Mg = Si + 2MgO;
3SiO2 + 4Al = 3Si + 2Al2O3
В промышленности
SiO2 + 2C = Si + 2CO
SiCl4 + 2H2 = Si + 4HCl
SiCl4 + 2Zn = Si + 2ZnCl2
SiH4 = Si + 2H2
ViTa - курсы по химии и биологии
32
33.
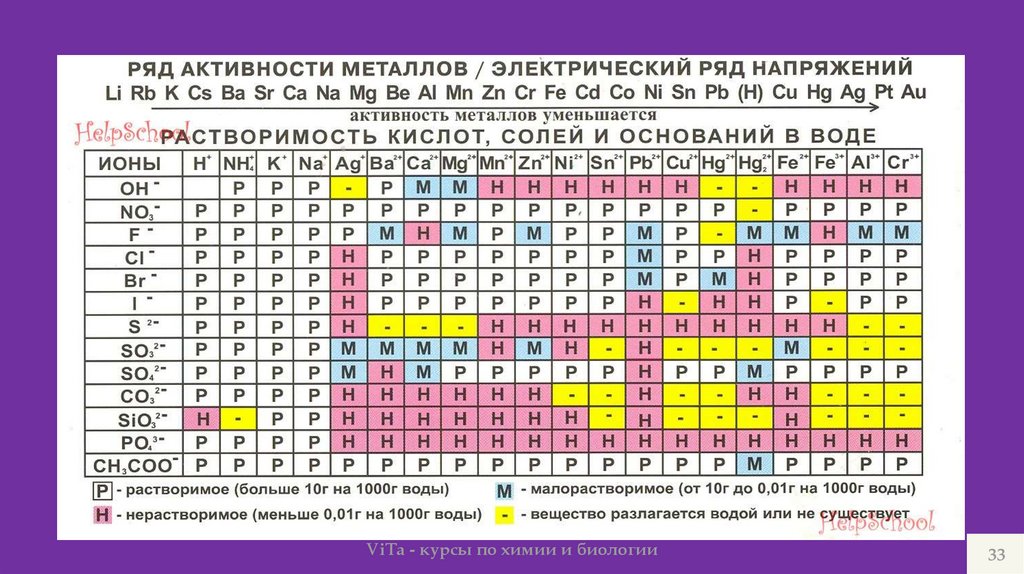
ViTa - курсы по химии и биологии33































 chemistry
chemistry








