Similar presentations:
Рубидий и цезий (Rb и Cs)
1. Литература по дисциплине «Химия редких и рассеянных элементов»
1) Редкие и рассеянные элементы. Химия и технология: в 3 кн.кн. 3: учебник для вузов / под общ. ред. С. С. Коровина. М.: МИСИС, 2003. – 440 с.;
2) Неорганическая химия: в 3 т. т. 2: Химия непереходных
элементов: учебник для студ. вузов / А. А. Дроздов [и др.];
под ред. Ю. Д. Третьякова. - М.: Академия, 2004. – 368 с.;
3) Неорганическая химия: в 3 т. т. 3, кн. 1, 2: Химия
переходных элементов: учебник для студ. вузов / А. А.
Дроздов [и др.]; под ред. Ю. Д. Третьякова. - М.: Академия,
2007. – 352 с.;
4) Неорганическая химия в реакциях. Справочник. / Лидин
Р.А., Молочко В.А., Андреева Л.Л. - 2-е изд., перераб. и доп. М.: Дрофа, 2007. - 637 с.
2. Рубидий и цезий (Rb и Cs)
3. История открытия рубидия
Рубидий был открыт в 1861 немецкимиучеными Робертом Бунзеном и
Густавом Кирхгоффом и стал одним из
первых элементов, открытых методом
спектроскопии, который был изобретен
Бунзеном и Кирхгоффом в 1859.
Название элемента отражает цвет
наиболее яркой линии в его спектре (от
латинского
rubidus
–
глубокий
красный).
Р.Бунзен, Г.Кирхгоф:
Rb, Cs (1861)
4. История открытия цезия
Цезий удостоился звания первогохимического элемента, нахождение
которого в земной коре было
обнаружено на основании данных,
полученных
при
помощи
спектрального анализа. Открытие
цезия произошло в 1860 г., в
результате изучения химического
состава
вод
Дюрхгеймского
минерального источника в Германии.
Сам
элемент
был
точно
идентифицирован
немецкими
учёными Р. В. Бунзеном и Г.
Кирхгофом методом спектрального
анализа, и по двум ярко-синим
линиям
в
спектре
получил
название caesius (Лат.) — небесноголубой.
5. Щелочные металлы на спектре
6. Распостранение рубидия в природе
Рубидий - типичный рассеянный элемент. Несмотряна сравнительно высокое содержание в земной
коре 1,5·10-2 % по массе, то есть больше, чем у Cu,
Pb, Zn и многих других металлов, рубидий не
образует собственных минералов и
преимущественно входит как изоморфная примесь
в минералы калия и цезия (сильвин, карналлит,
микроклин, Rb-мусковит и т. д.).
Рубидий, подобно калию, содержится в кислых
изверженных породах (до 1-3%).
Воды морей и океанов содержат от 1,0·10-5 до 2,1·10-5
% рубидия. Соли рубидия входят в состав вод
многих минеральных источников.
7. Минералы, содержащие рубидий
Карналлит K(RB)MgCl3 . 6H2Oкарналлит
Сильвин KCl
сильвин
8. Минералы, содержащие рубидий
Наиболее богаты рубидием так называемых минералыконцентраторы: лепидолит K2Li3Al4Si7O21(OH,F)3,циннвальдит K(Li,Fe,Al)3(OH,F)2[AlSi3O10],
поллуцит (Cs, Na)[AlSi2O6] · nH2O.
лепидолит
поллуцит
9. Распостранение цезия в природе
Цезий является очень редким и рассеянным элементом.Считается, что его содержание в земной коре в несколько
сотен раз меньше, чем рубидия и не превышает 7·10-4 %.
Цезий встречается в небольших количествах (порядка тысячных
долей процента) во многих горных породах; ничтожные
количества этого металла обнаружены в морской воде.
В большей концентрации (до нескольких десятых процента) он
содержится в некоторых калиевых и литиевых минералах,
главным образом в лепидолите.
Но особенно существенно то, что, в отличие от рубидия и
большинства других редких элементов, цезий образует
собственные минералы - поллуцит (Cs,Na)[AlSi2O6]·nH2O,
авогадрит (K,Cs)[BF4] и родицит (K,Cs)Al4Be4(B,Be)12O28.
Родицит крайне редок. Авогадрит тоже редок, поллуциты
встречаются нечасто; их залежи маломощны, зато цезия они
содержат не менее 20, а иногда и до 35%.
10. Минералы цезия
АвогадритРодицит
11. Получение рубидия
Соли рубидия получают как побочный продукт в производстве солей Li,Mg и К.
Металлический рубидий получают восстановлением соединений
рубидия (обычно галогенидов), кальцием или магнием:
2RbCl + 2Ca = 2Rb + CaCl2
Rb2CO3 + 3Mg = 2Rb + 3MgO + C
Рубидий также получают при переработке лепидолита на соединения Li,
или карналлита, служащего сырьем при производстве Mg. Остаток,
образующийся после отделения основных количеств Li, K и Mg и
содержащий соли K, Rb и Cs, разделяют на фракции методами
дробной кристаллизации, сорбции, экстракции и ионного обмена
(обратимая химическая реакция, при которой происходит обмен
ионами между твердым веществом (ионитом) и раствором
электролита).
12. Получение цезия
Лучший способ получения металлического цезия был предложен в 1911 г.французским химиком Акспилем. По методу Акспиля, хлорид цезия
восстанавливают металлическим кальцием в вакууме, реакция идет
практически до конца:
2CsCl + Ca = CaCl2 + 2Cs
Процесс ведут в специальном приборе (в лабораторных условиях - из кварца или
тугоплавкого стекла), снабженном отростком. Выделяющийся цезий
испаряется и отгоняется в отросток, а хлорид кальция полностью остается в
реакторе, так как в этих условиях летучесть соли ничтожна. В результате
повторной дистилляции в вакууме получается абсолютно чистый
металлический цезий. Этот способ до сих пор остается наиболее
распространенным.
По другому методу цезий получают, восстанавливая его бихроматом
циркония:
Cs2Cr2O7 + 2Zr = 2Cs + Cr2O3 + 2ZrO2
13. Физические свойства рубидия и цезия
СвойствоRb
Cs
Т пл., ⁰С
39,3
28,7
Т кип., ⁰С
696
667,6
Плотность,
г/см3 (20 ⁰С)
1,53
1,90
Рубидий - мягкий серебристо-белый металл.
При
обычной
температуре
имеет
пастообразную консистенцию.
Цезий - очень мягкий вязкий серебристожелтый, похожий на золото металл.
14. Химические свойства
Рубидий и цезий обладают высокой реакционной способностью. Навоздухе они мгновенно окисляются и воспламеняются, образуя
надпероксиды МO2 (с примесью пероксидов М2O2):
М + O2 = МO2 , 2М + O2 = М2O2
С водой рубидий и цезий реагируют со взрывом c образованием
гидроксидов и выделением водорода. Цезий взаимодействует даже
со льдом при –116° C:
2М + 2H2O = 2МOH + H2↑
Рубидий и цезий восстанавливают оксиды до простых веществ. Они
реагирует со всеми кислотами с образованием соответствующих
солей, а со спиртами дают алкоголяты:
2M + 2C2H5OH = 2C2H5OM + H2↑
15. Взаимодействие цезия с водой
16. Химические свойства
Рубидий и цезий взаимодействует и с углеродом. Только самая совершеннаямодификация углерода – алмаз – в состоянии противостоять рубидию и
цезию. При нагревании взаимодействуют с графитом, красным фосфором и
кремнием.
Выше 300 ⁰С разрушают стекло, восстанавливая кремний из SiO2 и силикатов:
4M + 3SiO2 = 2M2SiO3 + Si
Даже при обычной температуре реакции рубидия и цезия с фтором, хлором и
другими галогенами сопровождаются воспламенением, а с серой и
диоксидом углерода – взрывом. При нагревании рубидий и цезий
соединяется с водородом, образуя гидриды:
2M + H2 = 2MH
С азотом в обычных условиях рубидий и цезий не взаимодействуют. Нитрид
рубидия Rb3N и цезия Cs3N образуется в реакции с жидким азотом при
электрическом разряде между электродами, изготовленными из рубидия и
цезия соответственно.
17. Химические свойства
В аммиачном растворе рубидий и цезий медленно реагирует с аммиаком свыделением водорода и образованием амидов:
2М + 2NH3 = 2MNH2 + H2 ↑
Рубидий и цезий растворяются в жидком аммиаке, при этом получаются синие
растворы, обладающие электронной проводимостью:
M + 6NH3(ж.) = [M(NH3)6] (синий)
Со многими металлами рубидий и цезий образуют сплавы и интерметаллические
соединения. Соединения RbAu, CsAu (ауриды), является полупроводниками.
Антимонид цезия Cs2Sb используется при изготовлении фотоэлементов.
Рубидий и цезий опасны в обращении! Их хранят в ампулах из специального
стекла в атмосфере аргона или в стальных герметичных сосудах под слоем
обезвоженного масла (вазелинового, парафинового).
18. Пламя спиртовки при внесении солей лития (1), калия (2), рубидия (3) и цезия (4), пламя соответственно
Пламя спиртовки при внесении солей лития (1),калия (2), рубидия (3) и цезия (4), пламя
соответственно малинового, бледнофиолетового, рубинового и небесно-голубого цвета.
(1)
(2)
(3)
(4)
19. Соединения рубидия и цезия с водородом
Гидриды рубидия и цезия МеН в зависимости от метода получения представляютсобой либо белые сильно блестящие войлокообразное вещества, либо белую
довольно плотную массу.
Гидриды рубидия и цезия относятся к солеобразным соединениям, содержащим
анион Н–, который по своим физическим особенностям близок к галогенидионам.
Гидриды рубидия и цезия являются чрезвычайно химически активными
веществами. Они воспламеняются на воздухе, содержащем следы влаги,
самовоспламеняются в атмосфере хлора и фтора, взаимодействуют с бромом.
При нагревании с азотом или аммиаком гидриды образуют амиды рубидия и
цезия:
МН + NH3(ж.) = MNH2 + H2 ↑
Важная в практическом отношении реакция гидридов с водой протекает очень
бурно с выделением водорода:
МH + Н20 = МOH + Н2↑
20. Соединения рубидия и цезия с кислородом
Рубидий и цезий образуют (в зависимости от условий окисленияметалла) ряд соединений с кислородом: оксиды М20, пероксиды
М202, триоксиды М4(02)3, надпероксиды М02 и озониды М03.
При сгорании рубидия (или цезия) на воздухе или в кислороде
образуется надпероксид М02, содержащий всегда примеси М4(02)3 и
М202.
Все соединения рубидия и цезия, содержащие кислород, активно
взаимодействуют с влагой и диоксидом углерода из воздуха, а
пероксиды, надпероксиды и озониды легко окисляют органические
вещества с воспламенением или взрывом и поэтому должны
сохраняться в герметически закрытой таре.
Основная область применения оксидов — электротехника. Оксиды цезия
и рубидия, используются в сложных фотокатодах в виде тонких
пленок.
21. Оксиды
Оксиды рубидия и цезия (монооксиды Ме20) представляютсобой прозрачные иглы или листочки слабо-желтого (Rb20)
и коричнево-красного (Cs20) цвета, расплывающиеся на
воздухе.
При нагревании цвет оксидов рубидия и цезия изменяется:
первое соединение приобретает золотисто-желтый цвет
(200° С), а второе—сначала карминово-красный, а затем
черный (150°С). При охлаждении первоначальная окраска
оксидов постепенно восстанавливается.
Оксиды бурно взаимодействуют с расплавленной серой по
уравнению:
4Ме20 + 7S = Me2S04 + 6MeS
22. Пероксиды
Пероксиды рубидия и цезия (диоксиды М202) —бледно-желтые крайнегигроскопичные соединения. Устойчивы только в сухом воздухе.
С водой выше 25° С протекает реакция:
М202 + 2Н20 = 2МОН + Н202
В кислотах:
2М202 + 2H2S04(разб.гор.) = 2M2S04 + 2Н20 + 02↑
Озониды рубидия и цезия Ме03 выделяются в виде мелкокристаллического
порошка оранжевого (Rb03) или оранжево-красного (Cs03) цвета.
Образование озонидов протекает по реакции:
4МОН + 403 = 4М03 + 2Н20 + 02↑
С водой бурно взаимодействуют по реакции:
4М03 + 2Н20 = 4МOH + 502↑
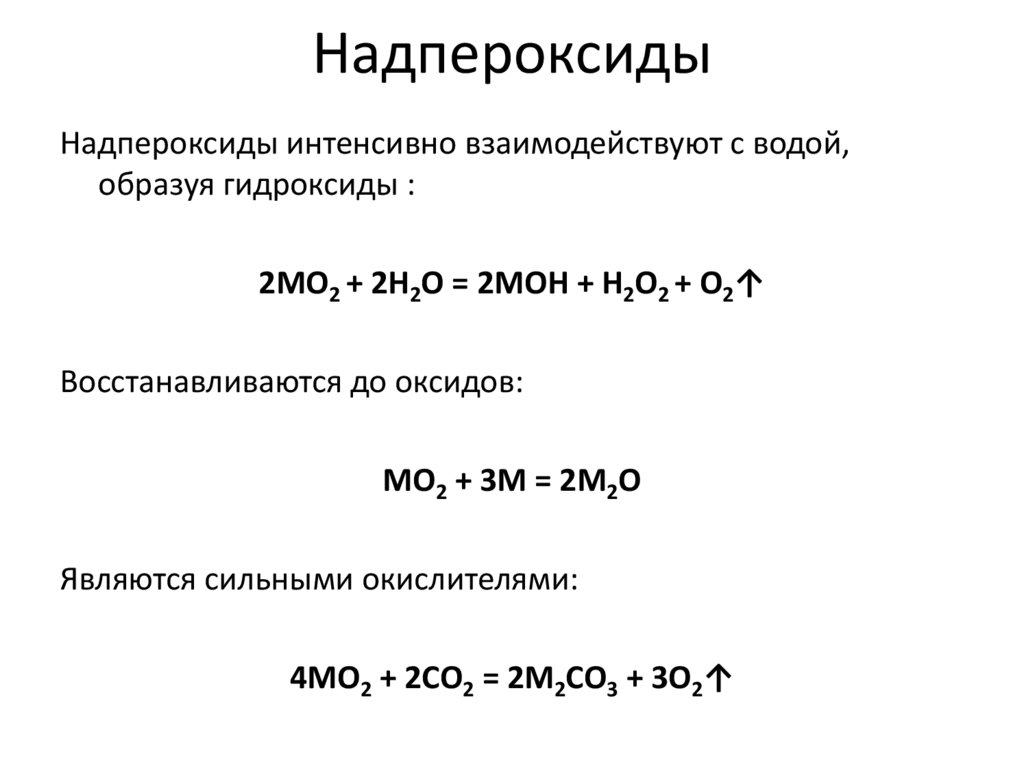
23. Надпероксиды
Надпероксиды интенсивно взаимодействуют с водой,образуя гидроксиды :
2МO2 + 2H2O = 2МOH + H2O2 + O2↑
Восстанавливаются до оксидов:
МO2 + 3М = 2М2O
Являются сильными окислителями:
4МO2 + 2CO2 = 2М2CO3 + 3O2↑
24. Гидроксиды
Безводные гидроксиды рубидия и цезия МОН представляют собой белые,кристаллические, очень гигроскопичные вещества, образующие с водой
различные гидраты МОН · nH2O .
Гидроксиды рубидия и цезия — весьма активные в химическом отношении
вещества. На воздухе они быстро расплываются и, поглощая диоксид
углерода, постепенно переходят в карбонаты:
2MOH (конц.) + CO2 = М2CO3 + H2O
При 400—500° С взаимодействуют с кислородом, образуя надпероксиды:
4MOH(ж.) + 3O2 = 4MO2 + 2H2O
Расплавленные гидроксиды рубидия и цезия разрушающе действуют на железо,
кобальт, никель, платину, изделия из корунда и диоксида циркония и
постепенно растворяют даже серебро и золото. Наиболее устойчивыми в
такой среде являются изделия из родия и сплавов родия с платиной.
25. "Рубидиевая лампа" ("лампа на рубидий") - используется в спектральном анализе
Применение изотопов рубидия.87Rb самопроизвольно испускает электроны
(β-излучение) и превращается в изотоп
стронция. Около 1% стронция образовалось
на Земле именно этим путем, и если
определить соотношение изотопов стронция
и рубидия с массовым числом 87 в какойлибо горной породе, то можно с большой
точностью вычислить ее возраст. Такой метод
пригоден применительно к наиболее
древним породам и минералам. С его
помощью установлено, например, что самые
старые скальные породы американского
континента возникли 2100 млн. лет тому
назад.
82Rb
Радионуклид
с
периодом
полураспада 76 с используется в диагностике.
С его помощью, в частности, оценивают
состояние миокарда (сердечной мышцы).
Изотоп вводится в кровеносную систему
пациента, и кровоток анализируется методом
позитронно-эмиссионной томографии (ПЭТ).
"Рубидиевая лампа" ("лампа
на рубидий") - используется в
спектральном анализе
26. Применение рубидия, цезия и их соединений
Цезий и его соединения нашли многочисленные применения в электронике,радиотехнике, химической промышленности, оптике, медицине, ядерной
энергетике и космической технике. В частности, цезий широко применяется в
фотоэлементах, иодид и бромид цезия используется в приборах
инфракрасного видения, монокристаллы CsI служат детекторами
ионизирующего излучения, соединения цезия входят в состав катализаторов
для ряда важных промышленных процессов (синтез аммиака, бутадиена,
получение оксида этилена).
Радиоактивный изотоп 137Cs (бета-излучатель с периодом полураспада 30,17 лет)
используется для стерилизации пищевых продуктов и медицинских
препаратов, в радиотерапии для лечения злокачественных опухолей. Кроме
того, 137Cs применяется в гамма-дефектоскопии и в производстве
радиоизотопных источников тока.
Изотоп 137Cs является одним из основных загрязнителей, которые попали в
окружающую среду в результате аварии на Чернобыльской АЭС.
Стабильный изотоп 133Cs используется в атомных часах - точнейшем приборе для
измерения времени.
27. Атомные часы
Согласносовременному
определению
секунда - интервал времени, равный
9192631770 периодам излучения, которое
соответствует переходу между двумя
сверхтонкими
уровнями
основного
состояния атома 133Cs. Другими словами,
атом 133Cs является стандартом для
измерений времени и частоты. Точность
измерения секунды лимитирует точность
измерения других основных единиц,
которые содержат секунду в своем
определении - например, таких как вольт
или метр. Цезиевые часы считались самыми
точными последние 50 лет. Сегодня много
областей науки и техники не могут обойтись
без цезия. В будущем следует ожидать, что
применение этого элемента станет более
широким
и
разнообразным.
28. Применение цезия и его соединений
Значительной сферой применения металлического цезия являются новейшие истремительно развивающиеся работы и производство энергетических
агрегатов. Ионизированые пары цезия являются лучшим рабочим телом для
ионных двигателей в космосе.
Ввиду того что цезий имеет большую теплоемкость, теплопроводность и ряд
собственных сплавов с очень низкой температурой плавления (цезий 94,5 и
натрий 5,5 %) -30 °C, то используется в качестве теплоносителя в атомных
реакторах и высокотемпературных турбоэнергетических установках.
Совершенно особое место и очень большую область применения и расхода
металлического цезия в последние годы представляет его использование в
качестве добавки к вольфраму для производства электродов мощных
осветительных дуговых ламп и электродов применяемых для сварки
алюминия, магния, титана, церия, нержавеющей стали и целого ряда
активных сплавов в среде аргона, гелия и водорода. Применение этой
добавки (около 0,1—0,35 %) в значительной степени облегчает зажигание и
горение дуги при низком напряжении.
29. Применение цезия и его соединений
Совсем недавно цезий приобрел новое направление своей ассимиляции(освоение практикой), и это направление является революционным
прорывом для разработки новейшей компьютерной техники, генераторов
энергии, холодильников глубокого холода (криогенных) и т.д. Так в опытах с
этим новым полупроводниковым материалом удалось на сегодняшний день
получить охлаждение вплоть до —237 °C, и это в свою очередь позволяет
создавать микрохолодильники для охлаждения мощных процессоров,
холодильники для глубокой заморозки тканей и клеточного материала,
сжижения газов, охлаждения боевых ультрафиолетовых и инфракрасных
лазерных систем, тепловизоров, а в перспективе для охлаждения
высокотемпературных сверхпроводников для высокоскоростного транспорта
на "магнитной подушке" (поезда и др).
Триборат цезия и триборат цезия-лития, а так же фосфат цезия-галлия
используются как специальные оптические материалы в новейших областях
радиоэлектроники.




























 chemistry
chemistry








