Similar presentations:
Общая характеристика металлов IА группы ПСХЭ Д.И. Менделеева
1. Общая характеристика металлов IА группы ПСХЭ Д.И.Менделеева
2. Периодическая система химических элементов Д.И.Менделеева
II
1
H
II
2
Li
III
3
Na
4
K
IV
5
6
V
7
8
VI
9
VII
10
II
Группы элементов
IV
V
VI
III
VII
VIII
He
Щелочные металлы
1
1.00797
Водород
6,939
3
Литий
19 Ca
39.102
Cu
63.546
37
85.47
Ag
107.868
Серебро
Cs
Цезий
79
Au
196.966
Золото
Fr
Франций
65.37
Цинк
38
87.62
Стронций
Sс
44.956
Скандий
Иттрий
112.41
Кадмий
Индий
56 57
137.34
Барий
Ртуть
200.59
Радий
Ac
227.028
Актиний
Ti
47.90
Zr
91.224
Цирконий
Hf
178.49
Гафний
Свинец
Rf
[261]
Резерфордий
O
8
15.996
Кислород
15 S
Фосфор
V
23
50.942
Ванадий
33
74.9216
Мышьяк
41
Nb
92.906
Ниобий
73
Ta
180.9479
Тантал
83
208.98
Висмут
105
Db
[262]
Дубний
F
фтор
16 Cl
32,064
Сера
Cr
24
51.996
Хром
Se
34
78.96
Селен
42
Mo
95.94
Молибден
51 Te
121.75
Сурьма
82 Bi
207.2
7
14.0067
30,9738
50 Sb
118.71
Олово
104
Азот
32 As
72.59
Германий
72
N
14 P
28,086
Титан
81 Pb
204.383
Таллий
88 89
[226]
La
138.81
Лантан
Hg Tl
80
22
49 Sn
114.82
12,011
Кремний
39 40
88.9059
6
Углерод
31 Ge
69.72
Галлий
Y
C
13 Si
26,9815
Алюминий
Cd In
48
87 Ra
[223]
5
10 .811
Zn Ga
30
55 Ba
132.905
Бор
20 21
40,08
Кальций
Sr
В
12 Al
24,312
Магний
Рубидий
47
4
9,012
11 Mg
Медь
Rb
Be
22,988
Калий
29
Гелий
Вериллий
Натрий
2
Теллур
74
52
127.60
W
183.85
Вольфрам
Po
25
Br
Бром
43
Sg
[263]
Сиборгий
10
20,18
Неон
18
Аргон
54.938
Железо
35 Kr
79.904
Tс
99
75
126.904
Re
186.2
Рений
Криптон
44
Астат
107
58.933
Кобальт
Ru 45 Rh
101.07
102.905
Родий
[262]
46
Pd
106.4
Палладий
54
Ксенон
131,3
Os 77 Ir 78 Pt
190.2
192.2
Осмий
Иридий
86
Радон
[222]
Bh 108 Hs 109 Mt
Борий
58.71
Никель
83,8
Рутений
76
Co 28 Ni
36
85 Rn
210
27
55.847
53 Xe
Иод
39,948
Mn 26 Fe
Технеций
I
Ne
17 Ar
35,453
Марганец
84 At
208.982
Полоний
106
Хлор
9
18.9984
4,003
[265 ]
Хассий
[266 ]
Мейтнерий
195.09
Платина
3.
Периодическая система химических элементов Д.И.МенделееваI
1
II
2
Li
III
3
Na
4
K
6,939
V
VI
11
Электроотрицательность
уменьшается
Металлические свойства
усиливаются
Радиус атома
увеличивается
22,9898
Натрий
19
39.102
Калий
Rb
37
85.47
Рубидий
Cs
55
132.905
Цезий
9
VII
10
VIII
В главной подгруппе:
Литий
7
8
VII
3
5
6
III
Щелочные металлы
I
IV
II
Группы элементов
IV
V
VI
Fr
87
[223]
Франций
4.
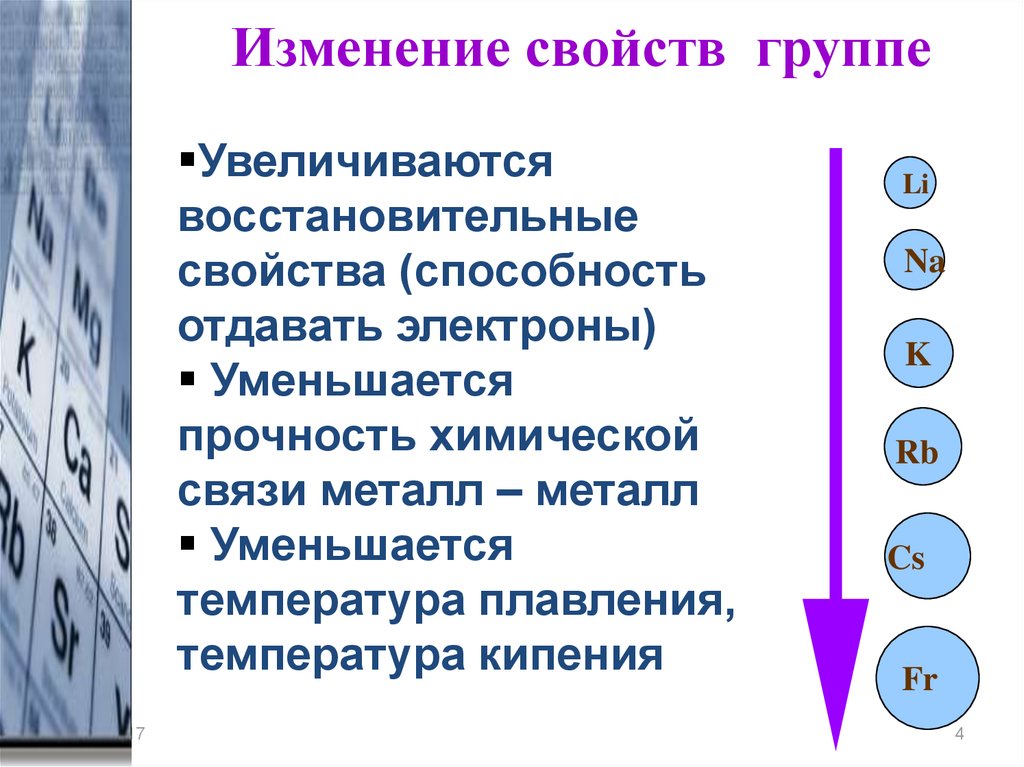
Изменение свойств группеУвеличиваются
восстановительные
свойства (способность
отдавать электроны)
Уменьшается
прочность химической
связи металл – металл
Уменьшается
температура плавления,
температура кипения
03.12.2017
Li
Na
K
Rb
Cs
Fr
4
5. Строение атомов щелочных металлов
СТРОЕНИЕ АТОМОВ ЩЕЛОЧНЫХ МЕТАЛЛОВСтроение внешнего энергетического уровня
1
ns
степень окисления +1.
6. ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ
• Литий был открытшведским химиком Й.
Арфведсоном в 1817 г.
• И назван литием (от
греч. литос – камень)
поскольку эта щелочь
впервые была
найдена в "царстве
минералов" (камней)
Арфведсон
Юхан Август
(12 .01.1792 г. –
28 .10.1841 г.)
6
7. ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ
• Натрий и калий были впервые полученыанглийским химиком и физиком Г. Дэви в
1807 г. при электролизе едких щелочей
Й. Берцелиус предложил назвать один
новый элемент натрием (от араб. натрун
– сода), а второй элемент калием (от
араб. алкали – щелочь)
Гемфри Дэви
(1778 – 1829)
7
8.
Эти металлы получилиназвание щелочных, потому
что большинство их
соединений растворимы в
воде.
По-славянски
«выщелачивать» означает
«растворять», это и
определило название данной
группы металлов
03.12.2017
8
9. Физические свойства
Liлитий
цезий
Все металлы этой подгруппы имеют
серебристо-белый цвет (кроме
серебристо-жёлтого цезия).
калий
натрий
рубидий
10. Франций
• радиоактивный щелочнойметалл
• В природе не существует в таких
количествах, которые достаточны
для изучения его свойств.
• Микроскопические количества франция223 и франция-224 могут быть
химически выделены из минералов урана
и тория. Другие изотопы франция
получают искусственным путём с
помощью ядерных реакций.
11. Физические свойства
• Литий, натрий и калий легче воды и плавают наеё поверхности, реагируя с ней.
12. Физические свойства
• Они очень мягкие, их можно резатьножом, скальпелем.
13. ХИМИЧЕСКИЕ СВОЙСТВА
• Из-за высокой химической активностищелочных металлов по отношению
к воде, кислороду, и иногда даже
и азоту (Li, Cs) их хранят под слоем керосина.
14.
Нахождение в природеКак очень активные металлы, они
встречаются в природе только в
виде соединений.
Натрий и калий широко
распространены в природе в виде
солей.
Соединения других щелочных
металлов встречаются редко.
15.
СподуменнLiAl[Si2O6]
16.
Галит NaСl17.
Сильвин КСl18.
Лепидолит- один из основных источниковредких щелочных металлов, рубидия и цезия
19. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВАВЗАИМОДЕЙСТВИЕ С КИСЛОРОДОМ:
4Li + O2 =2Li2O(оксид лития)
20. ВЗАИМОДЕЙСТВИЕ С КИСЛОРОДОМ:
Щелочной металл на воздухе легкоокисляется до оксида натрия.
2Na + O2 = Na2O
При горении на воздухе или в кислороде
образуются пероксиды:
2Na + O2 = Na2O2(пероксид натрия)
K + O2 = K2O2(пероксид калия)
21. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВАРеакции с неметаллами :
2Li + Cl2 = 2LiCl(галогениды)
2Na + S = Na2S(сульфиды)
2Na + H2 = 2NaH(гидриды)
6Li + N2 = 2Li3N(нитриды)
2Li + 2C = 2Li2C2(карбиды)
22.
Взаимодействие с водойВсе щелочные металлы активно реагируют с
водой, образуя щелочи и восстанавливая воду до
водорода:
2Ме0 + 2Н2О = 2Ме+1ОН + Н2
2Na + 2Н2О = 2NaOH + H2
Скорость взаимодействия щелочного металла с водой
увеличивается от лития к цезию:
Li - спокойно,
Na - энергично,
остальные – со взрывом –
воспламеняется выделяющийся Н2
Rb и Cs реагируют не только
с жидкой Н2О, но и со льдом. .
22
https://www.youtube.com/watch?v=K-GC_YR3das
23. С кислотами:
2Na+ Н2SО4 = Na2SО4 + Н2(протекают очень бурно)
https://www.youtube.com/watch?v=Td6itaN
fJrU&t=3s
24.
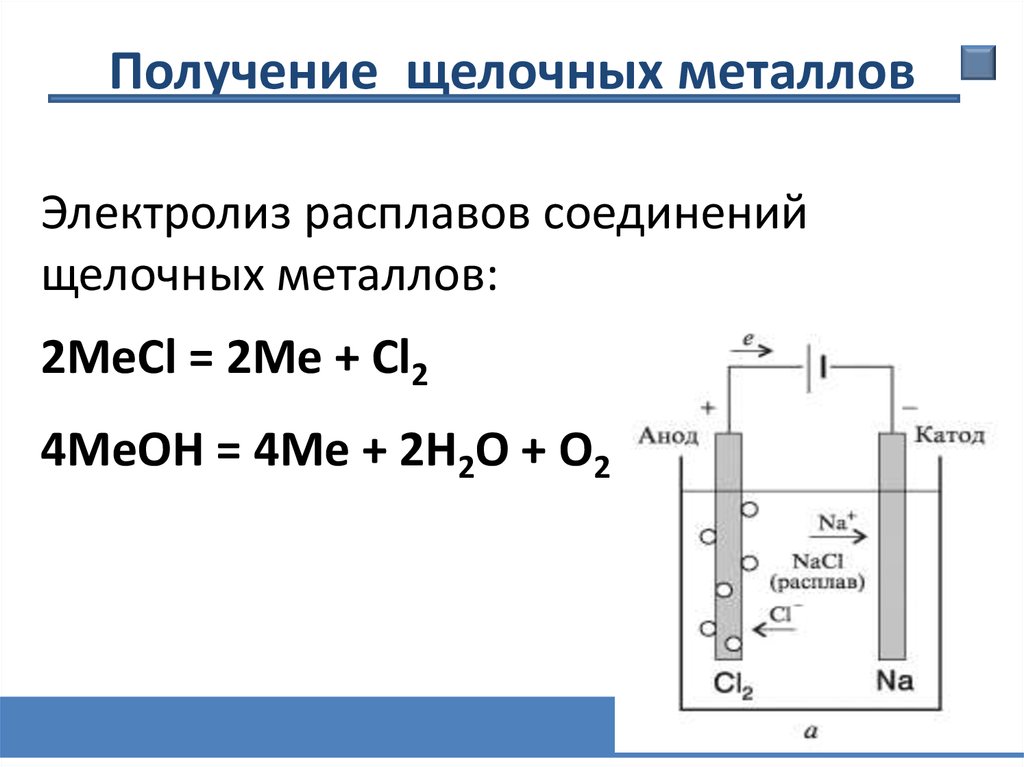
Получение щелочных металловЭлектролиз расплавов соединений
щелочных металлов:
2МеCl = 2Ме + Cl2
4МеOH = 4Ме + 2Н2О + О2
25. Окраска пламени ионами щелочных металлов
Качественная реакция на катионы щелочных металлов окрашивание пламени в следующие цвета:Li+
карминовокрасный
K+
Na+
желтый
Cs+
фиолетовый
03.12.2017
25
26. Оксид натрия
Хранить оксид натрия Na2O лучше всего вбезводном бензоле.
27.
Пероксид натрия Na2O228. ПОЛУЧЕНИЕ ОКСИДОВ
Чистый оксид натрия получитьнепосредственным окислением натрия
нельзя, так как образуется смесь,
состоящая из 20 % оксида натрия и
80 % пероксида натрия.
29.
ПОЛУЧЕНИЕ ОКСИДОВ1) Для получения оксидов натрия и калия
нагревают смеси гидроксида, пероксида
или надпероксида с избытком металла в
отсутствие кислорода:
Na2O2 + 2Na = 2Na2O
2) Прокаливанием
гидрокарбоната натрия:
2NаНСO3 = Na2O + Н2O + 2СO2
30.
Щёлочи• Общая формула – МеОН
• Белые кристаллические вещества,
гигроскопичны, хорошо растворимы в
воде (с выделением тепла). Растворы
мылкие на ощупь, очень едкие.
NaOH – едкий натр
КОН – едкое кали
LiOH - гидроксид лития
Основные свойства усиливаются в ряду:
LiOH → NaOH → KOH → RbOH → CsOH
31. Едкий натр (гидроксид натрия) NaOH
32. Едкое кали (гидроксид калия) КOH
33.
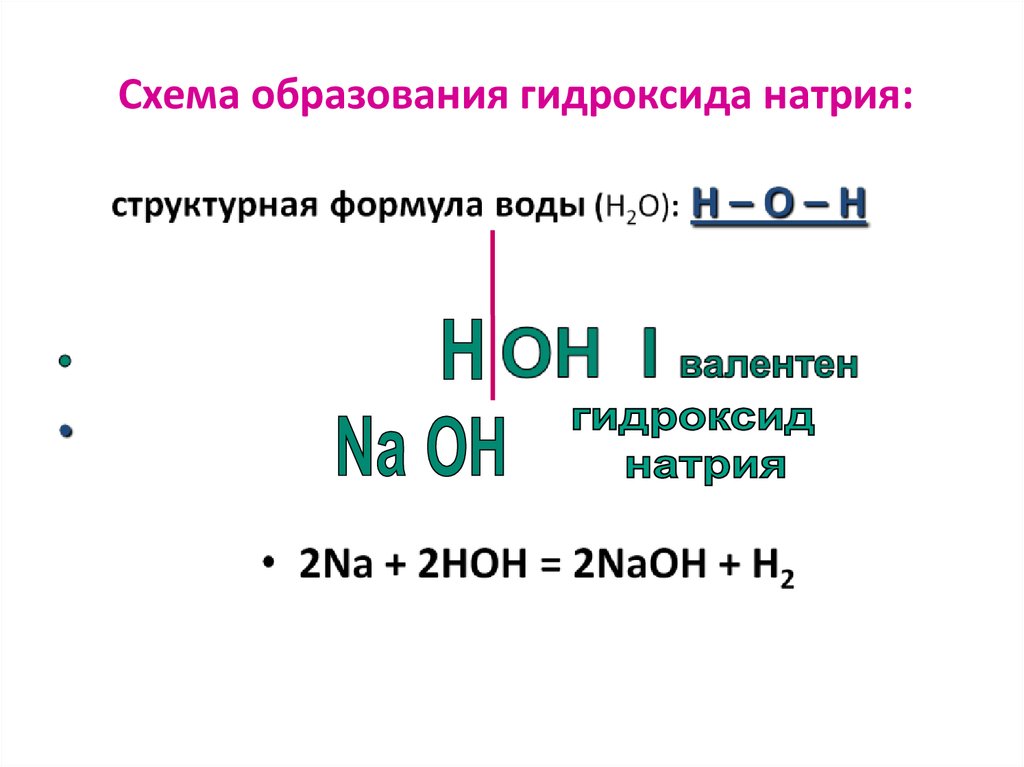
Схема образования гидроксида натрия:34.
Фенолфталеин- малиновый
35. Химические свойства
Они участвуют во всех реакциях,характерных для оснований —
реагируют с
кислотами,
кислотными и амфотерными оксидами,
амфотерными гидроксидами
с солями :
36.
Химические свойства1.С кислотами
Основание + кислота = Соль + вода
NaOH + HCl = NaCl + H2O
Реакцию между кислотой и
основанием, в результате которой
образуется соль и вода, называются
реакциями нейтрализации
37.
Химические свойства2. С кислотными оксидами
Щёлочь + кислотный оксид = соль + вода
(р-ция обмена)
Ca(OH)2 + CO2 = CaCO3 + H2O
Р2О5 + 6КОН = 2К3РО4 + 3Н2О
38. 3. С амфотерными гидроксидами:
2 NaOH + Zn(ОН)2 → Na2[Zn(OH)4]Тетрагидроксоцинкат
натрия
39.
Химические свойства4. С солями
Щёлочь + соли = (новое)основание +
(новая) соль.
NaOH + CuSO4 = Na2SO4+ 2 Cu(OH) 2 ↓
40. Соли натрия
Na2CO310H2O – кристаллическаясода используется в
стекольном производстве,
мыловарении, в производстве
стиральных и чистящих
порошков.
NaHCO3 Гидрокарбонат
натрия (другие
названия: питьевая сода(E500), пищевая
сода, бикарбонат
натрия, натрий
двууглекислый) —
кристаллическая соль.
41. Цезий - самый активный металл на Земле!
• https://www.youtube.com/watch?v=1gh5JJDvdiQ
42. Значение и роль калия в организме
• Натриий и калий отвечают за нормальныйводный баланс в организме. От этого
зависит работа сердца, а также
деятельность нервов и мышц.
• Калий уменьшает отёки и стимулирует
выработку необходимых ферментов.
43. источники натрия
Натрий содержится в капусте брокколи,цветной капусте, картофеле, фасоли,
винограде, арбузе.
44. источники калия
Калий содержится в продуктах растительногопроисхождения: фруктах, овощах,
картофеле, бобовых и злаковых культурах.
45.
• Мыла – это натриевые или калиевые соливысших жирных кислот, гидролизующихся в
водном растворе с образованием кислоты и
щелочи.
46. Рубидий
• Играет немалую роль в организме иоказывает такое влияние:
• оказывает антигистаминное воздействие
(борется с воздействием аллергенов);
• ослабляет воспалительные процессы в
клетках и организме в целом;
• оказывает успокаивающее воздействие
• Изотопы Rb(87) и Cs(137) - при лечении
злокачественных опухолей.
47. повторим:
ПОВТОРИМ:Наиболее выраженные металлические свойства проявляет:
? алюминий
? натрий
? магний
? бериллий
? железо
Активнее других реагирует с кислородом....
? алюминий
? серебро
? цинк
? барий
При комнатной температуре вытесняет водород из воды...
? медь
? железо
? литий
? цинк
48.
Калий взаимодействует с водой с образованием.... и....
? соли
? водорода
? щелочи
? оксида калия
В химических реакциях атом алюминия - ...
? окислитель
? восстановитель
? окислитель и восстановитель
? не отдает и не принимает электроны
49.
ЗАДАНИЕС помощью уравнений реакций осуществите
превращения:
1)
Na → Na2O2 → Na2O
NaOH → Na2CO3
2) Li → Li2O → LiOH → LiCl
LiOH
https://www.youtube.com/watch?v=nMptepCx0Jw
https://www.youtube.com/watch?v=rccFLDrWMxc&t=4s
Окраска пламени
49














































 chemistry
chemistry








