Similar presentations:
Щелочные металлы. Нахождение в природе и получение
1. s-элементы 1 группы: щелочные металлы
Береснева Е. В.к.п.н., профессор кафедры
фундаментальной химии и методики
обучения химии ВятГУ
2. План лекции
• Введение• 1. Нахождение в природе и получение
• 2. Общая характеристика элементов и простых
веществ
• 3. Химические свойства простых веществ и
соединений
• 4. История открытия
• 5. Значение и применение щелочных металлов
и их соединений (самостоятельная работа)
• 6. Круговорот натрия и калия в природе
(самостоятельная работа)
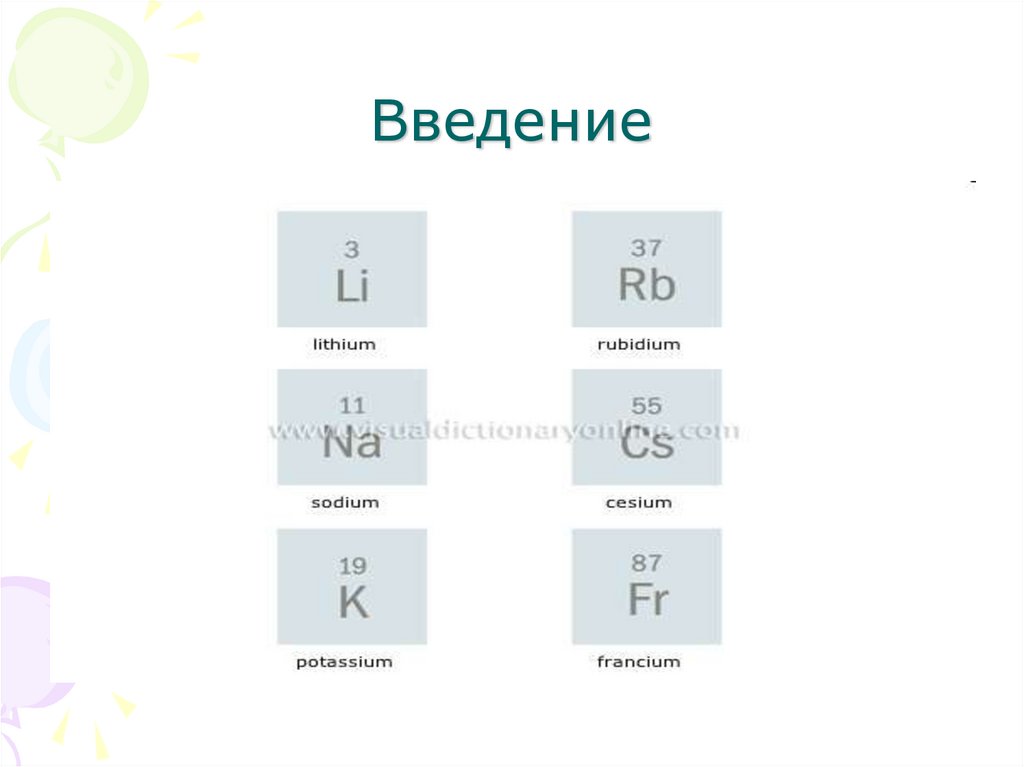
3. Введение
4. Почему эти металлы называются щелочными?
• Большинство соединений щелочных металловявляются растворимыми. По-славянски
растворять – выщелачивать. «Щелок» –
раствор, который получали после растворения
золы, – обладал моющими свойствами, так как
содержал карбонаты щелочных металлов,
которые подвергались гидролизу, увеличивая
рН раствора и умягчая воду
5. Дополнительная литература
• 1. Венецкий С. И. Рассказы о металлах. – М.:Металлургия, 1978
• 2. Крицман В. А. Книга для чтения по неорганической
химии. Ч. 2. – М:. Просвещение, 1983
• 3. Гроссе Э., Вайсмантель Х. Химия для любознательных.
– Л.: Химия, 1978
• 4. Популярная библиотека химических элементов. – М.:
Наука, 1977
• 5. Альтшулер С. В., Кривомазов А. Н. и др. Открытие
химических элементов. – М.: Просвещение, 1980
• 6. Николаев А. Л. Первые в рядах элементов. – М.:
Просвещение, 1983
• 7. Реми Г. Курс неорганической химии. Т. 1. – М.: Мир,
1974
• 8. Карапетьянц М. Х., Дракин С. И. Общая и
неорганическая химия. – М.: Химия, 1993
6. 1. Нахождение в природе и получение
• Природные натрий и цезий – моноизотопныеэлементы, у лития и рубидия по 2 изотопа, у
калия – 3. Помимо 223Fr известно еще 22 его
радиоактивных изотопа с массовыми числами
от 204 до 226. Вследствие высокой химической
активности щелочные металлы в свободном
состоянии в природе не встречаются
• Литий, рубидий и цезий редко образуют
собственные минералы и главным образом
сопровождают натрий и калий, особенно в
алюмосиликатах: Me2[Al2Si8O9(F · OH)] –
лепидолит (Me – K, Li, Rb, Cs)
7. Нахождение в природе
• Франция в природе на всем земном шаресодержится ≈25мг (в ряде источников
указывается цифра до 500 г) Т1/2 (Fr)=21 мин.
• Минералы натрия и калия:
• алюмосиликаты: KAlSi3O8 – полевой шпат,
KAl2[AlSi3O10] · (OH · F)2 – калиевая слюда
• NaNO3 – чилийская селитра
• Na3[AlF6] – криолит
• Na2CO3 · 10H2O – натрон
(кристаллическая сода)
• K2SO4 · MgSO4 · 6H2O – шенит
• K2SO4 · 2MgSO4 – лангбейнит
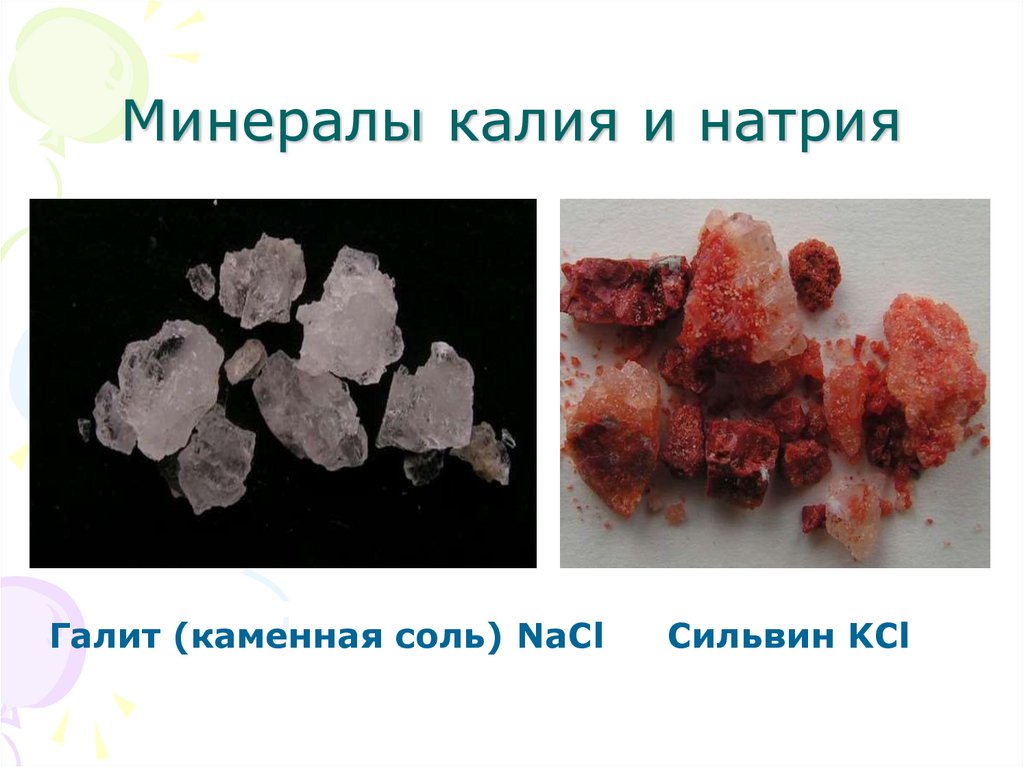
8. Минералы калия и натрия
Галит (каменная соль) NaClСильвин KCl
9. Минералы калия и натрия
СильвинитNaCl·KCl
Карналлит
KCl · MgCl2 · 6H2O
Каинит KCl · MgSO4 · 3H2O
10. Мирабилит (глауберова соль) Na2SO4 · 10H2O
11. Получение щелочных металлов
• Из-за высокой химической активностищелочные металлы нельзя получать
восстановлением их соединений оксидом
углерода(II) подобно железу или электролизом
водного раствора соли
• 1. Электролиз расплавов веществ
• Литий – электролиз расплава смеси LiCl · LiF:
• K (-) Li+ + e → Lio
• A (+) 2Cl- - 2e → 2Clo → Cl2
• Натрий и калий – электролиз расплава солей
и гидроксидов:
• K(-) Na+ + e → Nao
• A(+) 4OH- - 4e → 4OH → 2H2O + O2
12. Получение щелочных металлов
• 2. Металлотермия• Литий восстанавливают алюминием из
алюмината лития:
• 3LiAlO2 + Al → 3Li + 2Al2O3
• Калий чаще получают пропусканием паров
натрия через хлорид или гидроксид калия:
• KCl + Na → NaCl + K; t = 800°C
• KOH + Na → NaOH + K
• Рубидий и цезий восстанавливают из
хлоридов металлическим кальцием (t = 700800оС, вакуум)
• 2RbCl + Ca → 2Rb + CaCl2
• Франций извлекается из растворов
хлорплатинатами цезия и рубидия:
Cs2PtCl6, Rb2PtCl6
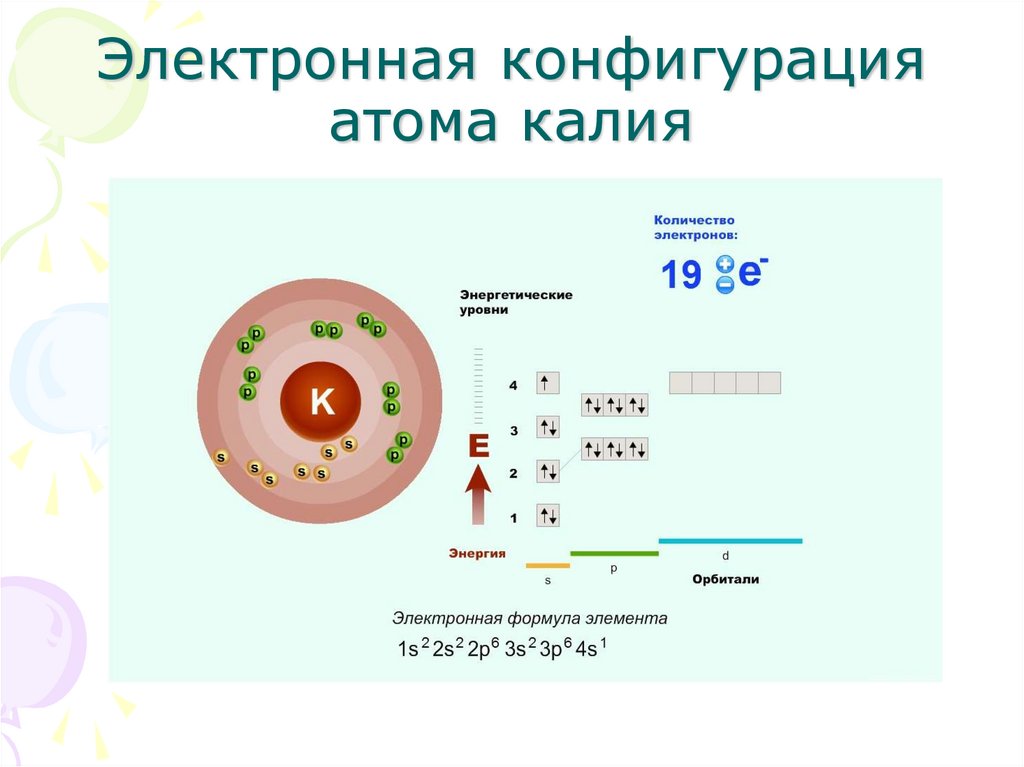
13. 2. Общая характеристика элементов и простых веществ
Элементы 1 группы – щелочные металлы –имеют на внешнем энергетическом уровне только
1 электрон, поэтому они одновалентны
Общая электронная конфигурация атомов этих
элементов:
Напишите электронные формулы атомов
всех элементов 1 группы. Какие степени
окисления они будут проявлять?
14. Электронная конфигурация атома калия
15. Строение атомов щелочных металлов
• Атомы щелочных металлов имеют относительновысокие радиусы в сравнении с атомами других
элементов (почему?)
• В группе сверху вниз радиусы атомов возрастают
(почему?): r(Li) = 0,155 нм; r(Na) = 0,189
нм; r(K) = 0,233 нм; r(Rb) = 0,248 нм; r(Cs) =
0,268 нм; r(Fr) = 0,280 нм
• Атомы щелочных металлов связаны
металлической связью, прочность которой
уменьшается от лития к цезию (почему?), имеют
металлическую кристаллическую решетку
16. Металлическая связь
• Связь между атомами в кристалле щелочныхметаллов однотипна, так как все они
кристаллизуются по типу центрированного куба
(кубическая объемноцентрированная
решетка). Однотипные связи тем прочнее, чем
они короче, увеличение радиусов от лития к
цезию свидетельствует об ослаблении прочности
металлической связи
• Прочность связи между атомами щелочных
металлов в их кристаллических структурах
количественно характеризуется энтальпиями
сублимации (что называется сублимацией?):
Ме(К) = Ме(Г), ∆Носубл., которые уменьшаются в
подгруппе. Почему?
17. Энтальпия сублимации
• Самая высокая энтальпия сублимации у лития,она вызвана малыми размерами атомов лития и
поэтому относительно большим перекрыванием
s-орбиталей в кристаллической решетке
• Атомы цезия в структуре металла связаны между
собой наименее прочно – металлическая связь
из-за больших размеров атомов и малой
электронной плотности в зонах перекрывания sорбиталей наиболее слаба
• Пары щелочных металлов ~ на 1% состоят из
двухатомных молекул, подобно молекуле
водорода
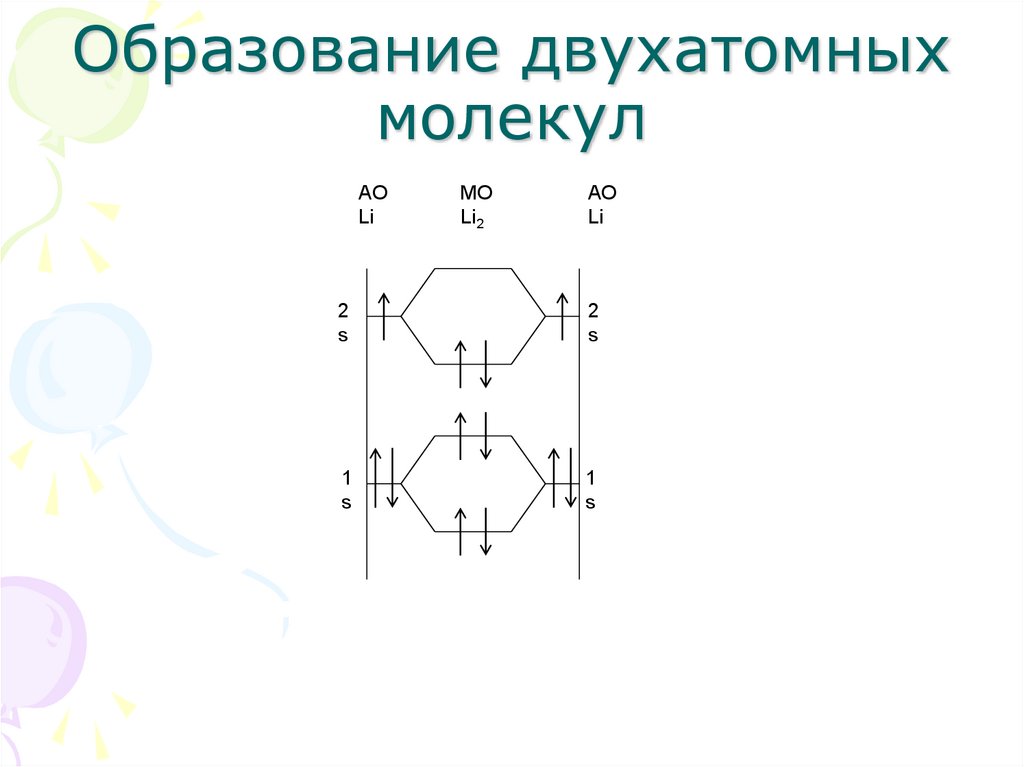
18. Образование двухатомных молекул
AOLi
МО
Li2
АО
Li
2
s
2
s
1
s
1
s
19.
LiRb
Na
Cs
K
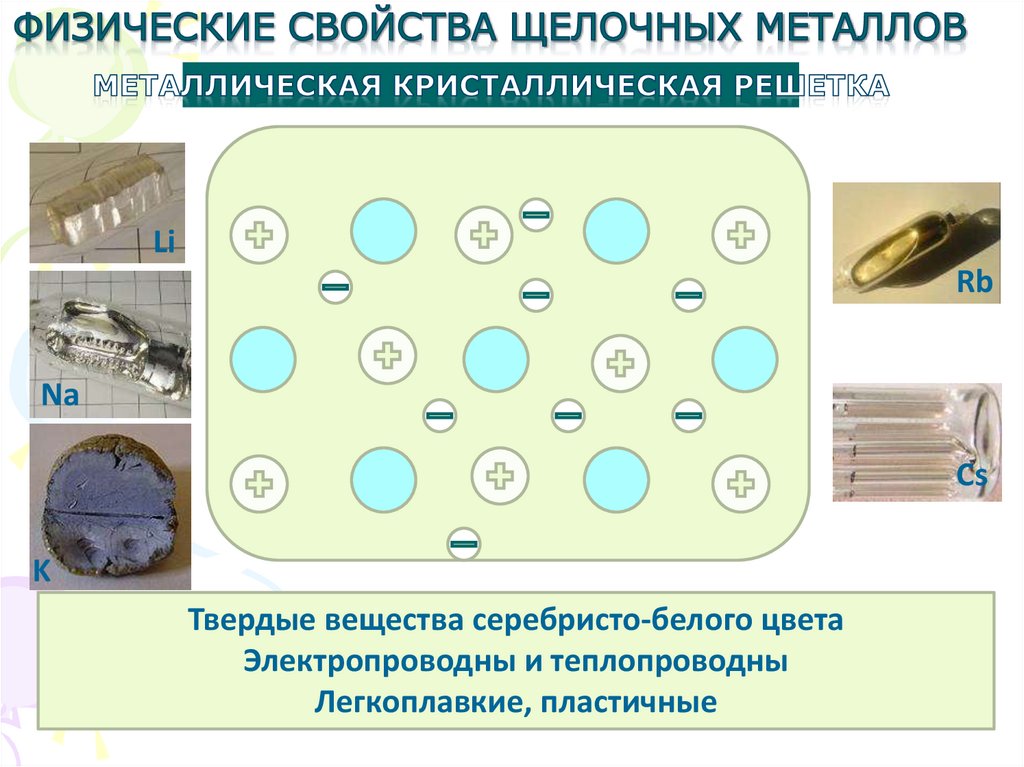
Твердые вещества серебристо-белого цвета
Электропроводны и теплопроводны
Легкоплавкие, пластичные
20. Физические свойства
• На срезе щелочные металлы – блестящие,серебристо-белые, легко покрываются на
воздухе оксидной пленкой
• Хранят щелочные металлы обычно в
керосине, а цезий, как наиболее активный – в
откаченных от воздуха стеклянных ампулах.
• Самый тяжелый и самый активный щелочной
металл – франций. Кроме того, это самый
неустойчивый из первых 100 элементов
периодической системы
21. Физические свойства
При переходе от лития кцезию температура
плавления металлов
понижается, указывая на
ослабление связи между
атомами
Щелочные металлы –
легкие. Самый легкий –
литий, он всплывает на
поверхность даже легких
масел; это затрудняет и
усложняет его хранение
22. Физические свойства
• Электропроводность металлов в основномзависит от энергии ионизации, типа, энергии и
длины связи между атомами в кристаллической
решетке, координационного числа атома,
температуры и других факторов. Цезий, являясь
самым типичным металлом, тем не менее,
обладает наименьшей удельной
электропроводностью среди щелочных металлов
• Щелочные металлы – мягкие. Самым твердым
металлом является литий, хотя он мягче талька
– первого минерала шкалы твердости.
Наименьшую твердость имеет цезий,
напоминающий по своей консистенции воск
23. 3. Химические свойства простых веществ и соединений
• Химическая активность щелочных металлов неимеет себе равных среди других металлов
• Литий значительно отличается по свойствам
от остальных щелочных металлов. Ион лития
способен значительно сильнее притягивать к себе
противоположно заряженные ионы (гидроксид
лития – сильная щелочь, но самое слабое
основание в ряду оснований МеОН). Энергия
гидратации иона Li+ максимальна в ряду ионов
щелочных металлов (справочник)
24. Гидратация ионов
• Размеры гидратной оболочки характеризуютсярадиусом гидратированного катиона. Он
уменьшается от Li+ к Cs+, то есть самый
маленький катион Li+ имеет самую крупную
гидратную оболочку и самые большие энтальпию
и свободную энергию гидратации
• Это приводит к различного рода аномальным
свойствам катиона лития и явному отличию от
других щелочных металлов
25. Восстановительные потенциалы
• Стандартные восстановительные потенциалыщелочных металлов изменяются от лития к цезию
без какой-либо закономерности
• В растворе у лития наибольший отрицательный
стандартный электродный потенциал не только
среди щелочных металлов, но и среди всех
металлов (самый сильный восстановитель в
водном растворе). У Na наименьший
потенциал среди щелочных металлов. У K, Rb и
Cs восстановительные потенциалы примерно
равны
26. Восстановительные потенциалы
• Электродные потенциалы щелочных металловв расплавленных солях изменяются так, как
это можно ожидать по их положению в группе
– их отрицательные значения возрастают от
лития к цезию. Цезий обладает наиболее
сильными восстановительными
свойствами в расплавах среди щелочных
металлов:
• LiClрасплав + Cs → CsCl + Li
• https://www.youtube.com/watch?v=6j_CA9SyrC
w
27. Восстановительные свойства
• Реакции с простыми веществами• С галогенами:
• 2Na + Cl2 → 2NaCl (галогениды)
• С кислородом:
• 4Li + O2 → 2Li2O
оксид лития
• 2Na + O2 → Na2O2 пероксид натрия
• K + O2 → KO2 надпероксид калия
• С азотом:
• 6Li + N2 → 2Li3N реагирует при комнатной
температуре с образованием нитрида лития.
Остальные щелочные металлы реагируют с
азотом при нагревании
28. Восстановительные свойства
• С фосфором:• 3K + P → K3P (фосфиды)
• С серой:
• 2Na + S → Na2S (сульфиды)
• С углеродом:
• 2Na + 2C → Na2C2 (карбиды,
преимущественно ацетилениды)
• С водородом:
• 2Na + H2 → 2NaH (гидриды)
• https://ok.ru/video/262500585826
29. Химические свойства простых веществ
• Реакции со сложными веществами• С водой: 2Na + 2Н2О → 2NaOH + H2
• С пероксидами металлов:
• Na2O2 + 2Na → 2Na2O
• С концентрированными кислотами:
• 8Na + 5H2SO4(конц.) → 4Na2SO4 + H2S + 4H2O
• 8Na + 10HNO3(конц) → N2O + 8NaNO3 + 5H2O
• 2Na + 2HCl → 2NaCl + H2↑
• С расплавами солей: 3Na + AlCl3 → 3NaCl + Al
• Почему щелочные металлы не используют
для реакции с растворами кислот и солей?
30. Свойства соединений
• Оксиды щелочных металлов хорошорастворимы в воде и обладают всеми общими
свойствами основных оксидов
• Напишите уравнения реакций,
подтверждающие способы получения и
свойства оксидов (реакции с водой,
кислотными и амфотерными оксидами,
кислотами)
31. Свойства соединений
• Пероксиды и надпероксиды щелочныхметаллов являются сильными окислителями.
Горючие вещества (алюминиевый порошок,
древесные опилки и т.д.) при смешивании с
Na2O2 дают яркую вспышку при поджигании.
Реакцию можно вызвать добавлением
небольшого количества воды или серной
кислоты:
• Na2O2 + 2H2O(хол.) → 2NaOH + H2O2
• 2Na2O2 + 2H2O(гор.) → 4NaOH + O2
• Na2O2 + H2SO4 → Na2SO4 + H2O2 → O + H2O
32.
• https://yandex.ru/video/preview/?filmId=6502817004906371631&url=http%3A%2F%2Ffrontend.
vh.yandex.ru%2Fplayer%2F28704102022756987
02&text=%D0%93%D0%B0%D0%BB%D0%B8
%D0%BB%D0%B5%D0%BE.%20%20%D0%AD
%D0%BA%D1%81%D0%BF%D0%B5%D1%80
%D0%B8%D0%BC%D0%B5%D0%BD%D1%82.
%20%20%D0%9E%D0%B3%D0%BE%D0%BD
%D1%8C%20%D0%B8%D0%B7%20%D0%B2
%D0%BE%D0%B4%D1%8B&path=sharelink
33. Свойства соединений
• Пероксиды диспропорционируют привзаимодействии с кислотными оксидами:
• 2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
• Разлагаются при нагревании:
• 2Na2O2 → 2Na2O + O2↑
• В зависимости от другого компонента
пероксиды могут проявлять как
окислительные, так и восстановительные
свойства. Если пероксиды проявляют
окислительные свойства, образуются
гидроксид-ионы или вода:
• 2KI + Na2O2 + 2H2SO4 → I2 + Na2SO4 +
K2SO4 + 2H2O
34. Свойства соединений
• Если пероксиды проявляют восстановительныесвойства, образуется молекулярный кислород:
• 2KMnO4 + 5Na2O2 + 8H2SO4 → O2 + K2SO4 +
2MnSO4 + 5Na2SO4 + 8H2O
• Гидроксиды щелочных металлов – сильные
основания. Их основные свойства возрастают от
LiOH к CsOH. Электролитическая диссоциация
гидроксидов осуществляется только по основному
типу (уравнение)
• Напишите уравнения всех возможных
способов получения гидроксидов щелочных
металлов и их свойств
35. Соединения щелочных металлов
• Соли. Большинство солей хорошо растворимы вводе. Малорастворимым является фторид лития,
практически нерастворимыми – фосфат и силикат
лития
• Соли щелочных металлов гидролизуются по
аниону, если образованы слабой кислотой
(приведите примеры уравнений реакций)
• Щелочные металлы и их соединения можно
обнаружить по характерной окраске пламени:
литий окрашивает пламя в карминово-красный
цвет; натрий – в желтый; калий – в
фиолетовый; рубидий и цезий – в розовофиолетовый (буро-красный и фиолетовокрасный)
https://www.youtube.com/watch?v=xrMn2bAVU0k
36. 4. История открытия
• Натрий и калий –ровесники, открыты в
один год – 1807 г.
англ. химиком Гемфри
Дэви (17.12.1778 –
29.05.1829)
электролизом
расплавленных
гидроксидов натрия и
калия
• Название «натрий» с
араб. «натрум» – сода,
«калий» с араб.
«алкали» – щелочь
37. Йоган Август Арфведсон 12 января 1792 – 28 октября 1841
Литий обнаружил вминерале петалите
шведский химик
Йоган Август
Арфведсон в 1817
г. В металлическом
состоянии получен в
1818 г. Г. Дэви
электролизом
гидроксида лития
Название «литий» с
лат. «литос» –
камень
38. Густав Роберт Кирхгоф (12.03.1824 – 17.10.1887)
Цезий и рубидийбыли обнаружены нем.
учеными Робертом
Вильгельмом
Бунзеном и Густавом
Робертом Кирхгофом
методом спектрального
анализа – цезий в
минеральных водах в
1860 г., а рубидий в
минерале лепидолите в
1861 г.
Название «рубидий» с
лат. «рубидус» –
темно-красный,
«цезий» с лат. «цезиус»
– небесно-голубой
39. Роберт Вильгельм Бунзен
40. Перей Маргарита Катрин (19.10.1909 -13.05.1975)
Перей Маргарита Катрин(19.10.1909 -13.05.1975)
Франций был открыт
ученицей Марии
Склодовской Кюри,
франц. ученойисследовательницей
Маргаритой Перей
в 1939 г. в продуктах
радиоактивного
распада урана
Название элемента
происходит от
названия страны
Франции
41.
Значение и применение щелочныхметаллов и их соединений
Сколько
водынатрия
и хлорида
Раствор хлорида
(0,9%)
натрия нужно
взятьТакой
для
применяется
в медицине.
приготовления
раствор называется
физиологическим
физиологического раствора
массой 0,5 кг?
ответ
4,5г
соли
495,5 г воды
Смесь
хлорида
и
Питьевая
сода применяется
в
гидрокарбоната
натрия
массой
кулинарии, для выпечки
кондитерских
15 г обработали
уксусной
изделий.
кислотой,
при- как
этом
Хлорид натрия
добавка к пище
выделилось 2,8 л (н.у.) газа.
Определите массовые доли в
процентах компонентов смеси.
70% NaHCO3
ответ
30%
NaCl
Калийные
удобрения
играюценное
важную
Хлорид калия
- очень
Тривиальные названия солей:
роль в жизниудобрение.
растений
минеральное
Kпоташ
Рассчитайте массовую долю калия Поваренная
2CO3
NaCl соль
(%) в этом веществе.
ответ
52%
КристаллиNa
2CO3*10H2O
ческая
сода
Калийная
KNO
селитра 3
Питьевая
сода
NaHCO
3
Глауберова
соль
Na2SO4*10H
2O
42. Выводы
• 1. Щелочные металлы являются активнымиметаллами. Активность их в подгруппе сверху
вниз возрастает. Самый активный щелочной
металл – франций. Для лития характерны
аномальные свойства
• 2. Щелочные металлы – сильные
восстановители. В растворах самый сильный
восстановитель литий, в расплавах – цезий
• 3. Щелочные металлы вступают в реакции
почти со всеми неметаллами и большинством
металлов, образуя бинарные соединения
43. Выводы
• 4. Оксиды и гидроксиды щелочных металловхорошо растворимы в воде, проявляют
типичные основные свойства
• 5.Соли щелочных металлов в основном хорошо
растворимы в воде за исключением фосфатов,
гидрофосфатов натрия и калия и большинства
солей лития. Гидролизу по катиону не
подвергаются
• 6. Щелочные металлы и их соединения находят
широкое применение в народном хозяйстве
• 7. В работе со щелочными металлами и
гидроксидами требуются особые меры
предосторожности
44.
Благодарю за работуна лекции!







































 chemistry
chemistry








