Similar presentations:
Щелочные металлы
1. Щелочные металлы
2. Щелочные металлы
Группы элементовПери –
оды
1
Н
2
Li
3
Na
II
1
1,00797
Водород
6.939
3
Литий
Калий
29
Сu
Медь
Rb
107,868
85,47
6
Ag
196,967
7
Высшие
оксиды
ЛВС
112,40
55 Ва
132,905
Аu
[223]
Бор
Скандий
Иттрий
Сd In
114,82
Барий
80
200,59
Rа
Индий
*
138,81
Hg ТI
[226]
49
Кремний
204,37
91,22
81
Sn
Радий
R2О
RO
118,69
Таллий
Гафний
41
92,906
Свинец
Rf
Nb
Ниобий
73
180,948
Та
Тантал
[262]
Сера
2
51,996
Хром
Db
Фтор
34 Br
Селен
42
95,94
Мо
183.85
[263]
[99]
Технеций
52 I
55,847
W
58,9332
Со
Кобальт
75
186,2
Re
Рений
44
101,07
Ru
Рутений
45
102,905
Rh
Родий
[262]
Борий
RO2
R2O5
RO3
R2O7
RH4
RH3
RH2
RH
Никель
36
83,80
46
106,4
Pd
Палладий
54
131,30
Ксенон
76
190,2
Оs
77
192,2
Ir
Иридий
78
195,09
Рt
Платина
Rn
85
Bh
Ni
Xe
Радон
Астат
107
58,71
39,948
Криптон
Осмий
210
28
Кr
53
84 At
Сиборгий
27
126,9044
[210]
Sg
Fe
Железо
Йод
Полоний
106
Тс
43
26
35
Бром
18
Аргон
79,904
78,96
Теллур
74
Хлор
10
Ar
17
4.0026
20,183
Неон
35,453
Марганец
78,96
Nе
9
18,9984
Cr 25
Мn
44,956
24
83 Ро
Висмут
105
32,064
Вольфрам
208,980
F
17 Cl
51 Тe
121,75
Актиний Резерфордий Дубний
R2O3
Кислород
Молибден
Сурьма
82 Вi
207,19
8
15,9994
33 Se
74,9216
Мышьяк
50 Sb
Олово
** Ас 104
88 89
138,81
[261]
Франций
Zr
Цирконий
Pb
Фосфор
32 As
72,59
О
15 S
30,9738
Ванадий
Германий
40
Азот
7
14,0067
Ti 23
V
50,942
La 72
Hf
178.49
Лантан
Ртуть
87
Y
88,905
N
14 P
28,086
31 Ge
26,9815
38 39
56 57
Углерод
Титан
Галлий
137.34
6
12,01115
Sc 22
47,90
44,956
Zn Ga
87,62
С
13 Si
26,9815
Алюминий
Кадмий
Золото
Fr
48
5
10,811
20 21
Стронций
Цезий
79
65,37
37 Sr
Серебро
Cs
40,08
Кальций
30
В
12 Al
24,312
Цинк
Рубидий
47
4
9,0122
Магний
19 Сa
39,102
63,546
5
Ве
11 Мg
22,9898
Не
Гелий
Бериллий
Натрий
К
4
Щелочные
металлы
III
IV
V
VI
VII
VIII
I
108
[265]
Hs
Хассий
109
[266]
Мt
Мейтнерий
RO4
86
[222]
3. Щелочные металлы
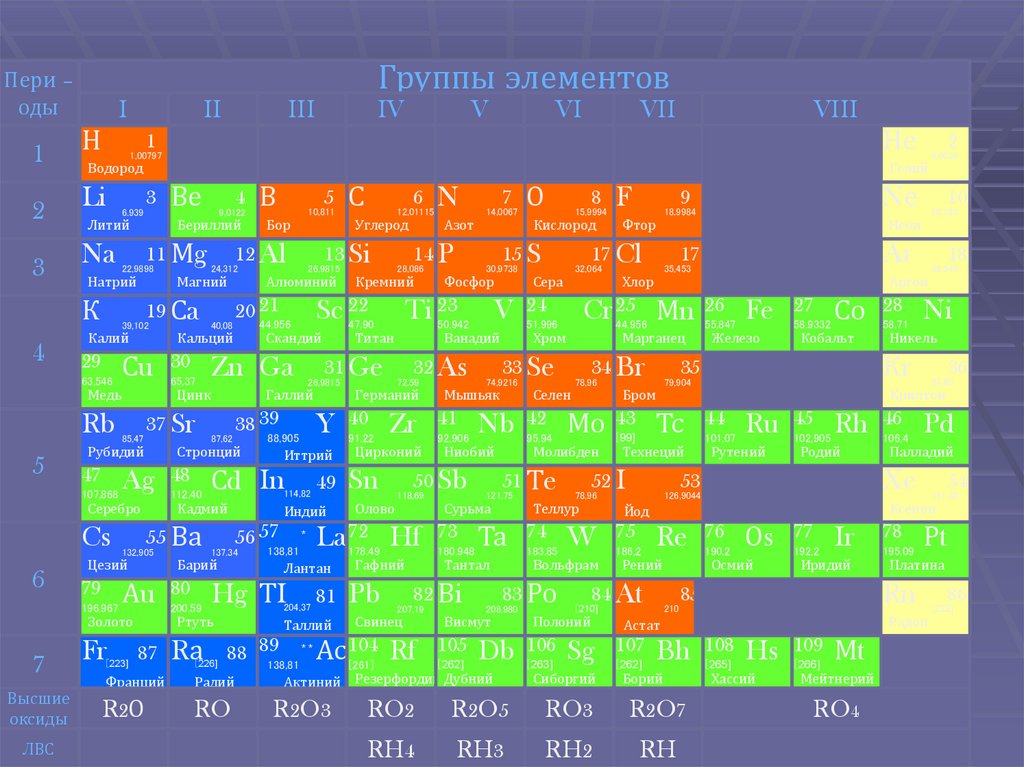
Щелочные металлы -это элементы 1-йгруппы периодической таблицы
химических элементов.
При растворении щелочных металлов, в
воде образуются растворимые
гидроксиды
4. Общая характеристика щелочных металлов
В Периодической системе они следуют сразу заинертными газами, поэтому особенность
строения атомов щелочных металлов
заключается в том, что они содержат
один электрон на внешнем энергетическом
уровне: их электронная конфигурация ns1.
Очевидно, что валентные электроны
щелочных металлов могут быть легко
удалены, потому что атому энергетически
выгодно отдать электрон и приобрести
конфигурацию инертного газа. Поэтому для
всех щелочных металлов
характерны восстановительные свойства. Это
подтверждают низкие значения
их потенциалов ионизации (потенциал
ионизации атома цезия — один из самых низких)
и электроотрицателиьности (ЭО).
5. Химические свойства
а)с простыми веществами:2Li + Н2 = 2LiН – гидрид лития;
2К + Сl2 = 2КСl – хлорид калия;
2Nа + S = Nа2S – сульфид натрия;
4 Li + О2 = 2Li2О – оксид лития.
б) со сложными веществами
2Nа + 2НОН = 2NаОН + Н2
6. Физические свойства
Серебристо – белые мягкие вещества(режутся ножом), с характерным
блеском на свежесрезанной
поверхности. Все они лёгкие и
легкоплавкие, причём, как правило,
плотность их возрастает от лития к
цезию.
7. Получение щелочных металлов
1. Для получениящелочных металлов используют в
основном электролизрасплавов их галогени
дов, чаще всего — хлоридов, образующих
природные минералы:
катод: Li+ + e → Li
анод: 2Cl− — 2e → Cl2
2. Иногда для получения
щелочных металлов проводят электролиз рас
плавов их гидроксидов:
катод: Na+ + e → Na
анод: 4OH− — 4e → 2H2O + O2
8. Соединения щелочных металлов
Дляполучения гидроксидов щелочных металлов в
основном используют электролитические
методы. Наиболее крупнотоннажным
является производство гидроксида
натрия электролизом концентрированного
водного раствора поваренной
соликатод: анод: Прежде щёлочь получали
реакцией обмена.
Получаемая таким способом щёлочь была
сильно загрязнена содой Na2CO3
9. Щелочные металлы- простые вещества
Щелочные металлыпростые веществаЛитий
Натрий
10. Получение лития
Литий был открытв 1817
году шведским химиком
и
минерологом Иоганном
Арфведсоном Своё
название литий получил
из-за того, что был
обнаружен в «камнях»
(греч. λίθος — камень).
Первоначально
назывался «литион»,
современное название
было
11. Получение натрия
В1807 г. Дэви путемэлектролиза слегка
увлажненных твердых
щелочей получил
свободные металлы калий, назвав его
потассий . В
следующем году
Гильберт, издатель
известных "Анналов
физики", предложил
именовать новый
металл калием
12. Щелочные металлы
КалийРубидий
13. Получение рубидия
В 1861 году немецкиеучёные Роберт
Вильгельм Бунзен и
Густав Роберт Кирхгоф,
изучая с
помощью спектрального
анализа природные
алюмосиликаты,
обнаружили в них
новый элемент,
впоследствии
названный рубидием по
цвету наиболее
сильных линий спектра.
14. Получение калия
В 1807 году английскийхимик Дэви электролизо
м расплава едкого кали
(KOH) выделил калий и
назвал
его «потассий»(лат. pot
assium; это название до
сих пор употребительно
в английском,
французском,
испанском,
португальском и
польском языках).
15. Цезий
Цезий16. Получение цезия
Цезий был открыт в 1860году немецкими
учёными Р. В. Бунзеном и Г.
Р. Кирхгофом в водах БадДюркхаймского
минерального источника
в Германии методом оптичес
кой спектроскопии, тем
самым, став первым
элементом, открытым при
помощи спектрального
анализа. В чистом виде
цезий впервые был выделен
в 1882 году шведским
химиком К. Сеттербергом
при электролизе расплава см
еси цианида цезия (CsCN)
и бария.
















 chemistry
chemistry








