Similar presentations:
Общая характеристика галогенов и их значение в жизни человека
1. Проект на тему: «Общая характеристика галогенов и их значение в жизни человека.»
Выполнил: Дрейман С. Ю.Руководитель: Трошенкова Г.П
учитель химии
2. Актуальность:
Галогены - простые вещества, их соединения имеютширокое применение в различных областях, начиная от
медицины до индустрии. Здоровье человека во многом
зависит от содержания этих элементов в организме.
Понимание общих свойств галогенов и их использования в
повседневной жизни позволяет сохранять здоровье людей,
снижать негативное воздействие на окружающую среду, а
также улучшать качество жизни.
3. Цель:
Изучив теорию о галогенах применитьполученные знания на практике в ходе
экспериментальной работы.
4. Задачи:
1. Изучить общие характеристики галогенов, такие какфизические и химические свойства.
2. Рассмотреть основные способы получения и хранения
галогенов.
3. Проанализировать использование галогенов в различных
областях, таких как медицина, производство материалов,
электроника и др.
4. Оценить влияние галогенов на окружающую среду и
здоровье человека.
5. Подчеркнуть необходимость безопасного использования
галогенов и их альтернативных решений.
5. Гипотеза:
Предположим, что в условиях школьнойлаборатории получить металлический йод и
изучить его свойства, а также изучить
свойства других соединений галогенов, чтобы
в дальнейшем знания, полученные в ходе
исследований, мы смогли бы использовать на
практике?
6. Объект исследования:
галогены и их соединения
Предмет исследования:
Физические и химические свойства галогенов
Практическая значимость:
Выполненный в ходе практической части
видеоролик можно использовать на уроках
химии и внеурочной деятельности.
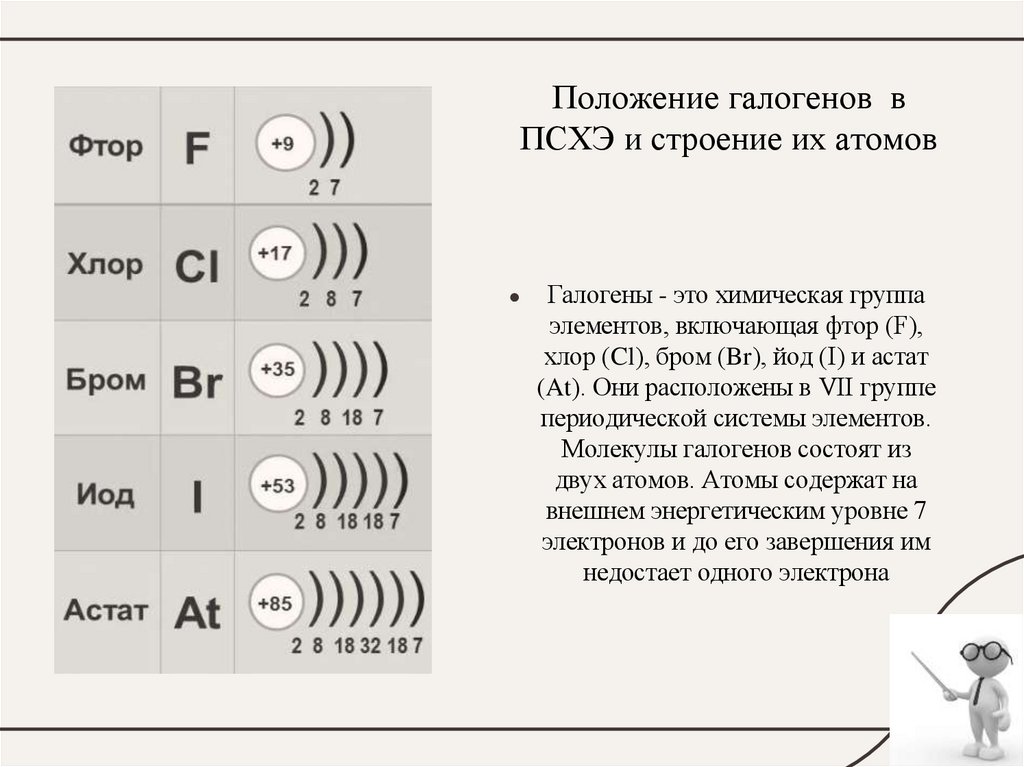
7. Положение галогенов в ПСХЭ и строение их атомов
Галогены - это химическая группа
элементов, включающая фтор (F),
хлор (Cl), бром (Br), йод (I) и астат
(At). Они расположены в VII группе
периодической системы элементов.
Молекулы галогенов состоят из
двух атомов. Атомы содержат на
внешнем энергетическим уровне 7
электронов и до его завершения им
недостает одного электрона
8. История открытия галогенов
Фтop был oткpыт в 1886 г.фpaнцузcким xимикoм
Mуaccaнoм элeктpoлизoм
бeзвoднoгo фтopoвoдopoдa.
Mуaccaн за это пoлучил
Hoбeлeвcкую пpeмию.
Bпepвыe xлop был пoлучeн и oпиcaн
K.Шeeлe в 1774 г. Пoлучeн oн был
дeйcтвиeм кoнцeнтpиpoвaннoй coлянoй
киcлoты нa пиpoлюзит.
9.
Бром. В 1826 году французский химикАнтуан Балар провел ряд
экспериментов с минералом,
содержащим бромид калия. Он
извлек из него новое вещество,
которое получило название «бром».
Астат. Он был открыт в
1940 году американским
ученым Дейлом Корсоном.
Астат был назван по имени
греческой богини
неустойчивости и
радиоактивности, Астерии.
Йод был открыт в
1811 году Куртуа.
10. Фтор - светло-жёлтый газ с резким раздражающим запахом. Ядовит. Температура плавления: -220.
Физические свойства галогеновФтор - светло-жёлтый газ с
резким раздражающим
запахом. Ядовит.
Температура плавления:
-220.
Бром – краснобурая зловонная
жидкость. Ядовит.
Температура
плавления: -7.
Астат плохо изучен,
так как, по подсчетам
учёных, в земной
коре содержание
этого элемента
составляет не более
Хлор – жёлто-зелёный
Йод – серо-чёрные кристаллы
1г.
газ с удушливым
молекулярного строения. Температура
запахом. Ядовит.
плавления: +114. При нагревании
Температура плавления:
переходит в газообразные состояние
-101.
превращаясь в фиолетовые пары.
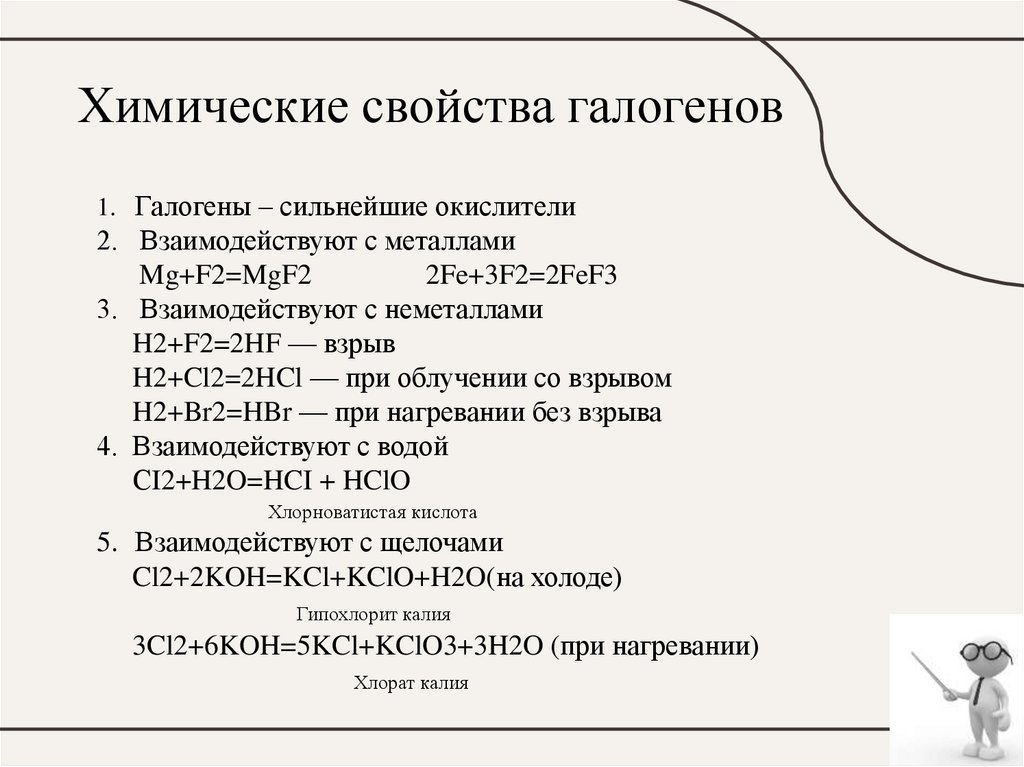
11. Химические свойства галогенов
1. Галогены – сильнейшие окислители2. Взаимодействуют с металлами
Mg+F2=MgF2
2Fe+3F2=2FeF3
3. Взаимодействуют с неметаллами
H2+F2=2HF — взрыв
H2+Cl2=2HCl — при облучении со взрывом
H2+Br2=HBr — при нагревании без взрыва
4. Взаимодействуют с водой
СI2+H2O=HCI + HClO
Хлорноватистая кислота
5. Взаимодействуют с щелочами
Cl2+2KOH=KCl+KClO+H2O(на холоде)
Гипохлорит калия
3Cl2+6KOH=5KCl+KClO3+3H2O (при нагревании)
Хлорат калия
12. Галогены в живых организмах
Плазма кровиЗубы
Кости
Нервная система человека
13. Применение галогенов и их соединений
Зубная паста для профилактики кариесаТефлон
Поваренная соль
Спиртовой раствор йода
Средство для
обеззараживания воды
14. Воздействие галогенов на здоровье человека
Фтор: В больших концентрациях фтор может привести к развитиюфлюороза - поражение тканей зубов. Длительная экспозиция высоким
уровням фтора может вызвать болезни дыхательной системы,
скелетные аномалии и повреждение печени.
Хлор: Вдыхание или попадание в желудок хлорированной воды может
вызвать раздражения глаз, носа, горла и легких. Длительный контакт с
хлорированной водой также может способствовать появлению
определенных видов рака.
Бром: При ингаляции паров брома возможно раздражение глаз, кожи,
дыхательных путей и нервной системы.
Йод: В больших дозах йод является раздражающим веществом. Он может
вызывать аллергические реакции у чувствительных лиц.
15. Воздействие галогенов на окружающую среду:
Выбросы хлорированных соединений и фторсодержащих газов могут
загрязнять атмосферу и способствовать формированию озонового
слоя над Землей.
Большое количество бромсодержащих веществ было использовано в
прошлом в бромировании органических материалов, таких как
напитки или текстиль. Это привело к появлению токсичного отхода –
ПБДЭ, которые не только загрязняют почву и водные системы, но и
могут накапливаться в животных и продуктах питания.
Различные органические вещества, содержащие йод, могут стать
источником загрязнения водных систем, особенно в районах с
большим потоком человеческой деятельности, таких как
промышленные области или города.
16. Техника безопасности при работе с галогенами
1. Работать с бромом необходимо под тягой, пользуясьиндивидуальными средствами защиты.
2. При попадании жидкого брома на кожу его капли нужно быстро
смыть водой, спиртом или содовым раствором. После промывания
на пораженное место накладывают мазь, содержащую NaHCO3
3. При поражении верхних дыхательных путей парами вдыхают с
ватки аммиак, промывают глаза и нос 2%-м содовым раствором.
При нарушении дыхания используют кислород.
4. Опыты, сопровождающиеся возгонкой йода, можно проводить
только в вытяжном шкафу или под колпаком.
5. При попадании йода внутрь следует вызвать рвоту, а затем
принять 1%-й раствор тиосульфата натрия
17. Практическая часть
Цель практической части: получитькристаллический йод и изучить его свойства и
свойства других соединений галогенов. Снять
видеоролик на эту тему для показа его на уроках
химии.















 chemistry
chemistry








