Similar presentations:
Общая характеристика галогенов
1.
Общая характеристика галогеновI. Исторические сведения
II. Галогены – химические элементы
1. Положение в ПСХЭ
2. Строение и свойства атомов
III. Галогены – простые вещества
1. Состав. Строение
2. Физические свойства
3. Химические свойства
IV. Тест
2.
Шееле Карл ВильгельмЛавуазье Антуан Лоран
Бертолле Клод Луи
Хлор. Первым из галогенов был открыт хлор. (К. Шееле, 1774 г.) Полученный
желто-зеленый газ шведский ученый принял за сложное вещество и назвал
«дефлогистированной соляной кислотой». Лавуазье и Бертолле считали что, этот
газ является оксидом неизвестного элемента «мурия». В 1807 г. английский химик
Гемфри Деви получил тот же газ, что и Шееле. Три года пытался Деви выделить из
него «мурий», но безуспешно. Он пришел к выводу, что получил новый элемент и
назвал его «хлорин». Через пять лет Гей-Люссак дал газу название хлор. А за год
до этого немец Иоган Швейгер предложил еще одно имя – галоген, которое
распространили на всю группу элементов с аналогичными свойствами. В жидком
виде хлор впервые получил в 1823 г. Фарадей.
Гемфри Деви
Гей-Люссак
Майкл Фарадей
3.
Балар А ЖеромЛибих Юстус фон
Бром. Этот во многом необычный элемент был открыт
последним из галогенов, существующих в природе.
Впервые его получил в 1825 г. студент Гейдельберского
университета К. Левел, действуя на воду минерального
источника Крейцнахе хлором.
В 1826 г. в Парижской Академии наук было сделано
сообщение французским химиком Баларом о том, что
при изучении рассолов средиземноморских соляных
промыслов он выделил темно-бурую жидкость по всей
вероятности являющуюся новым элементом, который
он назвал – «мурид» (от латинского слова muria,
означающую «рассол»). Комиссия Академии наук проверив это сообщение, подтвердила открытие Балара и
предложила назвать элемент бромом (от «бромос», с
греческого «зловонный». Пожалуй лишь один ученый
Ю. Либих, был раздражен этим известием. Несколькими годами ранее одна германская фирма прислала ему
бутыль с жидкостью, попросив узнать ее состав. Либих,
не проводя серьезного исследования заключил, что содержимое бутыли является соединением иода с
хлором.
Потом он легко обнаружил там бром (после открытия
Балара). Либих сказал «Не Балар открыл бром, а бром
открыл Балара.
4.
Гей-ЛюссакГемфри Деви
Иод. Это второй галоген, который был выделен в свободном виде. Свободный
иод получил парижский селитровар Куртуа в 1811 г. Название «иод» происходит
от греческого слова «иодес» - фиолетовый (по цвету паров).
Куртуа подарил его фармацевтической фирме в Дижоне.
Доказательство элементарной природы иода независимо друг от друга дали в
1813 г. Ж. Гей-Люссак и Гемфри Деви.
5.
Положение галогенов в ПСХЭпериод
группа
VII A группа
F
2
фтор
3
Cl
4
5
6
хлор
Br
бром
I
9
18,9984
17
35,453
35
79,904
53
иод
126,9044
At
85
астат
210
Определите положение галогенов в ПСХЭ.
Перечислите химические элементы ─ галогены и
дайте им краткую характеристику: выпишите их
их символы и названия.
Объясните характер изменений [(увеличение),
(усиление)] или [(уменьшение), (ослабление)]
в подгруппе галогенов с ростом порядкового
номера:
увеличивается
1. заряда ядра (Z);
2. количества электронов на внешнем слое;
не изменяется
0,085, 0,105
3. радиус атома, нм; 0,04 0,073
увеличивается
F
Cl
Br
I
4. прочность связи валентных электронов
уменьшается
с ядром;
ЭО
3,98
3,16
2,96
2,2
5. электроотрицательность
(ЭО); 2,66
уменьшается
F
Cl
Br
I
At
6. неметаллические свойства; ослабляются
7. окислительные свойства;
ослабляются
6.
периодСтроение и свойства атомов
группа
VII
77 A группа
2 F
+9
9
+17
17
Cl
3
+35
35
Br
4
Заряд ядра численно равен порядковому номеру.
Число энергетических уровней равно номеру периода
Число электронов N рассчитывается по формуле
N = 2n2
N = 2 ·12 = 2
N = 2 · 22 = 8
2
2
Число валентных электронов равно номеру группы.
))
)))
))))
8
5
I
6
At 85
53
Второй
Энергетический
энергетический
уровень
уровень
делится
(n=2)
на включает
энергетические
два подуровня:
подуровни,
Вкоторые
состав
третьего
уровня
(n=3)
входят три
подуровня:
(одна
2s-орбиталь)
образованы
и 2р
орбиталями.
(три
орбитали),
всего
четыре орбитали,
3s
(одна
орбиталь),
3р=1)
(три
орбитали),
3d(одна1s-орбиталь),
(пять
орбиталей),
на
На
которых
первом
может
уровне
находится
(n
1s-подуровень
до 8 электронов.
В атоме
фторана
9 орбиталей,
не более
электронов.
7всего
которой
электронов,
максимально
т.к. на содержащих
внешнем
может энергетическом
находится
2 18
электрона.
уровне атомы
В
атоме
хлора
7
электронов,
т.к.
атомы
галогенов
насвнешнем
галогенов содержат по 7 электронов, в соответствии
№ группы.
энергетическом уровне содержат по 7 электронов, в соответствии с № группы.
7.
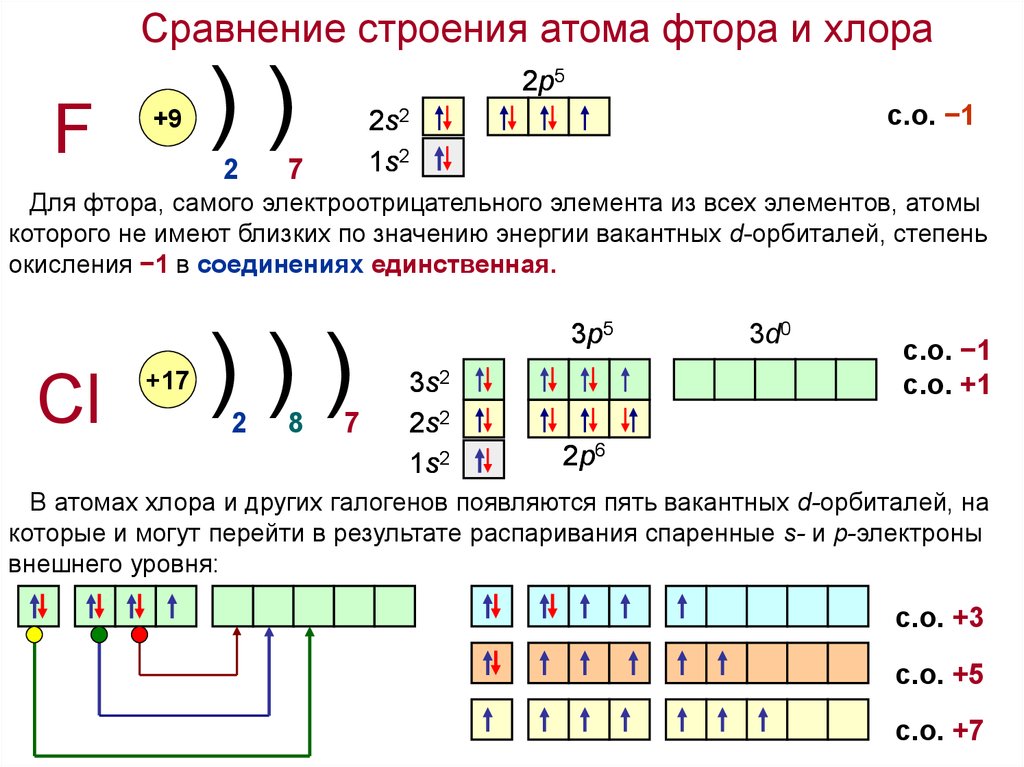
Сравнение строения атома фтора и хлораF
+9
))
2
2p5
с.о. −1
2s2
1s2
7
Для фтора, самого электроотрицательного элемента из всех элементов, атомы
которого не имеют близких по значению энергии вакантных d-орбиталей, степень
окисления −1 в соединениях единственная.
Cl
+17
)))
2
8
7
3p5
3s2
2s2
1s2
3d0
с.о. −1
с.о. +1
2p6
В атомах хлора и других галогенов появляются пять вакантных d-орбиталей, на
которые и могут перейти в результате распаривания спаренные s- и p-электроны
внешнего уровня:
с.о. +3
с.о. +5
с.о. +7
8.
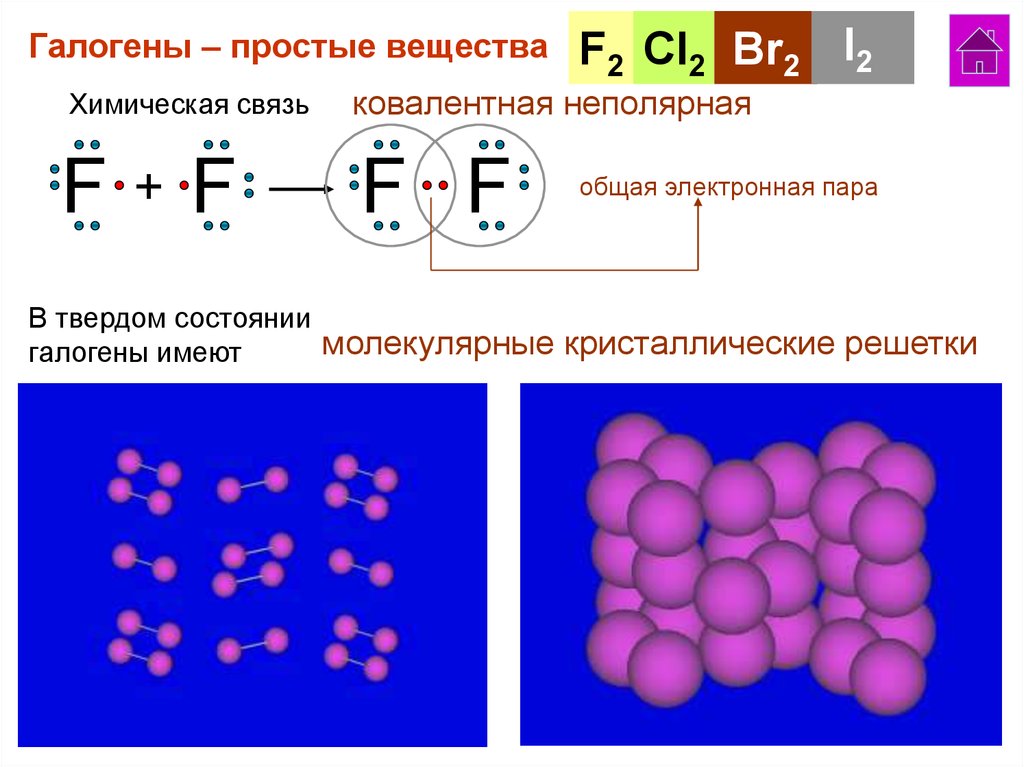
Галогены – простые веществаF2 Cl2 Br2 I2
Химическая связь
ковалентная неполярная
F
F F
+
F
общая электронная пара
В твердом состоянии
молекулярные кристаллические решетки
галогены имеют
9.
Физические свойства галогеновФтор −газ светло-желтого цвета, не сжижается
при обычной температуре.
С резким раздражающим запахом.
t плавления = −219°С ; t кипения = −188,2°С
Химически взаимодействуют 2F2 + 2H2O = 4HF + O2
Хлор – газ желто-зеленого
цвета, сжижающийся при
обычной температуре под
давлением. В 2,5 раза
тяжелее воздуха.
С резким удушливым
запахом.
t плавления = −101°С
t кипения = −34°С
1объем Н2О растворяет
2,3 объема Сl2 химическое
взаимодействие
Cl2 + H2O = HCl + HClO
Иод – твердое вещество.
Черно-фиолетовый, с
металлическим блеском
t плавления = 113,6°С
t кипения = 185,5°С
При нагревании образуются фиолетовые пары
Очень плохо растворим
0,3г/л
Бром – красно-бурая
жидкость. С резким
Зловонным запахом.
t плавления = −7,3°С
t кипения
= 59,2°С
Плохо растворим 3,5г/л
10.
Возгонка иода11.
Химические свойстваХимическая активность галогенов как неметаллов от фтора к иоду
ослабевает. Каждый галоген является самым сильным окислителем в своем
периоде. Окислительные свойства галогенов проявляются в первую очередь
при взаимодействии с металлами.
Составьте уравнения реакций взаимодействия железа с хлором, брома с алюминием, иода с алюминием. Рассмотрите с т.зр. ОВР.
2Fe0 +3Cl20 = 2Fe+3Cl3−
Fe0 −3e →Fe+3 3 2
Cl20 + 2e →2Cl− 2 3
Fe−восстановитель,
пр. окисления.
Cl2−окислитель,
пр. восстановления
2Al + 3Br2 = 2AlBr3
Al0 −3e →Al+3
3 2
Br20 + 2e →2Br− 2 3
Al− восстановитель,
пр. окисления.
Br2−окислитель,
пр. восстановления
2Al + 3I2 = 2AlI3
Al0 −3e →Al+3 3 2
I20 + 2e →2I− 2 3
Al−восстановитель,
пр. окисления.
I2− окислитель,
пр. восстановления
12.
1. Название «галогены» означает:а) «рождающие кислоты»;
б) «рождающие соли»;
Тест
в) «рождающие щелочи»;
г) «рождающие оксиды».
a
2. В ряду I2 → Br2 → Cl2 → F2 окислительные свойства
а) возрастают;
в) не изменяется
б) уменьшается
г) изменяется периодически
a
3. Какая степень окисления характерна для фтора:
а) +1;
б) – 1;
в) +3;
б
г) – 3.
4. Название какого из данных элементов означает «фиолетовый»:
а) фтор;
б) хлор;
в) бром;
г) иод.
г
5. В ряду F – Cl – Br – I
а) увеличивается число электронов на внешнем энергетическом уровне
б) увеличиваются окислительные свойства элементов
г
в) уменьшается высшая степень окисления элементов
г) увеличиваются восстановительные свойства элементов
в
6. Реакция иода с порошком алюминия происходит:
а) при нагревании
в) при добавлении катализатора (воды)
б) при низком давлении;
г) при высоком давлении










 chemistry
chemistry








