Similar presentations:
Альдегиды и кетоны
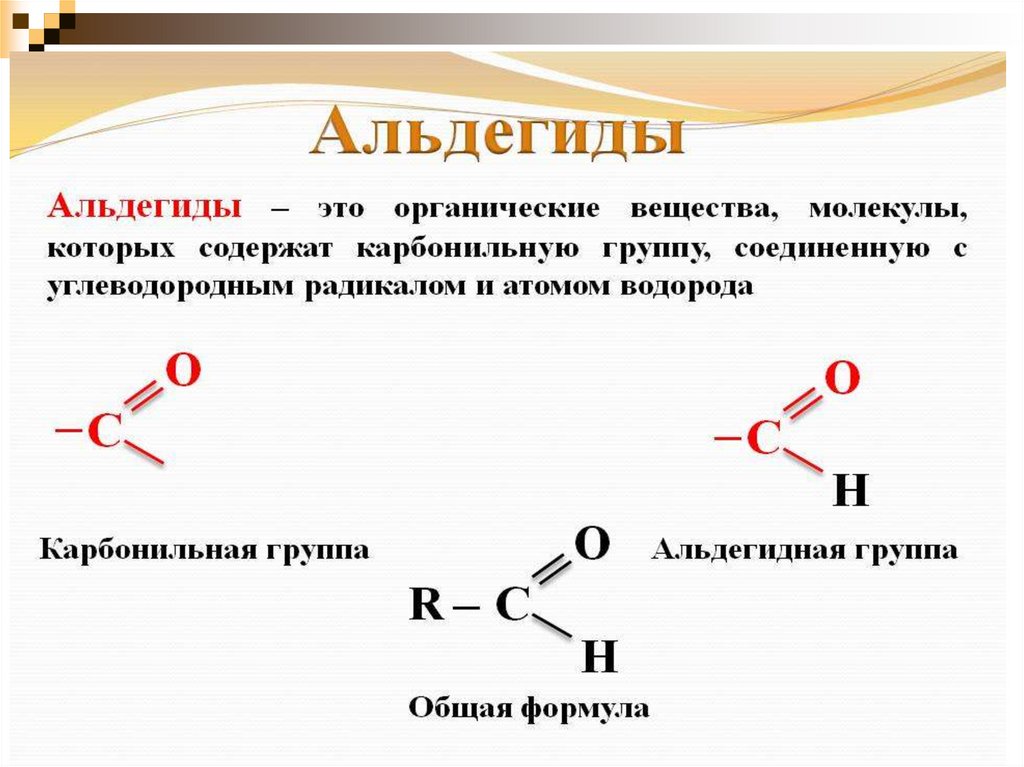
1. Альдегиды и кетоны
2.
3.
КЕТОНЫ – органические вещества, вмолекулах которых карбонильная группа
связана с двумя углеводородными радикалами
R1 – C – R2
||
O
Общая
формула
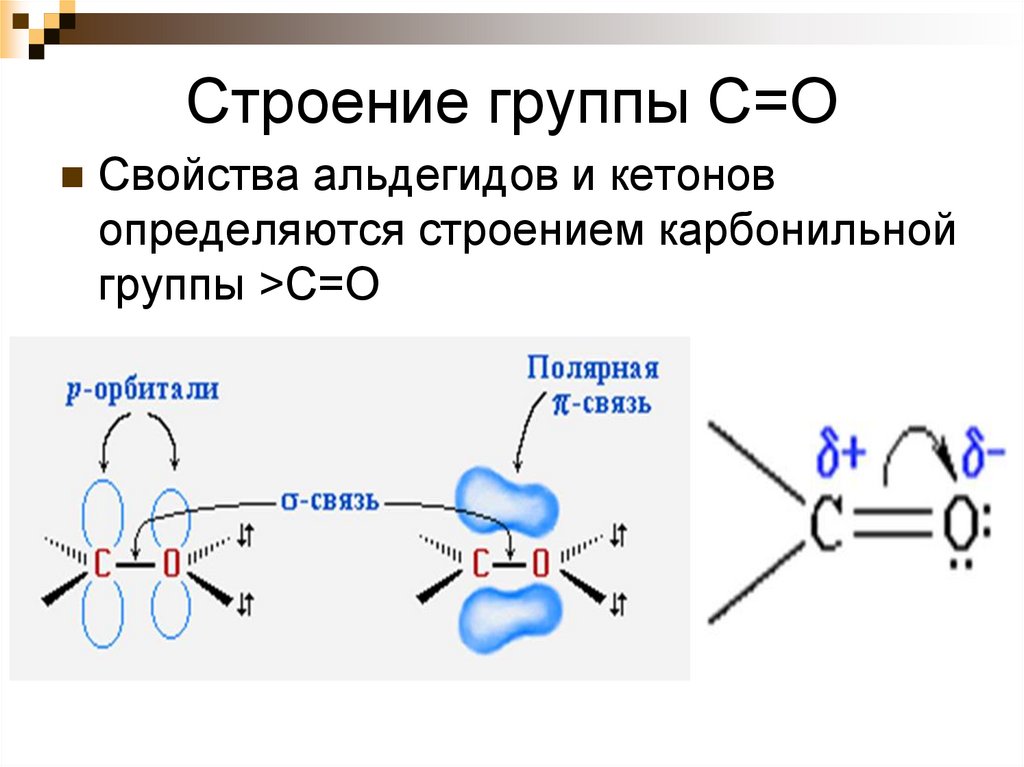
4. Строение группы С=О
Свойства альдегидов и кетоновопределяются строением карбонильной
группы >C=O
5.
6.
7. Номенклатура, изомерия
Названия альдегидовобразуется от названий
соответствующих
предельных углеродов
путем добавления
суффикса аль.
Для альдегидов
характерна изомерия
углеродного радикала,
который может иметь как
нормальную
(неразветвленную) цепь,
так и разветвленную, а
также межклассовая
изомерия с кетонами.
8. Классификация альдегидов
В зависимости от насыщенностиуглеводородного заместителя:
-предельные (насыщенные) альдегиды (ацетальдегид);
-непредельные (ненасыщенные) альдегиды (акролеин);
-ароматические альдегиды (бензальдегид).
По числу карбонильных групп:
-альдегиды с одной карбонильной группой (формальдегид);
-диальдегиды (глиоксаль);
- многоатомные альдегиды
9. Физические свойства альдегидов
Температура кипения альдегидов значительноменьше температур кипения спиртов, но больше чем
у углеводородов, если сравнивать вещества с
одинаковым числом углеродных атомов.
Низшие альдегиды имеют резкий запах, высшие
альдегиды, содержащие 8-12 атомов «С»,- душистые
вещества.
Альдегиды с 1-3 атомами «С»- хорошо растворяются
в воде, с увеличением числа атомов «С»
растворимость
уменьшается.
Все
альдегиды
растворяются в органических растворителях.
Альдегиды раздражают слизистые оболочки глаз и
верхних дыхательных путей, вредно влияют на
нервную систему
10.
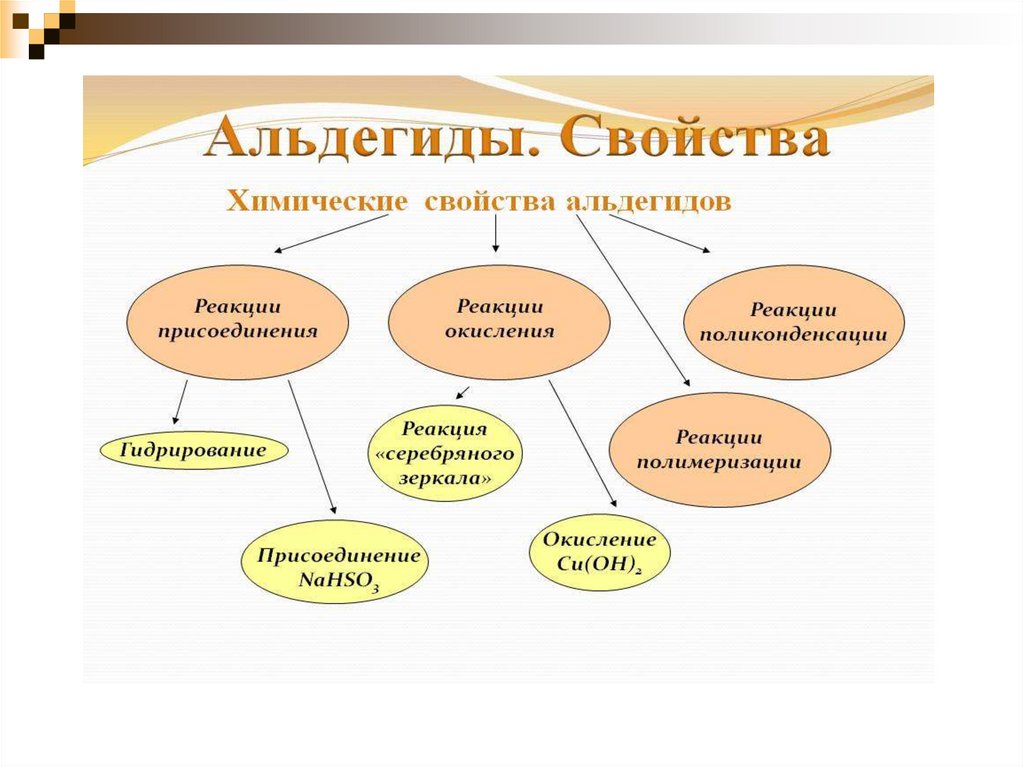
11. Гидрирование.
Реакция присоединения водорода-гидрирование (альдегиды восстанавливаются
до соответствующих спиртов).
12.
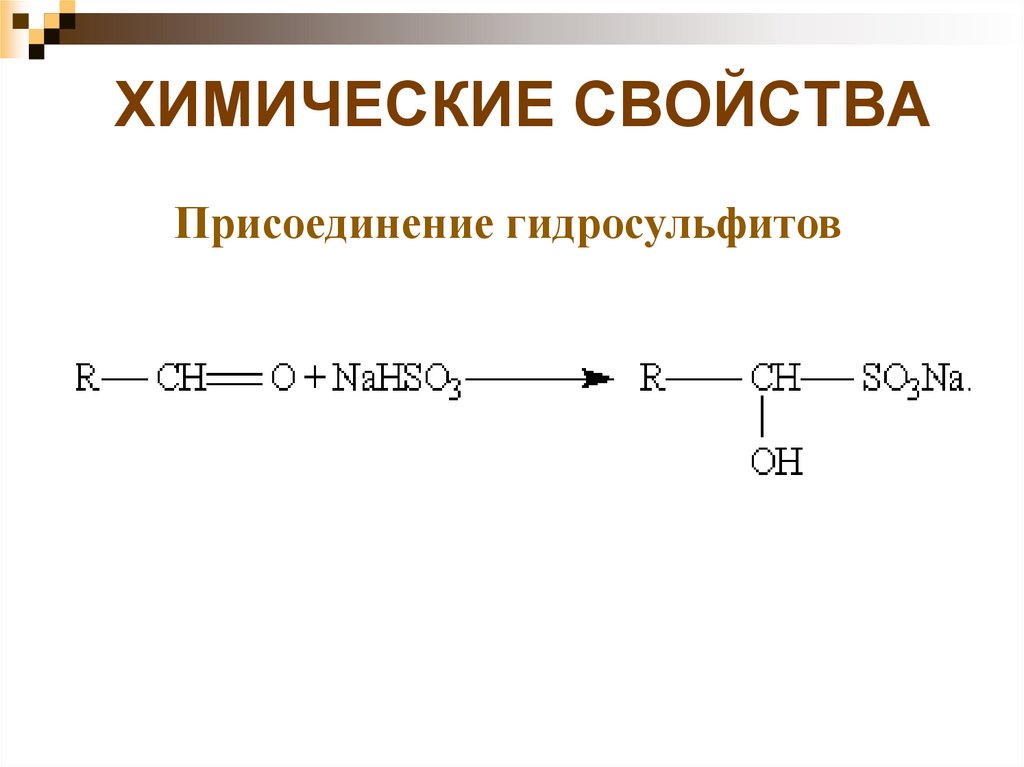
ХИМИЧЕСКИЕ СВОЙСТВАПрисоединение гидросульфитов
13. Реакция окисления
Реакция серебряного зеркала — взаимодействие альдегидов саммиачным раствором серебра при нагревании. При этом альдегид
окисляется до соответствующей карбоновой кислоты, а оксид серебра
превращается в свободное серебро, которое покрывает пробирку.
Если реакция проводится в сосуде с чистыми и гладкими стенками, то
серебро выпадает в виде тонкой плёнки, образуя зеркальную
поверхность. При наличии малейших загрязнений серебро выделяется
в виде серого рыхлого осадка.
14.
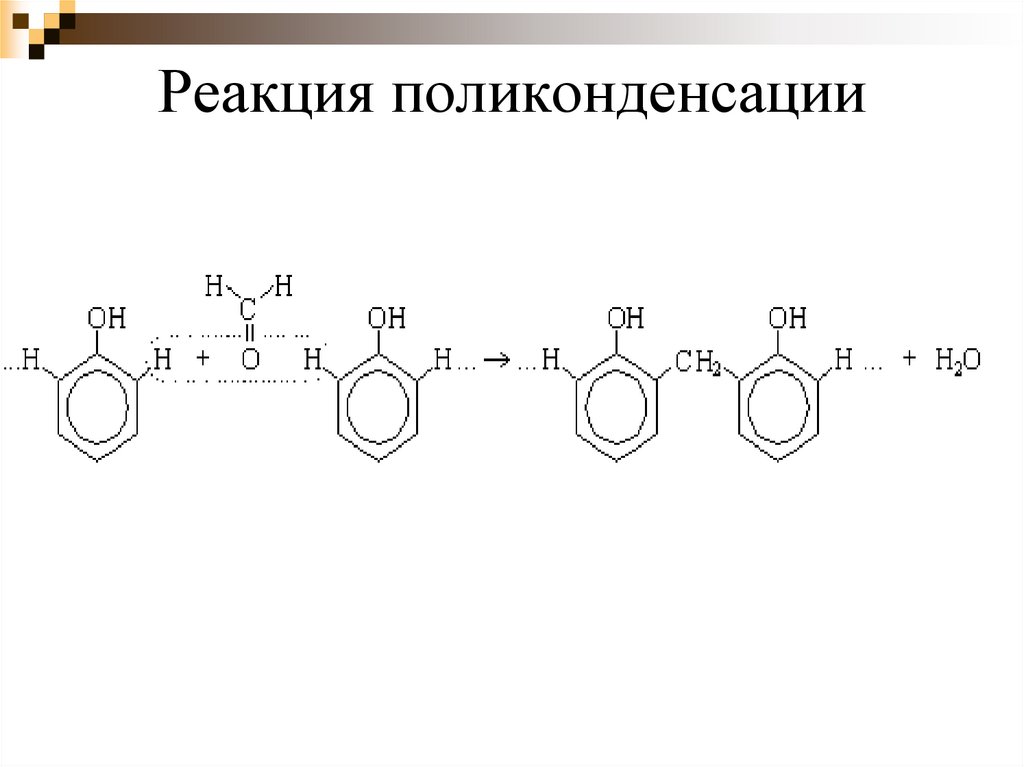
15. Реакция поликонденсации
16.
17.
18. Промышленное получение.
Известно много методов синтеза альдегидов, однако ихиспользование в промышленности зависит во многом от
доступности исходного сырья. Основными промышленными
методами получения насыщенных альдегидов являются:
гидроформилирование алкенов ;
дегидрирование или окисление первичных спиртов;
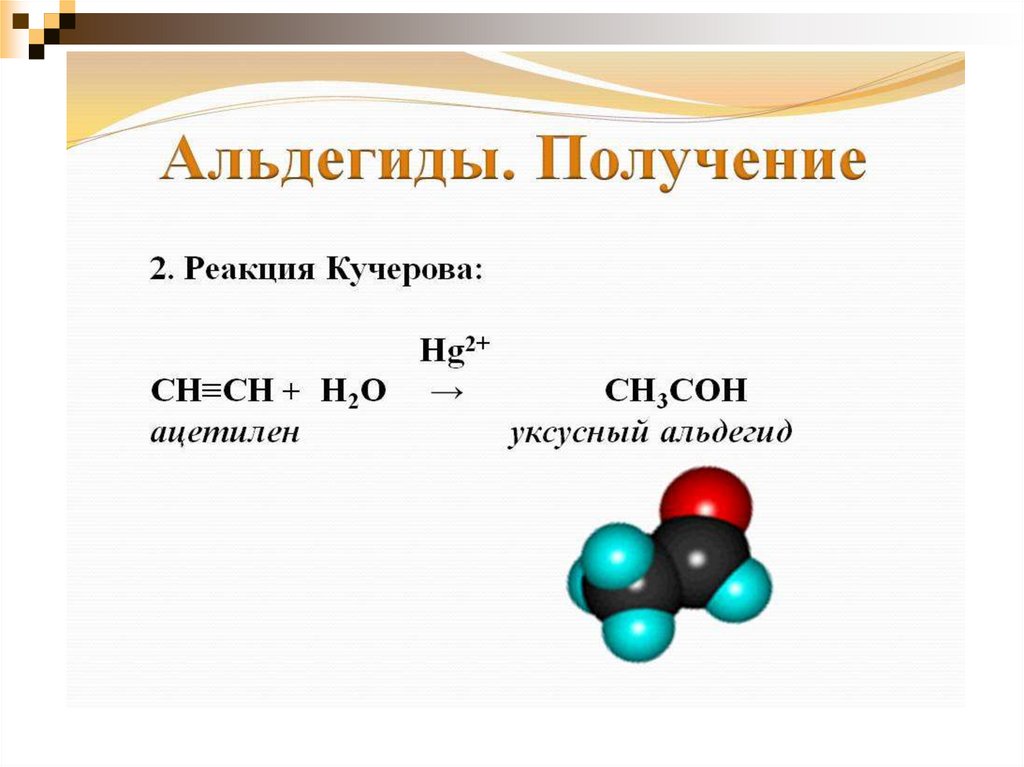
гидратация ацетилена;
окисление этилена;
окисление насыщенных углеводородов (С3, С4).
Также большое значение имеют некоторые специфические
синтезы альдегидов, широко применяемых в парфюмерной
промышленности.
19. Альдегиды в природе.
Фенилэтаналь по сравнению сбензальдегидом лучше
соответствует рецептору
цветочного запаха.
Фенилэтаналь пахнет
гиацинтом.
Цитраль.
Запах цитрусовых обусловлен
данным диеновым
альдегидом
20. Альдегиды в природе
Отличительной чертой многихальдегидов является их
запах. Высшие альдегиды,
особенно непредельные и
ароматические, входят в
состав эфирных масел и
содержатся в цветах,
фруктах, плодах, душистых и
пряных растениях.
21. Альдегиды в природе.
22. Альдегиды в медицине.
НазваниеДействие на организм
Формальдегид
(формалин )
Антисептическое
Хлоральгидрат
Снотворное,
противосудорожное
Снижает артериальное
давление
Противомикробное
Цитраль
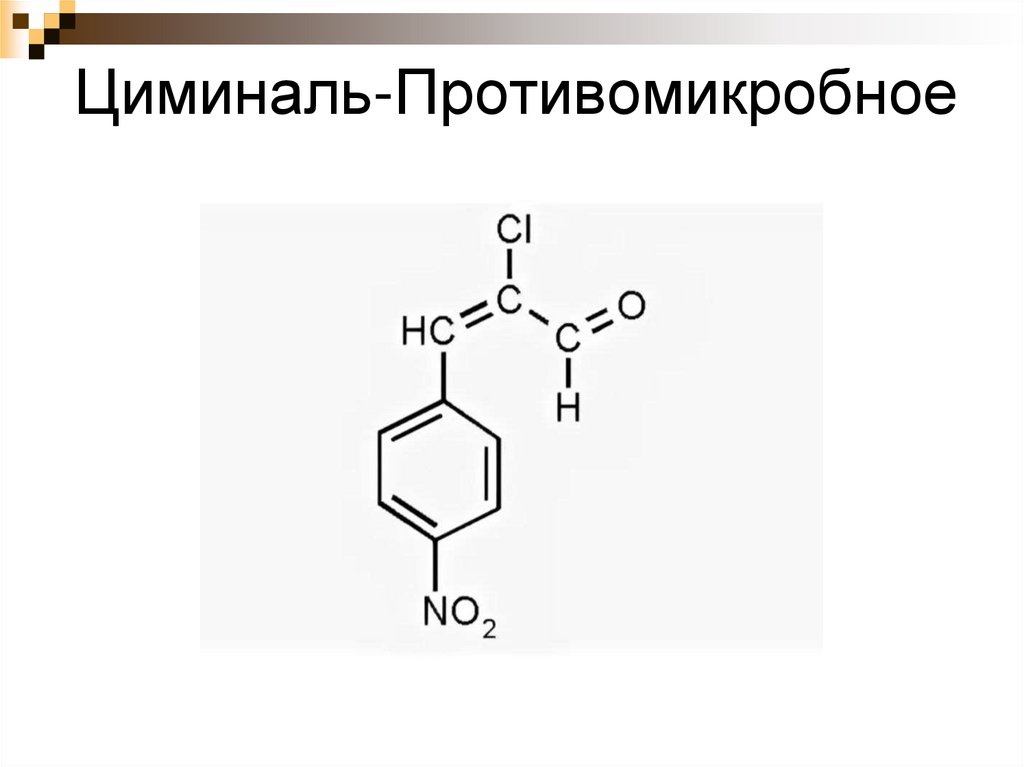
Циминаль
23. Циминаль-Противомикробное
24. Применение
25. Домашнее задание
Подготовиться к С.Р. по данной теме.Конспект на проверку


















 chemistry
chemistry








