Similar presentations:
Синтез полимеров. Цепные процессы образования макромолекул
1.
2.
Синтез полимеровЦепные процессы
образования макромолекул
Полимеризация
Учебная литература
Шур А.М. Высокомолекулярные соединения М.: Высш. шк., 1981.
Семчиков Ю.Д. Высокомолекулярные соединения М.: Изд. Центр
«Академия», 2003.
Березина Е.М., Волкова Г.И., Манжай В.Н. Практикум по синтезу полимеров.
Уч-метод пос., ТГУ.
3.
Непредельныемономеры:
Неустойчивые
циклы:
4.
Полимеризация (ПМ) это цепной процесс получения ВМС, прикотором рост каждой макромолекулы происходит в результате
последовательного присоединения молекул низкомолекулярного
вещества (мономера) к активному центру, локализованному на её
конце, согласно схеме:
где ∼Мi — цепь длиной в i звеньев, М* — активный центр, М —
молекула мономера.
По числу участвующих в ПМ мономеров различают:
гомополимеризацию (один мономер) и сополимеризацию (два
или более мономеров).
В зависимости от природы активного центра выделяют ПМ:
- Радикальную
- Ионную (катионную и анионную)
- Ионно-координационную
5.
Общая схема цепнойполимеризации
- Инициирование
• I→I*
• I* + M→I-M*
- Рост цепи
• I-M* + nM→ I-Mm*
- Реакции
ограничения цепи
(обрыв и передача
цепи)
• I-Mm* + I-Mk* →
неактивный
(мертвый) полимер
6.
7.
Способность мономеров к ПМЭнергетические и термодинамические характеристики ПМ
k A e
E / RT
Ap e
E p / RT
Ao
A
ин
e
Eo / 2 RT
1/ 2
1/ 2
e
Eи н / 2 RT
Ер и Ео составляют от 5 до 40 кДж/моль,
Еи – от 112 до 170 кДж/моль,
Еобщ – от 83 до 90 кДж/моль
8.
Термодинамические характеристики ПМ определяются только стадией роста• ΔG =ΔH – TΔS < 0
• ПМ – экзоэнтропийный и экзотермический
процесс
ΔQ >0 ΔH <0 и ΔS < 0
ΔH < TΔS
• при Т=300 К TΔS=31-42 кДж/моль,
ПМ возможна, если ∆Н > 31 кДж/моль
• Δ Q = - ΔH = 2·349,5 – 605,3 = 93,7 кДж/моль
9.
Причины изменения ΔH- Потеря энергии
на сопряжение
- Стерический эффект
- Смена набора водородных и
ван-дер-ваальсовых взаимодействий
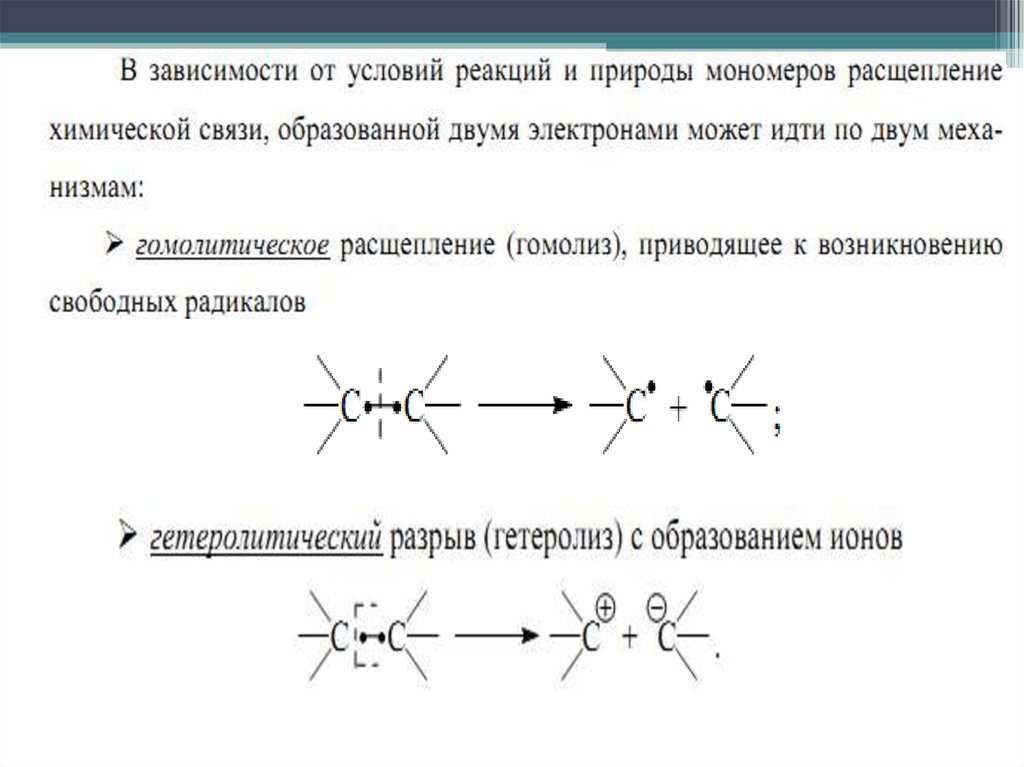
С т. зр. термодинамики разрешена
полимеризация всех винильных мономеров,
однако скорость ПМ зависит от кинетической
разрешимости
10.
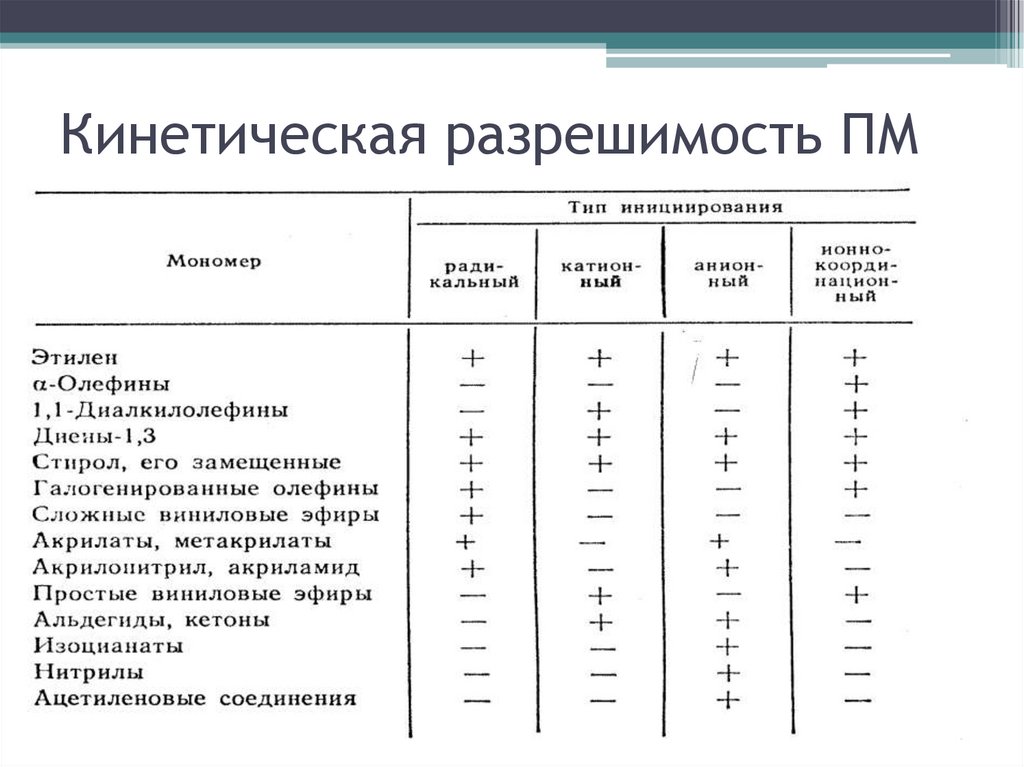
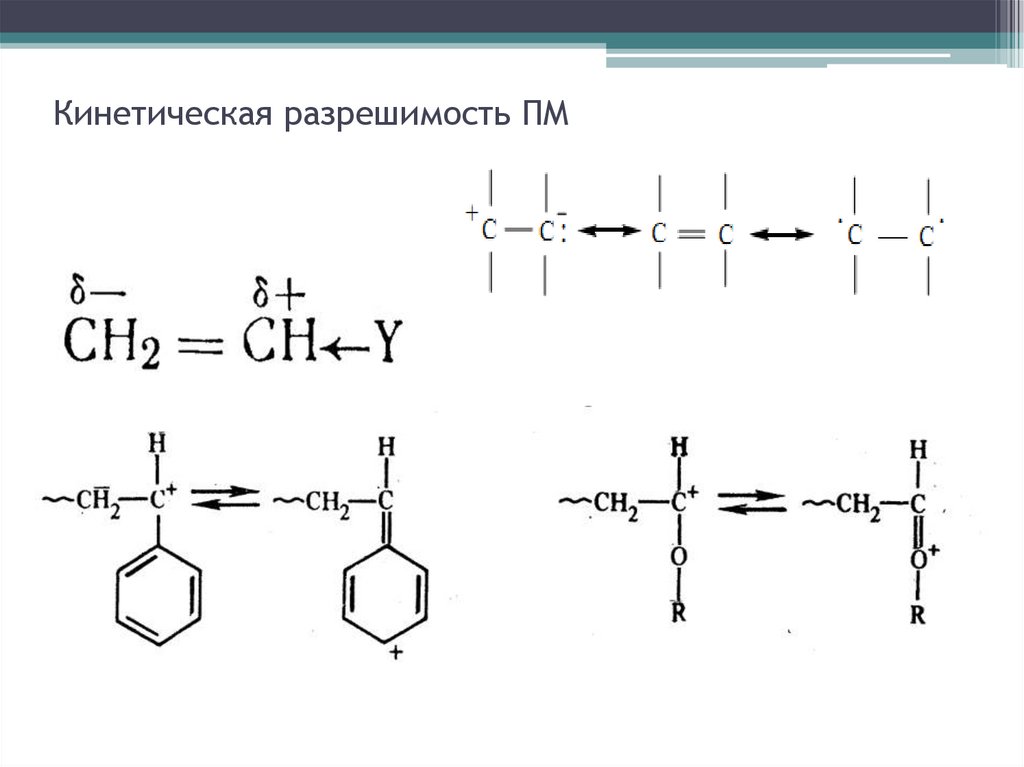
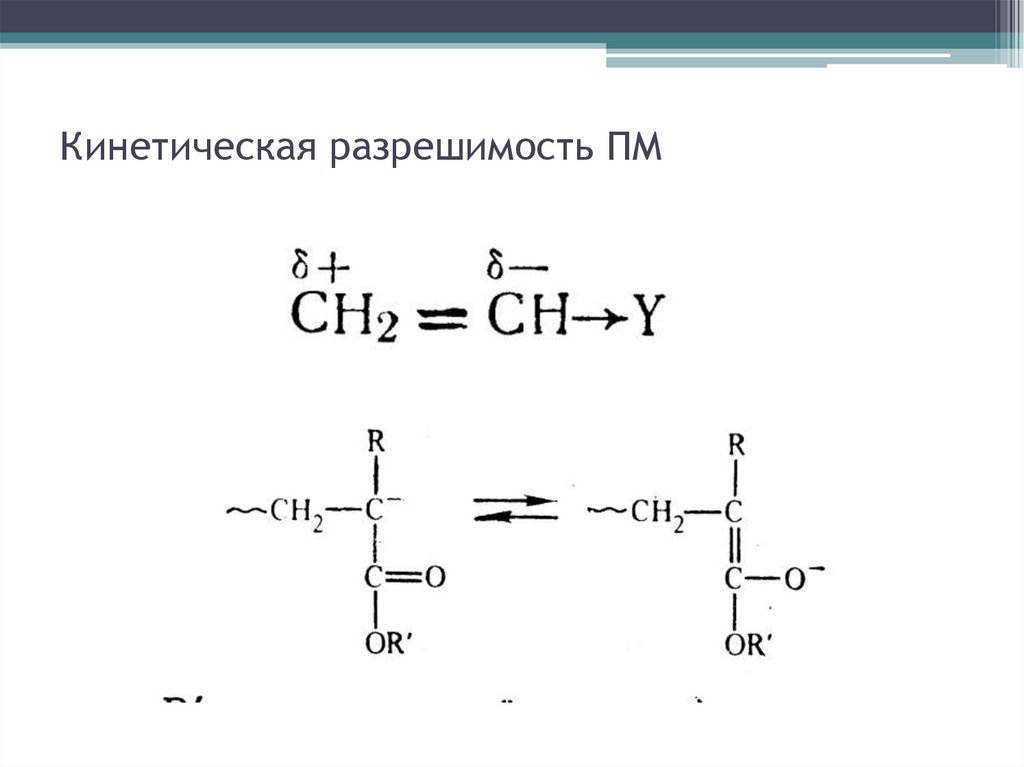
Кинетическая разрешимость ПМ11.
Кинетическая разрешимость ПМ12.
Кинетическая разрешимость ПМ13.
Предельная температура ПМТпр = ΔH / ΔS
14.
Радикальная ПМ (РадПМ)15.
.1.Стадия инициирования
I → 2R.
R. + M→ RM.
Энергия активации 100-170 кДж/моль
Типы инициирования ПМ
•Химическое
•Окислительно-восстановительное
•Термическое
•Фотоинициирование (фотохимическое)
•Радиационное
•Механическое (механоактивация)
16.
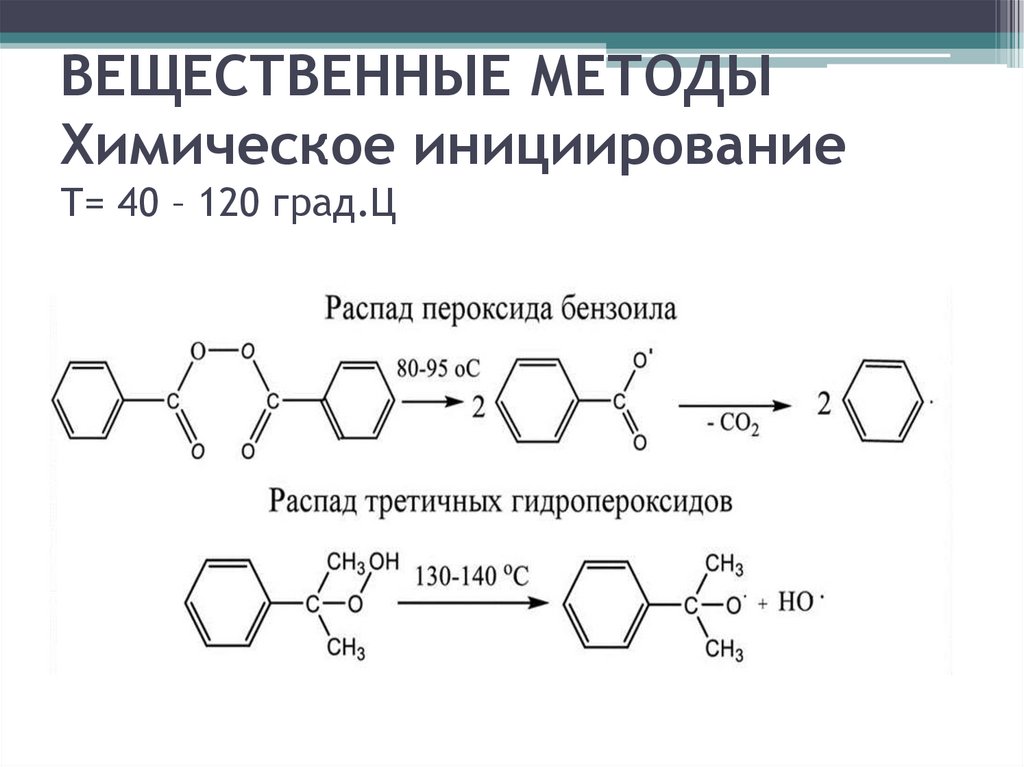
ВЕЩЕСТВЕННЫЕ МЕТОДЫХимическое инициирование
Т= 40 – 120 град.Ц
17.
Химическое инициирование18.
Окислительно-восстановительноеинициирование
19.
Окислительно-восстановительноеинициирование
• Энергия активации снижается в 5-6 раз,
температура процесса – 0 -50 град. Ц
• Скорость распада инициатора увеличивается
• Образуется 1 рабочий радикал, что снижает
вероятность рекомбинации (гибели)
радикалов
20.
Эффективность инициирования1 > f > 0,
f=0.3-0.8
Эффективность инициатора – доля
радикалов из образовавшихся на 1
стадии
инициирования,
которые
участвуют в инициировании
21.
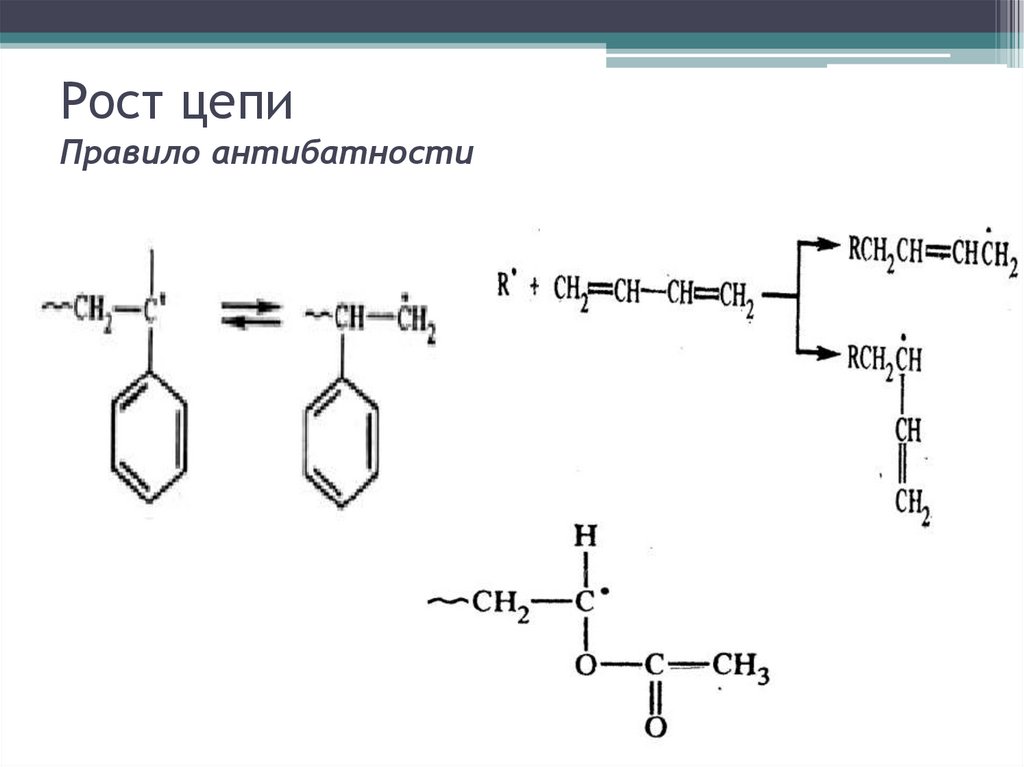
Стадия роста цепиR-M. + nM→ R-(M)n-1 М.
• Энергия активации 28-40 кДж/моль,
kр = 102 -104 л/ моль.с
• Цепной характер роста
• Способы роста: гол –к -гол, гол-к -хв
22.
Рост цепиПравило антибатности
23.
Обрыв материальной икинетической цепи
• Механизм – бимолекулярный
Из 2-х радикалов = 1 мертвая (или 2 мертвые)
макромолекулы
• Энергия активации 0 - 23 кДж/моль,
kо = 106 -108 л/ моль.с
Рекомбинация:
~ М. + ~ М. ↔ ~ М~ (мертвая макромолекула)
Диспропорционирование:
~ М. + ~ М.↔ ~ М1 + ~М2 (2 мертвые
макромолекулы)
24.
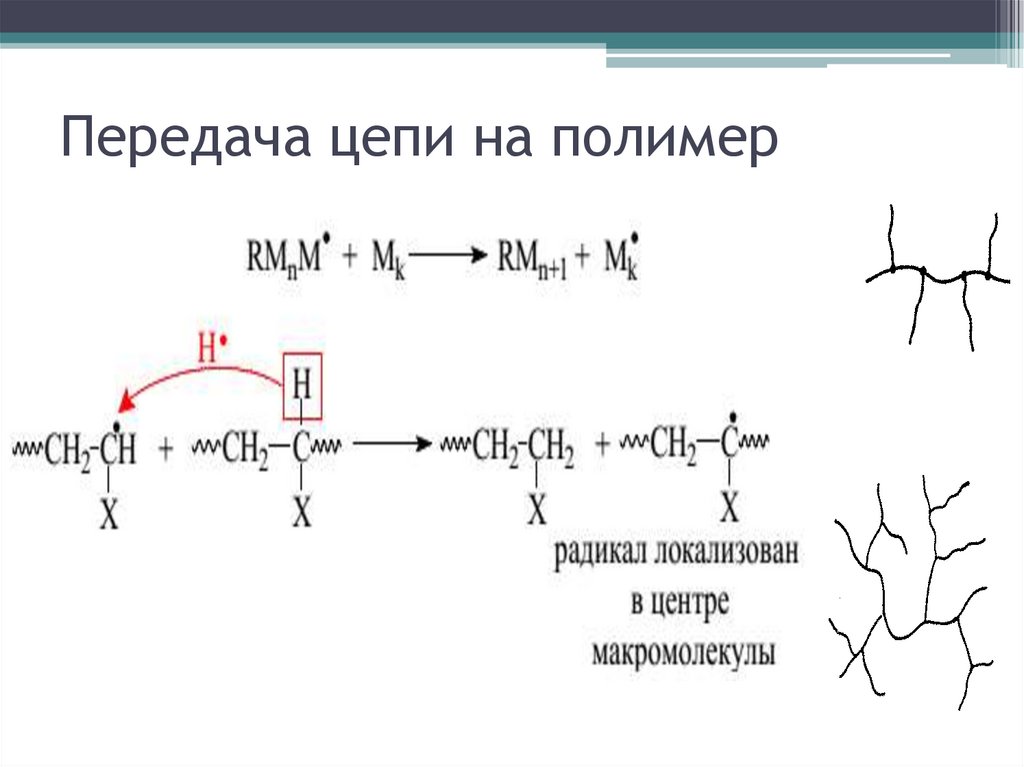
Передача цепи – обрывматериальной, продолжение
кинетической цепи
Механизм: отрыв подвижного атома (Н, Hal,
др.) от передатчика цепи
Передатчики цепи (агенты передачи):
мономер, растворитель, полимер, инициатор,
спец в-ва
25.
Передача цепи• Реакции передачи цепи уменьшают ММ полимера и
могут уменьшать скорость ПМ
• Если kp « kпер Ẍn=1 -5 теломеризация, телоген (CCl4,
CHCl3), теломер
• Константы передачи цепи:
• Cм = (0.03 – 4.0) . 10 -4
• Сs = (0.02 – 480 000) . 10 -4
• Сp = (2 -5) . 10 -4
• СI = (o.0002 -1.2) . 10 -4
26.
Передача цепи на р-ль, мономер27.
Передача цепи на полимер28.
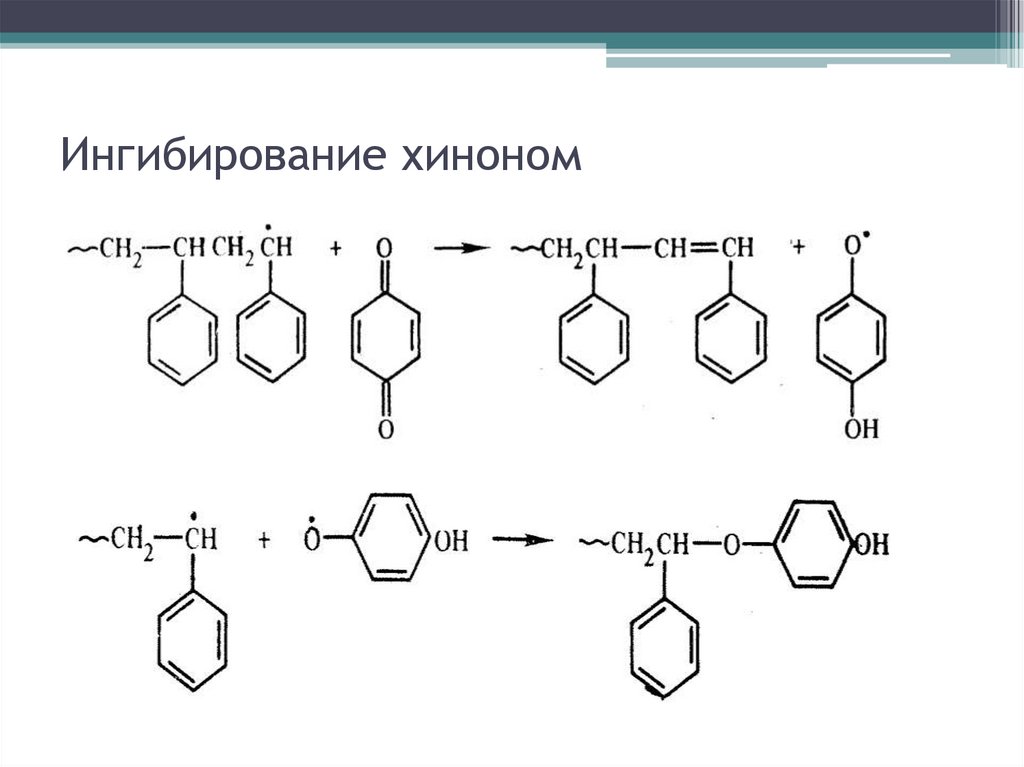
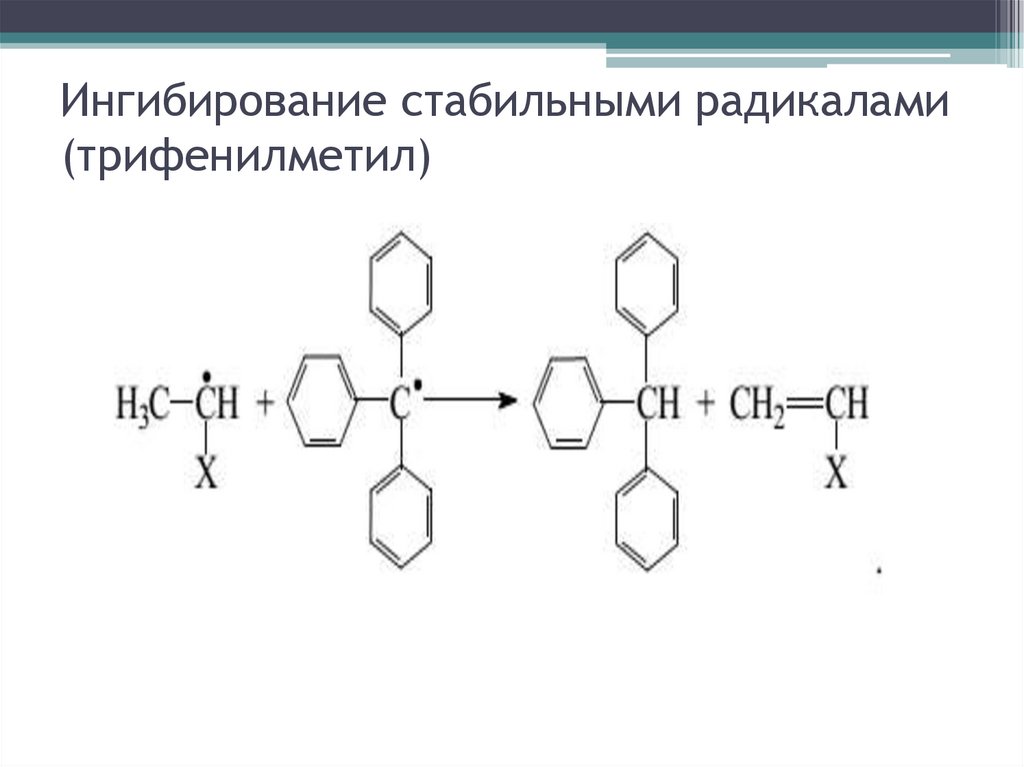
Ингибирование и замедление рад. ПМ29.
Ингибирование хиноном30.
Ингибирование стабильными радикалами(трифенилметил)
31.
32.
Кинетика радикальной ПМДопущения:
33.
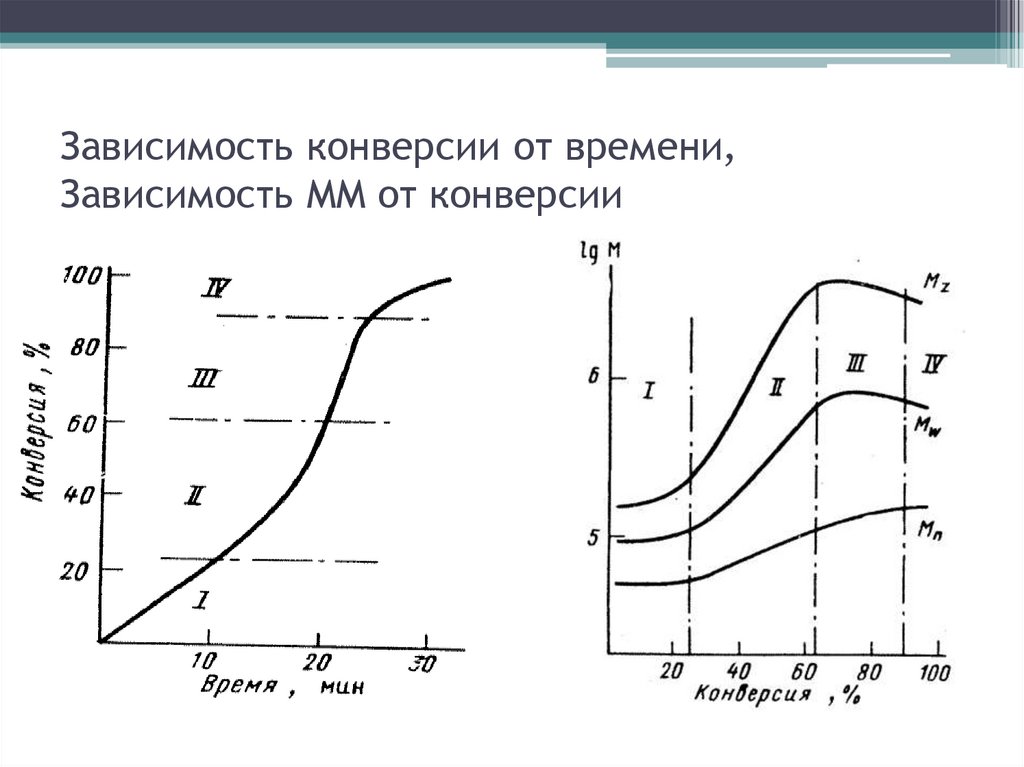
Анализ кинетической кривой34.
Общая схема радикальной ПМИнициирование
I → 2R.
R. + M1 → M1.
Рост цепи
M1. + M2 → M2.
M2. + M3→ M3.
……………………………..
Mn. + M→ Mn+1. (или R.)
Обрыв цепи
Mn. + Mm. → Мn+m (мертвый полимер)
35.
гдеи, р
- скорости инициирования и роста.
Кинетика радикальной ПМ
• Скорость полимеризации без учета реакций передачи цепи
(или скорость расходования мономера) есть сумма скорости
инициирования и роста:
dM
и р
d
• Можно пренебречь первым членом уравнения и скорость
полимеризации представить как сумму многих отдельных
последовательных реакций роста. А так как kр = const для этого
множества реакций, то можно записать:
dM
р k р R M
d
36.
Кинетика радикальной ПМ• Согласно принципу стационарности, концентрация
радикалов при полимеризации достигает
постоянной величины, когда
d R
0
d
kи
kp
kо
2
и о kи I kо R
0 .5
I M
0 .5
37.
Уравнение средней степени ПМ• ММ, Хn, ν, Р
• Длина кинетической цепи (т.е. количество присоединившихся
молекул мономера, приходящееся на один образовавшийся
активный центр) ν = Ʋр/Ʋи или ν = Ʋр/Ʋо
• Хn = 2ν (рекомбинация), Хn = ν (диспропорционирование)
• Р = Мм / Мn =1.5-2
k р M
0.5 0.5
и
о
k k
I
0.5
38.
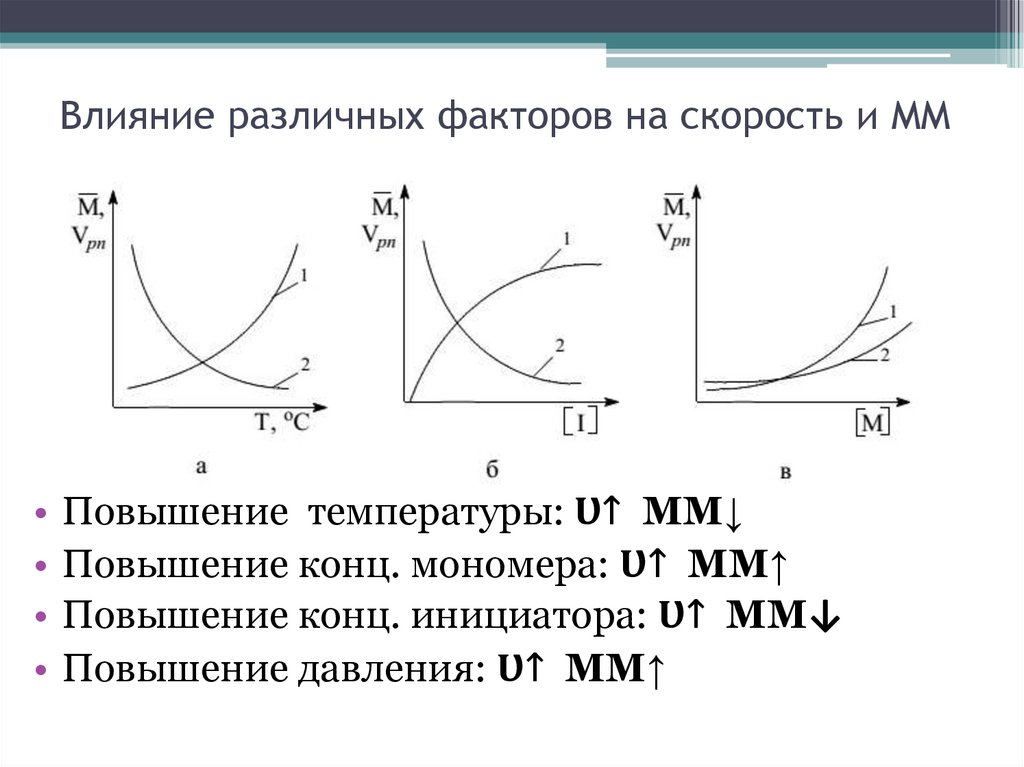
Влияние различных факторов на скорость и ММ• Повышение температуры: Ʋ↑ ММ↓
• Повышение конц. мономера: Ʋ↑ ММ↑
• Повышение конц. инициатора: Ʋ↑ ММ↓
• Повышение давления: Ʋ↑ ММ↑
39.
Зависимость конверсии от времени,Зависимость ММ от конверсии
40.
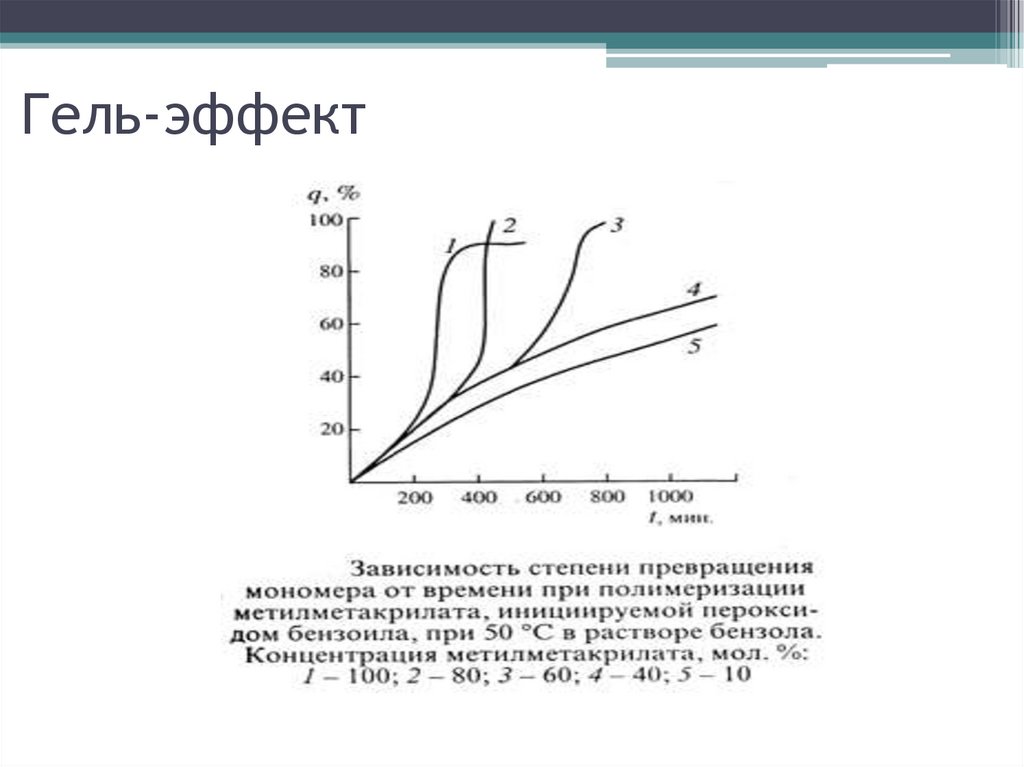
Гель-эффект41.
Гель-эффект – увеличение скорости и ММполимера на глубоких степенях превращения
при ПМ
• ~~М. + М ↔ ~~М М.
• ~~М. + .М~~ ↔ ~~М~~
Рост
Обрыв
Рост времени жизни радикалов:
от 0.1 -10 с до 200 с.
0.5
kи
0.5
k p I M
kо
42.
Способы проведения ПМ• В массе (в блоке)
• В растворе (гомогенное и гетерогенное
окончание)
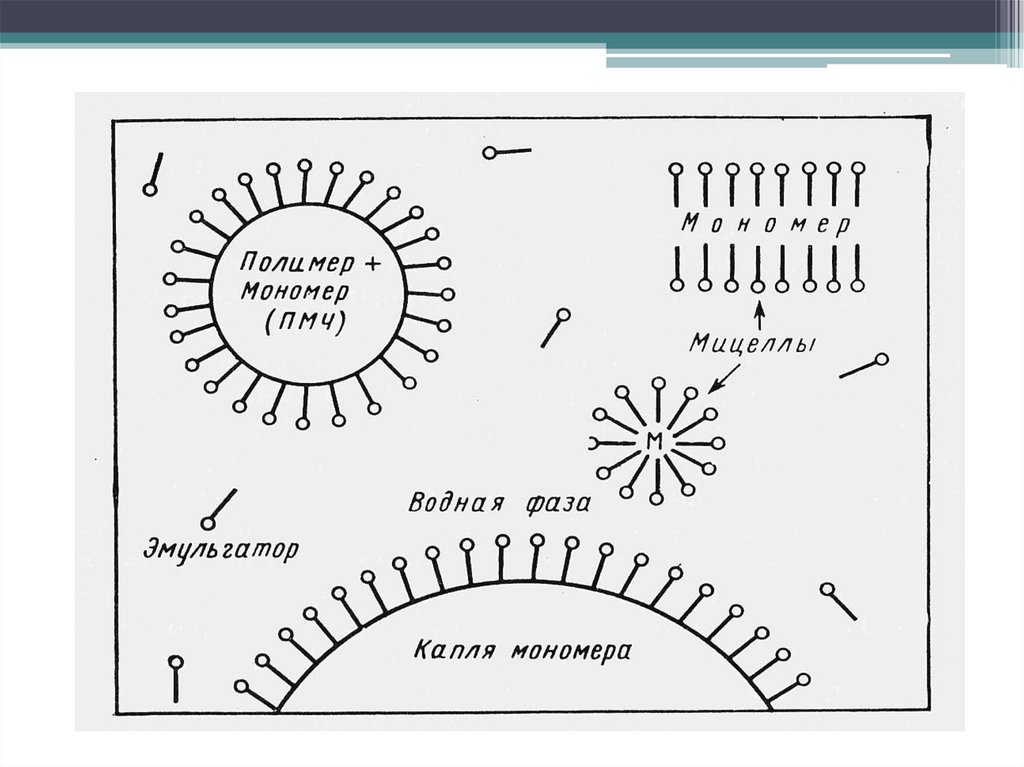
• Дисперсионная ПМ(суспензионная,
бисерная, жемчужная)
• Эмульсионная ПМ
• Твердофазная ПМ





























 chemistry
chemistry