Similar presentations:
Конфигурация макромолекулы
1. Конфигурация макромолекулы
Локальная изомерия (изомерия положения) –Возникает из-за возможности присоединения
мономеров к растущей цепи полимера в процессе
синтеза по различным вариантам:
• Для оценки характера соединения составных
звеньев в цепь иногда условно выделяют головную
часть («голова») и хвостовую («хвост») часть.
Составное звено – CH2 – CHX -, то возможны варианты
• – CH2 – CHX – CH2 – CHX – («голова» к «хвосту»);
• – CH2 – CHX – CHX – CH2– («хвост» к «хвосту»);
• – CHX – CH2 – CH2 – CHX – («голова» к «голове»);
• – CHX – CH2 – CHX – CH2 – («хвост» к «голове»).
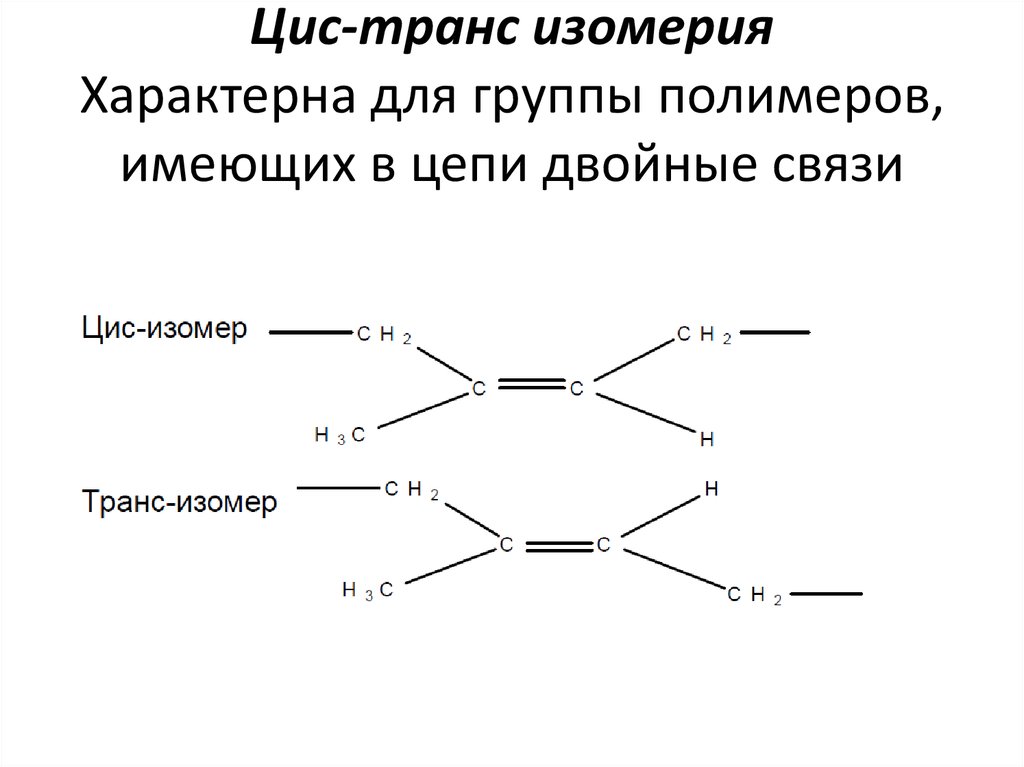
2. Цис-транс изомерия Характерна для группы полимеров, имеющих в цепи двойные связи
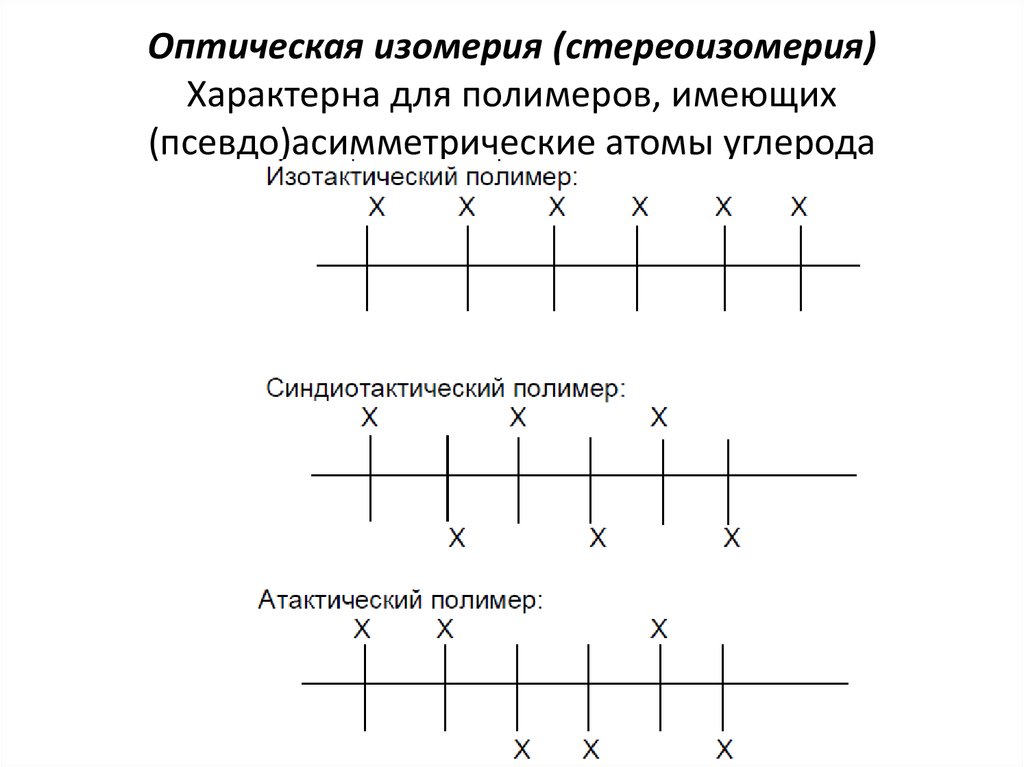
3. Оптическая изомерия (стереоизомерия) Характерна для полимеров, имеющих (псевдо)асимметрические атомы углерода
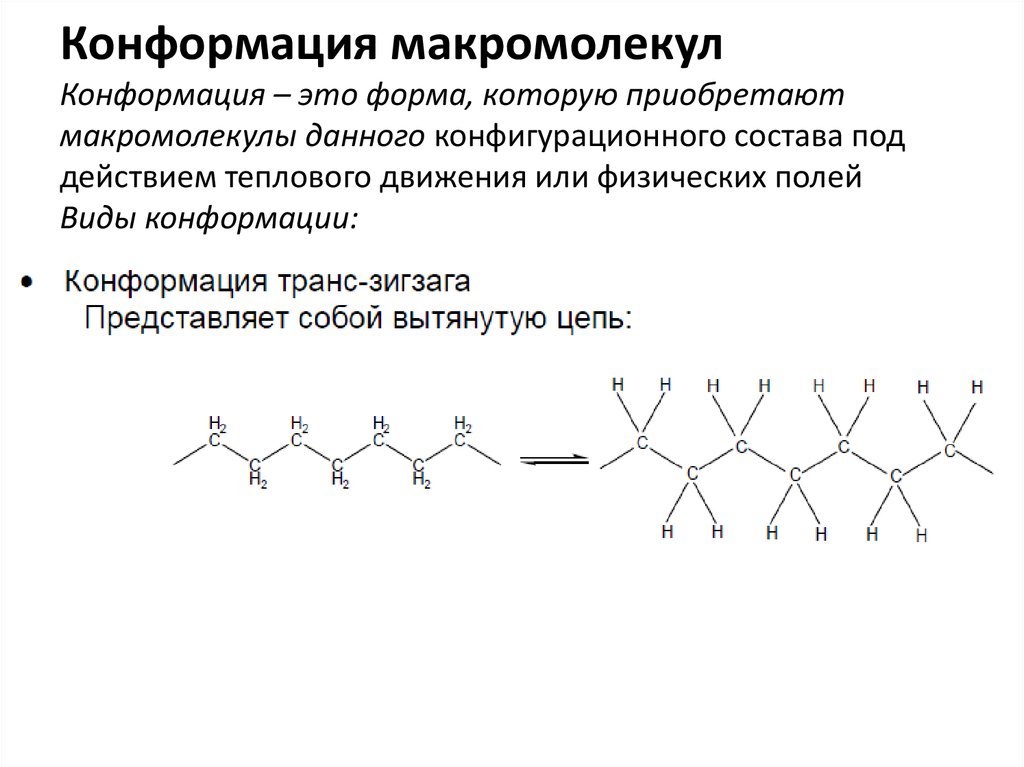
4. Конформация макромолекул Конформация – это форма, которую приобретают макромолекулы данного конфигурационного состава под
действием теплового движения или физических полейВиды конформации:
5.
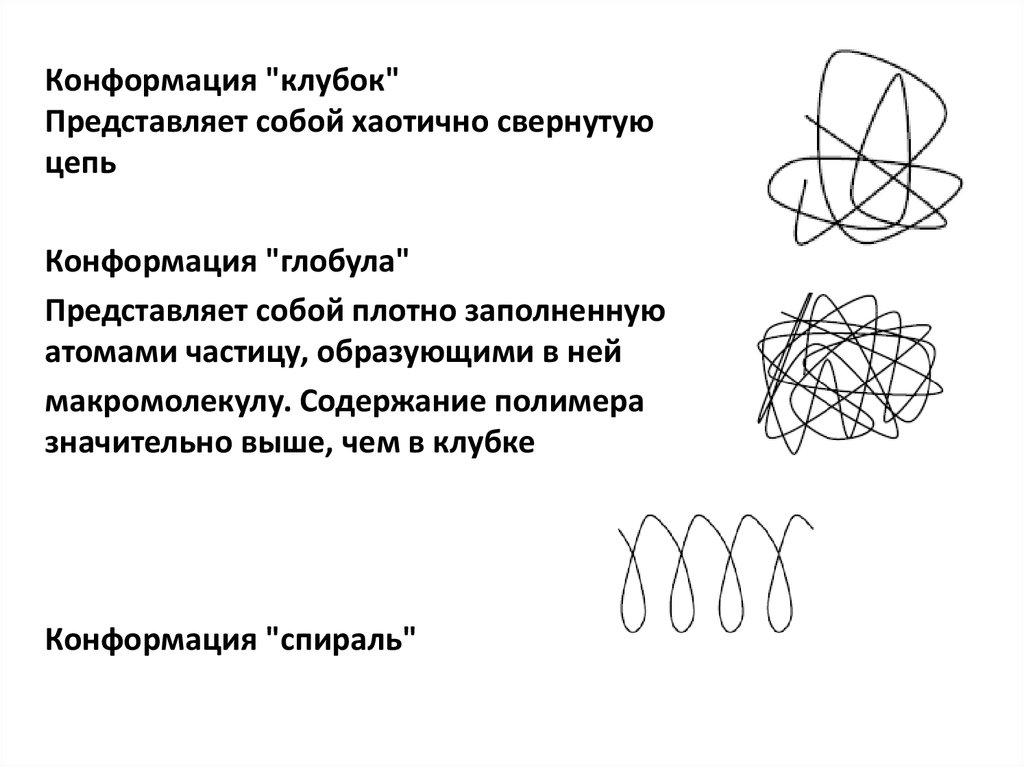
Конформация "клубок"Представляет собой хаотично свернутую
цепь
Конформация "глобула"
Представляет собой плотно заполненную
атомами частицу, образующими в ней
макромолекулу. Содержание полимера
значительно выше, чем в клубке
Конформация "спираль"
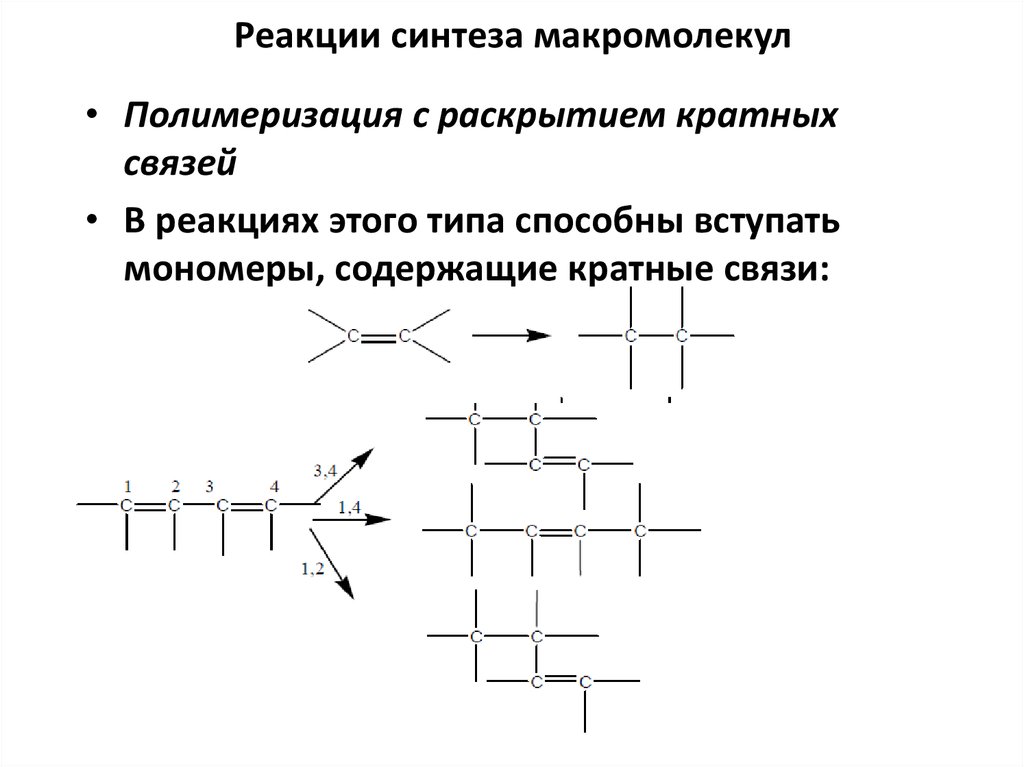
6. Реакции синтеза макромолекул
• Полимеризация с раскрытием кратныхсвязей
• В реакциях этого типа способны вступать
мономеры, содержащие кратные связи:
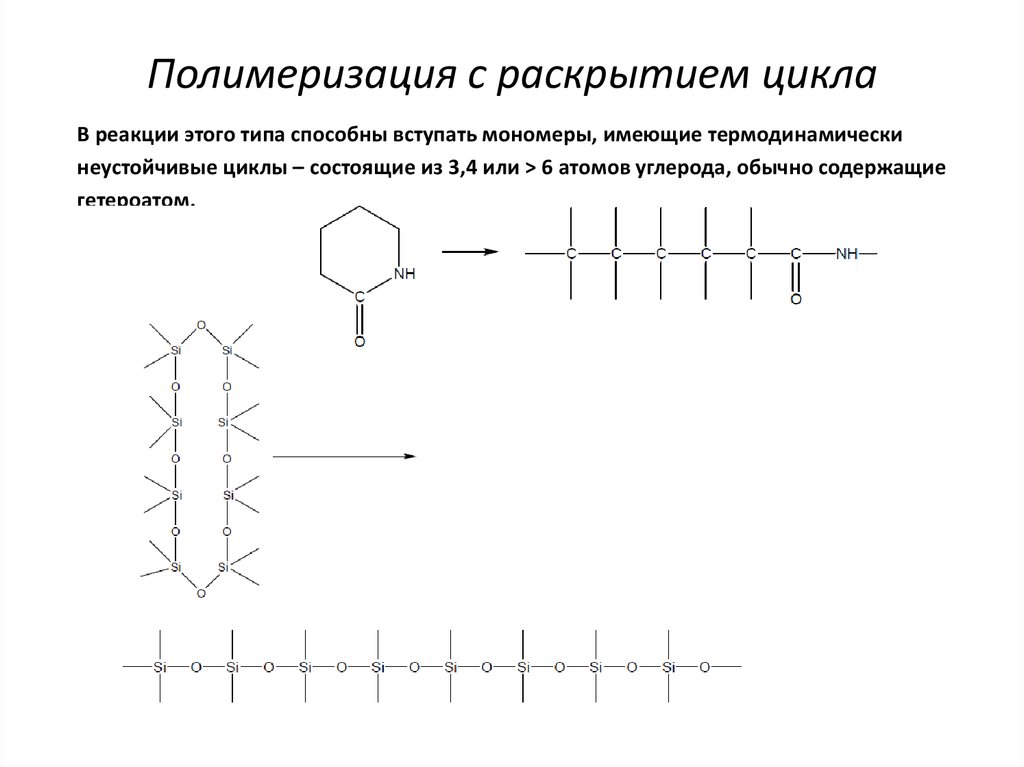
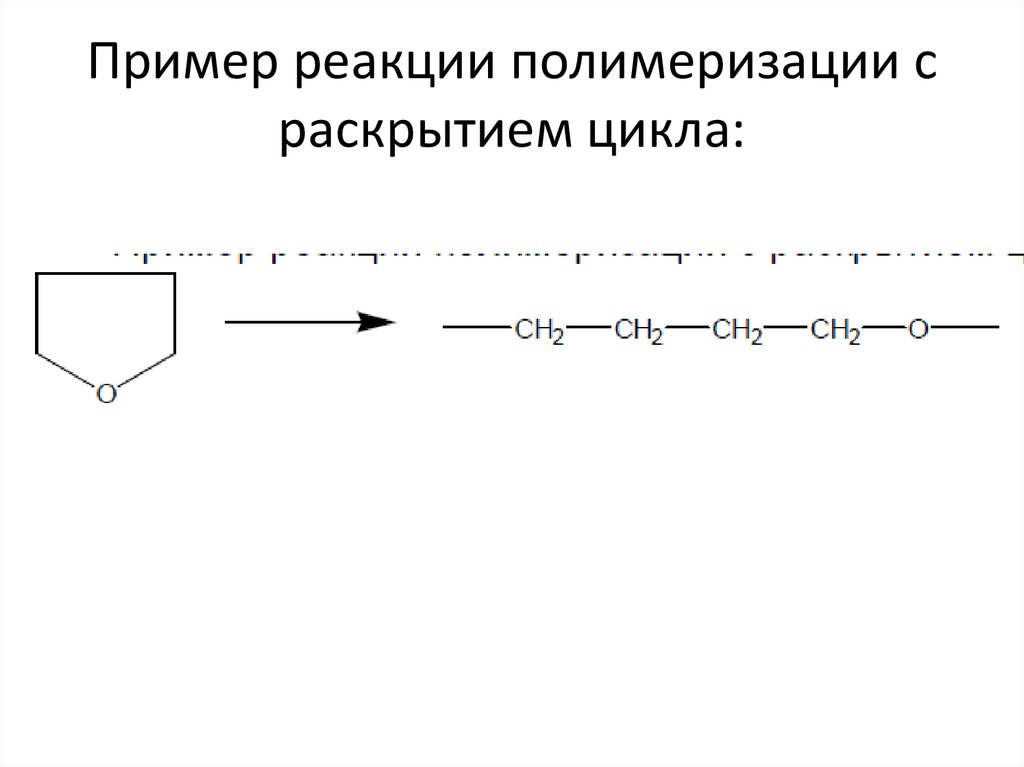
7. Полимеризация с раскрытием цикла
В реакции этого типа способны вступать мономеры, имеющие термодинамическинеустойчивые циклы – состоящие из 3,4 или > 6 атомов углерода, обычно содержащие
гетероатом.
8. Поликонденсация и полиприсоединение
• Поликонденсация – ступенчатый процессвзаимодействия молекул, содержащих функциональные
группы, приводящий в результате химического
взаимодействия этих групп к образованию полимера
(может сопровождаться выделением
низкомолекулярного вещества – воды, спирта, аммиака,
и.т.д.)
• Поликонденсация - это процесс синтеза
высокомолекулярных соединений, в котором рост
макромолекул происходит путем химического
взаимодействия исходных молекул друг с другом, с
реакционноспособными группами n-меров,
накапливающихся в ходе реакции, а также молекул nмеров между собой.
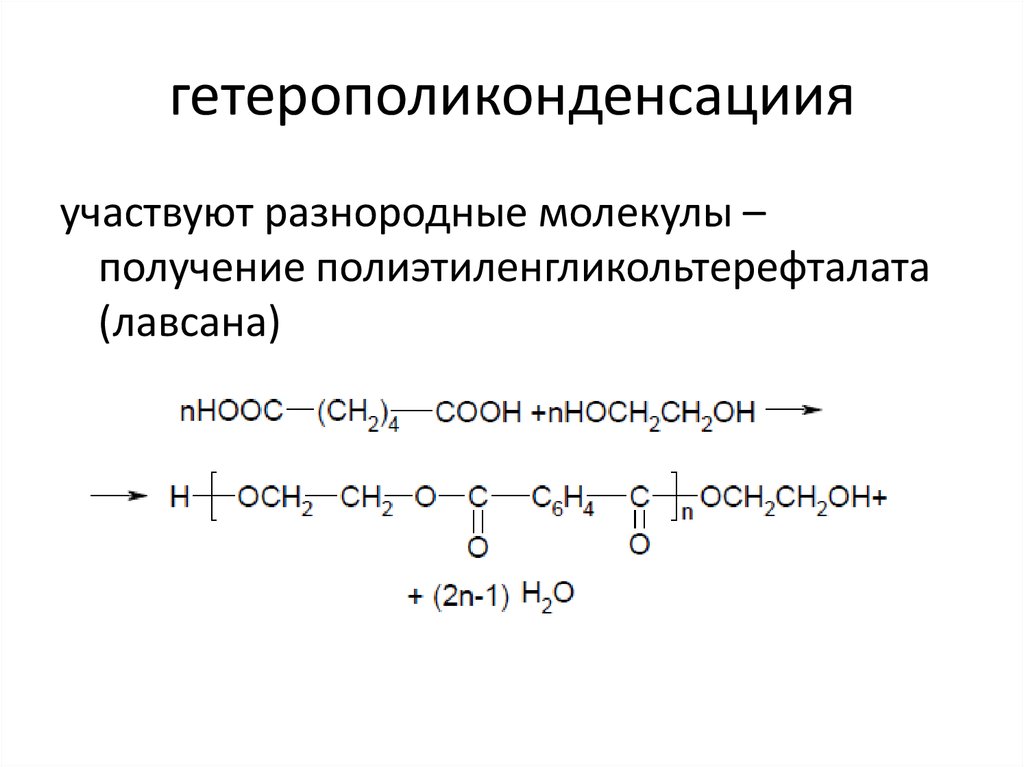
9. гетерополиконденсациия
участвуют разнородные молекулы –получение полиэтиленгликольтерефталата
(лавсана)
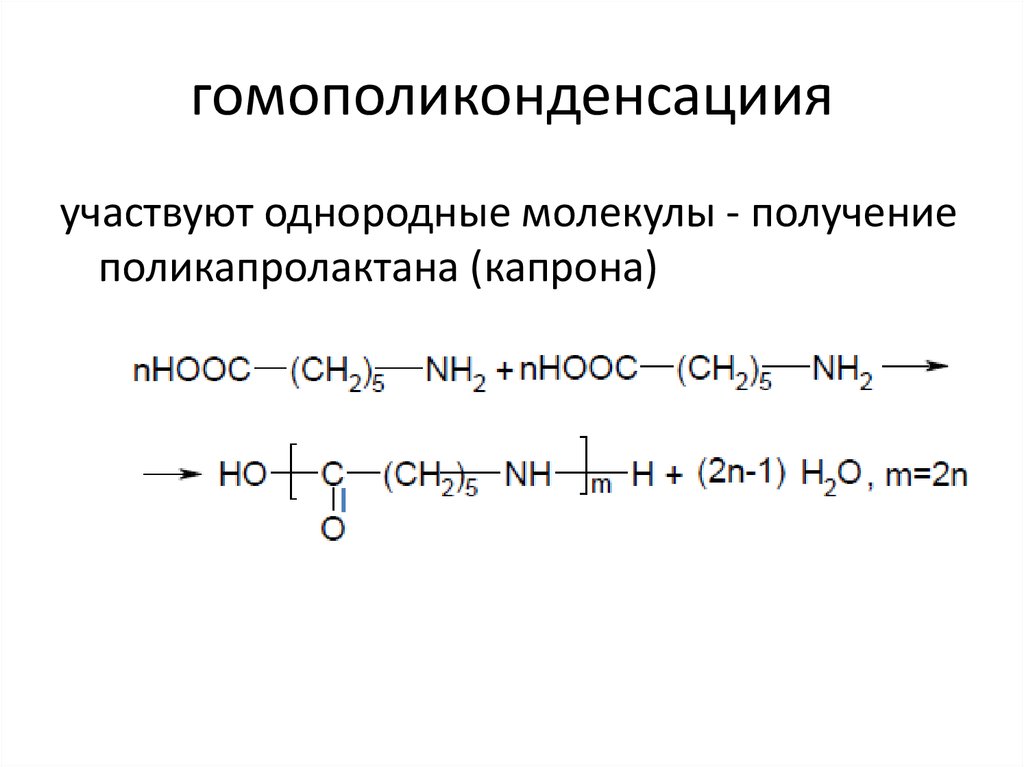
10. гомополиконденсациия
участвуют однородные молекулы - получениеполикапролактана (капрона)
11. Радикальная полимеризация
Радикальной полимеризацией называетсяцепная реакция, протекающая через
образование свободных радикалов.
12.
Как всякая цепная реакция, полимеризациясостоит в основном из трех элементарных
реакций:
• 1) образование активного центра;
• 2)рост цепи;
• 3) обрыв цепи.
13. Общая характеристика элементарных актов цепной полимеризации (ПМ) не отличается от тех же стадий цепных процессов
• 1. Реакция образования активных центроввсегда требует затраты большого количества
энергии и протекает медленно.
• 2. Рост цепи отличается малой энергией
активации, и скорость этой реакции очень
велика, тепловой эффект всегда
положительный.
• 3. Реакция обрыва цепи также характеризуется
небольшой энергией активации и протекает с
достаточно высокой скоростью.
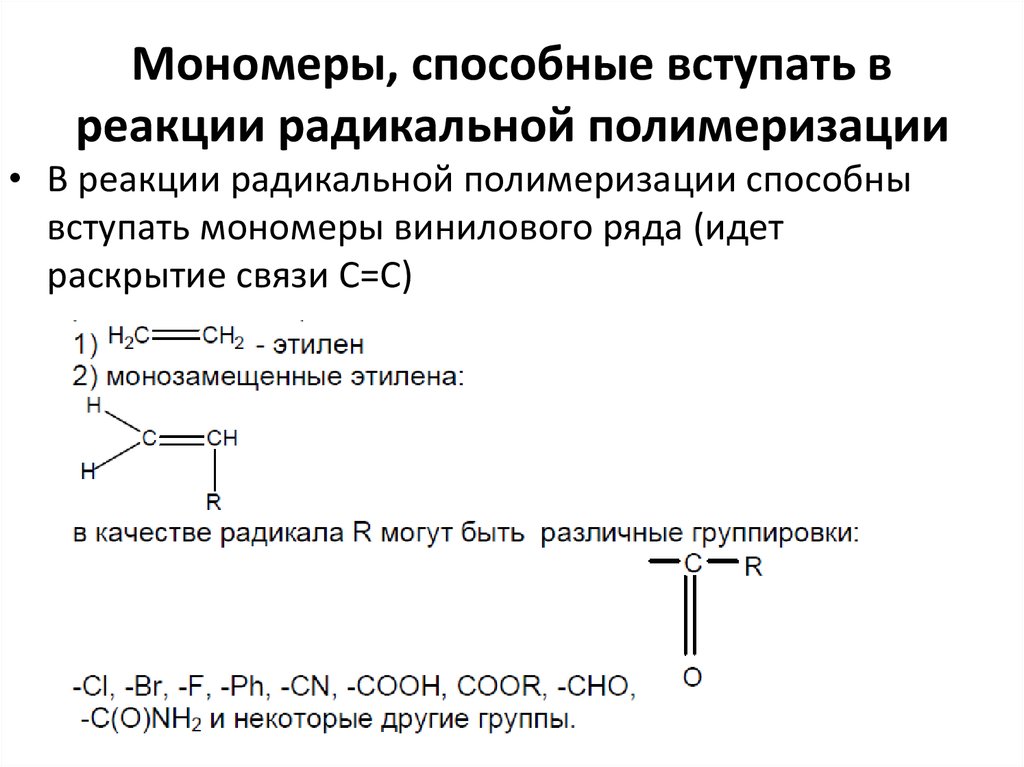
14. Мономеры, способные вступать в реакции радикальной полимеризации
• В реакции радикальной полимеризации способнывступать мономеры винилового ряда (идет
раскрытие связи С=С)
15.
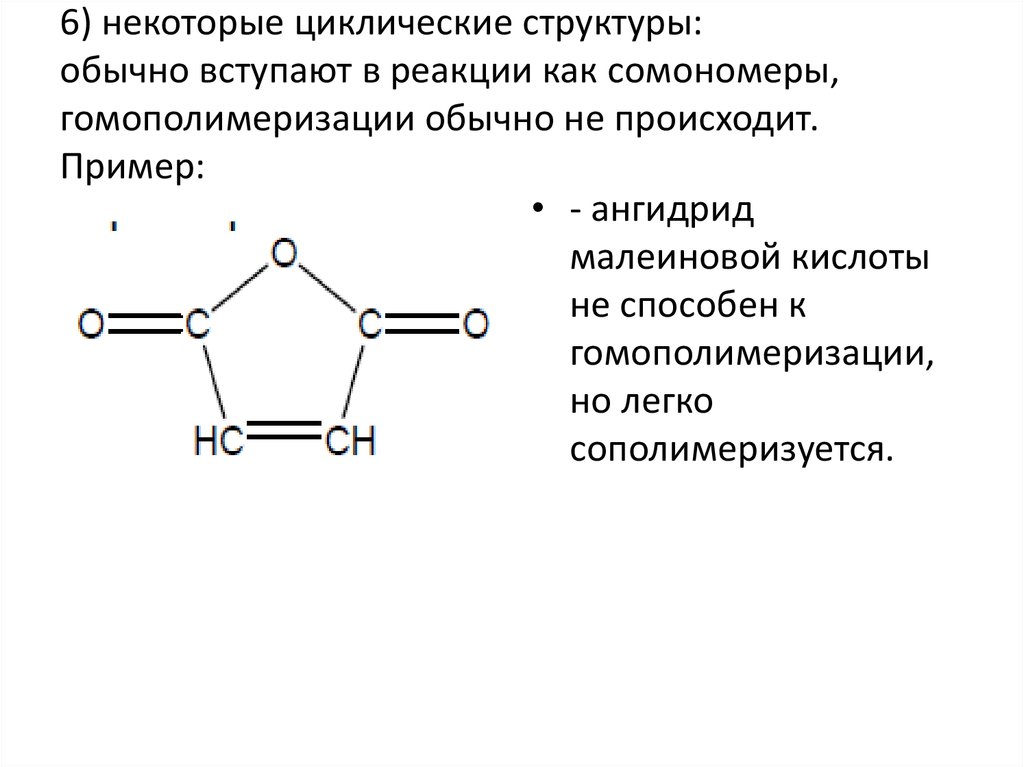
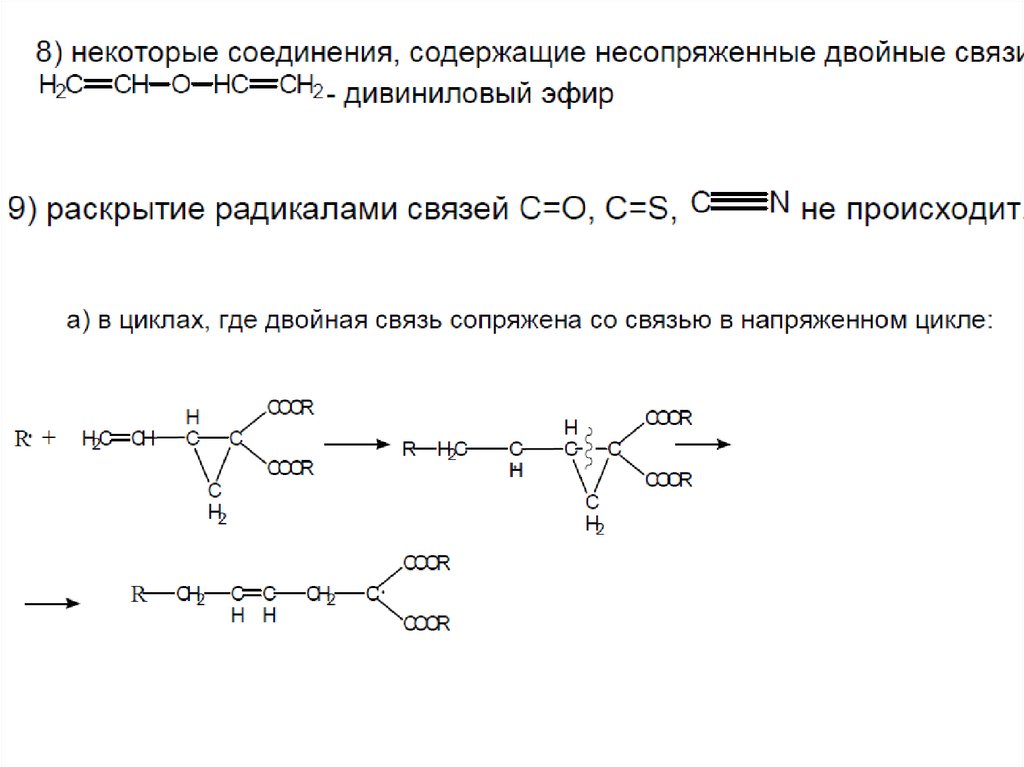
16. 6) некоторые циклические структуры: обычно вступают в реакции как сомономеры, гомополимеризации обычно не происходит. Пример:
• - ангидридмалеиновой кислоты
не способен к
гомополимеризации,
но легко
сополимеризуется.
17.
18. Пример реакции полимеризации с раскрытием цикла:
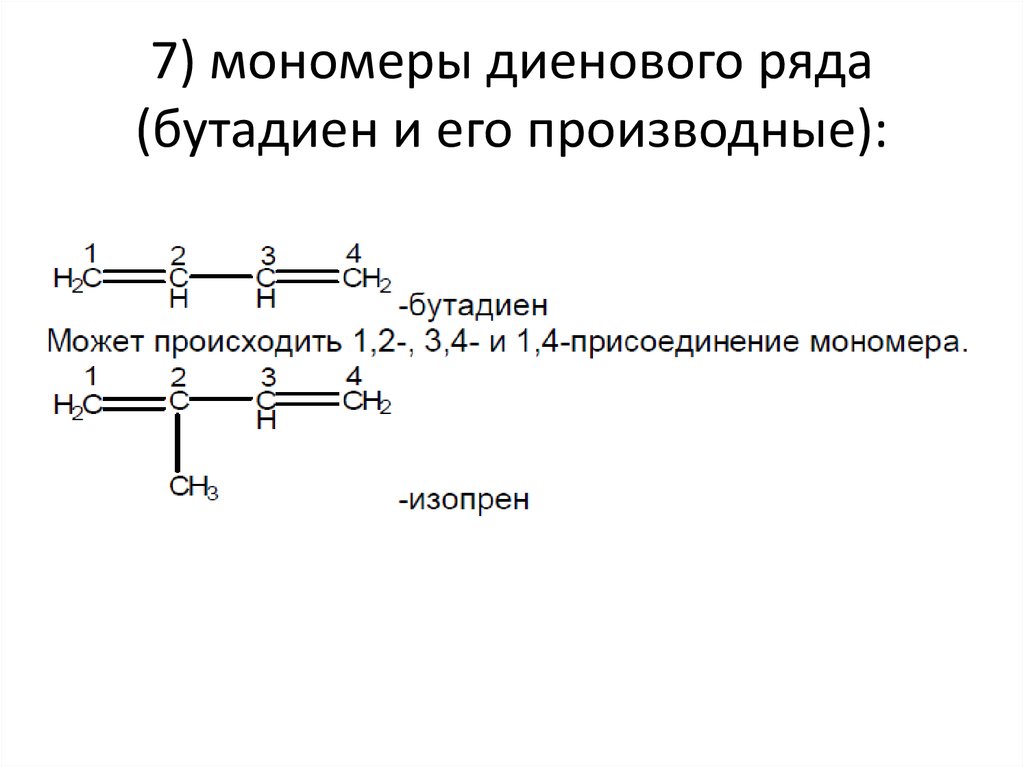
19. 7) мономеры диенового ряда (бутадиен и его производные):
20.
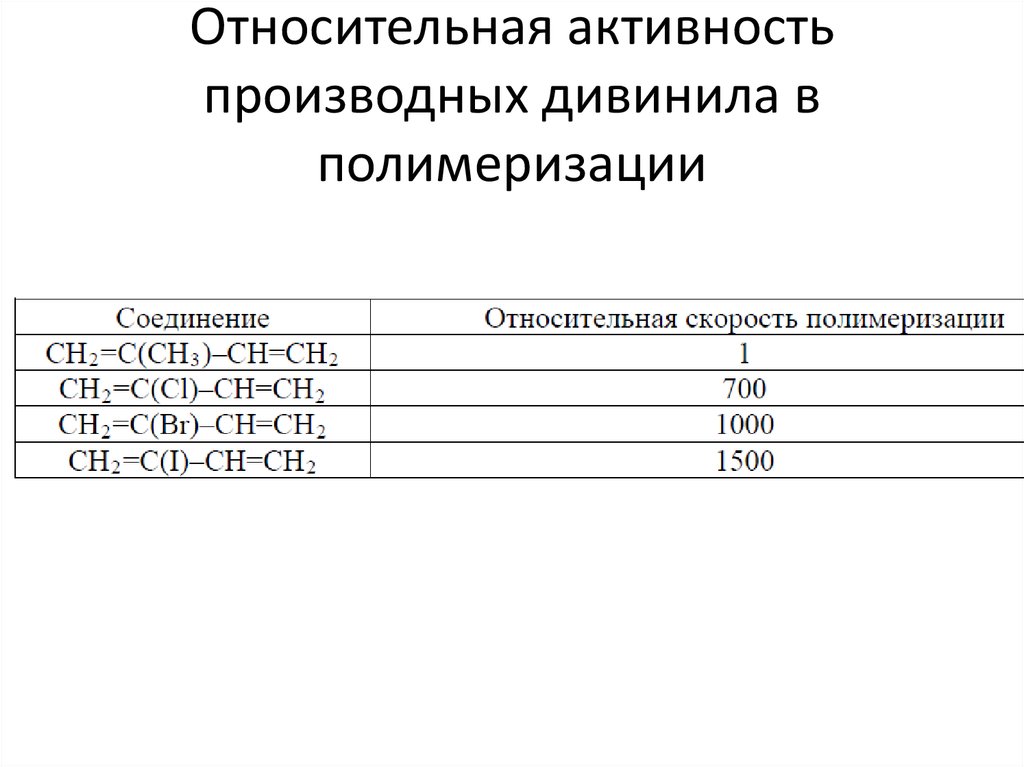
• СH2=CH–CH=CH2 полимеризуется;• СH2=C(Ph)–CH=CH2 полимеризуется в 10 раз
быстрее дивинила;
• (Ph)CH=CH–CH=CH2 полимеризуется с
трудом;
• (Ph)CH=CH–CH=CH(Ph) не полимеризуется
21. Относительная активность производных дивинила в полимеризации
22.
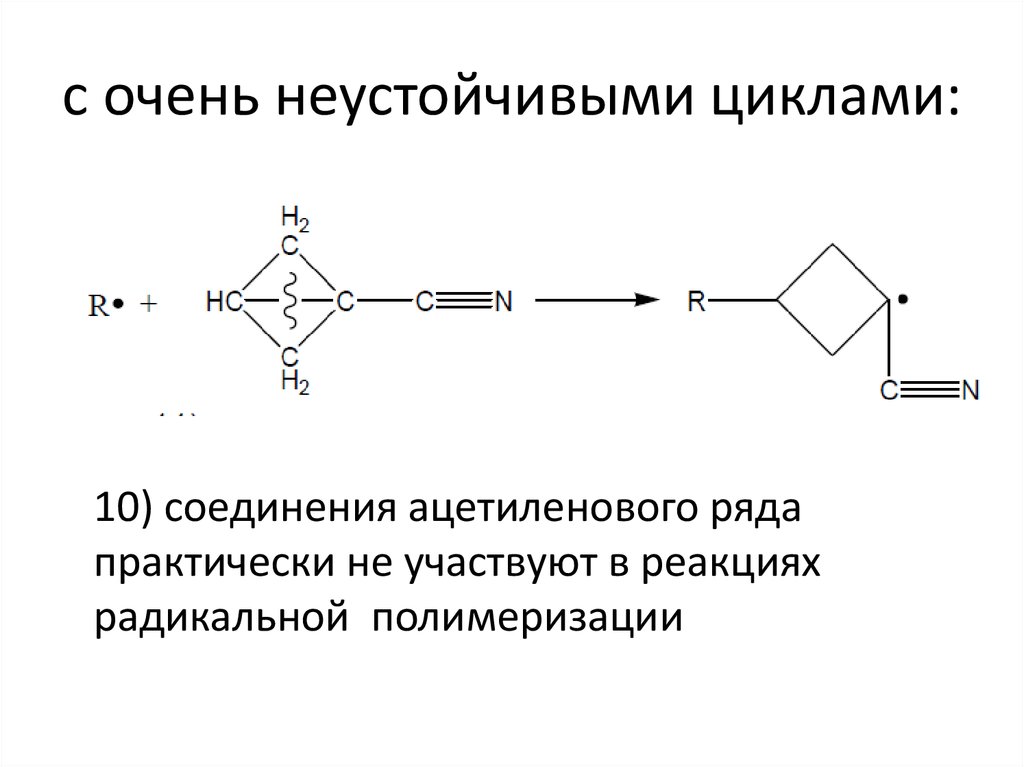
23. с очень неустойчивыми циклами:
10) соединения ацетиленового рядапрактически не участвуют в реакциях
радикальной полимеризации
24. Полимеризация
Полимеризацией называется реакциясоединения мономерных молекул с
раскрытием двойной (или тройной) связи,
которая не сопровождается выделением
побочных продуктов и протекает без
изменения состава реагирующих веществ,
т.е. элементный состав мономера и
полимера одинаков.
25. Процесс полимеризации является цепной реакцией, состоящей из трех элементарных актов:
1. Образования активного центра на мономере2. Роста цепи
3. Обрыва цепи
В зависимости от характера активных центров,
инициирующих цепной процесс, различают:
• Радикальную полимеризацию
• Ионную полимеризацию
26. Радикальная полимеризация
Активными центрами являются свободныерадикалы.
В зависимости от способа образования
свободных радикалов инициирование
может быть:
• Термическим (нагрев)
• Фотохимическим (квант света)
• Радиационным (под воздействием
ускоренных электронов
• Химическим (инициаторы) – в качестве
инициаторов применяют пероксиды,
гидропероксиды.
27.
• Реакции могут осуществляться различнымиспособами, но соблюдается следующая
принципиальная схема процесса.
• A1 A1* Образование активного центра
• А1*+А1 А2*
А2*+А1 А3*
Рост цепи
Аn-1*+А1 Аn*
• Аn* А2 – Обрыв цепи,
где A1 – молекула мономера; А1* - активный
центр; А2*, А3* … Аn-1*, Аn* - растущая цепь;
Аn – молекула полимера
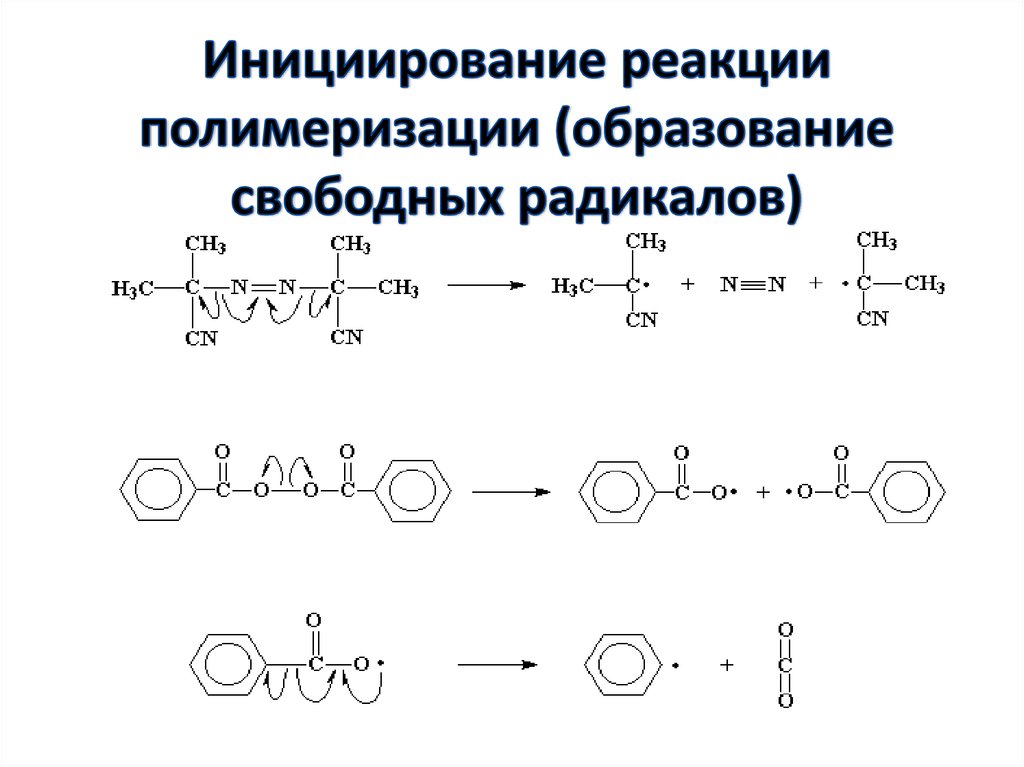
28. Инициирование реакции полимеризации (образование свободных радикалов)
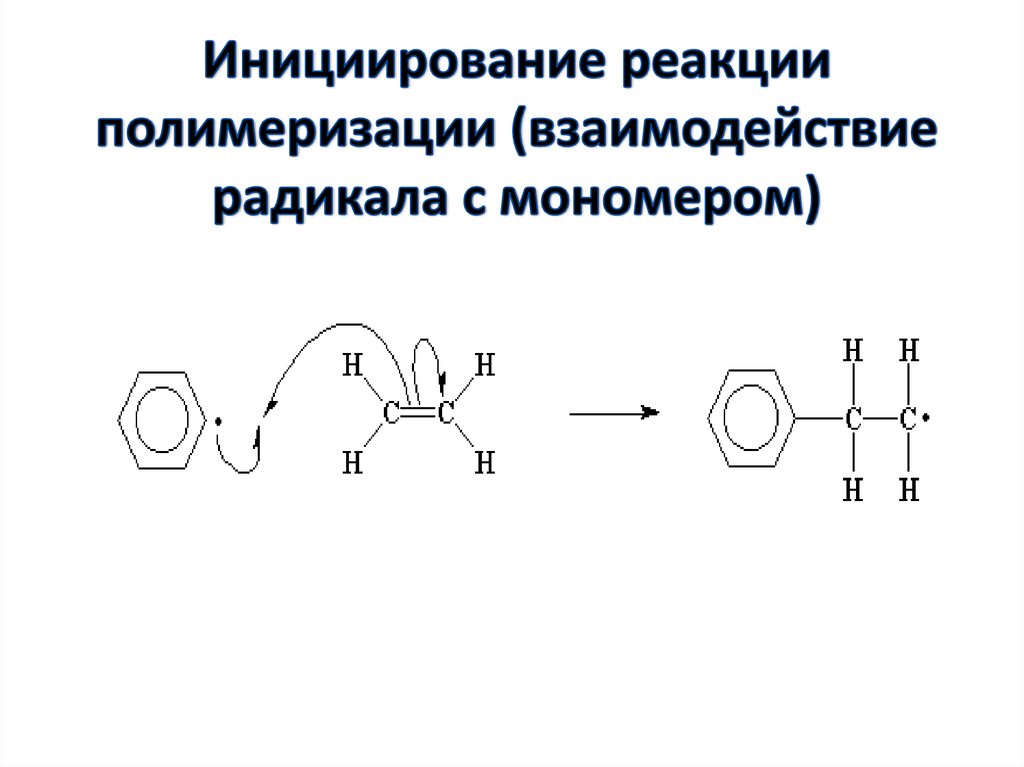
29. Инициирование реакции полимеризации (взаимодействие радикала с мономером)
30.
31.
32.
33.
34. Соединения, имеющие в своем составе азогруппу
35.
36.
Эффективность инициаторов1. Способность инициатора распадаться без
образования радикалов.
2. Возможность протекания реакции
передачи цепи на инициатор.
3. Возможность протекания побочных
реакций, в которых участвует радикал с
образованием малоактивных радикалов
или вообще неактивных веществ.
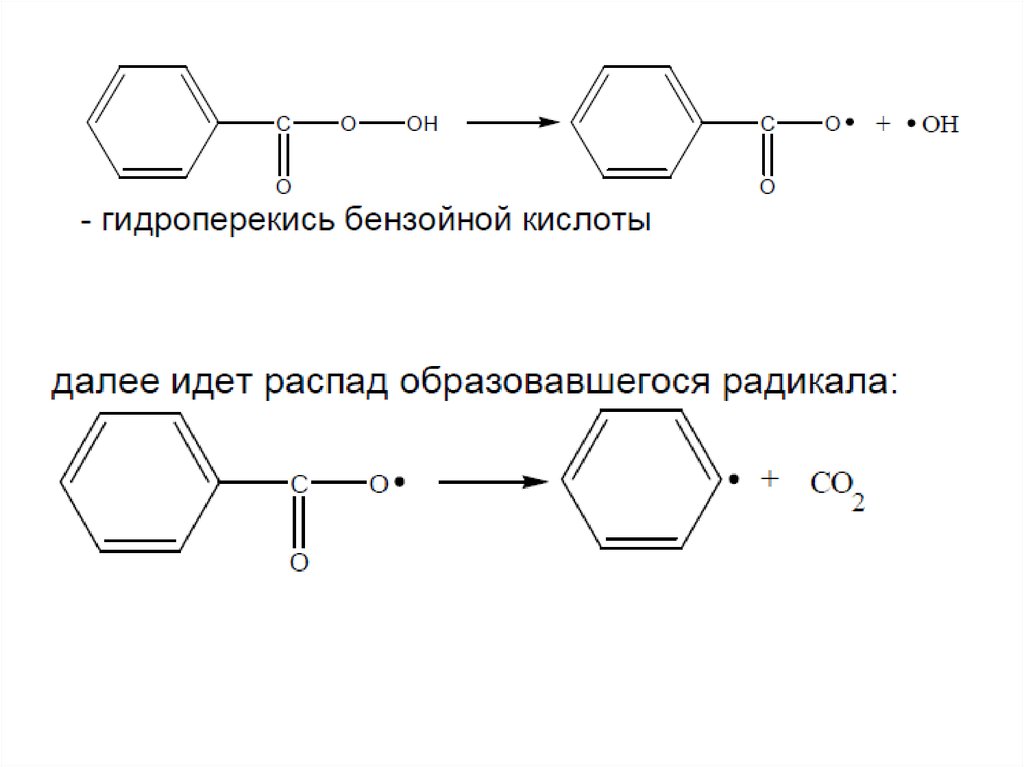
37. Эффективность инициаторов
Побочные реакции с участием радикаловперекиси бензоила
(а) [2С6Н5СО•] → [С6Н5СООС6Н5 + СО2];
(б) С6Н5• + 2С6Н5СОО• → С6Н5СООС6Н5;
(в) С6Н5• + С6Н5• → (С6Н5)2.
38. Эффективность инициирования
f= отношение числа радикалов,инициирующих полимеризацию к общему
числу радикалов
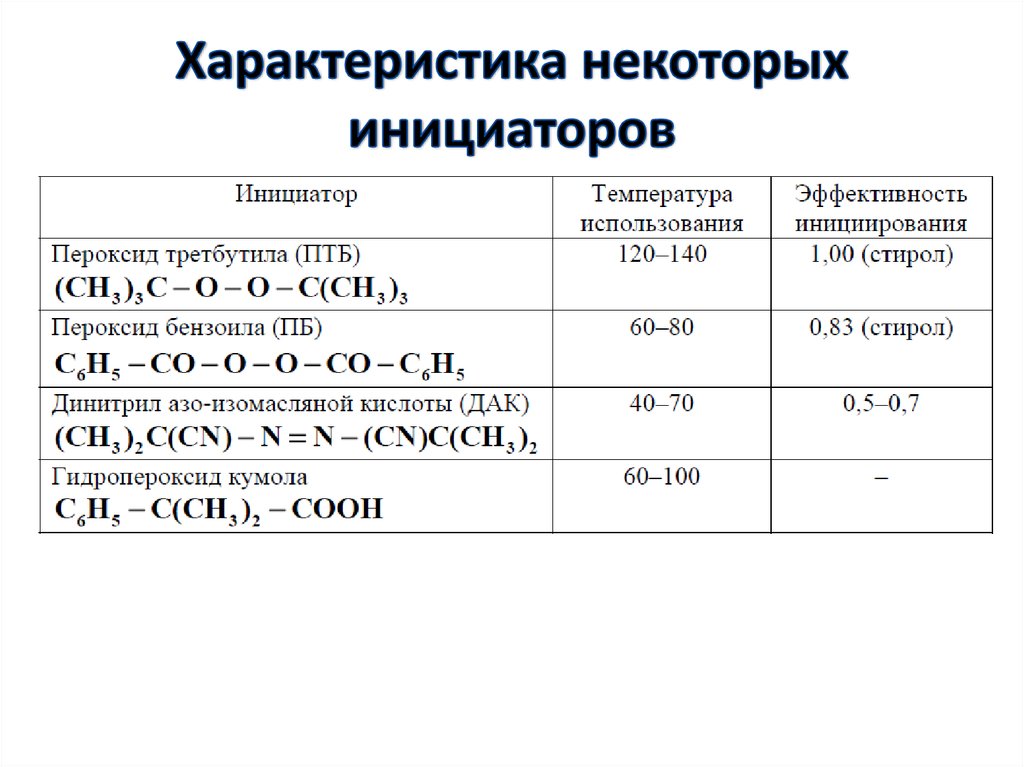
39. Характеристика некоторых инициаторов
40.
• Скорость инициирования представляет собойскорость распада с учетом эффективности
инициирования:
где f – эффективность инициирования –
выражается в долях (т. е. 0<f<1)
• Инициатор считается хорошим, если f > 0.5.
• Скорость распада, в свою очередь, зависит от
концентрации инициатора:
• поэтому выражение для скорости
инициирования принимает вид:
41. Влияние температуры на ход процесса
• Константа скорости распада зависит оттемпературы по уравнению Аррениуса
42.
• Обратным процессу распадаявляется процесс рекомбинации
образовавшихся в системе
радикалов.
• Рекомбинация может протекать в
окружении молекул мономера,
образовавшегося полимера или
растворителя. Это явление
называется эффектом клетки
43. Окислительно-восстановительные системы Реактив Фентона: Персульфат – Fe2+:
Реактив Фентона:Персульфат – Fe2+:
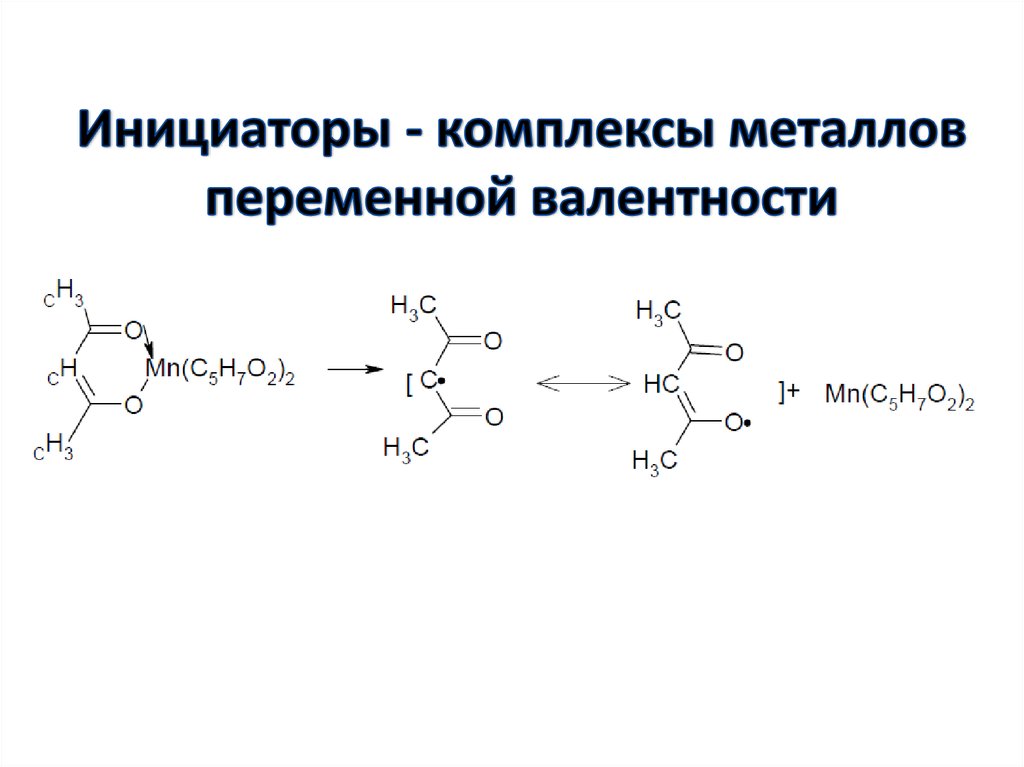
44. Инициаторы - комплексы металлов переменной валентности
45. Инициирование под действием различных излучений
• Радиационная химия - может идтиинициирование под действием γ-излучения
• Фотохимия:
Инициирование осуществляется при облучении
видимым или ультрафиолетовым светом:
Скорость инициирования в этом случае зависит
от интенсивности падающего света:
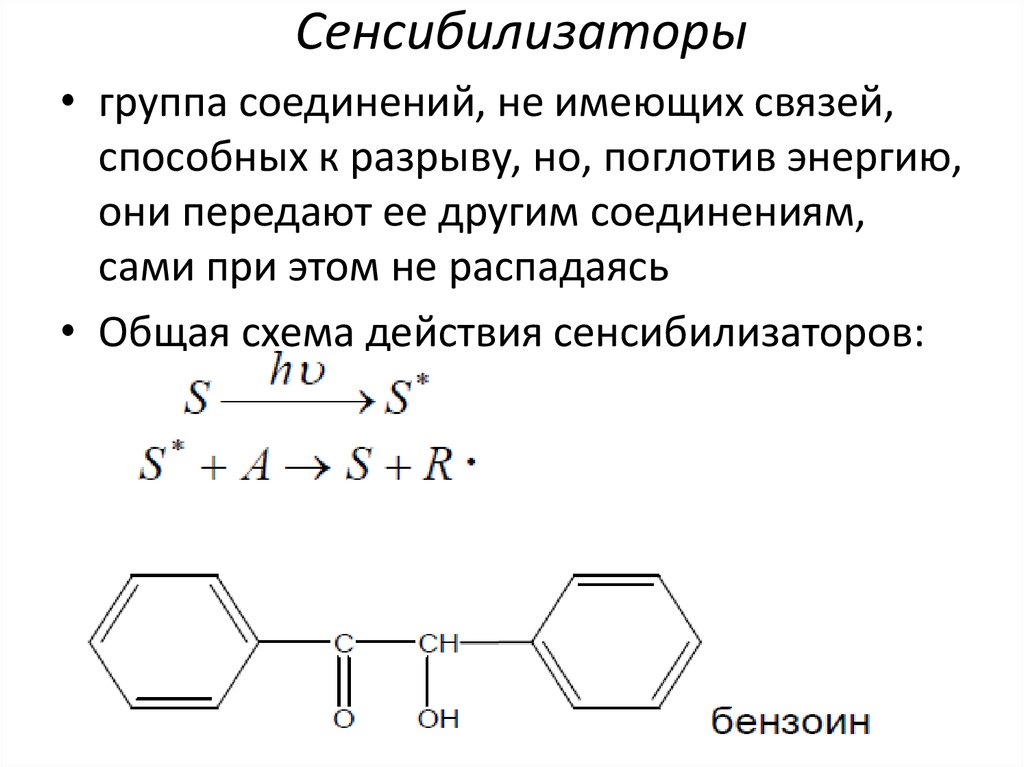
46. Сенсибилизаторы
• группа соединений, не имеющих связей,способных к разрыву, но, поглотив энергию,
они передают ее другим соединениям,
сами при этом не распадаясь
• Общая схема действия сенсибилизаторов:
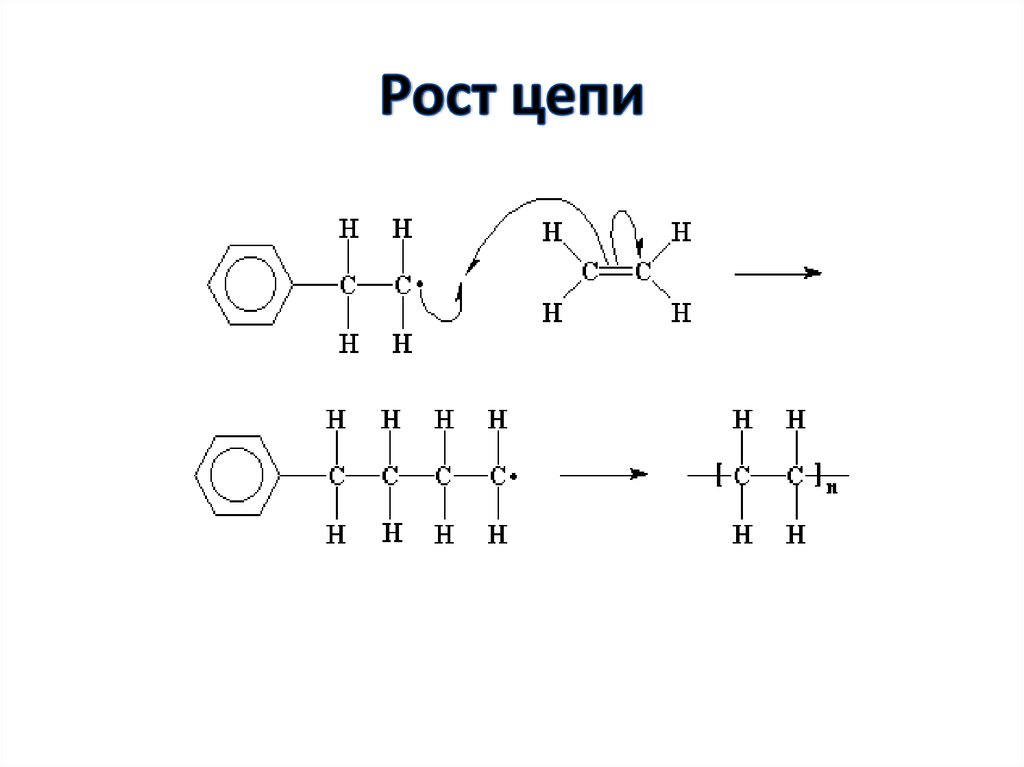
47. РОСТ ЦЕПИ
• Полимерная цепь растет в результатевзаимодействия мономера с
первоначально образовавшимся или
растущим радикалом
• А1*+А1 А2*
А2*+А1 А3*
Рост цепи
Аn-1*+А1 Аn*
где A1 – молекула мономера; А1* - активный
центр; А2*, А3* … Аn-1*, Аn* - растущая цепь
48. Рост цепи
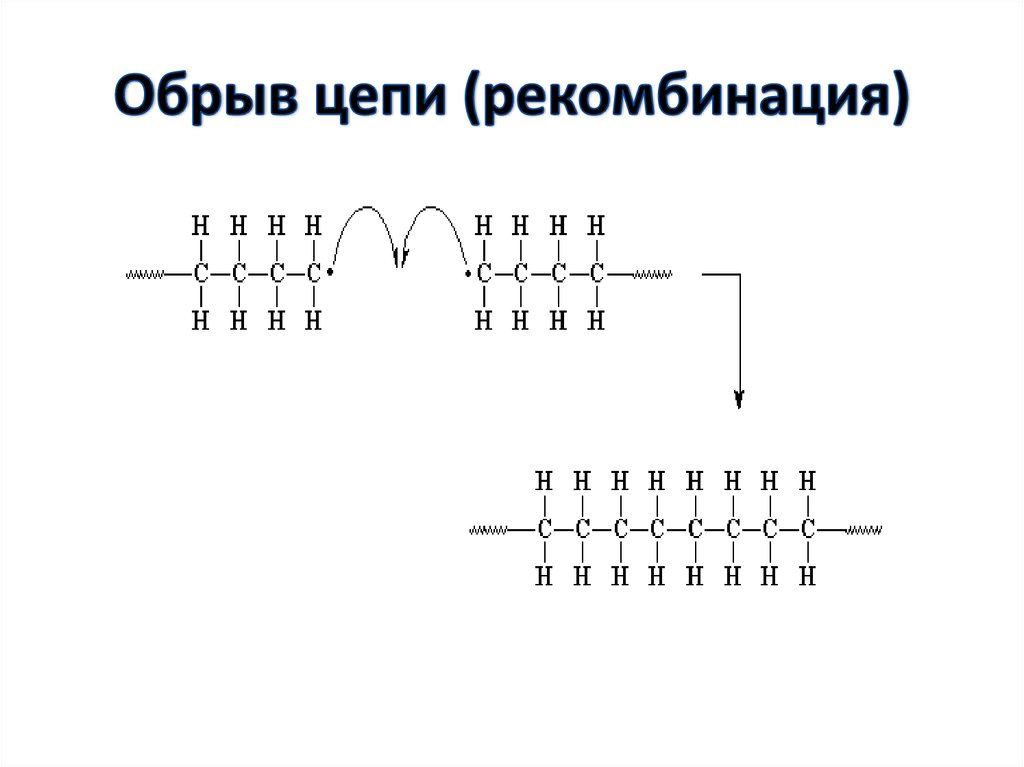
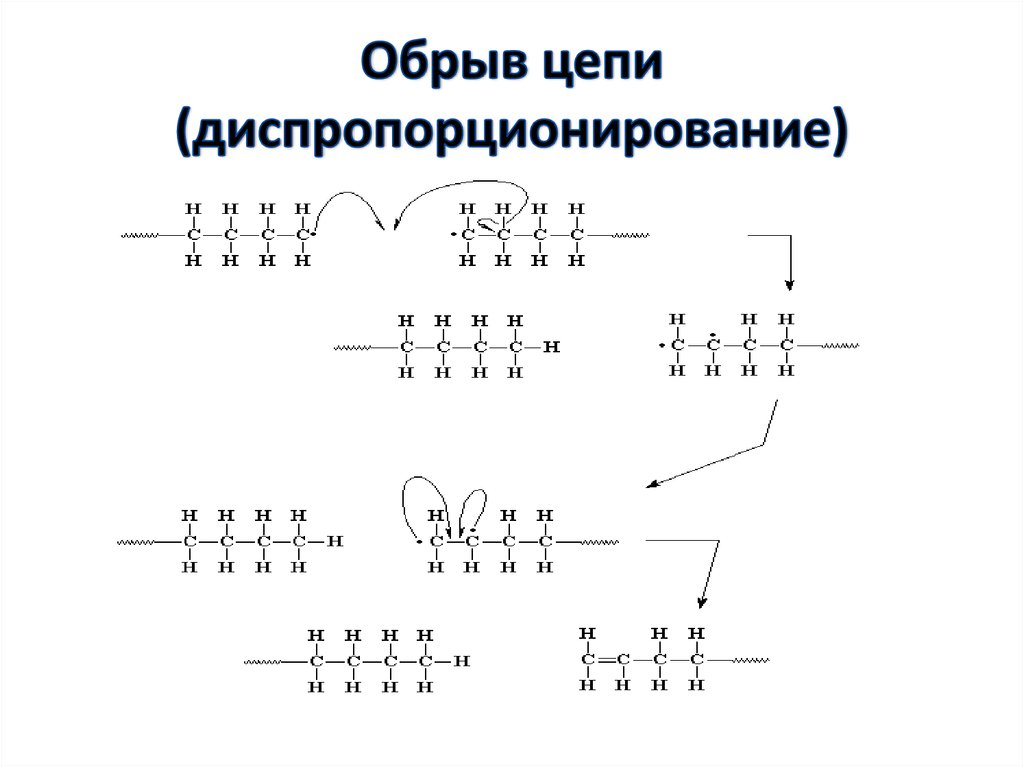
49. Обрыв цепи
• Обрыв цепи при радикальнойполимеризации может происходить
различными путями: реакции
рекомбинации и диспропорционирования
макрорадикалов, реакции передачи цепи
через полимер, мономер, растворитель,
инициатор, примеси и т.п.
50.
• Обрыв цепи при радикальнойполимеризации может происходить
различными путями: реакции
рекомбинации и диспропорционирования
макрорадикалов, реакции передачи цепи
через полимер, мономер, растворитель,
инициатор, примеси и т.п. В большинстве
случаев причиной обрыва являются
реакции рекомбинации и
диспропорционирования
51. Обрыв цепи (рекомбинация)
52. Обрыв цепи (диспропорционирование)
53. Скорость реакции обрыва зависит от концентрации радикалов в системе
54.
• Скорость процесса определяетсядиффузией
• Макрорадикалам нужно сблизиться и
развернуться в нужном направлении (2
стадии).
• Лимитирующей стадией является не
поступательная диффузия клубка, а
диффузия конца цепи. Таким образом,
константа обрыва в разбавленных
растворах полимера не зависит от длины
цепи.
55. Гель-эффект
56. Гель-эффект
При полимеризации винильных мономероввязкость системы изменяется на много
порядков. Когда она возрастает на 4–5
порядков, что означает 15–25 %
превращения, скорость полимеризации
многих мономеров самопроизвольно
увеличивается. Этот эффект получил
название гель-эффекта.
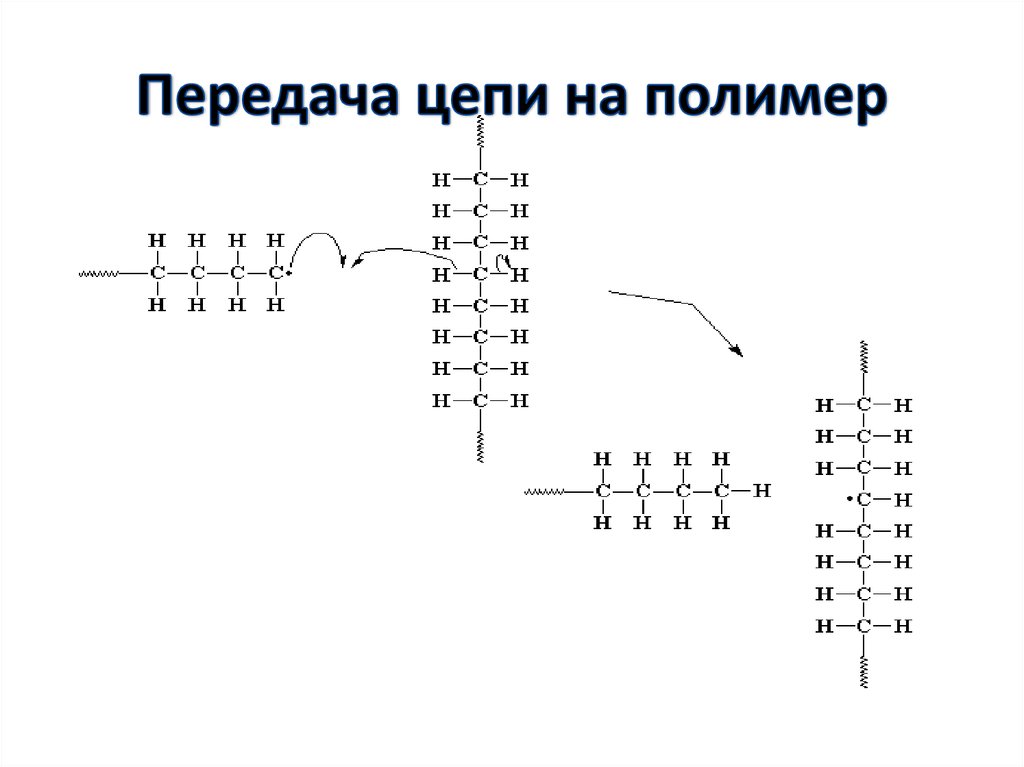
57. Передача цепи на полимер
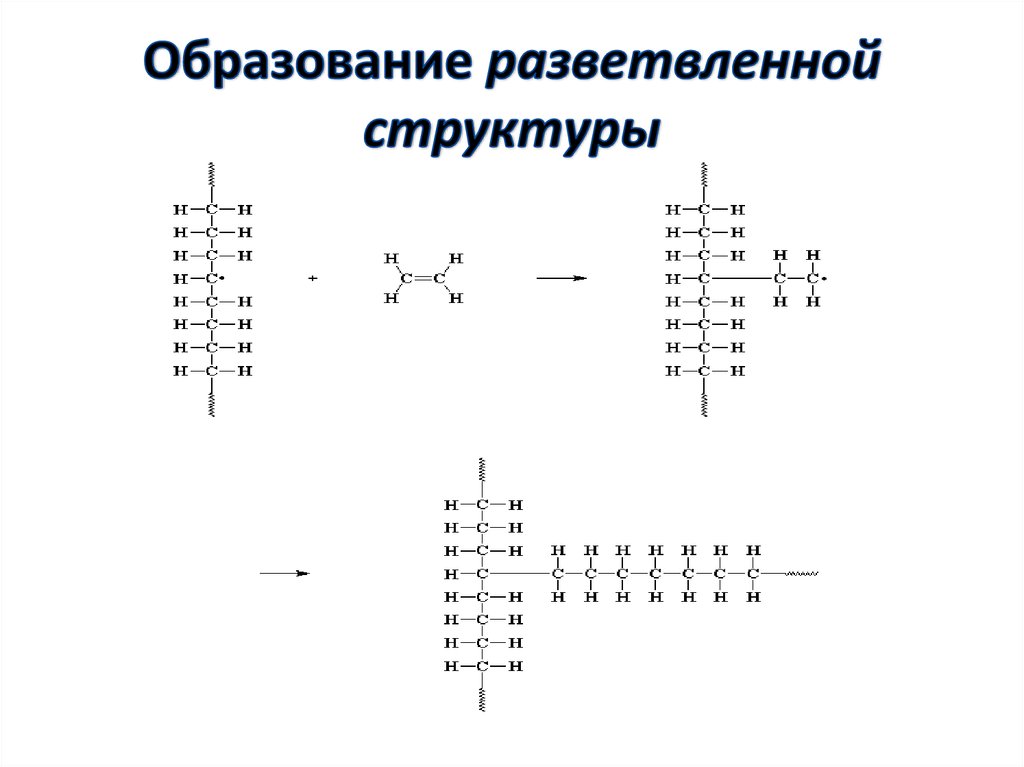
58. Образование разветвленной структуры
59. Передача цепи через молекулу мономера: через молекулу растворителя: через молекулу инициатора:
60. Ингибиторы – вещества, добавление которых к мономеру, вызывает полное прекращение полимеризации. Замедлители - вещества,
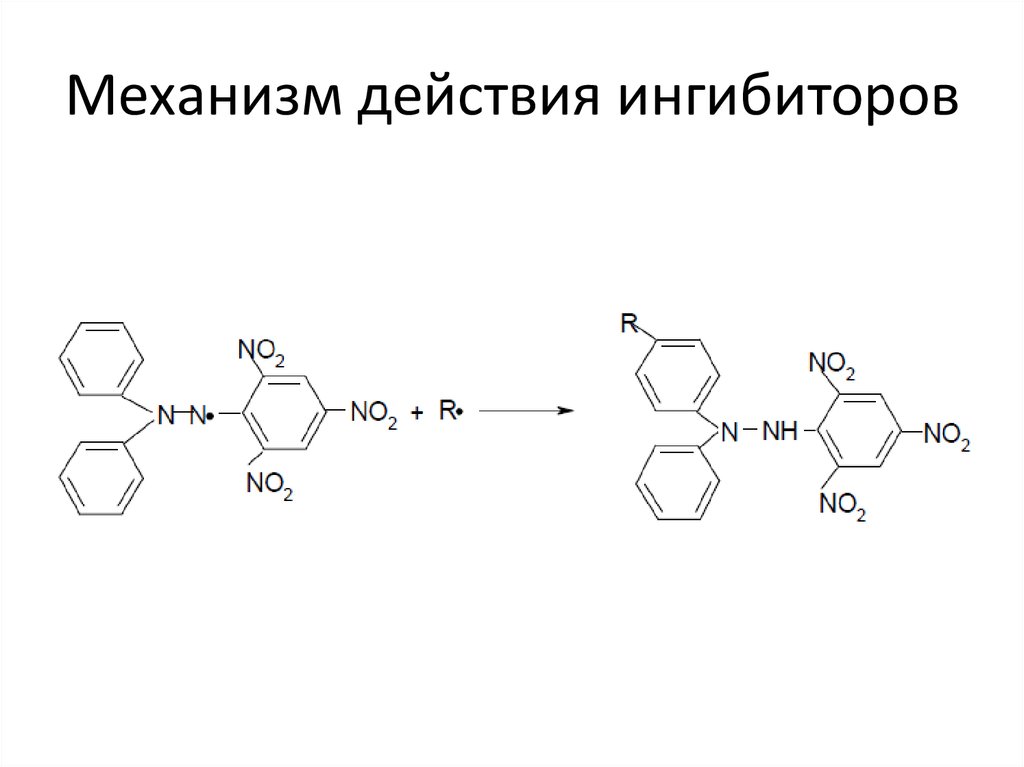
61. Механизм действия ингибиторов
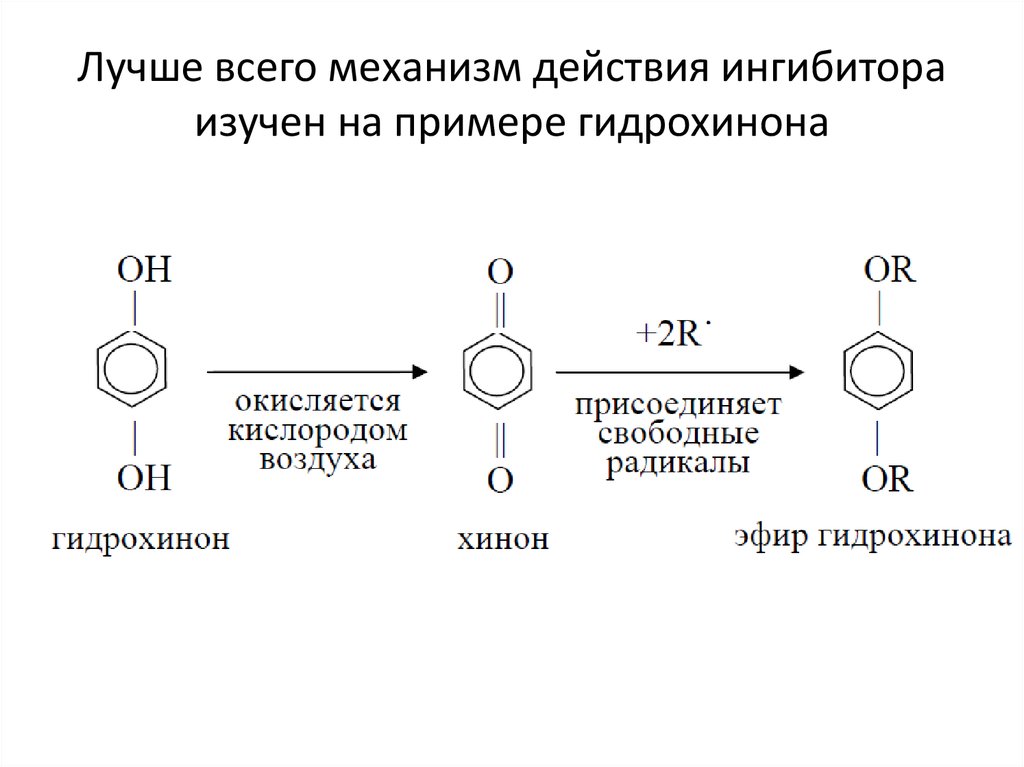
62. Лучше всего механизм действия ингибитора изучен на примере гидрохинона
63. Кислород играет двойную роль в процессе ингибирования. Ингибирующее действие: R• + O2→R-O-O• Инициирование полимеризации:
64.
Скоростьинициирования
складывается
из
инициаторов с образованием активных радикалов:
Kин
I
2R* ;
Vин = 2Kин [ I ],
где [ I ] – концентрация радикала,
например:
(C6H5COO)2
2C6H5COO*
2C6H5* + 2CO2 ;
и скорости собственно инициирования:
K/
R*+ M
RM* ; V/ = K/ [R*] [M],
где [R*] – концентрация свободных радикалов;
[M] – концентрация мономеров.
скорости
распада
65.
• Доля радикалов инициатора, фактическиучаствующих в инициировании и
определяемых скоростью V/, называется
эффективностью инициирования f и
равна f = V/ / Vин .
Так как Kин<< K/, то скорость инициирования
определяется скоростью распада
инициатора, и, следовательно,
Vин =2 Kин f [ I ].
66. Скорость инициирования
67.
Рост цепи происходит путём последовательного присоединениямолекул мономера к радикалам, образующимся в результате инициирования,
например:
KP
RM* + M
RMM*
KP
RMM*+M
RMMM* и тд.
KP
RMn+1* + M
RMn*
68.
• Скорость превращения мономера есть,практически, скорость роста.
• Vр= Кр [ M* ] [ M ],
где [ M* ] – концентрация макрорадикалов;
[ M ] – концентрация мономера;
Кр – константа скорости роста цепи.
69.
• При обрыве цепи в системе активныерадикалы исчезают или заменяются
малоактивными радикалами,
неспособными присоединять молекулы
мономера. Обрыв цепи при радикальной
полимеризации, в основном, происходит в
результате бимолекулярных реакций
растущих макрорадикалов по схеме
диспропорционирования или
рекомбинации.
70.
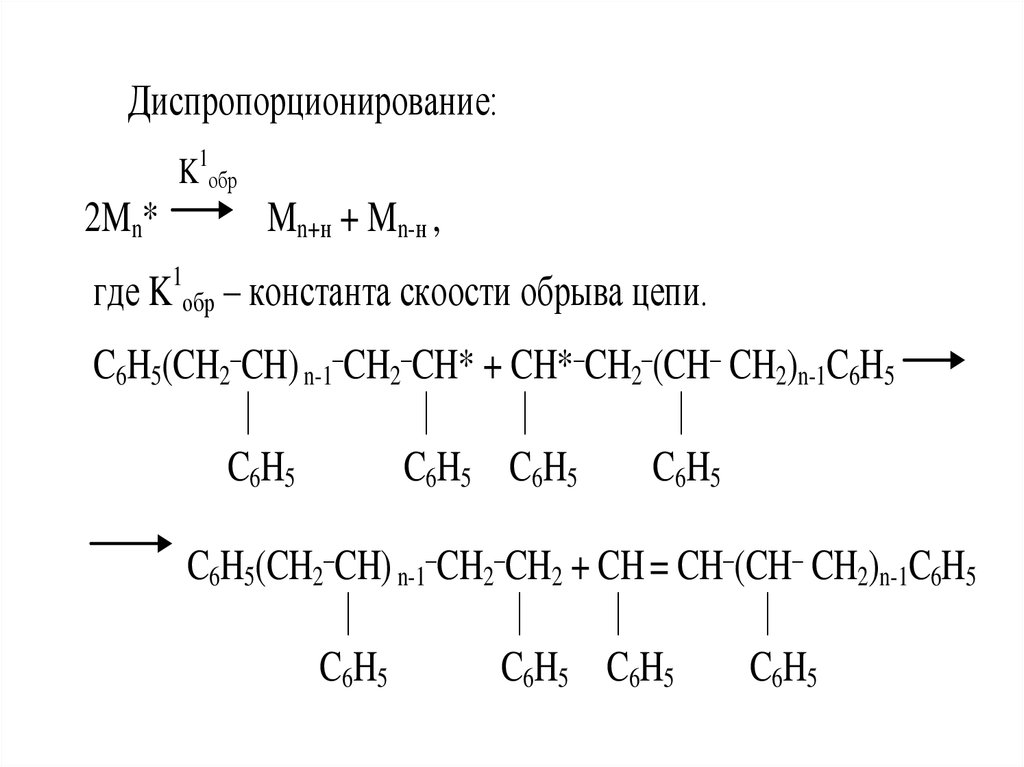
Диспропорционирование:K1обр
2Mn*
Mn+н + Mn-н ,
где K1обр – константа скоости обрыва цепи.
C6H5(CH2_CH) n-1_CH2_CH* + CH*_CH2_(CH_ CH2)n-1C6H5
C6H5
C6H5 C6H5
C6H5
C6H5(CH2_CH) n-1_CH2_CH2 + CH = CH_(CH_ CH2)n-1C6H5
C6H5
C6H5 C6H5
C6H5
71.
Рекомбинация:Kобр
2Mn*
Mn - Mн
C6H5(CH2_CH) n-1_CH2_CH* + CH*_CH2_(CH_ CH2)n-1C6H5
C6H5
C6H5 C6H5
C6H5
C6H5(CH2_CH) n_(CH_ CH2)n_C6H5
C6H5 C6H5
72. Скорость обрыва цепи: Vобр= Кобр [ M* ]2 .
Скорость обрыва цепи:2
Vобр= Кобр [ M* ] .
73. КИНЕТИКА РАДИКАЛЬНОЙ ПОЛИМЕРИЗАЦИИ
• Допущения:1. Реакционная способность радикалов,
образующихся в процессе ПМ, не зависит от
длины цепи;
2. Радикальная цепь участвует только в
реакции с мономером, доля всех побочных
процессов ничтожно мала;
• 3. Для вывода кинетических уравнений
воспользуемся принципом стационарного
состояния введенным Боденштейном.
74. Принцип стационарного состояния Боденштейна
Скорость реакции в стационарном состоянииравна скорости роста цепи:
75. Длина кинетической цепи –
–среднее число молекул мономера,
приходящихся на один образовавшийся
активный центр
76. Длина кинетической цепи обратно пропорциональна концентрации радикалов или скорости полимеризации. Она при постоянной
77.
• Общая скоростьполимеризации равна скорости
расходования мономера на
стадии роста и идентична
скорости роста цепи:
• Vобщ= Vр Кр [ M* ] [ M ].
(1)
78.
• Vин = Vобр ,т.е. 2Kин f [ I ] = Kобр [ M*]2,
где [ M* ] = Vин.1/2 / Kоб.1/2 .
• Подставив [ M* ] в уравнение (1):
Vр = ( Кр / Kобр1/2 ) Vин1/2 [M] =
= ( Кр / Kобр1/2 ) ( 2Kин f ) 1/2 [ I ] 1/2 [M],
• обозначив ( Кр / Kобр1/2 ) ( 2Kин f ) 1/2 = K, запишем
• Vр = K [ I ] 1/2 [M] __
общее кинетическое уравнение
радикальной полимеризации
79. Средняя степень полимеризации определяется соотношением скорости роста и суммарной скорости обрыва
• P = Vр / Vобр = Кр [ M* ] / (Kобр [ M*]2 ),подставим
• [ M*] = Vин1/2 / Kобр1/2 , получим:
Кр Kобр1/2 [ M ]
• P = Кр Kобр1/2 [ M ] / Vин1/2 = ___________________
( 2Kин f ) 1/2 [ I ] 1/2
• Объединив все константы величиной К1 ,
находим:
P =
1
К[
M]/[I
1/2
]
80. Влияние основных факторов на полимеризацию винильных соединений
С повышением температуры скоростьполимеризации возрастает, а
молекулярная масса полимера
уменьшается.
• Wp=Kp[M][R ]
• Wp=Kобр[R ]2
Давление, как правило, увеличивает скорость
и степень полимеризации.
81. Чем больше концентрация инициатора, тем выше скорость полимеризации, но ниже молекулярная масса образующегося полимера. С
увеличением концентрациимономера повышается скорость
полимеризации и увеличивается
средняя степень полимеризации.
82. Способы проведения радикальной полимеризации
в массе (или блоке),
в растворе,
в суспензии,
в эмульсии










































![Скорость обрыва цепи: Vобр= Кобр [ M* ]2 . Скорость обрыва цепи: Vобр= Кобр [ M* ]2 .](https://cf.ppt-online.org/files/slide/9/91vWlwkPybJ5KxD0z4sqI3uCAHVdcmagNnEr82/slide-71.jpg)










 chemistry
chemistry








