Similar presentations:
Соли
1.
Соли2.
микросамостоятельнаянапишите
формулы
кислот
1 вариант
азотная,
сернистая,
сероводородная,
угольная
2 вариант
серная,
азотистая,
хлороводородная,
угольная
3.
Соли - сложные вещества, состоящие из Ме икислотного остатка
Существуют соли, где вместо Ме - группа аммония NH4
4.
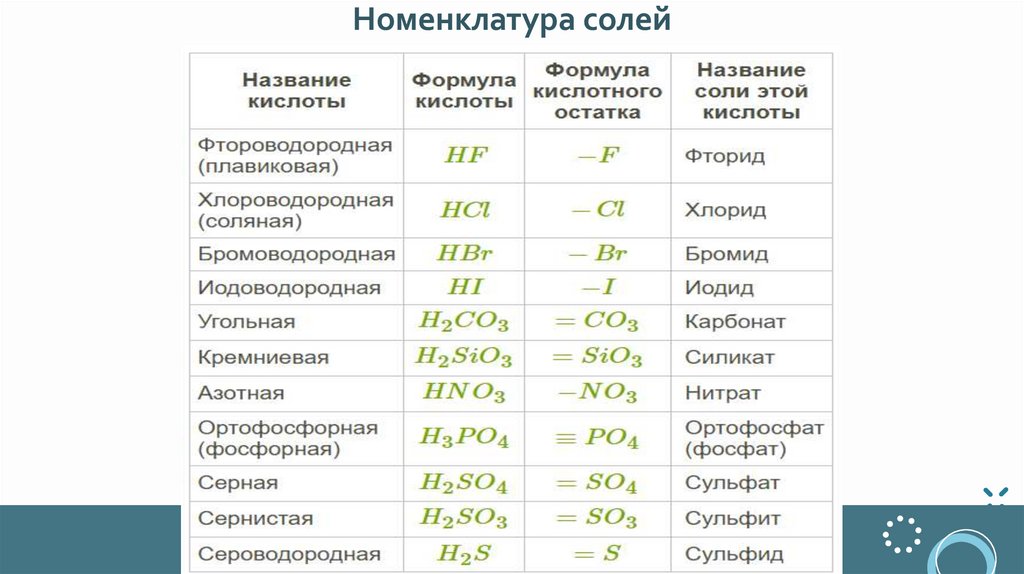
Номенклатура солей5.
Несколько правил для определения названий1. Если в состав соли входит кислотный остаток бескислородной
кислоты - суффикс ИД (HCl соль хлорИД)
2. Если в состав соли входит кислотный остаток кислоты,
заканчивающейся на -АЯ, у соли - суффикс АТ (H2SO4 соль
сульфАТ)
3. Если в состав соли входит кислотный остаток кислоты, у
которой есть суффикс -ИСТ, у соли - суффикс ИТ (H2SO3 соль
сульфИТ)
4. Если Ме с переменной валентностью - её указываем римскими
цифрами
6.
При составлении формул: сумма валентностей Медолжна быть равна сумме валентностей кислотного
остатка
7.
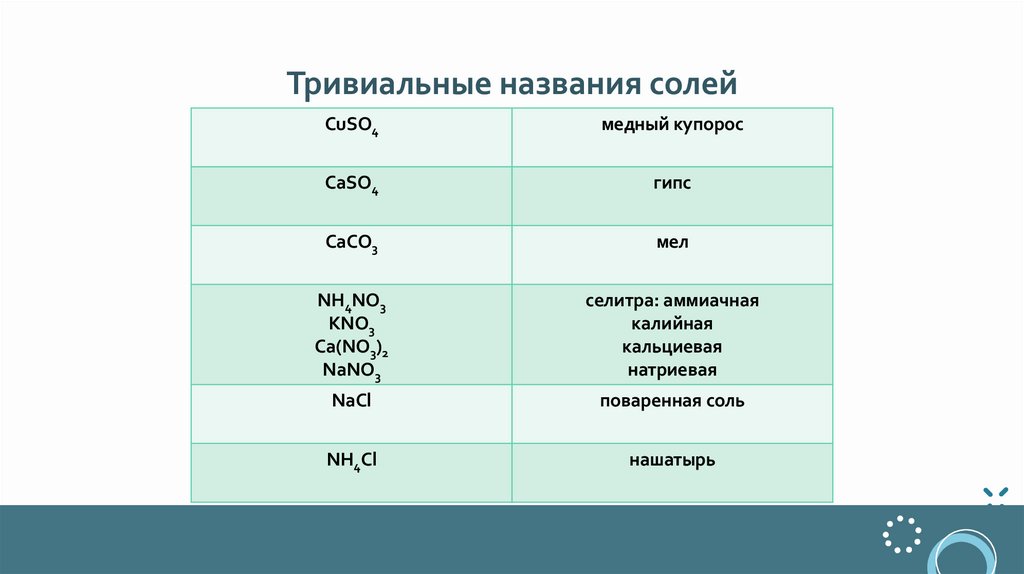
Тривиальные названия солейCuSO4
медный купорос
CaSO4
гипс
CaCO3
мел
NH4NO3
KNO3
Ca(NO3)2
NaNO3
селитра: аммиачная
калийная
кальциевая
натриевая
NaCl
поваренная соль
NH4Cl
нашатырь
8.
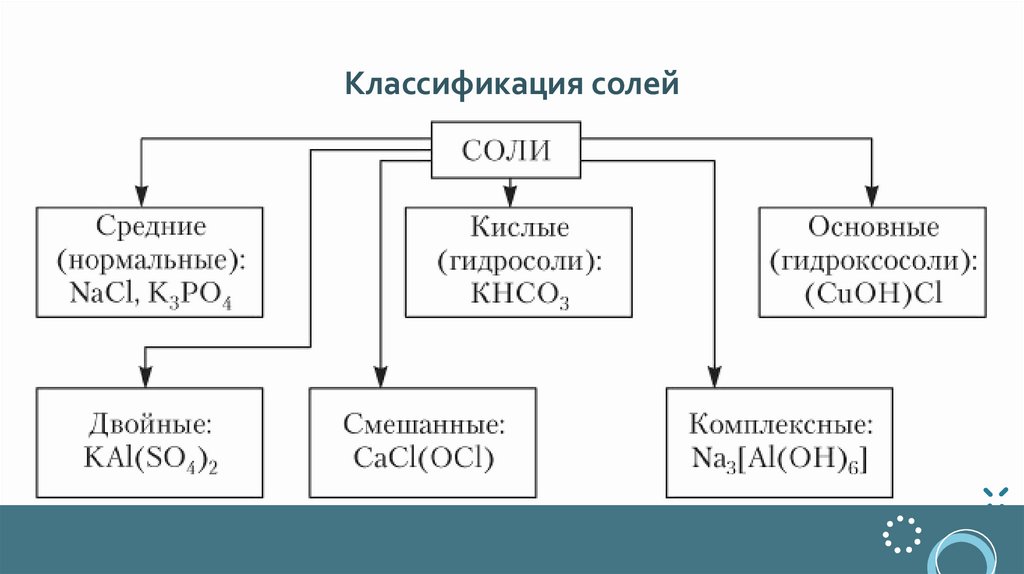
Классификация солей9.
Кристаллогидраты солей• многие соли выпадают в осадок в растворе в виде кристаллов,
содержащих молекулы воды
• в формулах принято указывать соотношение количества
вещества соли к количеству вещества воды
10.
Реакции солей• элекролитическая диссоциация
• с Ме
• с кислотами
• со щелочами
• с солями
• разложение при нагревании
11.
Электролитическая диссоциация12.
С Ме• реакция замещения (более активный Ме втесняет менее
активный)
13.
С кислотами• реакция обмена (более активная кислота вытесняет менее
активную)
14.
Со щелочами• реагируют только растворимые соли
• только если один из продуктов будет нерастворимым
• реакция обмена
15.
С солями• только растворимые соли с растворимыми солями
• только если хотя бы один продукт реакции будет не растворим
16.
Разложение при нагревании• без изменения степени оксиления
• с изменением степени окисления (ОВР)












 chemistry
chemistry








