Similar presentations:
Соли: классификация, получение, номенклатура
1.
Соли:классификация,
получение,
номенклатура
2.
Соли - сложные вещества, состоящие изатомов металлов (иногда входит водород
или гидроксильная группа) и кислотных
остатков.
y
x
Общая формула: MexAy,
где Ме – это металл;
А – кислотный остаток
3.
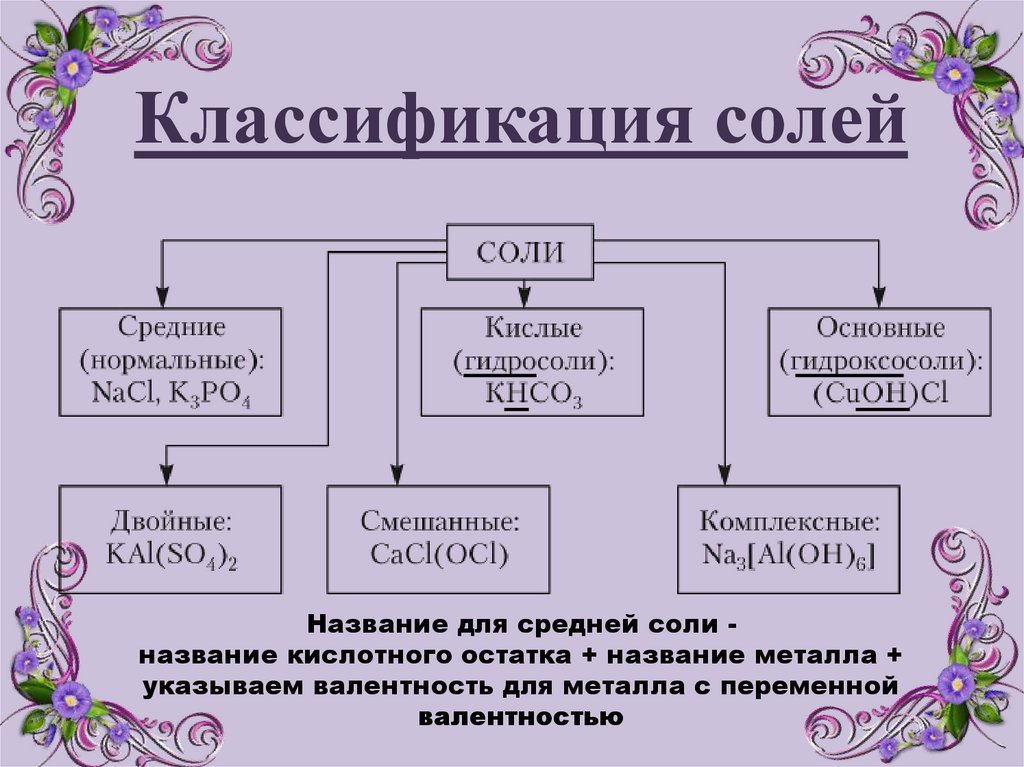
Классификация солейНазвание для средней соли название кислотного остатка + название металла +
указываем валентность для металла с переменной
валентностью
4.
Получение солей1. Из металлов:
металл + неметалл = соль
Приведите пример
металл (до Н2) + кислота (р-р) = соль + Н2
Приведите пример
Металл1 + соль1 = металл2 + соль2
Примечание: (металл2 стоит в ряду активности
правее)
Приведите пример
5.
2.Из оксидов:кислотный оксид + щелочь = соль + вода
Приведите пример
основный оксид + кислота = соль + вода
Приведите пример
основный оксид + кислотный оксид =
соль
Приведите пример
6.
3. Реакция нейтрализации:кислота + основание = соль + вода
Приведите пример
4. Из солей:
соль1 + соль2 = соль3 + соль4↓
соль1 + щелочь = нерастворимое основание + соль 2
соль1 + кислота1 = кислота2 + соль2
Примечание: Все реакции обмена протекают до
конца, если одно из образующихся веществ
нерастворимо в воде (осадок), газ или вода.
7.
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ№1. Дайте названия следующим
солям:
NaCl
KNO3
FeCl3
Li2SO4
KHSO4
BaOHCl
CaSO3
Al2S3
NaH2PO4
CuCl2
8.
№2. Составьте химические формулы солейпо их названиям: хлорид железа (II),
гидросульфид калия, сульфид калия,
сульфит калия, сульфат калия, ортофосфат
железа (III), нитрат магния, карбонат
натрия.
№3. Как двумя способами из оксида
кальция можно получить:
а) сульфат кальция; б) ортофосфат
кальция.
Составьте уравнения реакций.
9.
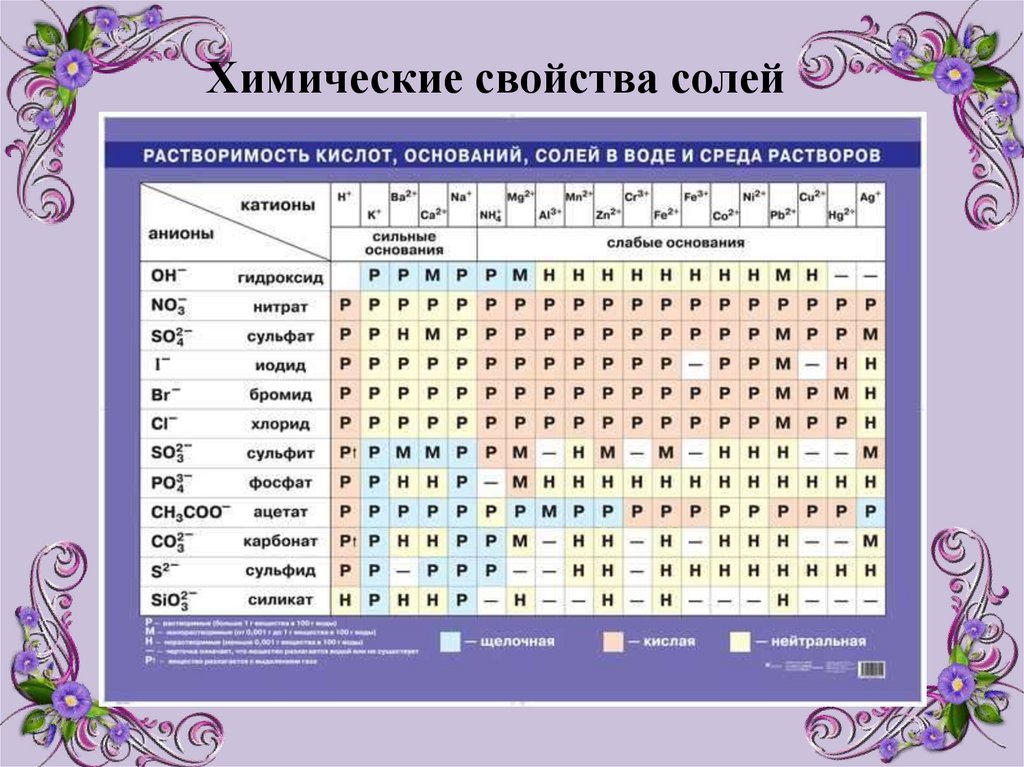
Химические свойства солей10.
Химические свойствасолей
1) Разложение при нагревании. При
нагревании некоторых солей они
разлагаются на оксид металла и кислотный
оксид:
СаСO3 → СаO + СО2.
соли бескислородных кислот при
нагревании могут распадаться на простые
вещества:
2AgCl→Ag + Cl2.
Исключение: соли щелочных металлов
2KClO3 = 2 KCl + 3 O2
2КNO3 →2КNO2 + O2
11.
2) Взаимодействие скислотами: реакция происходит, если
соль образована более слабой или
летучей кислотой, или если
образуется осадок.
2HCl + Na2CO3 →
СaCl2 + H2SO4→
12.
3) Взаимодействие со щелочами. Сощелочами реагируют соли, если при
этом образуется нерастворимое
основание.
CuSO4 + NaOH→
4) Взаимодействие друг с
другом. Реакция происходит, если
взаимодействуют растворимые соли и
при этом образуется осадок.
AgNO3 + NaCl →
13.
5) Взаимодействие сметаллами. Каждый предыдущий
металл в ряду напряжений вытесняет
последующий за ним из раствора его
соли:
Fe + CuSO4 →
6) Взаимодействие с кислотными
оксидами.
Na2CO3 + SiO2 →











 chemistry
chemistry








